Патоморфологическая характеристика метаболической антиоксидантной кардиопротекции при использовании противоопухолевых препаратов антрациклинового ряда
Автор: Тишина А.М., Плотникова Надежда Алексеевна, Кемайкин Сергей Павлович
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Экспериментальная и клиническая фармакология
Статья в выпуске: 1-2, 2013 года.
Бесплатный доступ
Противоопухолевые препараты антрациклинового ряда оказывают повреждающее воздействие на ткань миокарда. Мелатонин обладает кардиопротекторными свойствами. В эксперименте изучались патоморфологические изменения в миокарде при коррекции мелатонином кардиотоксического эффекта препарата антрациклинового ряда доксорубицина.
Короткий адрес: https://sciup.org/14719998
IDR: 14719998 | УДК: 615.277.3
Текст научной статьи Патоморфологическая характеристика метаболической антиоксидантной кардиопротекции при использовании противоопухолевых препаратов антрациклинового ряда
Противоопухолевые препараты антрациклинового ряда оказывают повреждающее воздействие на ткань миокарда. Мелатонин обладает кардиопротекторными свойствами. В эксперименте изучались патоморфологические изменения в миокарде при коррекции мелатонином кардиотоксического эффекта препарата антрациклинового ряда — доксорубицина.
Применение лекарственных препаратов является практически неотъемлемой частью адекватного современного лечения онкологических больных [3]. Возникающие при этом побочные эффекты существенно ухудшают качество жизни пациентов и имеют дозолимитирующий характер, который ставит жесткие условия при принятии решения о модификации доз цитостатиков, режиме их введения и даже о возможности продолжения противоопухолевой терапии. Ранняя профилактика, своевременное распознавание и коррекция осложнений химиотерапии являются обязательными условиями грамотного и безопасного лечения онкологических больных.
Способность противоопухолевых препаратов оказывать цитотоксическое действие наиболее часто реализуется в отношении интенсивно пролиферирующих клеток кишечного эпителия, костного мозга, волосяных фолликулов и имеет обратимый характер [2 — 3]. Сердечная мышца состоит из кардиомиоцитов, обладающих ограниченным пролиферативным и регенераторным потенциалом, что обусловливает развитие, как правило, персистирующих проявлений токсичности.
Наибольшим повреждающим воздействием на сердечно-сосудистую систему обладают антрациклиновые антибиотики, алкилирующие агенты, таксаны, фторпиримидины, транс-тузумаб [3]. Для коррекции кардиотоксического воздействия атибиотиков антрациклинового ряда препаратом выбора является мелатонин, обладающий антиоксидантной активностью. В литературе имеются сведения о способности данного препарата оказывать кардиопротекторное действие [1]. С учетом важной роли продуктов перекисного окисления липидов (ПОЛ) в развитии антра-циклиновой кардиотоксичности представляет интерес изучение кардиопротекторных свойств мелатонина в эксперименте.
Целью нашего исследования являлось изучение влияния противоопухолевых препаратов на патоморфологические изменения миокарда экспериментальных животных с перевиваемой карциномой Льюиса и определение перспектив лекарственной метаболической кардиопротекции. Экспериментальная часть работы проведена на 100 нелинейных белых мышах массой 20 — 22 г, которые содержались в стандартных условиях вивария при стандартном режиме освещения. В
возрасте трех месяцев животные были поделены на две равные группы. Суспензию клеток карциномы легкого Льюиса (106 клеток в растворе Хенкса) перевивали внутримышечно в область бедра всем грызунам. Первой группе мышей на 7-й и 12-й день эксперимента вводили доксорубицин в дозе 4 мг/кг, животные второй группы получали доксорубицин и мелатонин (Sigma, St. Louis; MS, США) в дозе 2 мг/л с питьевой водой с 19:00 до 7:00 ч. Длительность опыта составила три недели. У некоторых грызунов из каждой группы была взята ткань миокарда для гистологических исследований. Микропрепараты тканей опухолей, ткани миокарда фотографировали цифровой камерой Nikon L110 с помощью микроскопа Микмед-2 при увеличении х100 и х400. У всех животных, участвующих в эксперименте, в месте имплантации развивалась карцинома Льюиса. Микроскопическое исследование первичных опухолевых узлов показало, что их ткань представлена скоплением полиморфных клеток с характерным плотным расположе- нием, выраженным атипизмом, нарушением ядерно-цитоплазматического соотношения в сторону увеличения размеров ядер. В ткани перевиваемых неоплазий выявлялось большое количество гигантских атипичных опухолевых клеток. Кроме того, отмечалось наличие многоядерных клеток, ядра которых имели округлую, полигональную, бобовидную, палочковидную форму, встречались клетки с сегментированными ядрами. В отдельных опухолевых клетках наблюдались фигуры митоза, что отражает их высокую пролиферативную активность.
При патоморфологическом исследовании ткани сердца мышей первой группы в кардиомиоцитах выявлялись паренхиматозная белковая дистрофия по типу зернистой и гиалиново-капельной, лизис миофибрилл, уменьшение поперечно-полосатой исчерчен-ности. Наблюдались также отек интерстиция и разволокнение миокарда с очагами лимфо-гистиоцитарной инфильтрации. В сосудах микроциркуляторного русла отмечались явления полнокровия и стаза (рис. 1, 2).
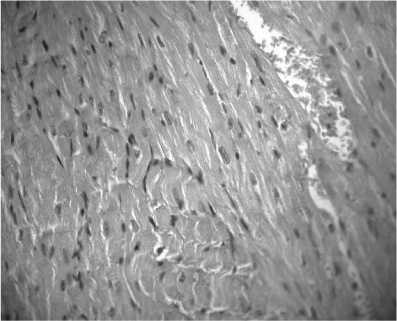
Рис. 1. Миокард. Явления полнокровия и стаза (гематоксилин и эозин; об. 40, ок. 10)
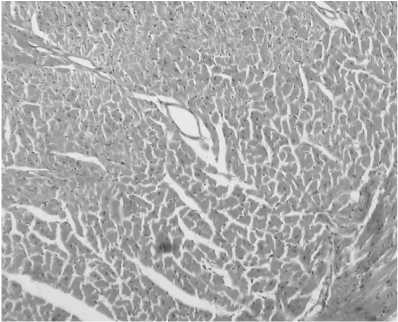
Рис. 2. Миокард. Явления отека интерстиция и разволокнения миокарда (гематоксилин и эозин; об. 40, ок. 10)
У мышей в группе с коррекцией антра-циклинового повреждения миокарда мелатонином морфологические проявления подострого повреждения сердечной мышцы были менее выражены. В кардиомиоцитах сохранялась поперечно-полосатая исчерченность, уменьшались отек и гиперемия интерстиция. Лимфогистиоцитарная инфильтрация встречалась в единичных случаях (рис. 3).
Известно, что противоопухолевые препараты могут оказывать различные побочные эффекты. Большинство ассоциированных с цитостатиками видов токсичности связано с быстро пролиферирующими клеточными системами и, как правило, спонтанно регрессируют с минимальной длительной токсичностью. Клетки миокарда имеют ограниченную регенеративную способность и могут быть восприимчивыми к перманентному или преходящему воздействию химиотерапевтических агентов. Индуцированная антрацикли-нами кардиотоксичность является потенци- ально фатальной и может значимо ухудшать качество жизни пациентов, а также существенно повышать стоимость медицинской помощи.
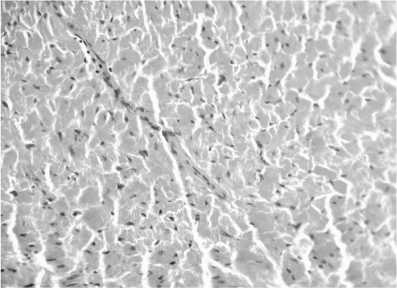
Рис. 3. Миокард. Очаговый характер лимфогистиоцитарных инфильтратов в строме (гематоксилин и эозин; об. 40, ок. 10)
В эксперименте подтвержден кардио-протекторный эффект мелатонина у мышей с перевиваемой карциномой Льюиса. При применении мелатонина морфологические проявления подострого повреждения сердечной мышцы были менее выражены. В кардиомиоцитах сохранялась поперечно-полосатая исчерченность, уменьшались явления отека и гиперемии интерстиция. Лимфогистиоцитар-ная инфильтрация встречалась в единичных случаях.
Выводы. При применении доксорубицина у мышей с перевиваемой карциномой Льюиса развивались морфологические проявления антрациклиновой кардиопатии, выражающиеся в развитии паренхиматозной белковой дистрофии кардиомиоцитов, отеке стромы, разволокнении миокарда, межуточной инфильтрации. При коррекции антрациклиновой кардиопатии мелатонином отмечались достоверная положительная динамика морфологических изменений сердечной мышцы и онкостатический эффект.
Список литературы Патоморфологическая характеристика метаболической антиоксидантной кардиопротекции при использовании противоопухолевых препаратов антрациклинового ряда
- Анисимов В. Н. Мелатонин: роль в организме и применение в клинике/В. Н. Аниси-мов. -СПб.: Система, 2007. -40 с.
- Кветная Т. В. Мелатонин: роль и значение в возрастной патологии/Т. В. Кветная, И. В. Князькин. -СПб.: ВМедА, 2003. -137 с.
- Семенова А. И. Кардио-и нейротоксичность противоопухолевых препаратов (патогенез, клиника, профилактика, лечение)/А. И. Семенова//Практ. онкология. -2009. -Т. 10, № 3. -С. 52 -67.


