Патоморфологическая оценка эффективности резонансной электростимуляции при тяжелом остром панкреатите
Автор: Фомин В.С., Зайратьянц Г.О., Луценко В.Д., Куницкий Ю.Б., Бутомо М.С.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Цель. Анализ динамики морфологических изменений кишечной стенки под воздействием резонансной электростимуляции в коррекции внутрибрюшного давления и пареза кишечника у пациентов с тяжелым острым панкреатитом.Материалы и методы. Анализирован исход лечения 105 пациентов, находившихся в хирургических клиниках по поводу тяжелого острого панкреатита за период 2015-2018гг. Были сформированы 2 группы исследования: основная (n-62, группа 1) и сравнения (n-43, группа 2), соизмеримые по возрасту, полу и тяжести состояния. Лечение проводилось согласно нормативным документам ДЗ г. Москвы и НКР РОХ. Дополнительно в лечебный арсенал 1-й группы для профилактики и коррекции моторно-эвакуаторных нарушений и внутрибрюшной гипертензии был включен метод селективной резонансной электростимуляции пищеварительного тракта. Для энтеральной поддержки применялась установка нахоеюнального эндоскопического зонда, при этом в ходе установки проводилась щипцевая биопсия слизистой дуодено-еюнального перехода на 1-е и в дальнейшем на 7-е сутки лечения...
Тяжелый острый панкреатит, синдром внутрибрюшной гипертензии, парез кишечника, морфологическая оценка, резонансная стимуляция
Короткий адрес: https://sciup.org/142224494
IDR: 142224494 | УДК: 616-091.8 | DOI: 10.17238/issn2223-2427.2019.4.53-61
Текст научной статьи Патоморфологическая оценка эффективности резонансной электростимуляции при тяжелом остром панкреатите
АКТУАЛЬНОСТЬ
Одной из наиболее трудно решаемых и актуальнейших проблем современной ургентной абдоминальной хирургии следует считать лечебную тактику при тяжелом остром панкреатите и его осложнениях [1,2]. В подтверждение вышесказанного можно привести данные Департамента здравоохранения г. Москвы, где в середине второй декады XXI века воспалительные заболевания поджелудочной железы регистрировались почти в четверти случаев всех пациентов хирургических стационаров, в том время как ранее удельный вес острого панкреатита составляет не более 10% от общей госпитализации [3]. Такая тенденция последних лет закономерно способствует росту доли пациентов с тяжелыми формами острого панкреатита [4,5].
Мультимодальность лечебно-диагностической концепции тяжелого острого панкреатита не вызывает сомнений. Это подтверждается обязательным комплайнсом хирургической и реанимационно-анестезиологической служб, а также параклинических подразделений и смежных специалистов. Безусловно, одним из ведущих звеньев патогенеза и потенцирования деструкции в поджелудочной железе следует считать синдромы внутрибрюшной гипертензии и динамической кишечной непроходимости, которые, в частности, ведут к моно- и мультиорганной недостаточности за счет формирования патофизиологических «поломок» и замыкания «circulus vitiosus» [1,2,5,6].
Реализация возможности механической внутрипросветной декомпрессии при помощи назогастрального или -интестинального зондов, а также аноректальной интубации безусловно способствует снижению внутрипросветного давления и, таким образом, компенсирует на определенном этапе внутрибрюшную гипертензию [7,8]. В результате подобных манипуляций создаются условия по улучшению перфузии и венозного оттока кишечной стенки, что, в свою очередь, предотвращает транслокацию кишечной флоры и эндотоксемию за счет сохранения барьерной функции энтероцитов [7,9]. К сожалению, данный адаптивный механизм теряет свою эффективность в условиях длительной персистенции повышенного давления или его пикового возрастания со-дружественно с висцеральным отеком и динамическим илеусом [1,2,10-16]. В настоящее время при паралитической кишечной непроходимости, как одной из причин (или следствий) роста внутрибрюшного давления, возможно применение лекарственной стимуляции, что подтверждается внедрением ингибиторов ацетилхолинэстеразы в схемы ведения пациентов [8,17], а также методов электрофизиологического мониторинга и коррекции нарушений моторики [18]. Коррекция явлений внутрибрюшной гипертензии и мо-торно-эвакуаторных нарушений при тяжелом остром панкреатите необходима для улучшения показателей лечения у данных больных, что требует перманентной манометрии и комплекса патогенетически подобранной терапии [18-20].
Одним из важнейших критериев качества проводимого лечения является анализ морфологических изменений в так называемых «зонах интереса».
Таким образом, в приведенной работе нами была поставлена цель провести анализ динамики морфологических изменений кишечной стенки под воздействием резонансной электростимуляции в коррекции внутрибрюшного давления и пареза кишечника у пациентов с тяжелым острым панкреатитом.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе работы нами проанализирован исход лечения 105 пациентов, находившихся в хирургических клиниках по поводу тяжелого острого панкреатита за период 2015-2018гг. Во всех наблюдениях госпитализация проводилась по каналу скорой медицинской помощи.
Критериями включения в исследования явились клинико-инструментальная картина тяжелого острого панкреатита без инфицирования, признаков механической обструкции билиарного дерева, онкологического анамнеза у пациентов с значениями внутрибрюшного давления исходно ≤ 2сте-пени. Критериями невключения явились механическая обструкция желчного дерева, признаки декомпенсированного динамического илеуса, а также значения внутрибрюшного давления ≥ 3 степени.
Для адекватного анализа нами были выделены 2 группы исследования: основная (n-62, группа 1) и сравнения (n-43, группа 2). Для распределения участников по группам была использована последовательность случайных чисел, сгенерированная персональным компьютером. Все данные анализировались по принципу «intention to treat». Представленные группы исходно были соизмеримы по возрасту, полу и тяжести состояния; оценка проводилась проспективно. Всем пациентам проводилось лечение тяжелого острого панкреатита согласно нормативным документам ДЗ г. Москвы и НКР РОХ; при этом пациентам основной группы дополнительно выполнялась профилактика и коррекция моторно-эвакуаторных нарушений и внутрибрюшной гипертензии методом селективной резонансной транскутанной стимуляции перистальтической активности ЖКТ (патенты РФ №2648819 и 2655788).
В лечебной тактике придерживались мультимодального подхода с со-дружественной работой хирургической, эндоскопической, рентгенологической и реанимационной служб стационара с обязательным включением в арсенал терапии методов эфферентной терапии. Практически всем пациентам в курации тяжелого острого панкреатита в комплексной коррекции выполнялась перидуральная анальгезия, в том числе с задачей профилактики моторных нарушений. При этом данная методика применена у 83% пациентов без достоверных различий распределения внутри групп исследования (р≥0,05). Эндовидеохирургические вмешательства, а также вмешательства под УЗ-навигацией выполнены 32 (37,6%) пациентам в течение первой недели болезни без достоверных различий распределения внутри групп исследования (р≥0,05). Важно указать, что у 1/3 пациентов обеих групп требовалась респираторная поддержка в виде продленной ИВЛ, что также не имело достоверных межгрупповых различий (р≥0,05), однако существенно утяжеляло прогноз пациентов.
Согласно критериям включения по тяжести состояния всем 105 пациентам лечение проводилось в отделениях реанимации и интенсивной терапии с обязательной установкой назогастрального либо назоеюнального ниппельного зондов (в ходе манипуляции выполнялась также биопсия слизистой дуоденоеюнального перехода и проксимальной порции тощей кишки). Временной интервал для забора морфологического материала соответствовал 1-м и 7-м суткам лечения, что позволяло оценить степень редукции внутрибрюшной гипертензии (как результат проводимой терапии), а также восстановление моторно-эвакуаторной функции пищеварительного тракта в группах исследования.
Тощекишечная локализация биопсийного материала выбрана не случайно: во-первых, при прогрессивно нарастающем висцеральном отеке и внутрибрюшном давлении идет выраженная редукция всего внутриорганного кровотока; во-вторых, зона дуоденоеюнального перехода прилежит к поджелудочной железе и реагирует на локальный отек и гипоперфузию тканей довольно быстро; в-третьих, именно подобная локализация является наиболее доступной и технически «удобной» для забора материала в отличие от иных участков тонкой кишки, где данная манипуляция не реализуема без определенных условий и сложных технических приспособлений.
В исследовании для забора материала использовался ви-деоколоноскоп Olympus CF-Q150L. После установки ниппельного зонда производилась полифокусная биопсия стенки тощей кишки (не менее 4-5 фрагментов).
Безусловно, каждый случай летального исхода также подвергался морфологическому исследованию с анализом гистологических препаратов, что при отсутствии непосредственной интраабдоминальной причины смерти позволяло строить определенные выводы о качестве проведенного лечения. Таким образом, нами был проведен анализ морфологических изменений стенки тощей кишки как на основании биопсийных материалов, взятых во время эндоскопического исследования, так и в случае патологоанатомического вскрытия.
У больных 1-й группы отмечался более быстрый регресс внутрибрюшной гипертензии с нормализацией показателей давления в брюшной полости к 7-м суткам лечения (р≤0,05; Рисунок 1), в сравнении с группой 2, где данная динамика выглядела более торпидно. Во всех наблюдениях группы 1 к исходу 72 часов лечения получен самостоятельный стул и свободное отхождение газов, в то время как в группе 2 лишь 27 пациентов (64,3%) удовлетворяли этому критерию (p≤0,05).
При анализе клинического материала нами отмечены различия показателей инфицирования: в 1 группе инфицирование панкреонекроза наступило у 9 (14,5%), а в группе 2 процент гнойно-септических осложнений составил 37,2% (n-16; р≤0,05).
Летальных исходов в 1-й группе отмечено 3 (4,8% от всех больных основной группы на сроках лечения 6-е, 8-е и 9-е сутки), в группе 2 зарегистрировано 6 летальных исходов (13,9%, на срока лечения с 6-х по 11 сутки).
РЕЗУЛЬТАТЫ
Суммарно нами выполнено 47 еюнобиопсий на 1 сутки от начала лечения: в 1 группе - у 32 пациентов (51,6%), в группе 2 - у 15 пациентов (34,9%). В дальнейшем этим же пациентам на 7 сутки выполнена повторная гастроскопия с осмотром области дуоденоеюнального перехода и еюнобиопсией для повторной морфологической оценки полученного материала.
Во всех группах исследования при анализе исходных гистологических препаратов прослеживались тождественные морфологические изменения, что доказывало общность патогенетических каскадов и универсальность тех или иных морфологических находок.
В первую очередь определялся выраженный отек слизистого и подслизистого слоев стенки тощей кишки. Отмечалось резкое расширение просвета сосудов, преимущественно за счет венозного русла с визуализацией стазов в просвете сосудов. Имелись очаговые кровоизлияния, а также диффузная лимфо-лейкоцитарная воспалительная инфильтрация. На фоне выраженного интерстициального отека, а также высоких значений внутрибрюшного и внутрипросветного давления (согласно клиническо-инстру-ментальным и манометрическим данным, Рисунок 1) визуализировалась незначительная атрофия крипт, а также участки слущивания эпителия и острые эрозии в умеренном количестве (Рисунок 2).
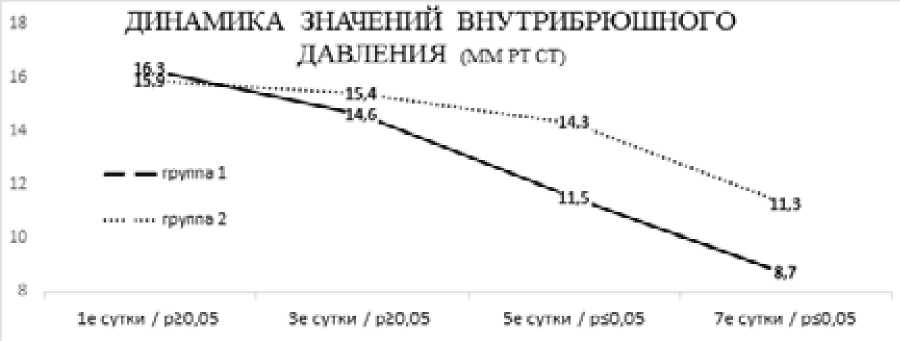
Рисунок 1. Динамика значений внутрибрюшного давления в группах исследования в течение первой недели лечения
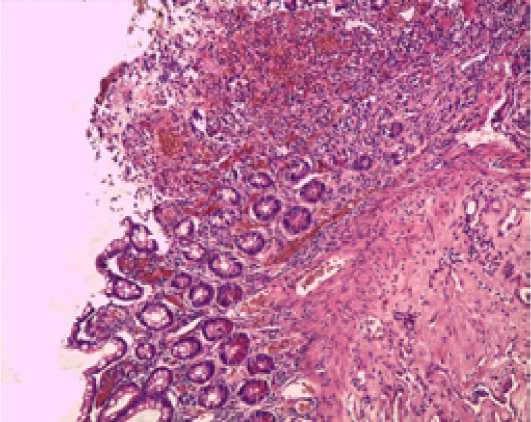
Окраска гематоксилином и эозином, х 100
Рисунок 2. Исходная морфологическая картина при анализе гистологических препаратов биопсий тощей кишки (1 сутки) у пациентов всех групп исследования.
Комментарий в тексте
При изучении препаратов на фоне лечения (7 сутки) в группах исследования отмечены отличные изменения как при визуальном осмотре, так и при описании гистологических заключений.
При морфологических исследования в основной группе на 7 сутки ( Рисунок 3 ):
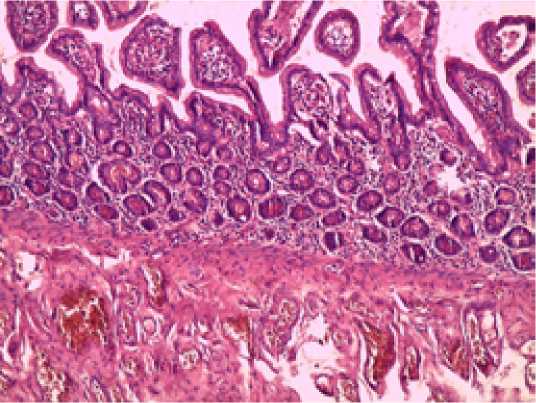
Окраска гематоксилином и эозином, х 100
Рисунок 3. Морфологическая картина при анализе гистологических препаратов биопсий тощей кишки (7 сутки) у пациентов 1-й группы исследования. Комментарий в тексте
-
1) сохранялся умеренный отек преимущественно подслизистого слоя;
-
2) отсутствовали кровоизлияния и воспалительная очаговая инфильтрация. Последняя в ряде наблюдений сохраня-
- лась, однако была слабовыраженная и представлена преимущественно лимфоцитами.
-
3) атрофия крипт была слабо выражена или отсутствова-
- ла; участки слущивания эпителия отсутствовали.
В группе сравнения на 7 сутки анализ эндоскопических биопсий показал ( Рисунок 4 ):
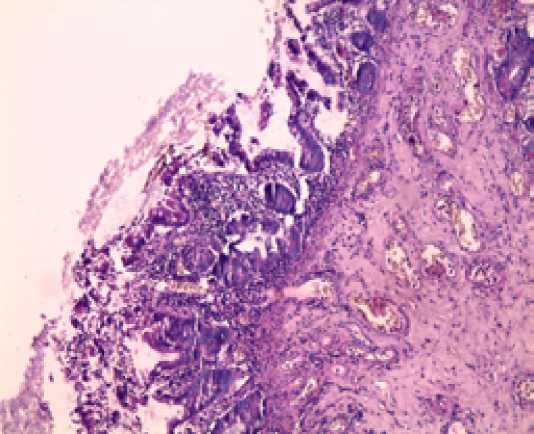
Окраска гематоксилином и эозином, х 100
Рисунок 4. Морфологическая картина при анализе гистологических препаратов биопсий тощей кишки (7 сутки) у пациентов 2-й группы.
Комментарий в тексте
-
1) сохранение выраженного межуточного (интерстициального) отека, преимущественно в подслизистом слое;
-
2) умеренно выраженную атрофию крипт и участки де-сквамации энтероцитов вплоть до трудностей дифференцировки эпителия, покрывающего ворсины с массивными кровоизлияниями и стазами в просвете сосудов этих зон.
Подобные морфологические изменения явились, на наш взгляд, следствием более значимых цифр внутрибрюшного и абдоминального перфузионного давления, а следовательно, большей редукции спланхнического кровотока и ишемии тканей. Морфологические находки в полной мере коррелировали с скоростью восстановления моторики кишечника и, соответственно, указывали на неразрешенную мальдиге-стию у пациентов группы сравнения ( Рисунок 4 ).
Важным дополнением явились морфологические исследования у пациентов групп исследования по данным аутопсии. Во всех случаях наступления летальных исходов в основной группе и группе сравнения наравне со стандартным протоколом патологоанатомического исследования проводилась биопсия тощей кишки на расстоянии 20-40см от связки Трейца с морфологическим исследованием всей толщи кишечной стенки.
В 3-х случаях летальных исходов 1 группы нами не выявлено грубых морфологических изменений слизистой обо- лочки и подслизистого слоя, отличных от вышеприведенных. Дополнительный анализ состояния мышечной оболочки не обнаружил нарушения архитектоники, а также дисцирку-ляторых изменений (Рисунок 5), что доказывает успешность проводимой терапии и своевременность коррекции и ликвидации синдрома внутрибрюшной гипертензии.
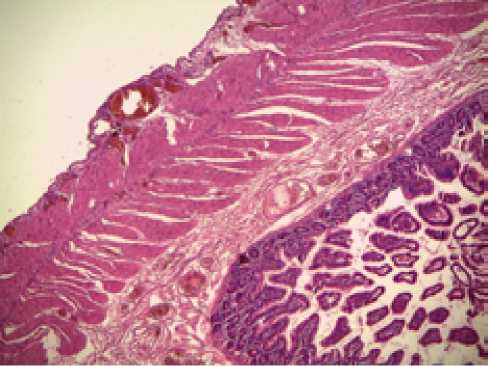
Окраска гематоксилином и эозином, х40
Рисунок 5. Морфологическая картина состояния всей толщи кишечной стенки по данным аутопсии в основной группе (6 сутки лечения). Комментарий в тексте
Секционные исследования мышечной оболочки стенки тощей кишки у всех 6 умерших пациентов группы сравнения установили ее дисциркуляторные изменения.
Во всех аутопсийных препаратах отмечался (от умеренного до выраженного) межмышечный отек с расширением и полнокровием сосудов, а также воспалительный лимфолейкоцитарный инфильтрат, распространяющийся, преимущественно, по ходу межмышечных пространств ( Рисунок 6 ).
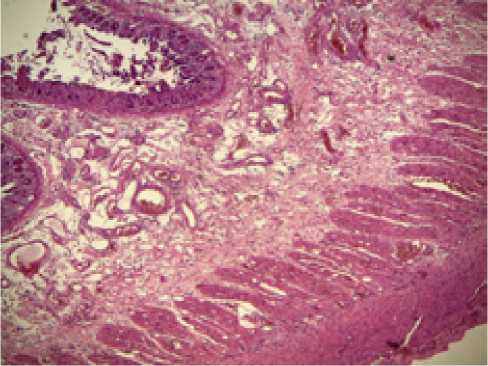
Окраска гематоксилином и эозином, х40
Рисунок 6 . Морфологическая картина состояния всей толщи кишечной стенки по данным аутопсии в группе сравнения (8-е сутки лечения).
Комментарий в тексте
На основании прижизненных морфологических исследований, выполненных исходно и в динамике у 47 пациентов, нами произведена систематизация полученных данных, что представлено в Таблице 1. Данные аутопсий не включены в сводную таблицу ввиду малой выборки для полноценного анализа.
Таблица 1
Морфологические изменения стенки кишки в группах исследования
|
Морфологический признак |
к § A S s |
л s И ь^ о |
к |
|
Отек слизистого слоя стенки кишки |
+++ |
- |
+ |
|
Отек подслизистого слоев стенки кишки |
+++ |
+ |
++ |
|
Расширение просвета кровеносных сосудов с наличием в просвете стазов |
++ |
- |
+ |
|
Очаговые кровоизлияния |
++ |
- |
++ |
|
Диффузная лимфо-лейкоцитарная воспалительная инфильтрация |
+++ |
+/- |
+ |
|
Атрофия крипт |
+/- |
- |
+/- |
|
Участки слущивания эпителия |
++ |
- |
+ |
|
- Признак не определяется +/- Встречается в единичных полях зрения + Встречается в большинстве полей зрения, слабо выражен ++ Встречается в каждом поле зрения, умеренно выражен +++ Визуализируется на всех полях зрения, резко выражен |
|||
Как видно, имеется четкая диссоциация картины до и после лечения (1 и 7 сутки) в группах резонансной стимуляции (основная) и рутинной профилактики и лечения (сравнения) внутрибрюшной гипертензии и моторно-эвакуаторных нарушений.
ОБСУЖДЕНИЕ
В настоящее время имеется достаточно широкое освещение роли и места внутрибрюшной гипертензии и динамического илеуса в системном влиянии на организм. Последние приводят к снижению кровотока по системе нижней полой вены, редукции гастрального и брыжеечного кровотока с ульцерогенными изменениями верхних отделов ЖКТ вплоть до тотального некроза кишечника с развитием его перфорации [7,14,15,18,21,22]. Происходящее под действием повышенного внутрибрюшного давления смещение диафрагмы ведёт к росту среднего внутригрудного давления, снижению вентиляции легких с развитием дыхательной недостаточности, респираторной, цирскуляторно, гистотоксической форм гипоксии [5,10,11,22].
Экспериментально установлено, что рост внутрибрюш-ного давления выше 15 мм рт. ст. сопровождается прогрессирующей ишемизацией кишечной стенки, постепенным развитием отека слизистой оболочки, некрозом энтероци-тов, что в последующим приводит к трансформации в синдром энтеральной недостаточности [7,11,22,23]. «Circulus vitiosus» замыкается на данном этапе вследствие прогрессирующей сердечно-легочной недостаточности, реналь- ной дисфункции и секвестрации жидкости (в том числе вводимой в рамках инфузионной терапии) в т.н. «третьем пространстве». При этом присоединение энтеральной дисфункции и пареза кишечника потенцируют прогрессивный рост внутрибрюшного давления и полиорганной недостаточности [23].
Синдром энтеральной недостаточности в рамках полиор-ганной дисфункции реализуется последовательной сменой патологических процессов. Так, дистрофия (атрофия) эн-тероцитов сопровождается супрессией выработки IgA, нарушением барьерной функции кишечника, контаминацией микрофлорой регионарных лимфоузлов, а также портального тракта [21,22]. Дальнейшие изменения сопровождаются лимфатической и чреспортальной транслокацией токсинов и микробов, дистрофией гепатоцитов, активацией макрофагальной системы и, как следствие, системными мультиорган-ными повреждениями [22].
Очевидно, что перфузия кишечной стенки ухудшается по мере повышения внутриполостного кишечного давления; при этом критическое давление в просвете кишки составляет 30 мм рт. ст. При прогрессирующем повышении давления свыше указанных параметров происходит шунтирование крови в венозное русло, недостаточная оксигенация и вторичная тканевая гипоксия. Ишемия приводит к анаэробному метаболизму, ацидозу, исчерпанию энергетических запасов клетки и её необратимым изменениям.
На сегодняшний день общепризнанной является точка зрения, согласно которой максимальное повреждающее действие на ткани оказывает не столько ишемия, сколько т.н. феномен «реперфузии». В условиях восстановленного кровотока в присутствии кислорода фермент ксантинокси-даза преобразует гипоксантин в ураты и кислородные радикалы (О2 , ОН+), запускающие процесс перекисного окисления тканей. Кроме того, при реперфузии повреждающим механизмом является перемещение ионов кальция внутрь клетки, что способствует усилению расстройств микроциркуляции и нарушению проницаемости мембран [21,22]. Следует также указать на то, что возросшая в условиях ишемии осмолярность тканей после восстановления кровотока способствует привлечению большого количества воды, что неизбежно потенцирует отек тканей и, как следствие, парез.
Таким образом патофизиологическая модель «поломок» и множества «порочных кругов» указывает на необходимость незамедлительной коррекции внутрибрюшной гипертензии и/или моторно-эвакуаторных нарушений на ранних этапах до запуска вышеприведенных механизмов. Полученные морфологические заключения и их сравнение с клинико-инструментальными данными позволяют убедительно продемонстрировать преимущество комплексной коррекции абдоминальной гипертензии и паретического илеуса с применением электрофизиологических стимулирующих технологий в отличии от рутинной терапии тяжелого острого панкреатита.
Проведенный нами анализ морфологических изменений по данным проксимальных отделов тощей кишки указывает на глубокие микроциркуляторные нарушения в ответ на рост и длительную экспозицию внутрибрюшной гипертензии, что, согласно закону Паскаля о равномерности распределения давления внутри замкнутой полости, прослеживается в той или иной степени на всем протяжении пищеварительного тракта. В свою очередь, при не устранении или торпид-ной ликвидации вышеприведенных условий гистологическая картина соответствует сохранению отека всех слоев стенки кишки с развитием стазов, очаговых кровоизлияний и повышением сосудистой проницаемости. В этой связи можно говорить о серьезных моторно-эвакуаторных нарушениях кишечника ввиду сохраняющегося выраженного отека, в том числе мышечной стенки по данным аутопсий. Подобный морфологический каскад сопровождается реализацией механизма кишечной транслокации микроорганизмов и токсинов, что трансформируется в развитие абдоминального сепсиса и синдром полиорганной недостаточности.
ЗАКЛЮЧЕНИЕ
Представленные данные позволяют проследить комплекс мероприятий по ликвидации повышенного внутрибрюшно-го давления с макро- и микроскопическими изменениями организма. Вышеприведенный тезис подкрепляется не только доказанным восстановлением естественной пропульсив-ности кишечника, но и результатами гистологического исследования (количественно и качественно) за счет регресса имевшихся на старте заболевания морфологических изменений.
Раннее мониторирование, активное внедрение методов ликвидации внутрибрюшной гипертензии, а также восстановления адекватной моторики кишечника, будут способствовать улучшению результаты лечения больных с тяжелым острым панкреатитом.
Список литературы Патоморфологическая оценка эффективности резонансной электростимуляции при тяжелом остром панкреатите
- Aitken E., Gough V., Jones A., Macdonald A. Observational study of intra-abdominal pressure monitoring in acute pancreatitis. Surgery. 2013;155(5):910-918. DOI: 10.1016/j.surg.2013.12.028
- Boone B., Zureikat A., Hughes S.J., Moser A.J., Yadav D., Zeh H.J., Lee K.K. Abdominal compartment syndrome is an early, lethal complication of acute pancreatitis. Am. Surg. 2013;79(6):601-607
- Ермолов А.С., Смоляр А.Н., Шляховский И.А., Храженков М.Г. 20 лет неотложной хирургии органов брюшной полости в Москве. Хирургия. 2014; 5: 7-16.
- Ermolov A.S., Smolyar A.N., Shlyakhovsky I.A., Khrazhenkov M.G. 20 years of emergency surgery of the abdominal organs in Moscow. Khirurgiya. 2014; 5: 7-16. (in Russ)
- Шабунин А.В., Араблинский А.В., Лукин А.Ю. Панкреонекроз. Диагностика и лечение. М.: ГЕОТАР-медиа, 2014, 96с.
- Shabunin A.V., Arablinsky A.V., Lukin A.Yu. Pankreonekroz. Diagnostika i lecheniye [Pancreatic necrosis. Diagnosis and treatment]. Moscow: GEOTAR-media, 2014, 96р.
- Dambrauskas Z., Parseliunas A., Gulbinas A., Pundzius J., Barauskas G. Early recognition of abdominal compartment syndrome in patients with acute pancreatitis. World J. Gastroent. 2009;15(6):717-721. DOI: 10.3748/wjg.15.717
- Прудков М.И., Шулутко А.М., Галимзянов Ф.В., Чернядьев С.А. Некротизирующий панкреатит. Екатеринбург: ЭКС-Пресс; 2005, 68с.
- Prudkov M.I., Shulutko A.M., Galimzyanov F.V., Chernyadiev S.A. Nekrotiziruyushchiy pankreatit [Necrotizing pancreatitis]. Yekaterinburg: EKS-Press; 2005, 68р. (in Russ)
- Тимербулатов В.М., Фаязов Р.Р., Тимербулатов Ш.В., Гареев Р.Н., Султанбаев А.У. Интраабдоминальная гипертензия в практике хирурга. Вестник Уральской медицинской академической науки. 2010; 2 (30): 56-58.
- Timerbulatov V.M., Fayazov R.R., Timerbulatov Sh.V., Gareev R.N., Sultanbaev A.U. Intraabdominal hypertension in practice of the surgeon. Vestnik Ural'skoi Meditsinskoi Akademicheskoi Nauki. 2010; 2 (30):56-8 (in Russ.)
- Herbert M.K., Holzer P. Standardized concept for the treatment of gastrointestinal dysmotility in critically ill patients - current status and future options. Clin. Nutr. 2008; 27 (1): 25-41. 10.1016/j. clnu.2007.08.001
- DOI: 10.1016/j.clnu.2007.08.001
- Van Der Spoel J.I., Schultz M.J., Van Der Voort P.H., De Jonge E. Influence of severity of illness, medication and selective decontamination on defecation. Intensive Care Med. 2006; 32 (6): 875-80.
- DOI: 10.1007/s00134-006-0175-9
- Kyoung K.H., Hong S.K. The duration of intra-abdominal hypertension strongly predicts outcomes for the critically ill surgical patients: a prospective observational study. World J. Emerg. Surg. 2015; 10 (1): 22.
- DOI: 10.1186/s13017-015-0016-7
- Kirkpatrick A.W., Roberts D.J., Ball C.G., De Waele J., Jaeschke R., Malbrain M.L., De Keulenaer B. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013; 39 (7): 1190-206.
- DOI: 10.1007/s00134-013-2906-z
- Cheatham M.L., Malbrain M.L., Kirkpatrick A., Sugrue M., Parr M., De Waele J., Balogh Z., Leppäniemi A., Olvera C., Ivatury R., D'Amours S., Wendon J., Hillman K., Wilmer A. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. II. Recommendations. Intensive Care Med. 2007; 33 (6): 951-62.
- DOI: 10.1007/s00134-007-0592-4
- De Keulenaer B., Regli A., De laet I., Roberts D., Malbrain M.L. What's new in medical management strategies for raised intraabdominal pressure: evacuating intra-abdominal contents, improving abdominal wall compliance, pharmacotherapy, and continuous negative extra-abdominal pressure. Anaesthesiol. Intensive Ther. 2015; 47 (1): 54-62. 10.5603/ AIT.a2014.0065
- DOI: 10.5603/AIT.a2014.0065
- Ekka N.M.P., Malua S., Bodra P., Jha R.K., Murari K. Intraabdominal hypertension and abdominal syndrome: a review of current concept and trends. Int. J. Med. Dent. Sci. 2015; 4 (2): 922-31.
- DOI: 10.19056/ijmdsjssmes/2015/v4i2/79867
- Забелин М.В., Попугаев К.А., Нестерова Е.А., Самойлов А.С., Покровский К.А. Диагностика и интенсивная терапия внутрибрюшной гипертензии. Анналы хирургии. 2018; 23 (2): 81-91. DOI.:.
- DOI: 10.18821/1560-9502-2018-23-2-81-91
- Zabelin M.V., Popugaev K.A., Nesterova E.A., Samoylov A.S., Pokrovskiy K.A. Diagnostics and intensive therapy of intraabdominal hypertension. Annaly Khirurgii. 2018; 23 (2): 81-91 (in Russ.). DOI.:
- DOI: 10.18821/1560-9502-2018-23-2-81-91
- Van Der Spoel J.I., Oudemans-van Straaten H.M., Stoutenbeek C.P., Bosman R.J., Zandstra D.F. Neostigmine resolves critical illness-related colonic ileus in intensive care patients with multiple organ failure - a prospective, double-blind, placebo-controlled trial. Intensive Care Med. 2001; 27 (5): 822-7
- Яковенко В.Н., Фомин В.С., Бобринская И.Г. Основные направления развития электрогастроэнтерографии и восстановления координации сокращений пищеварительного тракта у больных хирургического профиля. Хирургическая практика. 2017;3:5
- Yakovenko V.N., Fomin V.S., Bobrinskaja I.G. Main directions of development of electrogasrtoenterography and restoration of coordination of abbreviations of digestive tract in patients with surgical profile. Khirurgicheskaya praktika. 2017;3:5-11. (in Russ).
- Carr J.A. Abdominal compartment syndrome: a decade of progress. J. Am. Coll. Surg. 2013; 216 (1): 135-46. 10.1016/ j.jamcollsurg.2012.09.004
- DOI: 10.1016/j.jamcollsurg.2012.09.004
- Дюжева Т.Г., Шефер А.В. Внутрибрюшная гипертензия у больных тяжелым острым панкреатитом. Хирургия. 2014;1:21-29.
- Dyuzheva T.G., Shefer A.V. Intraperitoneal hypertension in patients with severe acute pancreatitis. Khirurgiya. 2014;1:21-29. (in Russ)
- Wittmann D.H., Iskander G.A. The compartment syndrome of the abdominal cavity: a state of the art review. J. Intensive Care Med. 2010; 17 (2): 201-20.
- DOI: 10.1177/088506660001500403
- Doty J.M., Oda J., Ivatury R.R., Blocher C.R., Christie G.E., Yelon J.A., Sugerman H.J. The effects of hemodynamic shock and increased intra-abdominal pressure on bacterial translocation. J Trauma. 2002;52(1):13-17
- Zbar A.P., Wun L., Chiappa А., Al-Hashemy М., Monteleone М., Ferrari С.S., Parkes S. Primary intraabdominal hypertension and abdominal compartment syndrome: pathophysiology and treatment. Emerg. Med. Open J. 2015;1(2):46-63.
- DOI: 10.17140/EMOJ-1-110
- VandeHei M.S., Papageorge C.M., Murphy M.M., Kennedy G.D. The effect of perioperative fluid management on postoperative ileus in rectal cancer patients. Surgery. 2017;161(6):1628-1632. 10.1016/j. surg.2016.11.015
- DOI: 10.1016/j.surg.2016.11.015


