Патоморфологические и функциональные изменения желудочно-кишечного тракта в отдаленном периоде после миниинвазивной холецистэктомии
Автор: Калибатов Р.М., Асланов А.Д., Логвина О.Е., Гадаборшева З.Р., Карданова Л.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.19, 2024 года.
Бесплатный доступ
Обоснование: В настоящее время среди взрослого населения большинства стран мира продолжается рост желчнокаменной болезни (ЖКБ) и ее осложнений, которые достигают 20% от общего количества заболевших. Невзирая на возраст и сопутствующие заболевания, золотым стандартом лечения таких пациентов стала миниинвазивная лапароскопическая холецистэктомия, но после ее выполнения возникают различные издержки хирургического вмешательства; например, в отдаленные сроки послеоперационного периода происходят изменения со стороны желудочно-кишечного тракта, имеющие характерную клинико-эндоскопическую картину.Цель: Целью исследования явилось патоморфологическое обоснование клинико-функциональных изменений верхних отделов желудочно-кишечного тракта в отдаленном послеоперационном периоде после миниинвазивной холецистэктомии.Методы: Проанализированы данные 119 пациентов с хроническим калькулезным холециститом. Больные разделены на 3 группы: первая - лечившиеся в стационаре без операции, медикаментозно, вторая - наблюдамые после холецистэктомии в срок от 8 месяцев до 1 года и третья - в срок более 3-х лет. Для сравнения была сформирована группа из 50 добровольцев, которые не предъявляли каких-либо жалоб. Диагноз хронический калькулезный холецистит, ставился на основании клинических признаков, лабораторного и ультразвукового обследования. С помощью фиброгастроскопии осуществлялась эндоскопическая, а затем морфологическая оценка состояния слизистой верхних отделов пищеварительной системы путем прицельной биопсии слизистой с гистологическим исследованием. В полученных биоптатах методом иммуногистохимии производилось распознавание клеток, относящихся к диффузной эндокринной системе.Результаты: Установлено, что у больных после миниинвазивной холецистэктомии в послеоперационном периоде развиваются клинические, эндоскопически подтвержденные воспалительные и атрофические процессы пищеварительного тракта и они не исчезают.Заключение: Воспаление слизистой пищевода, желудка и двенадцатиперстной кишки приводит к снижению плотности диффузных эндокринных желез и нарушению выработки ими пищеварительных пептидов. За счет недостатка пищеварительных пептидов возникает порочный круг, поддерживающий нарушение пищеварения
Желчнокаменная болезнь, лапароскопическая холецистэктомия, послеоперационный период, диффузная эндокринная система
Короткий адрес: https://sciup.org/140307031
IDR: 140307031 | DOI: 10.25881/20728255_2024_19_1_22
Текст научной статьи Патоморфологические и функциональные изменения желудочно-кишечного тракта в отдаленном периоде после миниинвазивной холецистэктомии
Обоснование
В настоящее время среди взрослого населения большинства стран мира продолжается рост желчнокаменной болезни (ЖКБ) и ее осложнений, которые достигают 20% от общего количества заболевших [1–3]. Это подтверждают данные EASL Clinical Practice [4].
Невзирая на возраст и сопутствующие заболевания, золотым стандартом лечения таких пациентов стала миниинвазивная лапароскопическая холецистэктомия, но после ее выполнения возникают различные издержки хирургического вмешательства; например, в отдаленные сроки послеоперационного периода происходят изменения со стороны желудочно-кишечного тракта (ЖКТ), имеющие характерную клинико-эндоскопическую картину [5–7].
В начале 2000 гг. уже дискутировались вопросы патогенеза воспалительных процессов слизистой верхних отделов ЖКТ после холецистэктомии [8; 9]. Участвовав-

Калибатов Р.М., Асланов А.Д., Логвина О.Е. и др.
ПАТОМОРФОЛОГИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В ОТДАЛЕННОМ ПЕРИОДЕ ПОСЛЕ МИНИИНВАЗИВНОЙ ХОЛЕЦИСТЭКТОМИИ шие в обсуждении авторы тогда подчеркивали ключевую роль изменений диффузной эндокринной системы (ДЭС), которая в структурном плане представлялась как эндоэпителиальная железа мозаично-клеточного типа [10; 11]. Многие другие исследователи [12–14] также пришли к выводу, что именно в этих клетках происходит образование гормонов, аминов и пептидов, влияющих на процессы пищеварения.
С тех пор клинико-эндоскопические изменения пищеварения после удаления желчного пузыря продолжают анализироваться, но реакция ДЭС у таких больных так и осталась недостаточно изученной, что определило актуальность данной публикации.
Цель
Патоморфологическое обоснование клинико-функциональных изменений верхних отделов ЖКТ после миниинвазивной холецистэктомии в отдаленном послеоперационном периоде.
Методы
В ГБУЗ «Республиканской клинической больнице» МЗ КБР на базе кафедры госпитальной хирургии медицинской академии КБГУ им. Х.М. Бербекова получены и проанализированы клинико-лабораторные и эндоскопические данные 119 пациентов с неосложненной ЖКБ, хроническим калькулезным холециститом. С учетом опыта предыдущих исследователей [15–17] больные разделены на 3 группы: первая — лечившиеся в стационаре без операции, медикаментозно, вторая — наблюдаемые после холецистэктомии в срок до 1 года и третья — после холецистэктомии в срок более 3-х лет.
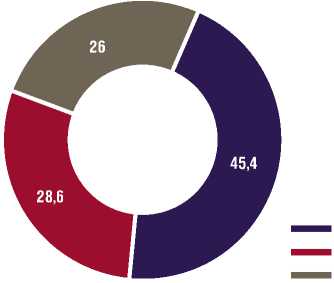
Пациентов, лечившихся в стационаре без операции (группа 1) было 54 (45,4%) человека (Рис. 1). Их средний возраст составил 54±4,9 лет. Пациенты женского пола составили 41 (75,9%) человек, а мужского — 13 (24,1%).
Из других 65 (54,6%) больных группу 2 составили 34 (28,6%) человека, которым была произведена ми-ниинвазивная холецистэктомия в плановом порядке. Все они после удаления желчного пузыря обследованы в послеоперационном периоде, составлявшим срок от 8 мес. до 1 года. То есть, в данную группу попадали оперированные сразу после окончания ближайшей послеоперационной реабилитации. Их средний возраст составлял 55±3,4 лет. Мужчин было 11 (32,4 %) человек, а женщин — 23 (67,4%).
Группу 3 составил 31 (26,0 %) больной. Это были те, которые находились в «окончательном» отдаленном послеоперационном периоде. Они обследованы в сроки от 3 лет и более после холецистэктомии. Их средний возраст составил 55±3,1 лет. Мужчин было 10 (32,3 %) человек, а женщин — 21 (67,7 %).
В перечисленных трех группах не было тяжелых сопутствующих болезней в стадии декомпенсации. Соотношение мужчин и женщин было приблизительно
Не оперированные
До 1 года
3 года и более
Рис. 1. Распределение пациентов на группы в зависимости от сроков выполненной холецистэктомии (%).
одинаковое. Средний возраст — практически одинаков. То есть, данные этих групп были сопоставимы.
Критериями включения в исследование являлись наличие ЖКБ, хронического калькулезного холецистита у неоперированных пациентов, а также у лиц после уже выполненной лапароскопической холецистэктомии, обследованные в различные сроки отдаленного послеоперационного периода. Возрастной интервал анализированных составлял от 20 до 75 лет. У всех получено письменное согласие на участие в исследовании.
Критериям исключения соответствовали те пациенты, у которых имелись деструктивные и осложненные формы калькулезного холецистита, оперированные ла-паротомным доступом (в том числе те, которым выполнялась интраоперационная конверсия), воспалительные изменения в холедохе и желчных протоках различной степени тяжести: стриктуры, резидуальный холедохо-литиаз, интраоперационные травмы холедоха, а также сочетанные с ЖКБ опухоли печени, желчного пузыря и внепеченочных желчных путей. К ним же относились пациенты, имеющие сопутствующие заболевания в стадии обострения или декомпенсации с сердечно-сосудистой и дыхательной недостаточностью, онкологические заболевания других локализаций, а также — отказ от исследования.
Для сравнения показателей была сформирована группа из 50 добровольцев, которые не предъявляли каких-либо жалоб. У них ранее не выявляли патологии пищеварительной системы и желчного пузыря. Возраст данной группы колебался от 28 до 45 лет, средний возраст составлял 37±2,3 лет.
Диагноз ЖКБ, хронический калькулезный холецистит, ставился на основании клинических признаков, данных лабораторного обследования, УЗИ.
Проведение фиброгастродуоденоскопии (ФГДС) являлось обязательным для всех обследуемых групп. С ее помощью осуществлялась эндоскопическая, а затем морфологическая оценка состояния слизистой верхних отделов пищеварительной системы. Во время эндоскопии всем пациентам производилась прицельная биопсия слизистой с гистологическим исследованием. Окраска

Калибатов Р.М., Асланов А.Д., Логвина О.Е. и др.
ПАТОМОРФОЛОГИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В ОТДАЛЕННОМ ПЕРИОДЕ ПОСЛЕ МИНИИНВАЗИВНОЙ ХОЛЕЦИСТЭКТОМИИ
полученных препаратов проводилась гематоксилин-эо-зином.
Определение иммунопозитивных клеток эпителия осуществляли с помощью наборов моноклональных мышиных антител к мотилину, а также поликлональных кроличьих антител к глюкагону и панкреатическому полипептиду. Полученный материал после обработки реактивами оценивался визуально, для чего использовался комплекс авидина с биотинилированной пероксидазой и последующим проявлением пероксидазы диаминобензидином. В тех случаях, когда происходила положительная иммуногистохимическая реакция, окраска клеток становилась коричневой. Клетки, давшие положительную реакцию, подчитывались с помощью компьютера, имеющего программу, позволяющую проводить анализ таких изображений. Полученное количество клеток пересчитывали на площадь в 1 мм2 слизистой оболочки луковицы двенадцатиперстной кишки при помощи компьютерного анализа микроскопических изображений.
Для проведения данного исследования получено разрешение этического комитета кафедры госпитальной хирургии медицинской академии КБГУ им. Х.М. Бербеко-ва. Больным проводилось объяснение характера исследования. Получение письменного согласия являлось обязательным для всех групп, в том числе и контрольной.
Результаты эндоскопических и гистологических данных подвергались статистической обработке с использованием программы «Excel». При сравнении средних показателей между различными группами использовали критерий достоверности Стьюдента с оценкой уровней значимых величин при p<0,05.
Результаты
Клиническая картина ЖКБ у всех обследованных в клинике была типичной: она характеризовалась болью в правом подреберье. Для оценки интенсивности болевого синдрома использовалась шкала боли Bloechle C. et al. (1995) [18].
До операции оценка интенсивности болевого синдрома по ней достигала 75.
После хирургического вмешательства в отдаленном периоде интенсивность болевого синдрома существенно менялась. По шкале Bloechle C. et al. (1995) в таких случаях она не превышала 50, но и не снижалась до 0. Боль становилась непостоянной, нелокализованной и распространенной по всему животу.
До операции пациентов беспокоили рвота, тошнота, горечь во рту. В послеоперационном периоде рвота исчезала, а признаки диспепсии менялись качественно и количественно.
Диагноз дополнительно подтверждался традиционными лабораторными тестами и ультразвуковыми данными.
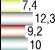
Фиброгастроскопическая картина до и после холецистэктомии также была разная. У неоперированных пациентов (группа 1) выявили хронический дуоденит в 7 (12,9%) случаях. После холецистэктомии (группа 2+3) число дуоденитов увеличилось более, чем в 2 раза: оно выросло до 18 (27,7%) (Рис. 2).
Суммарно у оперированных (группа 2+3) наблюдалось почти в 2 раза больше больных с гастритом — 48 (73,8%) случаев, чем в группе 1 — 21 (38,9%). Диффузный атрофический гастрит в группе 2+3 стал наблюдаться в 4 раза чаще — в 12 (25% от числа лиц с гастритом) случаях, в то время как в группе 1 (до операции) эти цифры составляли 3 (5,6%) случая.
Частота гастрита, обусловленного билиарным рефлюксом, после операции (в группе 2+3) увеличилась с 18 (33,3%) случаев — у неоперированных в группе 1, до 36 (55,4% от числа всех прооперированных) у оперированных.
Частота хронического эзофагита в группе 2+3 также увеличилась — с 5 (9,2%) случаев среди неоперированных до 8 (12,3%) — после хирургического вмешательства.
Данные сравнительной 4 группы свидетельствовали, что у здоровых лиц все вышеперечисленные изменения встречались очень редко. Дуоденит обнаружен в 5 (10%) случаях, случаев гастрита было всего 4 (8%): диффузного атрофического гастрита — 2 (4%) и рефлюкс-гастрита — 2 (4%). Эзофагит верифицирован также в 2 (4%) случаях.
Хронический дуоденит
Хронический гастрит всего
Диффузный атрофический гастрит
Рефлюкс-гастрит
Хронический эзофагит

38.9
33,8
5,6
____13
33,3
25,4
9,2
_ 6'3
_6
О 5 10 15 20 25 30 35 40 45
Группа 1 ■ I Группа 3
I Группа 2 Группа 4
Рис. 2. Характер и частота эндоскопических изменений верхних отделов ЖКТ при ЖКБ.
Хронический дуоденит
Хронический рефлюкс-гастрит
Гастрит с частичной атрофией желез
Распространённый атрофический гастрит
Хронический эзофагит с умеренной лимфоцитарной инфильтрацией
I
Калибатов Р.М., Асланов А.Д., Логвина О.Е. и др.
ПАТОМОРФОЛОГИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В ОТДАЛЕННОМ ПЕРИОДЕ ПОСЛЕ МИНИИНВАЗИВНОЙ ХОЛЕЦИСТЭКТОМИИ
12,9
_____________ 47,7
------------- 36,9
Неоперированные (Группа 1)
9,2
_______ 20
_______15,4
14,8
,____ 73,8
_______27,7
До 1 года после операции (Группа 2)
9,2
18,5 "12,3
40,1
___________________________ 61,6
О 10 20 30 40 50 60 70 80 90
Группа 1
Группа 2
I Группа 3
Группа 4
Гистологическая картина, свойственная хроническому дуодениту, наблюдалась в группе 2 у 31 (47,7% от числа всех прооперированных) больного, а в группе 3 их было несколько меньше — 24 (36,9% от числа всех прооперированных). То есть, разница была небольшая. А вот в группе 1 дуоденит наблюдался только у 7 (12,9% больных) — разница с послеоперационными данными была большая.
Признаки дуоденального заброса желчи в желудок с развитием рефлюкс-гастрита в группе 2 встречались очень часто — у 48 (73,8% от числа всех прооперированных) больных. В группе 3 они встречались реже — у 18 (27,7% от числа всех прооперированных), что меньше, более, чем на 50%. У неоперированных, в группе 1, рефлюкс-гастрит встречался намного реже, чем в группах 2 и 3 — у 8 (14,8%) пациентов с калькулезным холециститом.
Более 3 лет после операции (Группа 3)
Здоровые (Группа 4)
I ЕС2 клетки ■ ■ L-клетки РР-клетки
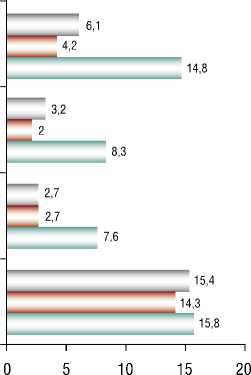
Рис. 4. Количественная плотность клеток эпителия двенадцатиперстной кишки до и в различные сроки после холецистэктомии.
В послеоперационном периоде гастрит с признаками частичной атрофии желез в группе 2 наблюдался у 12 (18,5% от числа всех прооперированных) больных, а в группе 3 — реже, у 8 (12,3% от числа всех прооперированных). У неоперированных, в группе 1, такие изменения встречались еще реже — у 5 (9,2%) пациентов.
Морфологические признаки распространенного атрофического гастрита в послеоперационном периоде в группе 2 наблюдались очень часто — у 52 (80% от числа всех прооперированных) больных, а в группе 3 — у 40 (61,6% от числа всех прооперированных). У неоперированных (группа 1) данные изменения наблюдались в 22 (40,1%) случаях, что немало, но существенно меньше, чем у оперированных.
После холецистэктомии хронический эзофагит с признаками умеренной лимфоцитарной инфильтрации был выявлен в группе 2 — у 8 (12,3% от числа прооперированных) обследованных, а в группе 3 — у 6 (9,2% от числа всех прооперированных). В группе 1 данные изменения наблюдались реже — у 4 (7,4%) больных.
Проведенный анализ гистохимического исследования (Рис. 4) позволил установить, что наибольшее количество EC2-клеток, отвечающих за выработку мотилина, наблюдалось в группе сравнения — 15,4 и до

Калибатов Р.М., Асланов А.Д., Логвина О.Е. и др.
ПАТОМОРФОЛОГИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В ОТДАЛЕННОМ ПЕРИОДЕ ПОСЛЕ МИНИИНВАЗИВНОЙ ХОЛЕЦИСТЭКТОМИИ операции — 6,1 на 1 мм2 слизистой оболочки луковицы двенадцатиперстной кишки. После операции в группе 2 их количество снизилось до 3,2, а в группе 3 — до 2,7.
Количество L-клеток было наибольшим в группе сравнения — 14,3, а у неоперированных их стало 4,2. После холецистэктомии в группе 2 выявлено снижение количества L-клеток, продуцирующих глюкагон до 2, а в группе 3 их количество слегка повысилось до 2,7 на 1 мм2 слизистой оболочки луковицы двенадцатиперстной кишки.
В группе сравнения количество PP-клеток, продуцирующих панкреатический полипептид составило 15,8. У неоперированных данный показатель несколько снизился до 14,8.
У прооперированных в группе 2 показатель стал намного меньше и составил 8,3, а в 3 группе — 7,6 на 1 мм2 слизистой оболочки луковицы двенадцатиперстной кишки.
Обсуждение
В настоящее время уже не требует доказательств то, что результаты хирургического лечения ЖКБ определяются не только тяжестью морфологических изменений в желчном пузыре и билиарной системе. Об этом сообщали И.В. Козлова и Е.В. Граушкина [15; 16]. По их данным, изменения пищеварительной системы, появляющиеся при отсутствии желчного пузыря в отдаленные сроки, клинически появляются в виде абдоминального болевого синдрома и желудочной диспепсии у 57,5% пациентов.
По результатам иммуногистохимического анализа установлено, что основным механизмом сохранения описанных клинических симптомов, эндоскопических и морфологических проявлений, подтверждающих их, является реакция ДЭС: на фоне воспаления до и после холецистэктомии снижалась плотность клеток эпителия, продуцирующих мотилин, панкреатический полипептид и глюкагон. С увеличением срока, прошедшего после операции, наблюдалось существенное снижение количественной плотности исследуемых типов клеток.
Даже в сроки более 3 лет после операции эти явления сохранялись.
Заключение

Калибатов Р.М., Асланов А.Д., Логвина О.Е. и др.
ПАТОМОРФОЛОГИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В ОТДАЛЕННОМ ПЕРИОДЕ ПОСЛЕ МИНИИНВАЗИВНОЙ ХОЛЕЦИСТЭКТОМИИ
Список литературы Патоморфологические и функциональные изменения желудочно-кишечного тракта в отдаленном периоде после миниинвазивной холецистэктомии
- Ивашкин В.Т., Маев И.В., Баранская Е.К. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению желчнокаменной болезни // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2016. — №26(3). — С.64-80. doi: 10.22416/1382-4376-2016-26-3-64-80.
- Кукош М.В., Федоров В.Э. Логвина О.А. Эпидемиологические особенности течения неопухолевой механической желтухи (сравнительный клинико-статистический обзор) // Медицинский альманах. — 2019. — №3-4(60). — С.102-109.
- De Oliveira SA, Lemos TE, De Medeiras AC. Acute acalculous cholecystitis in critically ill patients: risk factors, diagnosis and treatment strategies. Journal of the Pancreas 2016; 17(6): 580-586.
- EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstone. Journal of Hepatology. 2016; 65: j146-181. doi:10.1016/j.jhep.2016.03.005.
- Хамдамов Б.З., Мирходжаев И.А., Хайдаров Ф.Н., Хамдамов И.Б. Дифференцированный подход в хирургическом лечении острого калькулёзного холецистита, осложненного гнойным холангитом // Тошкент тиббиёт академияси ахборотномаси. — 2021. — №4. — С.167-170.
- Pisano M, Ceresoli M, Cimbanassi S, et al. 2017 WSES and SICG guidelines on acute calcolous cholecystitis in elderly population. World J Emerg Surg. 2019; 14: 10. doi: 10.1186/s13017-019-0224-7.
- Gaziev K.U. Current Views on Laparoscopic Cholecystectomy. Central Asian Journal of Medical and Natural Sciences. 2022; 3: 767-774.
- Маев И.В. Коррекция проявлений холестаза у больных с калькулезным холециститом, перенесшим холецистэктомию // Практикующий врач. — 2006. — №1. — С.29-35.
- Пальцев М.А. Руководство по нейроиммуноэндокринологии. — М.: Медицина, 2006. — С.304-311.
- Яглов В.В., Яглова Н.В. Новые концепции биологии диффузной эндокринной системы: итоги и перспективы ее изучения // Вестник РАМН. — 2012. — №4. — С.74-81.
- De Lellis R, Dayal Y. The Neuroendocrine System. In: Histology for Pathologists (3rd ed.). Lippincott Williams & Wilkins, a Wolters Kluwer business. 2007; 1240 p.
- Хавкин А.И., Гурина О.П., Дементьева Е.А., Блинов А.Е., Варламова О.Н. Современные возможности лабораторной диагностики нарушений функций желудочно-кишечного тракта // Экспериментальная и клиническая гастроэнтерология. — 2020. — 178(6). — С.173-185.
- Бельмер С.В., Разумовский А.Ю., Хавкин А.И. и др. Болезни желудка и двенадцатиперстной кишки у детей. М.: МЕДПРАКТИКА-М, 2017. — 536 с.
- Drucher DJ. Evolving concepts and translational relevance of enteroendocrine cell biology. The Journal of Clinical Endocrinology and Metabolism. 2016; 101(3): 778-786. doi: 10.1210/jc.2015-3449.
- Граушкина Е.В., Козлова И.В., Федоров В.Э. Морфометрический анализ некоторых компонентов диффузной эндокринной системы эзофагогастродуоденальной зоны в различные сроки после холецистэктомии // Саратовский научно-медицинский журнал. — 2009. — Т.5. — №3. — С.342–347.
- Козлова И.В., Граушкина Е.В., Волков С.В. Клинико-функциональные и структурные нарушения гастродуоденальной зоны после холецистэктомии // Врач. — 2010. — №9. — С.72-76.
- Федоров В.Э., Козлова И.В., Граушкина Е.В. Состояние пищевода, желудка и двенадцатиперстной кишки после холецистэктомии // Медицинский альманах. — 2010. — №1(10). — С.140-142.
- Александрович Ю.С., Гордеев В.И. Оценочные и прогностические шкалы в медицине критических состояний. — СПб, 2010. — С.12-21.
- Осадчук М.А., Калинин. А.В., Липатова Т.Е., Усик С.Ф., Кветной И.М. Роль диффузной нейроэндокринной системы в патогенезе и исходе гастроэзофагеальной рефлюксной болезни // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2007. — №3. — С.35-39.
- Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. 4-е изд. — Казань, 2012. — 624 с.


