Патоморфологические изменения почек у пациентов с диабетической нефропатией
Автор: Гусятникова Ю.И., Маклакова А.Д., Мишечкин М.М., Харитонов С.В.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 7 т.12, 2024 года.
Бесплатный доступ
Диабетическая нефропатия является тяжелым осложнением сахарного диабета. Целью работы стало изучение патоморфологических изменений почек у пациентов с диабетической нефропатией по данным научной литературы. Описано значение метаболических нарушений (повышение глюкозы и липидов в крови) и гемодинамических аспектов поражения почек при сахарном диабете.
Альбуминурия, диабетическая нефропатия, повреждение подоцитов, сахарный диабет
Короткий адрес: https://sciup.org/147250574
IDR: 147250574 | УДК: 616.61-004.6:616.43
Текст научной статьи Патоморфологические изменения почек у пациентов с диабетической нефропатией
Статистика в России также тревожная: на начало 2021 г. на диспансерном учете находится почти 5 миллионов пациентов с СД [1].
Диабетическая нефропатия (ДН) – одно из самых опасных осложнений сахарного диабета, возникающее вследствие повреждения сосудов. Согласно исследованиям, ДН развивается у более чем четверти пациентов с СД 1-го типа и у более чем 15% пациентов с СД
2-го типа [2]. ДН приводит к формированию хронической болезни почек (ХБП), ограничивая качество жизни и повышая риск преждевременной смерти [3].
Целью работы стало изучение патоморфологических изменений почек у пациентов с диабетической нефропатией по данным научной литературы.
Патогенез диабетической нефропатии. Повышенный уровень глюкозы в крови и давление в почечных клубочках - лишь часть проблемы, с которой сталкиваются пациенты с СД. Изучая процессы поражения почек у таких пациентов, ученые обращают внимание на сложность их механизмов. Помимо метаболических нарушений (повышение глюкозы и липидов в крови) и гемодинамических аспектов (внутриклубочковая гипертензия и артериальная гипертензия), существуют и другие факторы, влияющие на развитие ДН.
Гипергликемия. Существует несколько путей воздействия данного фактора. Во-первых, ферментативный процесс гликозилирования, который приводит к присоединению остатков сахаров к органическим молекулам, что ведет к изменениям в функциях и свойствах тканей. Конечные продукты гликозилирования оказывают влияние на метаболизм коллагена, миелина, ДНК. Нарушение конфигурации структурных белков базальной мембраны клубочков и мезангия, происходящее в результате гликозилирования, приводит к замедлению метаболизма основных белковых компонентов почечных структур. Этот процесс сопровождается утолщением базальных мембран сосудов и увеличением объема мезангиального матрикса [4].
Конечные продукты гликирования, образовавшиеся в базальной мембране клубочков (БМК), фиксируют на ней альбумин, иммуноглобулин G, что приводит к ее утолщению, отложению иммунных комплексов, которые влекут за собой изменение свойств и структуры компонентов клубочкового матрикса [5]. Продукты гликозилирования вызывают перекисное окисление липидов с нарушением биоактивности липидных структур, их транспортировки и расщепления. В клетки продолжает поступать липопротеиды низкой плотности (ЛПНП), несмотря на избыточное насыщение ими. В ответ клетки сосудов выделяют провоспалительные медиаторы, вызывая макро- и микрососудистые осложнения [6].
Происходит нарушение внутрипочечной гемодинамики и гиперфильтрация почек. Увеличение площади фильтрации и давления внутри клубочков приводят к изменению стенки приносящих кровь сосудов и образованию новых патологических сосудов, но уже с тонкой структурой и набухшими эндотелиоцитами, к утечке белков из фильтрующейся плазмы крови, что является первопричиной гипертрофии почечных клубочков и ДН [7].
Гиперлипидемия. Гиперлипидемия является одним из ключевых факторов в формировании диабетической нефропатии, оказывая значительное влияние на развитие данного заболевания. Повышение уровня общего холестерина, ЛПНП и липопротеидов очень низкой плотности (ЛПОНП), а также снижение липопротеидов высокой плотности (ЛПВП) создают неблагоприятную среду для работы почек. Окисленные ЛПНП, ростовые факторы и цитокины активизируют процессы склерозирования клубочков, что приводит к деструкции почечных структур. Имеющиеся данные также указывают на то, что липиды, проникающие в первичную мочу, способны вызывать повреждения в клетках почечных канальцев [8].
Внутриклубочковая гипертензия. Работа ренин-ангиотензин-альдостероновой системы (РААС) представляет собой сложный механизм регуляции гомеостаза организма. Важную роль в этой системе играет ренин. С его помощью происходит превращение ангиотензиногена в ангиотензин (АТ) I, а затем в АТ II. Последний воздействует на рецепторы АТ I и АТ II, причем основное воздействие наблюдается на рецептор АТ I, вызывая биологические ответы, включая провоспалительные и пролиферативные процессы.
Существует подтверждение того, локально-почечный АТ II синтезируется в собирательных трубках нефрона. Из-за того, что при СД повышена активность локальнопочечного АТ II, происходит активное воздействие на рецепторы сосудов АТ I. Это приводит к спазму артериол и развитию клубочковой гипертензии (рис. 1), которая может прогрессировать до замещения соединительной тканью клубочков. В современной медицине особое внимание уделяется исследованию воздействия стимуляции рецепторов АТ I на организм. Этот процесс активизирует синтез провоспалительных цитокинов, что, в свою очередь, оказывает влияние на развитие гломерулосклероза, тубулоинтерстициального фиброза и хронической почечной недостаточности [9].
|
Хроническая к артериола гипергликемия Эндотелиальная \ Л дисфункция / Оксид азота NO ' |
Выносящая Симпатикотония артериола /] к / пг Повышение 1 ( активности J \ ангиотензина II \ Повышение чувствительности к 11 катехоламинам ГИПЕРФИЛЬТРАЦИЯ ГИПЕРАКТИВАЦИЯ РААС -------- ПОВРЕЖДЕНИЕ БМ |
Рис. 1. Формирование внутриклубочковой гипертензии у пациентов с сахарным диабетом.
Системная гипертензия Приносящая
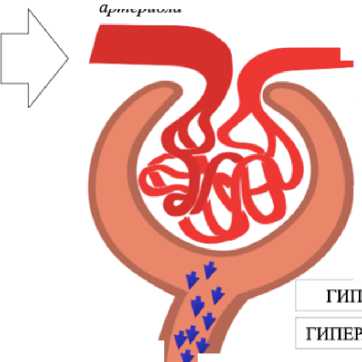

Повреждение подоцитов. Подоциты – висцеральные эпителиальные клетки, которые покрывают капилляры клубочков в почках, представляют собой основной компонент щелевой диафрагмы клубочков в капсулах Боумена-Шумлянского. Экспериментальные и клинические исследования позволили углубить понимание механизмов развития микроальбуминурии и протеинурии. Обнаружено, что повреждение подоцитов играет ключевую роль в патогенезе этих состояний [10].
В экспериментальных и клинических исследованиях установлена тесная взаимосвязь между нарушением функции подоцитов и развитием альбуминурии [11, 12]. Эти открытия показывают новые перспективы для более точного диагностирования и лечения заболеваний почек, связанных с нарушениями функции подоцитов.
Исследования показали, что подоциты в почках чувствительны к различным воздействиям, таким как метаболические, токсические и гемодинамические факторы. Это приводит к структурным и функциональным изменениям – «подоцитопатии» [13]. Согласно данным исследований, поражение подоцитов в почках начинается уже на ранних стадиях СД, задолго до появления микроальбуминурии [11].
В результате снижения проницаемости щелевидной диафрагмы, гипертрофии и апоптоза происходит сглаживание ножек подоцитов. Эту патологическую реакцию можно подтвердить с помощью выявления в моче подоцина и нефрина, так как эти структурные белки слущиваются с базальной мембраны [10].
МикроРНК-192
ПОДОЦИТ
Коночные продукты гликирования
Гипергликемия
Ренин-ангиотензиновая система
Эпителиальномезенхимальная трансдифференциация
Альбуминурия протеинурия
Диабетическая нефропатия
4, Адипонек тина
Слияние ножковых отростков
Свободные окисленные радикалы
Гемодинамическое воздействие
Отделение от БМК
Апоптоз
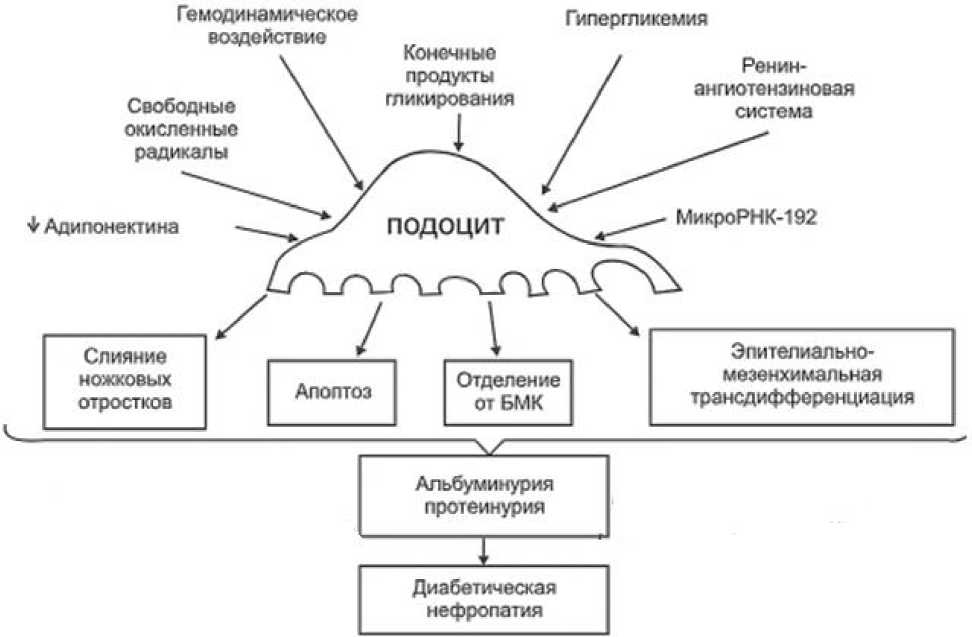
Рис. 2. Механизм повреждения подоцитов при диабетической нефропатии.
Феномен «сглаживания ножковых отростков» это сложная реакция эпителиальной клетки на воздействие губящего фактора. Конечным итогом этой реакции становится реорганизация актинового цитоскелета в уплотненную структуру и изменения в строении щелевидной диафрагмы, увеличивая, тем самым, гломерулярную фильтрацию [13].
В ходе экспериментов было доказано, что мембраноатакующий комплекс вызывает разрушение цитоскелета подоцита и отделение нефрина, который выводится через мочу. Нефрин, трансмембранный белок, основной компонент фильтрационных щелей, учавствующий в формировании щелевой диафрагмы посредством связывания с актиновым цитоскелетом.
При использовании электронной микроскопии в ткани почки еще до развития протеинурии обнаруживаются фокусы деструкции щелевидной диафрагмы, соответствующие участкам сглаженных отростков подоцитов и сниженной экспрессии нефрина. С увеличением протеинурии количество этих дефектов повышается, и они перемежаются с неповрежденными областями, распределяясь неравномерно. Поэтому высокая нефринурия у пациентов с СД может рассматриваться как ранний признак развития ДН [14].
Заключение. Сложность выявления диабетической нефропатии на начальной ее стадии заключается в отсутствии клинической картины и лабораторных изменений. Когда выявляется альбуминурия, в почках уже присутствуют структурные и функциональные изменения. При вовремя начатом лечении и хорошем гликемическом контроле возможна обратимость данных изменений. Осложнения, связанные с диабетом, могут серьезно угрожать здоровью и даже жизни человека. Поэтому важно принимать меры для контроля уровня сахара в крови и регулярно проходить обследования для выявления возможных осложнений, включая диабетическую нефропатию. Раннее обнаружение и лечение этого осложнения помогут предотвратить серьезные проблемы в будущем.
Важна профилактика как самого сахарного диабета, так и сосудистых осложнений, а это требует необходимости своевременного донесения информации до пациентов о важности изменения образа жизни и постоянном контроле гликемии.


