Патоморфологические изменения правой ножки пучка Гиса проводящей системы сердца человека при инфекционных заболеваниях
Автор: Мозгалва Наталья Владимировна, Пархоменко Юрий Георгиевич, Чукбар Александр Владимирович, Колесников Лев Львович, Тишкевич Олег Александрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.23, 2015 года.
Бесплатный доступ
Проведено исследование патоморфологических изменений правой ножки пучка Гиса проводящей системы сердца у 100 лиц, умерших от различных инфекционных заболеваний: дифтерии, инфекционного эндокардита у наркоманов в сочетании с ВИЧ-инфекцией и без ВИЧ-инфекции, менингококковой инфекции, стафилококковой пневмонии и рожистого воспаления. Показано, что поражение правой ножки менее выражено, чем в рабочем миокарде и более характерно для длительного течения заболевания с большей частотой воспалительных изменений в дистальной части правой ножки.
Проводящая система сердца, правая ножка пучка гиса, инфекционные заболевания, инфекционный эндокардит, дифтерия
Короткий адрес: https://sciup.org/143177050
IDR: 143177050
Текст научной статьи Патоморфологические изменения правой ножки пучка Гиса проводящей системы сердца человека при инфекционных заболеваниях
Введение. При некоторых инфекционных заболеваниях, таких как дифтерия, инфекционный эндокардит, сердце является «органом-мишенью», и его прямое поражение становится непосредственной причиной смерти больного [1,
3-4, 9, 11]. В то же время, сердечно-сосудистая недостаточность в составе синдрома полиорганной недостаточности может быть одним из ведущих компонентов танатогенеза практически при любом инфекционном заболевании. Наряду с общими закономерностями поражения сердца при различной инфекционной патологии представляет интерес анализ степени и частоты вовлечения в патологический процесс проводящей системы сердца, в частности, правой ножки пучка Гиса (ПН).
Цель исследования – изучить патоморфо-логические особенности ПН при инфекционных заболеваниях.
Материал и методы исследования. Объектом исследования послужили сердца пациентов, умерших от инфекционных заболеваний, всего 100 случаев. Исследованы сердца пациентов, умерших от дифтерии (60 случаев), инфекционного эндокардита (ИЭ) у наркоманов в сочетании с ВИЧ-инфекцией (22 случая) и без ВИЧ-инфекции (5 случаев), менингококковой инфекции (5 случаев), стафилококковой пневмонии (5 случаев) и рожистого воспаления (3 случая). Исследование ПН проводилось по модифицированной методике, предложенной Ю.Г. Пархоменко и соавт. [7]. Полученные на аутопсии кусочки сердца заливали в парафин с последующим изготовлением серийных срезов, которые окрашивали гематоксилином и эозином, по Ван Гизону, ШИФФ-реактивом. Для стандартизации оценки изменений в ПН выделены 2 части: проксимальная, начинающаяся от предсердно-желудочкового узла и проходящая в межжелудочковой перегородке, и дистальная, проходящая в перегородочно-краевой трабекуле к передней сосочковой мышце. Условной границей между проксимальной и дистальной частями ПН считали основание перегородочно-краевой трабекулы. При микроскопическом исследовании оценивали состояние не только ПН, но и окружающих ее структур сердца.
Результаты исследования и их обсуждение. Для случаев смерти от дифтерии, вызванной различными коринебактериями, было характер-
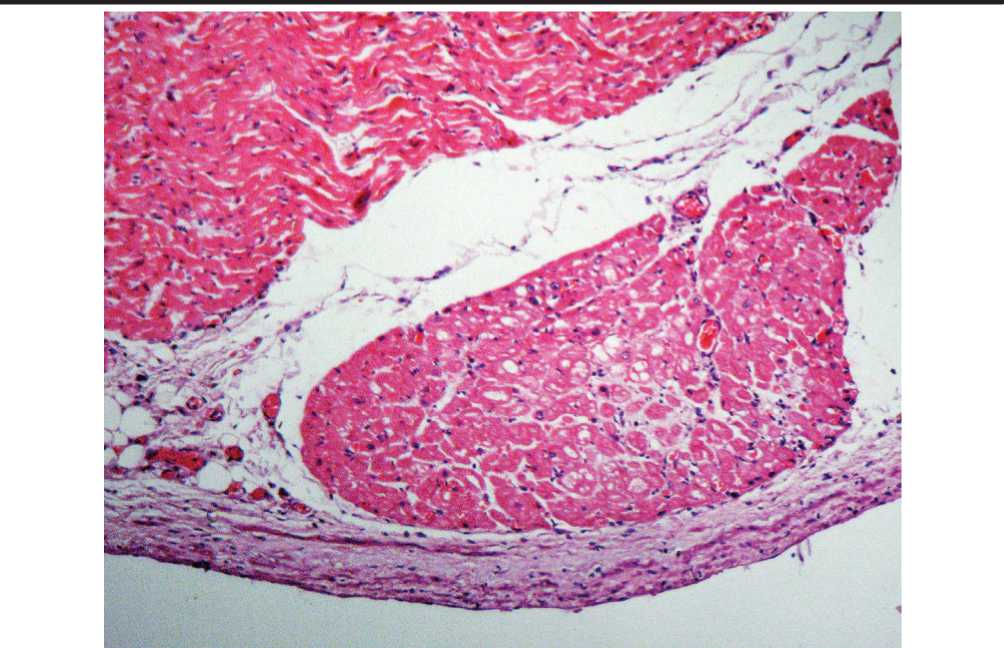
Рис. 1. Правая ножка пучка Гиса при инфекционном эндокардите у ВИЧ-инфицированного наркомана (дистальная часть). Правая ножка в виде округлого скопления вакуолизированных кардиомиоцитов располагается под утолщенным эндокардом, отделена от рабочего миокарда рыхлой соединительной тканью. Окраска гематоксилином и эозином, Х10.
ным выявление поражение миокарда во всех исследованных случаях (60 сердец), [4, 11]. При этом было выделено 3 группы по преобладающим патологическим признакам: с преимущественно циркуляторно-дистрофическими, воспалительными и склеротическими изменениями (25, 29 и 6 случаев соответственно), [4]. В первой группе, соответствующей острой фазе болезни (умершие на 2-10 день от начала заболевания), дистрофия проводящих миоцитов ПН была выявлена в 5 случаях (12%) и характеризовалась их вакуолизацией и нечеткостью контуров в сочетании с кровоизлияниями. Встречались мелкоочаговые лимфогисти-оцитарные инфильтраты. В рабочем миокарде в наблюдениях этой группы преобладали явления вакуолизации или миолиза кардиомиоцитов при отсутствии или незначительной выраженности воспалительной клеточной реакции, при этом в 13 случаях (45%) наблюдались массивные субэндокардиальные кровоизлияния в желудочках. Во второй группе (умершие с 6-го по 28 день от начала заболевания) в 6 случаях (7%) обнаружена лишь вакуольная дистрофия клеток ПН, в 7 случаях (24%) встречались некрозы, воспалительная инфильтрация и дистрофические изменения проводящих кардиомиоцитов. В окружающем миокарде при этом развивалась преимущественно воспалительная реакция, выраженная дистрофия, вплоть до миолиза кардиомиоцитов и диффузная и очаговая межуточная лимфогистиоцитарная инфильтрация с примесью полиморфноядерных лейкоцитов различной степени выраженности. В третьей группе (длительность течения заболевания более 30 дней) в рабочем миокарде преобладали склеротические изменения, при этом патологических процессов в ПН зафиксировано не было.
При ИЭ (27 случаев) смерть наступила на 3-64 сутки от возникновения клинических проявлений: в 24 случаях при развитии септикопиемии, в 3 случаях – от сочетания ИЭ и вторичных ВИЧ-ас-социированных инфекций, в том числе в 1 случае с развитием дилятационной кардиомиопатии после перенесенного ИЭ. В качестве возбудителя ИЭ в 89% (24 случая) выявлен Staphylococcus aureus, изолированно (10 случаев, 37%) или в сочетании с другими микробами (14 случаев, 52%). В поли-микробных ассоциациях помимо стафилококка
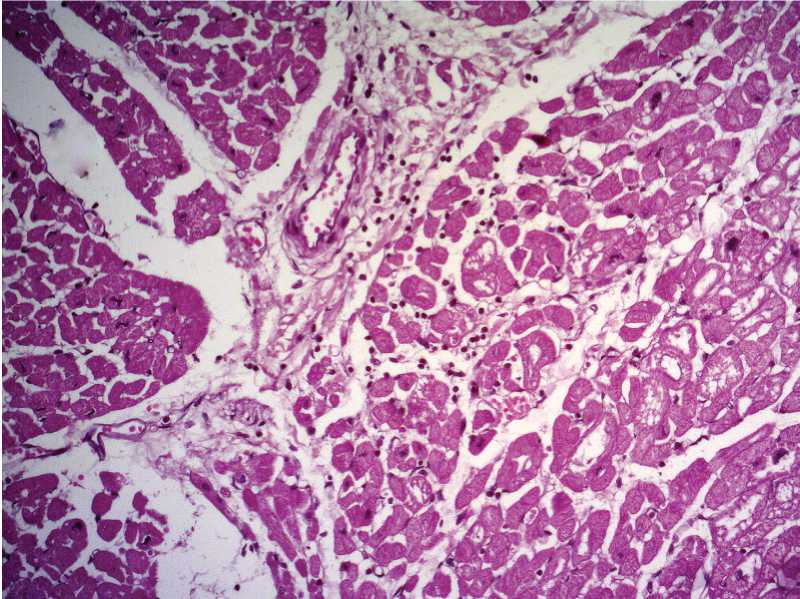
Рис. 2. Правая ножка пучка Гиса при инфекционном эндокардите у ВИЧ-инфицированного наркомана (дистальная часть). Очаговая лимфоидная инфильтрация окружающей клетчатки на границе с рабочим миокардом с распространением на проводящие кардиомиоциты. Окраска гематоксилином и эозином, Х20.
преобладали Klebsiella pneumoniae и грибы рода Candida (до 30%). Патологические изменения сократительного миокарда и других структур сердца были зарегистрированы во всех наблюдениях и проявлялись дистрофией и некрозом кардиомиоцитов, пристеночным эндокардитом, межуточной и паренхиматозной инфильтрацией миокарда вплоть до формирования абсцессов, эндокардиофиброзом и очаговым фиброзом миокарда, липоматозом.
ПН определялась в виде округлых или треугольной формы скоплений поперечно срезанных проводящих кардиомиоцитов, чаще окруженных рыхлой волокнистой соединительной тканью, причем в дистальной части располагалась субэн-докардиально в виде одного или двух (редко 3-х) стволов, а в проксимальной – преимущественно интрамиокардиально в виде одиночного ствола, реже (4 случая) в виде 2-х стволов (Рис. 1). Па-томорфологические изменения ПН проявлялись преимущественно нечеткостью контуров и некрозами проводящих кардиомиоцитов, отеком, воспалительной инфильтрацией внутри ПН и в окружающей ее клетчатке, очаговым фиброзом, некрозами кардиомиоцитов. Воспалительные изменения ПН встречались в 15 случаях (56%), причем в дистальной части в 2 раза чаще, чем в проксимальной (10 и 5 случаев соответственно, p<0,01), проявляясь очаговой воспалительной инфильтрацией преимущественно лимфогисти-оцитарного характера в окружающей ПН клетчатке, распространяющейся на межклеточное пространство ПН (рис. 2). При сопоставлении локализации эндокардита (правая или левая половина сердца) и развившихся воспалительных изменений отмечено, что для рабочего миокарда (РМ) и кардиомиоцитов ПН характерна сходная тенденция: максимальные воспалительные изменения зарегистрированы при двухстороннем ИЭ, минимальные - при правостороннем ИЭ, случаи ИЭ левой половины сердца занимают промежуточное положение. При этом общая частота обнаружения воспалительной инфильтрации в ПН была в среднем на 15 % меньше, чем в рабочем миокарде. Некрозы проводящих кардиомиоцитов наблюдались только при левостороннем и двухстороннем поражении сердца (8 случаев). Зарегистрированные явления фиброзирования ПН и РМ в большинстве случаев приходились на ИЭ левой половины сердца (7 из 9 для ПН, 8 из 12 для РМ). Фиброз РМ при двухстороннем ИЭ был отмечен лишь в 1 случае, а в ПН не наблюдался.
Достоверных различий в характере поражения ПН в случае наличия или отсутствия ВИЧ-инфекции обнаружено не было.
При стафилококковой пневмонии (5 случаев) и рожистом воспалении (3 случая) смерть наступала на 5-7 сутки. Характерным было выявление в рабочем миокарде субэндокардиальных кровоизлияний различной выраженности, дистрофии и некрозов кардиомиоцитов. При этом не наблюдалось вовлечения в патологический процесс элементов ПН, [6].
При генерализованной менингококковой инфекции , вызванной менингококками группы А и B, (5 случаев, смерть на 2-3 сутки) наблюдался выраженный геморрагический синдром, характеризующийся развитием в большинстве случаев (4) массивных, распространенных субэндокардиальных кровоизлияний. В ПН в 2 случаях определялись расстройства микроциркуляции в виде стаза эритроцитов, сладж-феномена, также выявлялась нечеткость контуров кардиомиоцитов и их миолиз. Аналогичные изменения наблюдались в рабочем миокарде.
По полученным нами данным, совпадающим с данными литературы, ПН на своем протяжении в основном представлена компактным одиночным пучком узких веретенообразных клеток, располагающимся интрамиокардиально. Однако ее дистальная часть сформирована другим типом клеток – крупными, вакуолизированными, Пуркинье-подобными клетками, которые в виде одного или нескольких пучков занимают, как правило, субэндокардиальное положение. Причем на всем протяжении ПН отграничена от окружающих структур лишь прослойкой рыхлой волокнистой соединительной ткани [5, 8]. Указанные структурно-топографические особенности ПН с одной стороны объясняют меньшую по сравнению с рабочим миокардом вовлеченность ПН в патологический процесс, с другой стороны – относительно более частое поражение дистальной части ПН по сравнению с проксимальной. Это соотносится с имеющимися в литературе данными об общих топографических закономерностях поражения сердца при миокардитах различной этиологии, согласно которым наиболее уязвимыми являются папиллярные мышцы и мясистые трабекулы, а также субэндокардиальные отделы сердца [10]. Это, в частности, связывают с выделением поврежденным эндотелием субстанций, оказывающих угнетающее действие на сократительную функцию подлежащих миоцитов [3-4, 6, 12].
Отмеченная взаимосвязь между выраженностью патологических изменений в ПН и локализацией ИЭ (наибольшее поражение при лево- и двухстороннем ИЭ) связана, по-видимому, с развивающимся метастазированием инфекцион- ного агента по большому кругу кровообращения и вторичным поражением сердца. При этом фиброзирование, как косвенный признак репарации, не характерно для двухстороннего эндокардита, который за счет более тяжелого течения, вероятно, приводит к летальному исходу ранее, чем успевают начаться репаративные процессы.
Выводы:
Патоморфологические изменения ПН при исследованных инфекционных заболеваниях были относительно менее выражены и встречались реже, чем в сократительном миокарде.
Максимально выраженное поражение ПН определялось в ее дистальной части, что объясняется структурно-топографическими особенностями ПН, и выражалось преимущественно дистрофическими изменениями в ранних фазах инфекционных заболеваний и воспалительными изменениями с развитием фиброза при их длительном течении.
В случае инфекционного эндокардита наибольшая выраженность патологических изменений ПН была характерна для левостороннего эндокардита и ИЭ с вовлечением обеих половин сердца.
Список литературы Патоморфологические изменения правой ножки пучка Гиса проводящей системы сердца человека при инфекционных заболеваниях
- Кадырова С.Н. Морфологические особенности дифтерии у взрослых в современных условиях/ С.Н. Кадырова, В.А. Цинзерлинг, Д.В. Комарова //Архив патологии. - 1996 г. - №6. - с. 28-32.
- Мозгалёва Н.В. Морфологические изменения правой ножки пучка Гиса при инфекционном эндокардите у ВИЧ-инфицированных наркоманов/ Н.В. Мозгалёва, Ю. Г. Пархоменко, А.В. Чукбар// Международная научная конференция «Актуальные вопросы морфогенеза в норме и патологии», г.Москва, 16-17.04.2014 г., Сборник тезисов, с.193-195
- Моисеева О.М. Спорные вопросы диагностики миокардитов/О.М. Моисеева, Л.Б. Митрофанова,А.В. Пахомов, Н.А. Митрофанов [и др.]//Сердце: журнал для практикующих врачей. - 2010. - Т. 9. -№4. - с.234-241.
- Пархоменко Ю.Г. Структурные закономерности морфологических изменений проводящей системы сердца и окружающего миокарда при заболевании дифтерией/ Ю. Г. Пархоменко, А. В. Чукбар, О. А. Тишкевич // Российские морфологические ведомости. - 2000. - № 3-4. - с. 121-125.
- Пархоменко Ю.Г. Закономерности строения и топографии образований проводящей системы сердца человека с позиций биомеханики/ Ю.Г. Пархоменко, Ю.М. Аникин, А.В. Чукбар [и др.]// Российские морфологические ведомости. - 2000. - № 1-2. - с. 69-74.
- Пархоменко Ю.Г. Структурные закономерности морфологических изменений проводящей системы и окружающего миокарда при менингококцемии, стафилококковой пневмонии и роже/ Ю. Г. Пархоменко, A. В. Чукбар, О. A. Тишкевич // Российские морфологические ведомости. - 2001. - № 3-4. - с. 56.
- Пархоменко Ю.Г. К методике морфологического исследования проводящей системы сердца человека/ Ю.Г. Пархоменко, A.В. Чукбар, О.A. Тишкевич //Aрхив патологии. - 2003. - Т. 65. - № 4. - с. 55-57.
- Пархоменко Ю.Г. Особенности гистоархитектоники правой ножки предсердно-желудочкового пучка проводящей системы сердца/Ю. Г. Пархоменко, A. В. Чукбар, О. A. Тишкевич//Российские морфологические ведомости. - 1999. - № 3-4. - с. 133-136.
- Пархоменко Ю.Г., Зайратьянц О.В., Макарова О.В. Сепсис. Инфекционный эндокардит. Этиология, патогенез, классификация, патологическая анатомия/ Руководство для врачей. - М.: Группа МДВ. - 2013. - 104 с., табл.
- Пауков В.С., Казанская T.A., Фролов В.A. // Aрхив патологии. - 1972. - №1. - с. 25-31.
- Ющук Н.Д. Клинические и структурные параллели изменений проводящей системы сердца и миокарда у больных дифтерией / Н. Д. Ющук, Ю. Г. Пархоменко, A. В. Чукбар [и др.]// Терапевтический архив. - 2002. - № 11. - с. 33-37.
- S. Price, P. B. Anning, J.A. Mitchell, T. W. Evans// European Heart Journal. - 1999. - 20. - p. 715-724


