Патоморфологические изменения в головном мозге при экспериментальном моделировании хронической ишемии
Автор: Смирнов А.В., Шмидт М.В., Березин Е.В., Замараев В.С., Пютая Е.Д.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Обзорные статьи
Статья в выпуске: 2 (62), 2019 года.
Бесплатный доступ
При сравнительном качественном и количественном структурном анализе выявлены патоморфологические изменения в церебральной коре, гиппокампе, стриопаллидарной системе, мозжечке и стволе головного мозга при экспериментальном моделировании ишемической энцефалопатии путем частичной двусторонней перевязки обеих общих сонных артерий. Наиболее выраженные признаки повреждения, подтвержденные значимыми изменениями морфометрических параметров, обнаружены в грушевидных нейронах мозжечка (клетки Пуркинье), а также нейронов отдельных крупноклеточных ядер ствола головного мозга.
Головной мозг, ишемия, мозжечок, ствол головного мозга
Короткий адрес: https://sciup.org/142224322
IDR: 142224322 | УДК: 616.61-091
Текст научной статьи Патоморфологические изменения в головном мозге при экспериментальном моделировании хронической ишемии
Цереброваскулярные болезни (ЦВБ) – группа заболеваний головного мозга, обусловленных патологическими изменениями церебральных сосудов с нарушением мозгового кровообращения. Из хронических форм ЦВБ можно выделить церебральный атеросклероз, который характерен преимущественно для лиц пожилого возраста, однако встречается и у молодых людей с выраженными признаками метаболических нарушений. Наиболее частой локализацией атеросклеротических бляшек являются общая сонная артерия (ОСА), особенно в месте бифуркации. Выраженность клиникоморфологических изменений головного мозга определяется распространенностью патологического процесса, а также степенью стеноза [4].
Билатеральный стеноз общих сонных артерий (БССА, BCAS) – является одной из экспериментальных моделей нарушений мозгового кровотока, связанного с атеросклерозом коронарных артерий. Чаще всего данная модель используется для воспроизведения хронической ишемии головного мозга, сопровождающаяся развитием нейродегенеративных процессов, когнитивными расстройствами, что в клинической практике соответствует основным признакам сосудистой деменции [1, 5]. Анализ результатов научных исследований, базирующихся на данной модели, свидетельствует о развитии морфофункциональных изменений в наиболее чувствительных к гипоксии отделах головного мозга (церебральная кора, структуры гиппокампа), при этом практически отсутствует какая-либо информация о деталях патоморфо-логических изменений в стволовой части головного мозга и мозжечке [7].
ЦЕЛЬ РАБОТЫ
Выявить наличие и описать характер па-томорфологических изменений мозжечка, а также некоторых ядер продолговатого и заднего мозга крыс при частичном двустороннем стенозе общих сонных артерий.
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальные исследования проводили в условиях НИИ Фармакологии. В серии экспериментов (n = 10) хроническую недостаточность мозгового кровообращения вызывали частичным стенозированием общих сонных артерий, путем наложения трех лигатур. В результате кровоток по сонным артериям ограничивался в среднем на 50–60 %. Оценку уровня локального кровотока осуществляли до и после стенозирования ОСА – в месте сразу после наложения лигатур. Регистрацию проводили с помощью лазерного допплерографа Biopac Systems, Inc., США. Интактная группа животных аналогичных по весу, полу и возрасту состояла из 10 особей. Животные выводились из эксперимента на 30-й день после операции. Головной мозг фиксировали в 10%-м нейтральном формалине, с дальнейшим обезвоживанием в батарее спиртов и изготовлением парафиновых блоков. Срезы – толщиной 5–7 мкм. Производили окрашивание срезов гематоксилином и эозином, тионином по методу Ниссля. Фотодокументирование осуществляли цифровой фотокамерой Olympus (Япония). Оценку степени нейродегенеративных изменений головного мозга проводили путем подсчета относительной численной плотности поврежденных нейронов, которые делили на 2 группы: слабо-измененные нейроны (СН) с сохранением ядра, но со структурными или тинкториальными нарушениями компонентов цитоплазмы (набухание, гиперхроматоз, хроматолиз, центральная тинкториальная ацидофилия); грубо изме- ненные нейроны (ГН) с выраженным пикнозом, «тяжелыми изменениями», гомогенизирующими изменениями нейронов, появлением клеток-теней. Статистическую обработку данных проводили с использованием пакета программ Sta-tistica 6,0 (StatSoft, USA). Различия между группами оценивали по критерию Манна–Уитни (Mann-Whitney, U-test) и считали статистически значимыми при p < 0,05 [4].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Комплексное морфологическое и морфометрическое исследование срезов мозжечка продемонстрировало наличие значимых патологических изменений клеток Пуркинье коры. Изменения носили мозаичный и нерегулярный характер, проявляющийся чередованием дисто-фически измененных клеток с грушевидными клетками, имеющими нормальную морфологию. Патоморфологические изменения выражались в уменьшении объема клеточных тел и усилении базофилии цитоплазмы (рис. 1).
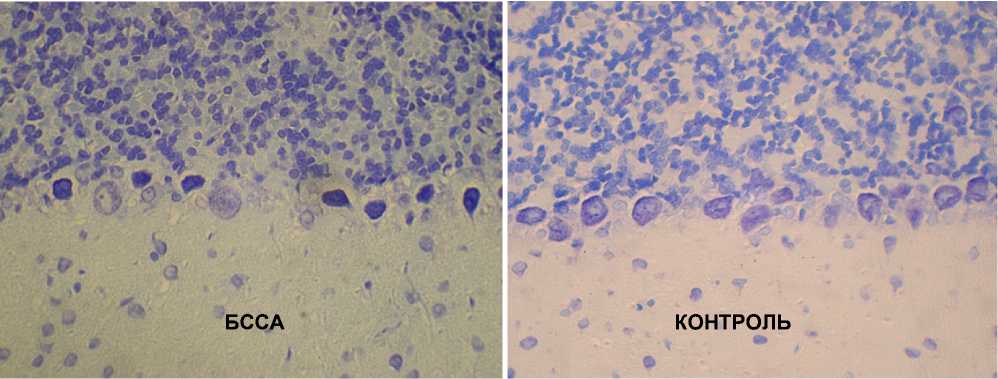
Рис.1. Уменьшение объема клеточных тел и усиление базофилии цитоплазмы клеток Пуркинье мозжечка. Головной мозг крысы. Окраска тионином по методу Ниссля. Ув. x 400
Пикнотические ядра таких клеток отличались более интенсивным окрашиванием, а также перераспределением гетерохроматина к периферии нуклеолеммы. Единичные клетки Пуркинье характеризовались выраженной гиперхромией и деформацией перикариона и ядра с признаками перицеллюлярного отека.
Статический анализ (табл. 1) продемонстрировал значительное увеличение относительной численной плотности слабо и грубо-поврежденных клеток [(17,60 ± 5,08 %) (39,04 ± 6,05 %) соответственно] по сравнению с контролем [(0,82 ± 0,52) % и (13,82 ± 4,94) % соответственно]. С другой стороны, не было выявлено достоверного уменьшения относительной площади перикарионов клеток Пуркинье (2,69 ± 0,25 % в опыте) по сравнению с интактными животными (2,75 ± 0,25 %).
В ядерных образованиях стволовой части головного мозга морфологические изменения носили нерегулярный характер. У части лабораторных животных (n = 3) значимые патоги-стологические изменения отсутствовали вовсе. В других наблюдениях (n = 5) изменения затрагивали отдельные ядерные образования и носили слабо выраженный характер. Так, в крупноклеточных двигательных ядрах тройничного и подъязычного нервов фиксировались единичные нейроны, характеризующиеся усилением базофилии ядра и цитоплазмы, без заметного уменьшения клеток в объеме. Только в единичных случаях (n = 2) выявлялись грубые изменения моторных нейронов подъязычного нерва со значительным пикнозом и гиперхромией перикарионов, при этом, нервные клетки приобретали вытянутую, палочкообразную форму (рис. 2). Дискриптивные данные подтверждались результатами статистического анализа, свидетельствующими о достоверном увеличении относительной численной плотности сла- боизмененных нейронов в двигательных ядрах тройничного нерва (V) и грубоизмененных нейронов в ядре подъязычного нерва (XII) (табл. 2). Тем не менее статистический показатель, отражающий относительную площадь нейронов, менялся незначительно. Для двигательного ядра тройничного нерва он составлял (6,47 ± 0, 38) %, при (7,23 ± 0,64) % в контроле, а для подъязычного нерва – (6,78 ± 0,54) % и (6,89 ± 0,77) % соответственно.
Таблица 1
Численная плотность дистрофически измененных клеток Пуркинье мозжечка M ± m, %
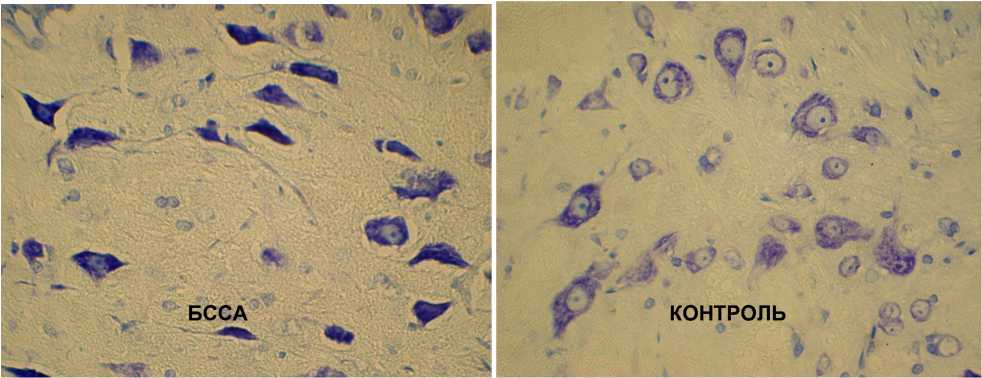
Рис. 2. Выраженный пикноз и гиперхромия крупноклеточных нейронов подъязычного нерва. Головной мозг крысы. Окраска тионином по методу Ниссля. Ув. x 400
|
Степень патоморфологических изменений |
Контроль |
Стеноз |
|
Неизмененные нейроны (НН) |
85,35 ± 4,90 |
43,35 ± 6,33* |
|
Слабоизмененные нейроны (СН) |
13,82 ± 4,94 |
39,04 ± 6,05* |
|
Грубо измененные нейроны (ГН) |
0,82 ± 0,52 |
17,60 ± 5,08* |
* Показатели статистически значимо отличаются от группы контроля при р < 0,05; Критерий Манна– Уитни.
Таблица 2
Численная плотность дистрофически измененных клеток отдельных ядерных образований ствола головного мозга M ± m, %
|
Ядерные образования ствола ГМ |
Степень патоморфологических изменений |
Контроль |
Стеноз |
|
V: моторное ядро тройничного нерва |
Неизмененные нейроны (НН) |
96,15 ± 2,77 |
71,58 ± 8,68* |
|
Слабоизмененные нейроны (СН) |
3,85 ± 2,77 |
28,42 ± 8,68* |
|
|
Грубо измененные нейроны (ГН) |
– |
– |
|
|
XII: ядро подъязычного нерва |
Неизмененные нейроны (НН) |
77,47 ± 7,49 |
53,47 ± 14,27 |
|
Слабоизмененные нейроны (СН) |
22,53 ± 7,49 |
30,03 ± 9,98 |
|
|
Грубо измененные нейроны (ГН) |
– |
16,49 ± 6,93* |
* Показатели статистически значимо отличаются от группы СД при р < 0,05; Критерий Манна–Уитни.
ЗАКЛЮЧЕНИЕ
Таким образом, морфологический и статистический анализ морфологических изменений, развивающихся в структурах головного мозга при месячном частичном билатеральном стенозе ОСА, свидетельствует о том, что данная модель приводит к развитию хронической гипоперфузии головного мозга и патоморфологиче- ским изменениям, развивающимся не только в церебральной коре, гиппокампе, стриопалли-дарной системе, но и в структурах мозжечка и стволе головного мозга. Полученные результаты, отражающие нейродегенеративные изменения клеток Пуркинье коры мозжечка, согласуются с литературными данными, свидетельствующими о высокой чувствительности данных клеток к ишемическому повреждению [1, 6]. В ядерных же образованиях ствола головного мозга патоморфологические изменения носили менее выраженный и нерегулярный характер, что, на наш взгляд, объясняется, во-первых, преимущественно вертебро-базилярным кровоснабжением данных отделов головного мозга, во-вторых, феноменом усиления растрокаудальной устойчивости нервных клеток головного мозга к повреждению, вызванному развитием острой или хронической ишемии [2, 3].
Список литературы Патоморфологические изменения в головном мозге при экспериментальном моделировании хронической ишемии
- A Novel Mouse Model of Ischemic Carotid Artery Disease / Y. Hattori [et al.] // PLoS ONE. - 2014. - № 9 (6). - Р. e100257. 10.1371/journal.pone. 0100257 DOI: 10.1371/journal.pone.0100257
- Brainstem Neurons Survive the Identical Ischemic Stress That Kills Higher Neurons: Insight to the Persistent Vegetative State / C. D. Brisson // PLoS ONE. - 2014. - № 9 (5). - Р. e96585. 10.1371/ journal.pone.0096585. DOI: 10.1371/journal.pone.0096585
- Brisson, C. D. A Distinct Boundary between the Higher Brain's Susceptibility to Ischemia and the Lower Brain's Resistance / C. D. Brisson, M. K. Lukewich, R. D. Andrew // PLoS ONE. -2013. - № 8 (11). - Р. e79589. 10.1371/journal. pone.0079589. DOI: 10.1371/journal.pone.0079589
- Carotid artery atherosclerosis, MRI indices of brain ischemia, aging, and cognitive impairment: The Framingham study / J. R. Romero [et al.] // Stroke. -2009. - № 40. - Р. 1590-1596. 10.1161/STR0-KEAHA. 108.535245. DOI: 10.1161/STR0-KEAHA.108.535245
- Dietmar, Rudolf Thal. Vascular dementia: different forms of vessel disorders contribute to the development of dementia in the elderly brain / Dietmar Rudolf Thal, Lea Tenenholz Grinberg, Johannes Attems // Exp Gerontol. - 2012. - № 47 (11). -Р. 816-824. DOI: 10.1016/j.exger.2012.05.023
- Inui, H. Matsunaga. Brainstem ischemic damage following occlusion of the blood vessels in the rat's posterior cerebral circulation / H. Inui, T. Murai -K. Yane, T. Matsunaga // Eur Arch Otorhinolaryngol. - 1996. - № 253. - Р. 176-181.
- Yorito Hattori, Junichiro Enmi, Satoshi Iguchi. Gradual Carotid Artery Stenosis in Mice Closely Replicates Hypoperfusive Vascular Dementia in Humans / Yorito Hattori, Junichiro Enmi, Satoshi Iguchi // J. Am Heart Assoc. - 2016. - № 5. -Р. e002757. DOI: 10.1161/JAHA.115.002757


