Патоморфологические изменения в паренхиматозных органах и костях у кошек при гемобартонеллезе
Автор: Ященко Е.А., Луцук С.Н., Дилекова О.В., Михайленко В.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 11, 2017 года.
Бесплатный доступ
В статье представлено описание пато-морфологических и патогистологических из-менений в паренхиматозных органах, трубча-тых костях и красном костном мозге кошек, павших от гемобартонеллеза. Объект иссле-дования - 10 кошек, павших от гемобартонел-леза. Для гистологических исследований от каждого животного были отобраны кусочки: легкого, сердца, селезенки, печени, почек, а также локтевой и лучевой костей, которые распиливали на кусочки толщиной 1 см3. Ма-териал фиксировали в 10 %-м нейтральном формалине на протяжении 3-5 дней и отмы-вали в течение 24 ч в проточной воде, прово-дили через этиловый спирт возрастающей концентрации (60, 70, 80, 96, 100), заливали в парафин. После чего по общепринятой мето-дике готовили срезы толщиной 5-8 мкм с по-мощью микротома МПС-П. Фотографировали гистологические препараты при помощи ком-плекса визуализации изображения на базе Olimpus 2000. Срезы окрашивали гемотокси-лином и эозином. Декальцинацию костей про-водили в 5 %-м растворе трихлоруксусной ки-слоты в течение 5 сут с ежедневной сменой рабочего раствора. Затем материал прово-дили через спирты возрастающей концентра-ции и ксилол и заливали в гистологическую среду «Гистомикс» («БиоВитрум», Россия) с использованием гистологического процессора замкнутого типа Tissue-Tek VIP™ 5Jr и стан-ции парафиновой заливки Tissue-Tek® TEC™ 5 фирмы Sakura (Япония). Из полученных блоков делали гистологические срезы толщиной 5- 7 мкм, которые окрашивали гематоксилином и эозином (Bio-Optica (Италия) и «БиоВитрум» (Россия)) на автоматическом мультистейне-ре Prisma™. Микроскопию срезов проводили на цифровом микроскопе Olympus BX 45. С каждо-го гистологического препарата выполняли по 10 цифровых снимков (в формате.jpg, разме-ром 3136 × 2352 пикселей в палитре 24 бит) случайно выбранных полей зрения при увели-чении ×100, ×200, ×400 и ×1000. При гемобар-тонеллезе кошек отмечаются следующие па-толого-анатомические изменения: подострый паренхиматозный миокардит, застойный отек легких и очаговая альвеолярная эмфизе-ма, геморрагический гломерулонефрит, ги-перплазия селезенки, токсическая дистрофия печени.
Аборигенные кошки, ге-мобартонеллез, анемия, дистрофия паренхи-матозных органов, геморрагический гломеру-лонефрит, дистрофия, альвеолярная эмфизема, гиперплазия селезенки, плечевая кость, лучевая кость, костные трабекулы, красный костный мозг, лимфоцитарно-лейкоцитарный инфильтрат, мегакариоциты, нарушение миелопоэза
Короткий адрес: https://sciup.org/140224187
IDR: 140224187 | УДК: 619:
Текст научной статьи Патоморфологические изменения в паренхиматозных органах и костях у кошек при гемобартонеллезе
Введение. Гемобартонеллез кошек - заболевание, характеризующееся интермиттирующей лихорадкой, слабостью, потерей массы тела, анемичностью или желтушностью наружных слизистых оболочек, гиперплазией селезенки, печени и лимфатических узлов. Возбудитель Haemobartonella felis (Eperythrozoon felis, Mycoplasma haemofelis) - облигатный паразит, локализующийся на поверхности или внутри эритроцитов хозяина [1, 2, 4]. Пораженные эритроциты фагоцитируются макрофагами селезенки и костного мозга. Кроме того, антитела, вырабатываемые против антигенов гемобартонелл, вступают в перекрестную реакцию с антигенами нормальных эритроцитов. В результате такой реакции многие эритроциты, подвергаясь фагоцитозу, уходят из кровяного русла. Из-за этого возникает и развивается тяжелая прогрес- сирующая анемия, выражающаяся в резком падении количества эритроцитов и снижении гемоглобина на 20–30 % и более. Уменьшение содержания эритроцитов и гемоглобина в крови приводит к нарушению кислородного питания клеток и тканей, в результате чего нарушается кислотно-щелочное равновесие, развивается ацидоз. Тканевая гипоксия способствует развитию диатезных геморрагий и дистрофии паренхиматозных органов [1]. Клинически данные процессы проявляются длительной лихорадкой с последующими общетоксическими проявлениями и развитием сердечно-сосудистого синдрома.
Трудности диагностики гемобартонеллеза у кошек заключаются в разнообразии клинических проявлений болезни и нехарактерной патологией изменений, а также не всегда возможно обнаружить возбудителя в периферической крови [1, 3, 5, 6].
При обобщении данных доступной нам литературы было отмечено, что патоморфологиче-ские изменения в паренхиматозных органах и красном костном мозге при данном заболевании недостаточно изучены.
Цель исследования : изучение и описание патоморфологических и патогистологических изменений в паренхиматозных органах, трубчатых костях и красном костном мозге кошек, павших от гемобартонеллеза.
Материал и методы исследования . Работа проводилась на базе Научно-диагностического и лечебного ветеринарного центра, на кафедре паразитологии и ветсанэкспертизы, анатомии и патанатомии им. профессора С.Н. Никольского факультета ветеринарной медицины Ставропольского государственного аграрного университета.
Материалом для исследования послужили десять кошек, павших от гемобартонеллеза. Мазки крови животных окрашивали, используя метод Романовского – Гимза и способ окраски мазков крови (патент РФ № 2304776) [4]. Для гистологических исследований от каждого животного были отобраны кусочки: легкого, сердца, селезенки, печени, почек, а также локтевой и лучевой костей, которые распиливали на кусочки толщиной 1 см3. Материал фиксировали в 10 %-м нейтральном формалине на протяжении 3–5 дней и отмывали в течение 24 ч в проточной воде, проводили через этиловый спирт возрастающей концентрации (60, 70, 80, 96, 100), заливали в парафин. После чего по общепринятой методике готовили срезы толщиной 5–8 мкм с помощью микротома МПС-П. Фотографировали гистологические препараты при помощи комплекса визуализации изображения на базе Olimpus 2000. Срезы окрашивали гемотоксили-ном и эозином. Декальцинацию костей проводили в 5 %-м растворе трихлоруксусной кислоты в течение 5 суток с ежедневной сменой рабочего раствора. Затем материал проводили через спирты возрастающей концентрации и ксилол и заливали в гистологическую среду «Гистомикс» («БиоВитрум», Россия) с использованием гистологического процессора замкнутого типа Tissue-Tek VIP™ 5Jr и станции парафиновой заливки Tissue-Tek® TEC™ 5 фирмы Sakura (Япония). Из полученных блоков делали гистологические срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином (BioOptica (Италия) и «БиоВитрум» (Россия)) на автоматическом мультистейнере Prisma™. Микроскопию срезов проводили на цифровом микроскопе Olympus BX 45. С каждого гистологического препарата выполняли по 10 цифровых снимков (в формате .jpg, размером 3136 × 2352 пикселей в палитре 24 бит) случайно выбранных полей зрения при увеличении ×100, ×200, ×400 и ×1000.
Результаты исследования. При вскрытии у всех павших животных в органах и тканях были отмечены следующие макро- и микроизменения.
Наблюдалась анемия видимых слизистых оболочек и кожи.
Кровь в сосудах жидкая несвернувшаяся, водянистой консистенции, светло-красного, а при остром течении – розового цвета. В мазках крови обнаружены гемобартонеллы (рис. 1).
Сердце увеличено в размере, округлой формы, правый желудочек нависает над левым, видны небольшие сгустки крови на разрезе, миокард дряблый, неоднородно окрашенный, имеет цвет вареного мяса, что характерно для подострого паренхиматозного миокардита.
Легкие красного цвета, тестоватой консистенции, с поверхности разреза выделялась пенистая жидкость алого цвета. Гиперемия в легких сопровождается обильным притоком лимфоцитов, нейтрофильных лейкоцитов, моноцитов и эритроцитов. Большая часть последних имеет ядро измененной формы, цитоплазматические гранулы-включения. Мышечный слой артериальных сосудов значительно утолщен, набухший, местами фрагментирован. Эн- дотелий набухший и слущивается. Адвентиция также местами фрагментирована. Наблюдается отек периваскулярных зон. Набухший эндотелий бронхов утрачивает четкие очертания цитоплазмы. При подостром течении отдельные межальвеолярные перегородки незначительно утолщены за счет пролиферации макрофагами, лимфоцитами, единичными нейтрофилами, а в сосудах только частично сохранен эндотелий. Характер выявленных изменений соответствует токсическому отеку легких (рис. 2).
Почки увеличены в объеме, плотной консистенции, светло-коричневого цвета с сероватым оттенком, паренхима выбухала за края разреза, граница коркового и мозгового слоев сглажена. Резко выражены дистрофические изменения эпителия дистальных и проксимальных канальцев вплоть до их некроза. В строме почек – очаговые лимфоплазмоцитарные инфильтраты.
Эпителиальные клетки почечных канальцев частично слущены. Вокруг клубочков отмечается скопление лимфоидных элементов, гистиоцитов, лейкоцитов (рис. 3). При остром и подостром течении в почках наблюдали изменения, характерные для белковой дистрофии извитых канальцев, разрастание соединительной ткани, клеточные инфильтраты. При хроническом течении – продуктивный интерстициальный нефрит и нефросклероз.
Селезенка увеличена в объеме, капсула напряжена, края притуплены, в острых случаях дряблой, а при подостром и хроническом течении плотной консистенции, паренхима светлокрасного или красного цвета с сероватым оттенком, рисунок фолликулярного строения четкий, соскоб обильный, густой, что характерно для гиперплазии селезенки (рис. 4).
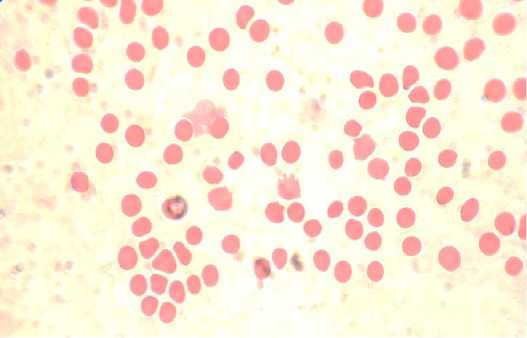
Рис.1. Гемобартонеллы в мазках крови
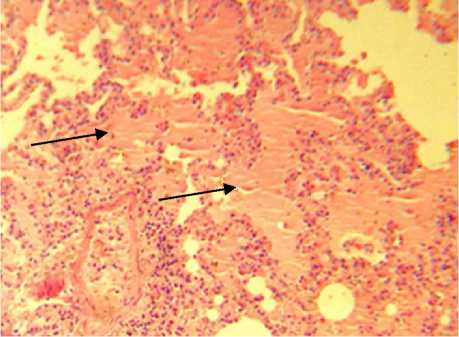
Рис. 2. Застойный отек легкого и клеточные инфильтраты вокруг артерии.
Окраска гематоксилином и эозином. Увел. об. 20 ок. 10
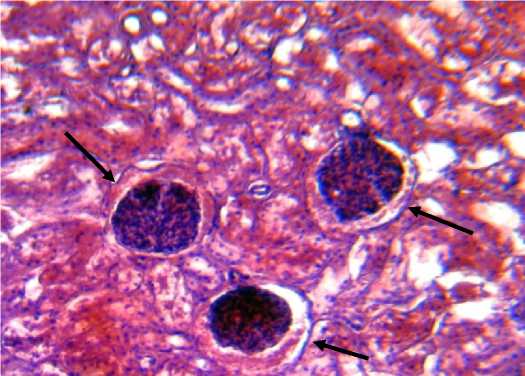
Рис. 3. Скопление разрушенных эритроцитов под капсулой клубочков. Окраска гематоксилином и эозином. Увел. об. 20 ок. 10
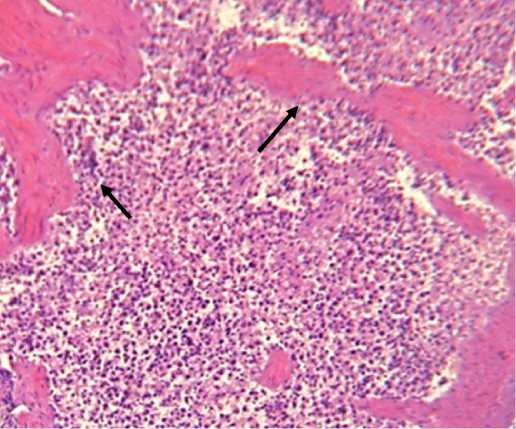
Рис. 4. Гиперплазия селезенки. Окраска гематоксилином и эозином. Увел. об. 20 ок. 10
Печень незначительно увеличена в объеме, дряблой консистенции, светло-коричневого глинистого цвета, рисунок дольчатого строения отсутствует, на поверхности и разрезе виден мозаичный рисунок строения. Наблюдается полнокровие центральной вены и синусоидных капилляров, вакуольная дистрофия гепатоцитов, встречаются гепатоциты с баллонной дистрофией. Некоторые гепатоциты крупные, с одним гиперхромным ядром, встречаются двуядерные гепатоциты. В строме определяются очаговые лимфоплацентарные инфильтраты с примесью макрофагов. Инфильтраты располагаются преимущественно в области триад. Гепатоциты периваскулярных зон атрофированы, а периферийных участков - дистрофированы. При остром течении отмечали патологические изменения, характерные для токсической дистрофии печени.
Кости белого цвета, твердой консистенции, в полости суставов незначительное количество прозрачной жидкости, суставной хрящ белого цвета без видимых патологических изменений. Однако при распиле плоских и трубчатых костей выявлены патологические изменения в красном костном мозге: неоднородная пестрая окраска органа, от бледно-розового до светло-красного цвета, местами с серым оттенком, мажущейся консистенции.
При гистологическом исследовании продольных и поперечных срезов костей на всех исследуемых образцах отмечается расслоение периоста, с частичной дезорганизацией его внутреннего слоя. Наблюдается врастание и фиброз наружного слоя периоста между волокнами скелетной мышечной ткани. Повсеместно визуализируются единичные участки деминерализации и резорбции компактного костного вещества в области системы наружных вставочных пластинок. Пластинчатая костная ткань на периферии кости имеет слоистое строение компактного костного вещества.
В красном костном мозге отмечается выраженный отек органа за счет выпота в межклеточное пространство большого количества серозной жидкости. Просматриваются картины отторжения органа от костных трабекул с образованием плотных клеточных «конгломератов» в виде детрита, пропитанного серозным экссудатом (рис. 5).
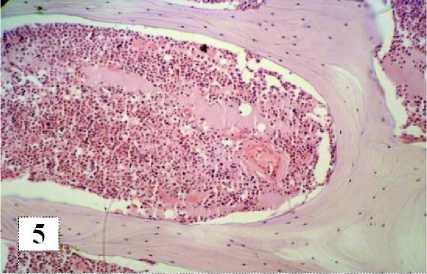
Рис. 5. Серозный отек красного костного мозга.
Окраска гематоксилином и эозином. Увел. об. 20, ок. 10
Клеточный состав красного костного мозга представлен клетками на разной стадии дифференцировки, с инфильтрацией эозинофильных лейкоцитов, плазмоцитов, лимфоцитов, макрофагов. Вокруг кровеносных сосудов просматривается появление крупных клеток с выраженной грануляцией, что, по нашему мнению, характеризует их как тучные клетки. Вместе с дифференцирующимися клетками и лимфоцитарно-лейкоцитарным инфильтратом наблюдаются клетки в состоянии некроза с карио- и ци-топикнозом, а также на стадии апоптоза.
В микроциркуляторном русле – эндоваскулит, стаз. Имеются единичные очаги фибриноидного набухания стенок сосудов и окружающих их тканей с образованием в сосудах пристеночных тромбов. Имеются незначительные очаги кровоизлияний.
Повсеместно между волокнами ретикулярной стромы визуализируются гигантские многоядерные клетки с оксифильной цитоплазмой и сильно выраженными базофильными ядрами, связанными между собой тонкими «кариоплазма-тическими» мостиками, что придает им вид сегментации, предположительно, это мегакариоциты II и III степени зрелости (рис. 6).
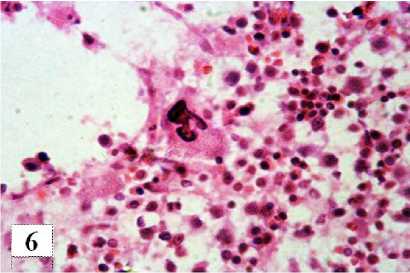
Рис. 6. Мегакариоцит II степени зрелости
Выводы . С.А. Боляхина в своей работе упоминает наблюдения S.C. Hibler, в которых говорится о том, что собаки с тяжелыми иммунологическими расстройствами также болеют гемобартонеллезом. Согласно описанию S.C. Hibler, у больных животных основными симптомами и патологическими изменениями являются: анемия, эритрофагоцитоз и гиперплазия селезенки и красного костного мозга [1, 12]. Подобные изменения мы наблюдали при гемобартонеллезе у кошек.
В собственных исследованиях мы уделили особое внимание более подробному изучению патоморфологических и патогистологических изменений в паренхиматозных органах, трубчатых костях и красном костном мозге кошек, павших от гемобартонеллеза.
При гемобартонеллезе кошек отмечаются следующие патолого-анатомические изменения: подострый паренхиматозный миокардит, застойный отек легких и очаговая альвеолярная эмфизема, геморрагический гломерулонефрит, гиперплазия селезенки, токсическая дистрофия печени. При остром и подостром течении в почках наблюдали белковую дистрофию извитых канальцев, нефросклероз. В печени отмечали патологические изменения, характерные для токсической дистрофии. При хроническом течении – продуктивный интерстициальный нефрит, жировая дистрофия печени.
Также нами были отмечены следующие изменения в красном костном мозге: гиперплазия, серозный отек, нарушение миелопоэза, расстройство кровообращения с преобладанием воспалительных реакций микрососудистого русла.
Список литературы Патоморфологические изменения в паренхиматозных органах и костях у кошек при гемобартонеллезе
- Боляхина С.А. Гемобартонеллез кошек в условиях крупного промышленного города: распространение, клиническое проявление, этиотропное лечение: автореф. дис. … канд. вет. наук. -Новосибирск, 2001. -128 с.
- Демкин В.В. Гемотропные микоплазмозы (гемоплазмы, гемобартонеллы) кошек и со-бак//Российский ветеринарный журнал. Мелкие домашние и дикие животные. -2014. -№ 4. -С. 23-28.
- Колабский Н.А. Паразитарные включения в эритроцитах крови при эпизоотическом заболевании кошек//Сб. ЛВИ. -Л., 1951. -Вып. XII. -С. 177-180.
- Пат. 2304776 Российская Федерация, МПК G 01 N 33/48, G 01 N 1/30. Способ окраски мазков крови/Трухачев В.И., Родин В.В., Михайленко В.В., Дергунов Д.А.; заявитель и патентообладатель ФГБОУ ВПО «Ставропольский ГАУ». № 2005104872/15; заявл. 22.02.2005; опубл. 20.08.2007, Бюл. № 23. -6 с.
- Sykes J.E. Feline Hemotropic Mycoplasmas//Vet Clin Small Anim. -2010. V. 40. -P. 1157-1170.
- Woods J.E., Wisnewski N., Lappin M.R. Attempted transmission of Candidatus Myco-plasma haemominutum and Mycoplasma haemofelis by feeding cats infected Ctenocephalides felis//Am J Vet Res. -2006. -V. 67, № 3. -P. 494-497.
- Barker E., Tasker S. Haemoplasmas: Lessons learnt from cats//New Zealand Veterinary Journal. -2013. -V. 61, № 4. -P. 184-192.
- Sykes J.E. et al. Identification of a novel hemotropic mycoplasma in a splenectomized dog with hemic neoplasia//J Am Vet Med Assoc. -2004. -V. 224, № 12. -P. 1946-1951.
- Колич Н.Б., Панкратьева Я. Некоторые аспекты патоморфологии инфекционной анемии кошек//Науч. вестн. НУБиП Украины. Сер. «Ветеринарная медицина, качество и безопасность продукции животноводства». -2013. -№ 188-1. -С. 195-199.
- Neimark H. et al. Revision of haemotrophic Mycoplasma species names//Int J Syst Evol Microbiol. -2002. -V. 52. -P. 683-684.
- Novacco M. et al. Prevalence and geographical distribution of canine hemotropic myco-plasma infections in Mediterranean countries and analysis of risk factors for infection//Vet Microbiol. -2010. -V. 142, № 3-4. -P. 276-284.
- Hibler S.C., Hoskins J.D., Greene C. Rickettsial infections in dogs. Pt 3. Salmon disease complex and haemobartonellosis//Compendium on continuing Educate. Practic-ing Veter. -1986. -V. 8, № 1. -P. 251-256.


