Патоморфологический анализ желудочного трансплантата при эзофагопластике
Автор: Лапий Г.А., Непомнящих Л.М., Чикинев Ю.В., Судовых И.Е.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (47), 2011 года.
Бесплатный доступ
Изучены структурные изменения при патологических состояниях искусственного пищевода, сформированного из желудочной трубки. Установлено значительное распространение атрофически-склеротических перестроек в слизистой оболочке эзофагогастроанастомоза и трансплантата. Ведущими морфологическими феноменами являются дистрофия и гиперсекреция поверхностного эпителия, атрофия фундальных желез, гипертрофия гладкомышечных клеток, склеротиче- ская реорганизация стромы. Показана гетерогенность ультраструктурных модификаций клеточных популяций эпителия, отражающая высокую секреторную функцию мукоцитов и дегенеративные изменения специализированных гландулоцитов желез. К важным структурным особенностям следует отнести отсутствие признаков кишечной метаплазии и очагов дис- плазии эпителия в слизистой оболочке желудочного трансплантата в отдаленном периоде после пластики, выполненной по поводу заболеваний пищевода.
Эзофагопластика, желудочный трансплантат искусственного пищевода, патоморфология
Короткий адрес: https://sciup.org/14055946
IDR: 14055946 | УДК: 616.329-089.844-091.8-078
Текст научной статьи Патоморфологический анализ желудочного трансплантата при эзофагопластике
Современный уровень развития хирургической техники и совершенствование методов анестезиологии и реаниматологии определили переход центральных аспектов проблемы реконструктивной хирургии пищевода из области интра- и периоперационных осложнений в сторону отдаленных результатов. Одной из главных задач эзофагопластики в настоящее время является достижение хорошего отдаленного прогноза, и с этих позиций болезнь искусственного пищевода выступает в роли ключевого критерия при оценке хирургического лечения доброкачественных и злокачественных заболеваний пищевода. Частота развития патологических состояний искусственного пищевода, по данным разных авторов, варьирует в широком диапазоне, составляя в среднем 23–26 %, и в настоящее время не имеет тенденции к снижению [6]. Большинство исследований, касающихся оценки морфофункционального состояния желудочной трубки после эзофагопластики, проводятся с применением методов эндоскопической визуализации [8, 10, 15]. Значительно меньше работ, в которых анализируются особенности тканевой и клеточной реорганизации трансплантата [3, 5].
Накопление информации об отдаленных результатах пластики пищевода свидетельствует о возможности развития в трансплантате с течением времени патологических процессов, типичных для органа-донора. В желудочной трубке встречаются воспалительные изменения, ишемические расстройства, явления дистрофии, атрофии, фиброза [4, 9]. Имеются единичные сообщения о возникновении в искусственном пищеводе злокачественных новообразований [11, 14]. Для разработки превентивных и реабилитационных мероприятий, направленных на улучшение качества жизни пациентов после эзофагопластики, раннее выявление и эффективную коррекцию патологических состояний искусственного пищевода, необходимо проведение интегральных исследований, важное место в которых занимает комплексный структурный анализ трансплантата.
Цель исследования – изучить характер морфологических изменений трансплантата желудочной трубки при патологических состояниях искусственного пищевода, возникших в отдаленном периоде после пластики.
Материал и методы
Обследовано 46 пациентов с болезнью искусственного пищевода, из них 19 мужчин и 27 женщин в возрасте от 20 до 63 лет, перенесших эзофагопластику по поводу доброкачественных заболеваний пищевода. Показаниями к проведению хирургического лечения явились рубцовые стриктуры пищевода после химического ожога (14 наблюдений), ахалазия пищевода III–IV степени (24), осложнения гастроэзофагеальной рефлюксной болезни (8). Во всех случаях реконструктивное вмешательство было выполнено в объеме экстирпации пищевода с одномоментной пластикой желудочной трубкой. В сроки от 1 мес до 8 лет после эзофагопластики проводился клинико-эндоскопический и морфологический мониторинг патологических состояний искусственного пищевода.
Для светооптического анализа биоптаты слизистой оболочки желудочного трансплантата и эзофагогастроанастомоза фиксировали в 10 % растворе нейтрального формалина. Парафиновые срезы красили гематоксилином и эозином в комбинации с реакцией Перлса, по ван Гизону с докраской эластических волокон резорцин-фуксином Вейгерта, ставили ШИК-реакцию. Гистологические препараты изучали в универсальном микроскопе Leica DM 4000B (Германия), микрофотографии получали с использованием цифровой фотокамеры Leica DFC 320 (Германия) и компьютерной программы Leica QWin.
Образцы, предназначенные для электронной микроскопии, фиксировали в 4 % растворе параформальдегида с дополнительной постфиксацией в 1 % растворе четырехокиси осмия, затем обрабатывали по стандартной методике и заливали в смесь эпона и аралдита. Полу-тонкие срезы красили 1 % раствором азура II и реактивом Шиффа. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца и исследовали в электронном микроскопе JEM 1400 («Jeol», Япония). Электронограммы получали с помощью цифровой камеры Veleta и программного обеспечения iTEM (фирма «Olympus», Япония, Германия).
Результаты и обсуждение
У пациентов с патологическими состояниями искусственного пищевода, перенесших эзофаго-пластику желудочной трубкой по поводу доброкачественных заболеваний пищевода, наиболее часто развивались рубцовые стриктуры эзофа-гогастроанастомоза – 25 (54,3 %) наблюдений, в 18 (39,1 %) случаях выявили гастропатию трансплантата, реже встречался демпинг-синдром – у 9 (19,6 %) больных. Необходимо отметить, что у некоторых пациентов наблюдалось сочетанное развитие патологических синдромов.
При эндоскопическом исследовании установлена высокая частота встречаемости стенозов эзофагогастроанастомоза II и III степени, что сопровождалось рубцовыми изменениями слизистой оболочки по периметру анастомоза (рис. 1а). Визуально искусственный пищевод, сформированный из желудочной трубки, характеризовался эластичными стенками с типичным рельефом поверхности (рис. 1б). Эпизодически наблюдались очаговые эритематозные изменения слизистой оболочки, реже очаги атрофии, в некоторых случаях регистрировался рефлюкс желчи в трансплантат.
При светооптическом анализе биоптатов искусственного пищевода обнаружено значительное распространение атрофически-склеротических изменений слизистой оболочки различной степени выраженности, регистрируемых как в зоне эзофагогастроанастомоза, так и в самом трансплантате (76,1 %). Отличительными особенностями этих изменений являлась преимущественная редукция железистого слоя на фоне сохранения архитектоники фовеолярных структур, которые оставались глубокими и в некоторых препаратах были штопорообразно извиты. Для соединительнотканого компартмента характерна гипертрофия мышечной пластинки в сочетании с лимфоплазмоцитарной инфильтрацией собственного слоя и повышенной коллагенизацией глубоких участков ткани.
Выстилающий слизистую оболочку цилиндрический эпителий в большинстве образцов демонстрировал высокую секрецию мукоида, что являлось, по всей видимости, компенсаторной реакцией, направленной на увеличение цитопротективного потенциала слизистой оболочки в новых условиях функционирования (рис. 2а). В некоторых биоптатах обращали на себя внимание дистрофические изменения поверхностного эпителия, наиболее выраженные при гастропатии трансплантата. Признаки нарушения клеточной дифференцировки эпителия с трансформацией в кишечную метаплазию и дисплазию, которые относятся к предраковым изменениям [1], ни в одном случае не зарегистрированы.
В образцах из зоны эзофагогастроанастомоза многослойный плоский эпителий пищевода сохранял типичную клеточную дифференцировку на слои, но характеризовался тенденцией к гиперплазии с признаками умеренно выраженного акантоза. В отдельных препаратах значительная часть клеток эпителиального пласта подвергались вакуольной дистрофии, интерцеллюлярные пространства местами были расширены, в них
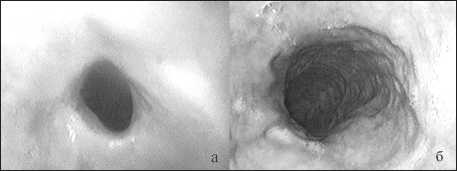
Рис. 1. Эндофотограммы искусственного пищевода, сформированного из желудочной трубки: а – рубцовый стеноз эзофагогастроанастомоза; б – трансплантат с характерным рельефом поверхности
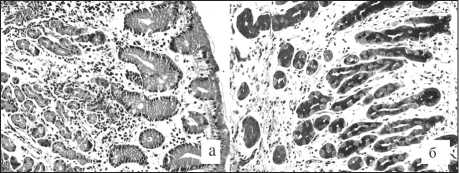
Рис. 2. Патоморфологические изменения слизистой оболочки желудочного трансплантата: а – дистрофия и гиперсекреция поверхностного эпителия, атрофия фундальных желез;
б – атрофия и пилорическая метаплазия желез, утолщение и склероз интерстициальных прослоек. а – окраска гематоксилином и эозином; б – ШИК-реакция. ×200
определялись единичные внутриэпителиальные лимфоциты.
При анализе патологии фундальных желез желудочной трубки в 66,7 % биопсий обнаружены атрофические изменения различной степени, что светооптически проявлялось сокращением численности и укорочением железистых ацинусов, кистозной трансформацией отдельных профилей, утолщением интерстициальных прослоек (рис. 2б). Эпителиальную выстилку секреторных отделов формировали дистрофически измененные главные, обкладочные и добавочные клетки, в 42,9 % образцов были найдены очаги пилоризации желез, в составе которых преобладали слизеобразующие гландулоциты. Известно, что пилорическая метаплазия нередко развивается вблизи гастроэнтероанастомоза при рефлюкс-гастрите [1].
Электронно-микроскопически большинство мукоцитов и добавочных клеток сохраняли отчетливую полярность внутриклеточной организации с базальной локализацией ядер овальной формы и обилием мукоидных гранул в апикальных отделах цитоплазмы. В популяции
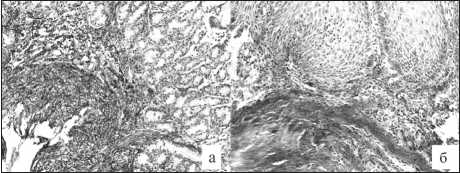
Рис. 3. Склеротические изменения слизистой оболочки желудочного трансплантата: а – утолщение и фиброз мышечной пластинки слизистой оболочки; б – разрастание коллагеновых волокон в слизистой оболочке эзофагогастроанастомоза.
Окраска по ван Гизону. ×400
главных клеток найдены гландулоциты с типичной ультраструктурой, характеризующейся наличием множества зимогенных гранул, крупными элементами пластинчатого комплекса, высокой концентрацией цистерн гранулярной цитоплазматической сети. Вместе с тем обнаружены гландулоциты с признаками нарушенной секреции, в цитоплазме которых, несмотря на развитые органеллы биосинтеза, визуализировались одиночные зимогенные гранулы, иногда встречались секреторные пузырьки мелкозернистого строения, липидные везикулы, полиморфные лизосомы.
Для ультраструктуры париетальных клеток наиболее типичны черты функционально незрелых гландулоцитов, что выражалось наличием слабо развитых элементов внутриклеточного канальца, низким содержанием тубуловезикул, в облитерированных просветах нередко дифференцировались осмиофильные ламеллы. В цитоплазме в большом количестве представлены митохондрии с плотным матриксом и трудно различимыми кристами, в некоторых клетках найдены крупные вакуоли и мультивезикуляр-ные тельца.
При оценке состояния соединительнотканых структур слизистой оболочки желудочного трансплантата обращала на себя внимание гипертрофия и фиброз мышечной пластинки, сформированной пучками крупных лейомио-цитов (рис. 3а). Наблюдались очаги гиперэла-стоза и повышенного коллагенообразования в собственной пластинке, иногда между концевыми отделами желез и гладкомышечным слоем визуализировалась широкая волокнистая прослойка. Подслизистая оболочка часто была склерозирована, с явлениями гиперэластоза и периваскулярного склероза. В биоптатах слизистой оболочки эзофагогастроанастомоза также обнаружены очаги разрастания утолщенных пучков коллагеновых волокон, местами выявлялась умеренная лимфоплазмоцитарная инфильтрация (рис. 3б).
Согласно современным представлениям, склеротические изменения при стриктурах эзо-фагогастроанастомоза тесно взаимосвязаны с микроциркуляторными нарушениями и локальной тканевой ишемией в стенке трансплантата [6]. Немаловажное значение имеют несостоятельность швов анастомоза и развитие воспалительного процесса в зоне соустья. Нельзя не учитывать регенераторный потенциал гладкомышечных клеток желудочного трансплантата, индуцированный на этапе его формирования, что может вести к гипертрофии лейомиоцитов и определять их некоторые ультраструктурные особенности [5].
Таким образом, результаты проведенного исследования показали, что при патологических состояниях искусственного пищевода, сформированного из желудочной трубки, в биоптатах эзофагогастроанастомоза и трансплантата часто выявляются атрофически-склеротические изменения слизистой оболочки различной степени выраженности. Ведущими морфологическими феноменами являются дистрофия и гиперсекреция поверхностного эпителия, атрофические изменения фундальных желез, гипертрофия гладкомышечных клеток, склеротическая реорганизация стромы. Ультраструктурные модификации клеточных популяций эпителия отражают высокую секреторную функцию мукоцитов фовеолярного слоя и дегенеративные изменения специализированных гландулоцитов желез. Важной структурной особенностью био-птатов являлось отсутствие признаков кишечной метаплазии и очагов дисплазии эпителия, что может свидетельствовать о низком риске неопластической трансформации желудочного трансплантата в отдаленном периоде после эзофагопластики.


