Патоморфоз экспериментальной диабетической кардиомиопатии при фармакологической коррекции сукцикардом
Автор: Тюренков Иван Николаевич, Смирнов Алексей Владимирович, Бакулин Дмитрий Александрович, Великородная Юлия Ивановна, Быхалов Леонид Сергеевич
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 т.20, 2023 года.
Бесплатный доступ
Экспериментальное моделирование стрептозотоцин-индуцированного сахарного диабета длительностью 6 месяцев проводили на 30 белых беспородных лабораторных крысах-самках в возрасте 12 месяцев. Обнаружено развитие диабетической кардиомиопатии, которая проявлялась фиброзом миокарда левого желудочка сердца, контрактурными повреждениями и гипертрофией кардиомиоцитов. Лечение проводили сукцикардом в течение месяца. Индуцированный патоморфоз диабетической кардиомиопатии проявлялся снижением степени выраженности патологических изменений в миокарде левого желудочка и сопровождался уменьшением выраженности фиброза, значимым снижением диаметра кардиомиоцитов, что, по-видимому, обеспечивается за счет протективного влияния препарата на метаболические процессы в кардиомиоцитах и эндотелиоцитах кровеносных сосудов миокарда.
Сахарный диабет, кардиомипатия, сукцикард
Короткий адрес: https://sciup.org/142238042
IDR: 142238042 | УДК: 616-005.4:611.813.14:616-092.9
Текст научной статьи Патоморфоз экспериментальной диабетической кардиомиопатии при фармакологической коррекции сукцикардом
Funding : the work was carried out with the financial support of the RSF grant No. 21-15-00192.
Диабетическая кардиомиопатия (ДКМП) рассматривается как сердечная патология, которая не объясняется другими сердечно-сосудистыми или несердечно-сосудистыми заболеваниями, которые могут быть отнесены к сахарному диабету (СД) [1, 2]. Существование кардиомиопатии, связанной исключительно с диабетом при наличии значительного числа пациентов с коморбидной патологией, включающейся в общий патогенез [2], было и остается предметом споров, поскольку ДКМП предполагает уникальный патогенез, отличный от других заболеваний, что можно использовать для разработки новых методов лечения данного заболевании [3].
Частота сердечной недостаточности (СН) у мужчин и женщин с сахарным диабетом 2-го типа (СД2) как минимум в 2,4 и 5,1 раза выше соответственно, чем у лиц того же пола без СД [4].
Инсулинорезистентность, гиперинсулинемия и гипергликемия являются независимыми факторами риска развития ДКМП. К патофизиологическим факторам СД, которые способствуют развитию кардиомиопатии, относятся системные метаболические нарушения, неадекватная активация ренин-ангиотензин-альдосте-роновой системы, аномалии субклеточного компонента, окислительный стресс, воспаление и дисфункциональная иммуномодуляция.
Вышеуказанные факторы способствуют интерстициальному фиброзу сердечной ткани, гипертрофии кардиомиоцитов [5].
Диабетическая кардиомиопатия характеризуется нарушениями различных метаболических, паракринных и нейрогуморальных механизмов регуляции [6] кардиомиоцитов и эндотелия, опосредуя концентрическое ремоделирование и гипертрофию миокарда левого желудочка (ЛЖ), что способствуют диастолической дисфункции [7].
Новые данные о выявляемых при кластерном анализе у пациентов с СД2 различных фенотипах, регистрируемых с использованием комбинации клинических, биохимических, визуализационных и генетических переменных, отображающих спектр уникальных профилей сердечно-сосудистого риска [8], и данные о повышении риска сердечной недостаточности при использовании некоторых сахароснижающих препаратов по сравнению со стандартной терапией способствуют поиску новых путей коррекции ДКМП [9].
Так, поскольку гамма-аминомасляная кислота (ГАМК) значительно увеличивает уровни АТФ и активность НАДН-дегидрогеназы дозозависимым образом, даже демонстрирует новую физиологическую роль в продукции эритропоэтина [10] и может способствовать снижению метаболических нарушений и ишемических повреждений миокарда, разработанные производные ГАМК, например сукцикард (4-фенилпирацетам и этан-1,2-дикарбоновая кислота, 2:1), проявляющий выраженный мембранопротекторный эффект [11], представляют собой новый потенциальный класс протективных средств, которые могут быть использованы при комплексном лечении СД. Более того, показано, что под влиянием производного ГАМК мефаргина отмечено снижение выраженности патологических изменений в миокарде левого желудочка предположительно за счет протективного влияния препарата на эндотелий сосудов микроциркуляторного миокарда левого желудочка [5].
ЦЕЛЬ РАБОТЫ
Охарактеризовать морфологические изменения миокарда левого желудочка при экспериментальном сахарном диабете и его фармакологической коррекции сукцикардом.
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальное исследование проведено на 30 белых беспородных лабораторных крысах-самках в возрасте 12 месяцев. Моделирование стреп-тозотоцин-индуцированного СД длительностью 6 месяцев и его проявлений в виде диабетической кардиомиопатии проводили по ранее описанной методике [5]. Лечение начинали через 6 месяцев после моделирования СД.
Исследуемое производное ГАМК, сукцикард, вводили перорально в течение 30 дней в дозе
50 мг/кг. Группе негативного контроля вводили физиологический раствор (крысы с СД без лечения). В качестве позитивного контроля использовали крыс без СД (интактных) той же партии животных.
После курсового лечения у наркотизированных (хлоралгидрат, 400 мг/кг, внутрибрюшинно) животных проводили забор образцов тканей левого желудочка сердца. Образцы тканей левого желудочка сердца проводили у наркотизированных (хлоралгидрат, 400 мг/кг, внутрибрюшинно) животных. Материал фиксировали в течение 24 часов в 10%-м растворе нейтрального забуференного формалина (pH 7,4), обезвоживали и заливали в парафин по общепринятой гистологической методике. На роторном микротоме изготавливали срезы толщиной 4–5 мкм. Окрашивали парафиновые срезы гематоксилином и эозином, трихромом по Массону.
Оценивали структурные изменения миокарда, степень фиброза, наличие воспалительной инфильтрации, выраженность изменений кардиомиоцитов при стандартном освещении и в поляризованном свете.
Гистологические срезы фотографировали цифровой камерой AxioCam 305 color (Carl Zeiss Microscopy GmbH, Германия) на базе микроскопа AxioImager A2 (Carl Zeiss Microscopy GmbH, Германия) с использованием объективов ×10, ×20, ×40. Средний диаметр кардиомиоцитов (мкм) определяли с помощью морфометрического метода исследования в произвольно выбранных областях левого желудочка с использованием программного обеспечения Zeiss Zen Pro 2.3 2021 (Carl Zeiss Microscopy GmbH, Германия).
Статистическую обработку данных проводили с использованием пакета программы «Statistica 10.0» (USA). Проверку выборки на нормальность проводили с помощью теста Колмогорова – Смирнова. Сравнение двух независимых выборок проводили непараметрическим методом (парный тест Манна – Уитни). Сравнение трех и более независимых выборок проводили непараметрическим методом (критерий Краскела – Уоллиса с посттестом Данна). Гипотезу о существовании различий между выборками принимали при уровне р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При экспериментальном моделировании СД в миокарде левого желудочка помимо дистрофических изменений в кардиомицитах отмечалось увеличение очаговых контрактурных изменений в миокарде левого желудочка по сравнению с интактным контролем, определяем при поляризационной микроскопии (рис. 1, 2).
Выявлена гипертрофия в значительной части кардиомиоцитов в стенке левого желудочка. Отмечено фиброзирование миокарда, в большей степени в левом желудочке, за счет разрастания волокнистой соединительной ткани, преимущественно в субэндо- кардиальных отделах миокарда и переваскулярно субэпикардиальных отделах.
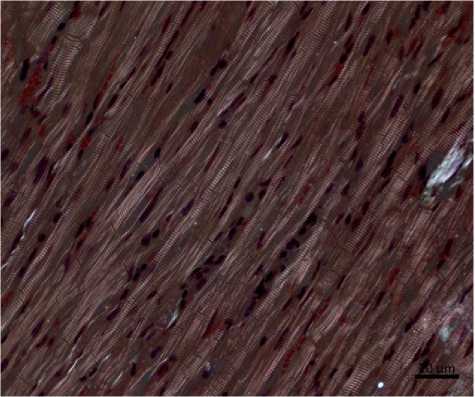
Рис. 1. Строение миокарда левого желудочка интактной крысы.
Окраска гематоксилином и эозином, поляризационная микроскопия

Рис. 2. Строение миокарда левого желудочка крысы с экспериментальным сахарным диабетом.
Окраска гематоксилином и эозином, поляризационная микроскопия
У животных с сахарным диабетом, получавших сукцикард, было отмечено менее выраженное фиброзирование миокарда за счет меньшего разрастания периваскулярной соединительной ткани, по сравнению с группой сахарного диабета. В кардиомиоцитах определялась поперечная исчерченность, наряду с наличием дистрофических изменений. Преобладали участки миокарда левого желудочка с умеренной гипертрофией, которые сочетались с наличием участков с атрофическими изменениями. Фиброзирование миокарда наблюдалось преимущественно в периваскулярных отделах, обнаруживались единичные прослойки фиброзной соединительной ткани в интерстиции миокарда при окраске по Массону. В целом степень фиброза в миокарде была оценена как слабо выраженная.
При поляризационной микроскопии гистологических препаратов, окрашенных гематоксилином и эозином, у животных с сахарным диабетом, получавших сукцикард, было выявлено наличие хорошо выявляемой поперечной исчерченности в кардиомиоцитах, отсутствие контрактурных изменений в миокарде левого желудочка (рис. 3).
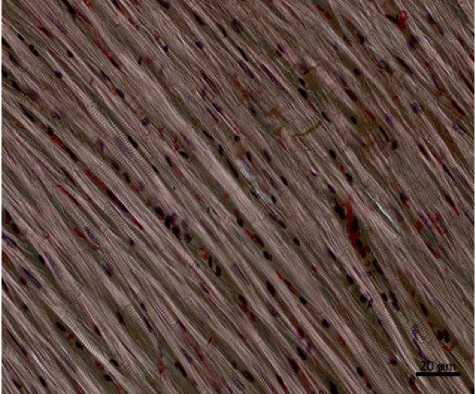
Рис. 3. Строение миокарда левого желудочка крысы с экспериментальным сахарным диабетом, получавших сукцикард. Окраска гематоксилином и эозином, поляризационная микроскопия
Морфометрическое исследование выявило увеличение размеров кардиомиоцитов левого желудочка у животных с сахарным диабетом: диаметр кардиомиоцитов левого желудочка у животных с сахарным диабетом составил 16,40 мкм (ДИ 14,11783; 18,42735), у интактных крыс – Ме 9,41 мкм (ДИ 8,32797; 10,74161), увеличение размеров кардиомиоцитов составило 74,3 % (при p < 0,01).
У животных с сахарным диабетом, получавших сукцикард, диаметр кардиомиоцитов по сравнению с группой интактных крыс вырос на 24,8 % (при p < 0,01) и составил Ме 11,74 мкм (ДИ 10,44734; 12,53243), что на 28,4 % (при p < 0,01) меньше по сравнению с группой животных с сахарным диабетом без лечения.
Результаты проведенного исследования уточняют количественные данные о морфогенезе ДКМП у экспериментальных животных, которая сопровождается диффузно-очаговым фиброзированием миокарда левого желудочка и значительной гипертрофией кардиомиоцитов.
При рассмотрении лекарственного патоморфоза ДКМП у экспериментальных животных выявлено про-тективное влияние сукцикарда на миокард левого желудочка, что проявлялось в снижении выраженности гипертрофии миокарда, контрактурных повреждений кардиомиоцитов, что может быть обусловлено мем-брано- и кардиопротективным действием производных ГАМК, механизм которого связан с симпатоинги-бирующими эффектами посредством активации рецепторов ГАМК, тормозных влияний на центральные симпатические структуры, ведущих к нормализации гемодинамики и нормализации метаболизма кардиомиоцитов [12].
Наблюдаемое в эксперименте снижение выраженности фиброза при исследовании индуцированного сукцикардом патоморфоза ДКМП может быть связано с уменьшением метаболических изменений в миокарде вследствие антиоксидантной защиты эндотелия производным ГАМК, сукцикардом, и снижением эндотелиальной дисфункции [13].
ЗАКЛЮЧЕНИЕ
Таким образом, обнаруженное при индуцированном патоморфозе диабетической кардиомиопатии при фармакологической коррекции сукцикардом снижение выраженности фиброзирования и гипертрофии миокарда левого желудочка сердца рассматривается как морфологическое проявление ДКМП.
Наблюдаемое под влиянием сукцикарда снижение выраженности патологических изменений в миокарде левого желудочка, по нашему мнению, реализуется посредством протективного влияния препарата на метаболические процессы в кардиомиоцитах и эн-дотелиоцитах кровеносных сосудов миокарда. Изучение роли эндотелиальной дисфункции в патогенезе ДКМП требует дальнейшего углубленного анализа молекулярных механизмов.
Список литературы Патоморфоз экспериментальной диабетической кардиомиопатии при фармакологической коррекции сукцикардом
- Смирнов А. В., Бисинбекова А. И., Файбисович Т. И. Морфофункциональные изменения головного мозга при сахарном диабете // Вестник Волгоградского государственного медицинского университета. 2022. Т. 19, № 3. С. 3–8.
- Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: preclinical and clinical evidence / Y. Tan, Z. Zhang, C. Zheng [et al.] // Nat Rev Cardiol. 2020. No. 17(9). Р. 585–607.
- Lorenzo-Almorós A., Cepeda-Rodrigo J. M., Lorenzo Ó. Diabetic cardiomyopathy // Rev Clin Esp (Barc). 2022. No. 222(2). Р. 100–111.
- Prognostic impact of diabetes and prediabetes on survival outcomes in patients with chronic heart failure: A Post-Hoc Analysis of the GISSI-HF (Gruppo Italiano per lo Studio della Sopravvivenza nella Insufficienza Cardiaca-Heart Failure) / M. Dauriz, G. Targher, P. L. Temporelli [et al.] // Trial. J Am Heart Assoc. 2017. No. 6(7). e005156.
- Тюренков И. Н., Смирнов А. В., Бакулин Д. А., Великородная Ю. И. Морфологические особенности миокарда при экспериментальном сахарном диабете и его фармако-логической коррекции мефаргином // Волгоградский научно-медицинский журнал. 2022. № 4. С. 25–29.
- Phenotype-specific treatment of heart failure with pre-served ejection fraction: a multiorgan roadmap / S. J. Shah, D. W. Kitzman, B. A. Borlaug [et al.] // Circulation. 2016. No. 134(1). Р. 73–90.
- Wan A., Rodrigues B. Endothelial cell-cardiomyocyte crosstalk in diabetic cardiomyopathy // Cardiovasc Res. 2016. No. 111(3). Р. 172–183.
- Clinical phenotypes in patients with type 2 diabetes mellitus: characteristics, cardiovascular outcomes and treat-ment strategies / P. Gouda, S. Zheng, T. Peters [et al.] // Curr Heart Fail Rep. 2021. No. 18(5). Р. 253–263.
- Udell J. A., Cavender M. A., Bhatt D. L. Glucose-lowering drugs or strategies and cardiovascular outcomes in patients with or at risk for type 2 diabetes: a meta-analysis of randomised controlled trials // Lancet Diabetes Endocrinol. 2015. No. 3. Р. 356–366.
- Park K. T., Han J. K., Kim S. J., Lim Y. H. Gamma-aminobutyric acid increases erythropoietin by activation of cit-rate cycle and stimulation of hypoxia-inducible factors expres-sion in rats // Biomolecules. 2020. No. 10(4). Р. 595.
- Изменение деформабельности и резистентности мембран эритроцитов у потомства крыс с экспериментальной преэклампсией под действием производных гамма-аминомасляной кислоты / Е. А. Музыко, Л. В. Науменко, В. Н. Перфилова [и др.] // Российский медико-биологический вестник им. академика И. П. Павлова. 2022. Т. 30, № 1. C. 13–20.
- Перфилова В. Н. Кардиопротекторные свойства структурных аналогов ГАМК: автореф. дис. … докт. биол. наук: 14.00.25 / Перфилова Валентина Николаевна. Волгоград, 2009. 49 с.
- Антиоксидантная терапия эндотелиальной дис-функци / И. Н. Тюренков, А. В. Воронков, А. А. Слиецанс [и др.] // Обзоры по клинической фармакологии и лекарственной терапии. 2013. Т. 11, № 1. С. 14–25.


