Пентраксин-3: возможности и перспективы использования биомаркера у пациентов с перенесенным COVID-19
Автор: Канаева Т.В., Кароли Н.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 1 т.20, 2024 года.
Бесплатный доступ
Цель: определить потенциальную прогностическую ценность сывороточных биомаркеров в отношении развития неблагоприятных сердечно-сосудистых событий (НССС) у пациентов, перенесших COVID-19. Материал и методы. В проспективном исследовании приняли участие 114 пациентов, госпитализированных с подтвержденным COVID-19. Помимо стандартных обследований, в день госпитализации были взяты образцы крови для определения уровня сывороточных сердечно-сосудистых биомаркеров, в том числе пентраксина-3 (PTX3). Наблюдение за пациентами осуществлялось на протяжении 366 [365; 380] дней после выписки из COVID-госпиталя с регистрацией развившихся у пациентов НССС.
Пентраксин-3 (ptx3), сердечно-сосудистые заболевания, неблагоприятные сердечно-сосудистые события, covid-19
Короткий адрес: https://sciup.org/149146376
IDR: 149146376 | УДК: 616.1:57.089»313»:616.98:538.834.1-06]-07 | DOI: 10.15275/ssmj2001022
Текст научной статьи Пентраксин-3: возможности и перспективы использования биомаркера у пациентов с перенесенным COVID-19
EDN: NEWRUC
Введение. Коронавирус тяжелого острого респираторного синдрома 2 (Severe acute respiratory syndrome-related coronavirus 2, SARS-CoV-2),
как и большинство вирусов, при попадании в организм активирует врожденное звено иммунного ответа, проявляющееся гиперпродукцией провос-палительных цитокинов [интерлейкина (ИЛ) –1, –6, фактора некроза опухоли α (TNF-α)] [1].
Пентраксины — белки врожденного иммунитета, уничтожающие микробы, активирующие комплемент,
рекрутирующие лимфоциты. В экспериментальных условиях доказано, что провоспалительные цитокины (TNF-α, ИЛ-1), Toll-подобные рецепторы (TLR), микроорганизмы (в том числе вирусы) и микробные группы стимулируют секрецию длинных пентракси-нов [пентраксина-3 (PTX3)] полиморфноядерными нейтрофилами, макрофагами, эндотелиальными и гладкомышечными клетками, адипоцитами, альвеолярным эпителием [2]. В свою очередь, короткий пентраксин [С-реактивный белок (СРБ)] синтезируется гепатоцитами, а его высвобождение также индуцируется провоспалительными цитокинами (главным образом ИЛ-6, ИЛ-1, TNF-α) [3]. Следовательно, основной отличительной характеристикой PTX3 от СРБ является его локальное образование в очаге воспаления (сосудистой стенке, сердце, легких и т. д.) несколькими типами клеток и быстрое повышение его концентрации при воспалительных или инфекционных процессах.
Поражение сердечно-сосудистой системы (ССС) вирусом SARS-CoV-2 активно обсуждалось с начала пандемии COVID-19. Основанием для этого были аутопсийные исследования, подтверждающие повреждение миокарда у пациентов с COVID-19 [4, 5]. У пациентов, у которых во время госпитализации по поводу COVID-19 отмечалось развитие миокардита, острой правожелудочковой недостаточности, тромбоэмболии, нарушения сердечного ритма и асистолии, были зарегистрированы повышения концентраций высокочувствительных сердечных тропонинов (вчTr) [6, 7]. К сывороточным маркерам повреждения миокарда, наряду с вчTr, относят креатинфосфокиназу (КФК), МB-фракцию креатинфосфокиназы (КФК-МВ), миоглобин и PTX3 [8].
В нескольких исследованиях показано, что PTX3 играет прогностическую роль при многих заболеваниях, таких как грибковые, бактериальные и вирусные инфекции, сепсис, сердечно-сосудистые заболевания (ССЗ) и острый респираторный дистресс-синдром [9]. В работах 2021 г. E. Brunetta и со-авт. и A. Schirinzi и соавт. PTX3 рассматривается в качестве прогностического маркера неблагоприятных исходов у пациентов с COVID-19 [10, 11].
Из сказанного следует, что PTX3 возможно использовать в качестве прогностического маркера как активности воспалительного ответа организма, так и повреждения ССС у пациентов с COVID-19.
Цель — определить прогностическую значимость PTX3 и других сывороточных биомаркеров в отношении развития неблагоприятных сердечно-сосудистых событий (НССС) у больных новой коронавирусной инфекцией при долгосрочном наблюдении.
Материал и методы . В проспективное нерандомизированное открытое сравнительное исследование исходно включено 144 пациента, находившихся на стационарном лечении, соответствующих критериям включения и не имевших критериев исключения. Критерии включения: госпитализация в COVID-госпиталь; положительный ПЦР-тест на выявление РНК SARS-CoV-2; поражение легких при поступлении 1–4-й степеней; добровольное согласие больного на участие в исследовании; возраст 18–70 лет. Критерии исключения: имеющиеся ССЗ; острые и хронические заболевания бронхов и легких другой этиологии; онкологические заболевания; сахарный диабет 1-го и 2-го типов.
В последующем по различным причинам из исследования выбыло 30 пациентов, в том числе
3 пациента с развившимися НССС на стационарном этапе лечения.
Проведение исследования одобрено этическим комитетом ФГБОУ ВО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России.
При поступлении в COVID-госпиталь всем пациентам выполнена компьютерная томография органов грудной клетки (КТ ОГК), взяты образцы венозной крови для общего анализа крови и биохимического анализа крови (общий белок, альбумин, креатинин, аспартатаминотрансфераза, аланинаминотрансфераза, общий холестерин, прокальцитонин, лактатдегидрогеназа (ЛДГ), КФК, КФК-МВ, вчTrT, вчTrI, D-димер, СРБ, ферритин, ИЛ-6). Помимо общего анализа крови и стандартной биохимии, в течение 24 ч с момента поступления были взяты образцы крови у пациентов для определения уровня PTX3. Для определения концентрации PTX3 использовался коммерческий набор, предназначенный для количественного определения человеческого PTX3 методом иммуноферментного анализа в образцах сыворотки, плазмы крови, а также супернатантов клеточных культур. Согласно инструкции, прилагаемой к набору, пороговым принято значение PTX3, равное 2 нг/мл.
Во время стационарного лечения пациенты получали медикаментозную терапию, прописанную в действующих временных методических рекомендациях «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» [12].
Когорта пациентов наблюдалась в течение года с момента выписки из стационара. За время наблюдения оценивалось развитие конечных точек — НССС: острый коронарный синдром, тромбоэмболия легочной артерии, острое нарушение мозгового кровообращения, нарушение ритма (пароксизмальная суправентрикулярная/желудочковая тахикардия, фибрилляция предсердий) и летальных исходов от сердечно-сосудистых причин (ССП).
Статистическая обработка полученных результатов производилась с использованием программы Statistica 8 (StatSoft Inc., США) и MedCalc 8.2.0.3. Проверка признака на соответствие нормальному закону распределения проводилась с помощью критериев Шапиро — Уилка и Колмогорова — Смирнова. Для описания признаков с распределением, отличным от нормального, указывали медиану, верхний и нижний квартили ( Ме [ Q 1; Q 3]). Различия между группами анализировали непараметрическими методами с использованием U -критерия Манна — Уитни. Различия между категориальными переменными анализировались с помощью критерия χ2 Пирсона. Для прогнозирования развития НССС в зависимости от значений клинико-лабораторных показателей использовался логистический регрессионный анализ с расчетом натуральных логарифмов отношения шансов (ОШ) при 95% доверительном интервале (ДИ). Для определения прогностической ценности перспективных биомаркеров (PTX3) рассчитывалась площадь под ROC-кривой (AUC). В процессе ROC-анализа определялась точка cut-off с расчетом чувствительности и специфичности. Как статистически значимые различия рассматривали при р <0,05.
Результаты. Клиническая и лабораторная характеристика пациентов на момент госпитализации в стационар представлена в табл. 1–3.
Таблица 1
|
Параметр |
Пациенты ( n =114) |
|
Мужчины, абс. (%) |
48 (42,1) |
|
Женщины, абс. (%) |
66 (57,9) |
|
Возраст, лет |
57 [46; 63] |
|
Индекс массы тела, кг/м2 |
25,0 [22,7; 29,4] |
|
Тяжесть течения COVID-19, абс. (%): |
|
|
среднетяжелое |
81 (71,1) |
|
тяжелое |
33 (28,9) |
|
Стадия КТ на момент госпитализации, абс. (%): |
|
|
1-я |
66 (57,9) |
|
2-я |
31 (27,2) |
|
3-я |
15 (13,1) |
|
4-я |
2 (1,8) |
|
SpO2, % |
96,0 [94,0; 97,0] |
|
Частота сердечных сокращений, в мин. |
85,0 [75,0; 95,5] |
|
Частота дыхательных движений, в мин. |
17,0 [16,0; 20,0] |
|
Оксигенотерапия, абс. (%) |
45 (39,5) |
|
Курение, абс. (%) |
27 (23,7) |
|
SCORE-2, риск на момент госпитализации, абс. (%): |
|
|
низкий |
4 (3,5) |
|
умеренный |
55 (48,2) |
|
высокий |
41 (36) |
|
Избыточная масса тела, абс. (%) |
31 (27,2) |
|
Ожирение, абс. (%): |
|
|
1-й степени |
17 (15) |
|
2-й степени |
5 (4,4) |
|
Артериальная гипертензия, абс. (%): |
|
|
1-й степени |
7 (6,1) |
|
2-й степени |
3 (2,6) |
П р и м еч а н и е : SCORE-2 — Systematic Coronary Risk Evaluation 2.
Таблица 2
|
Параметр |
Пациенты ( n =114) |
|
Лейкоциты, х10 9 /л |
6,9 [4,8; 9,0] |
|
Лимфоциты, % |
19 [13,0; 27,0] |
|
Моноциты, % |
5 [3; 8] |
|
Тромбоциты, х10 9 /л |
199 [151; 264] |
|
Гемоглобин, г/л |
139 [128; 151] |
|
Эритроциты, х1012/л |
4,6 [4,3; 5,1] |
|
Скорость оседания эритроцитов, мм/ч |
27 [19; 36] |
|
СРБ, мг/л |
41 [17; 98] |
|
Ферритин, нг/мл |
285 [150; 601] |
|
Интерлейкин-6, пг/мл |
4,1 [0,6; 28,6] |
|
Общий холестерин, ммоль/л |
4,2 [3,5; 5,0] |
|
D-димер, мкг/мл |
0,6 [0,4; 1,0] |
Окончание табл. 2
|
Параметр |
Пациенты ( n =114) |
|
Витамин D , нг/мл |
35 [31,0; 38,0] |
|
Скорость клубочковой фильтрации, мл/мин/м2 |
84 [68; 94] |
|
Таблица 3 |
|
|
Сердечно-сосудистые биомаркеры на момент госпитализации |
|
|
Параметр |
Пациенты ( n =114) |
|
ЛДГ, Ед/л |
175 [170; 190] |
|
КФК, Ед/л |
61 [57; 68] |
|
КФК-МВ, Ед/л |
12 [9; 15] |
|
вчТгТ, нг/мл |
0,03 [0,01; 0,05] |
|
вчТг1, нг/мл |
0,22 [0,2; 0,25] |
|
PTX3, нг/мл |
5,7 [3,6; 8,9] |
|
Таблица 4 |
|
|
Структура нежелательных сердечно-сосудистых событий при годичном наблюдении за пациентами |
|
|
Конечные точки исследования |
Пациенты, абс. (%) |
|
НССС |
|
|
Острый коронарный синдром |
5 (4,4) |
|
Нарушения ритма |
10 (8,8) |
|
Острое нарушение мозгового кровообращения |
4 (3,5) |
|
Тромбоэмболия легочной артерии |
1 (0,9) |
|
Смерть от ССП |
|
|
Острый коронарный синдром |
1 (0,9) |
|
Тромбоэмболия легочной артерии |
1 (0,9) |
Клинические характеристики пациентов на момент госпитализации
Лабораторные параметры пациентов на момент госпитализации
Из табл. 1 следует, что среди госпитализированных пациентов было больше женщин (57,9%), стаж курения отмечался менее чем у ¼ пациентов, а продолжительность госпитализации составила 10,0 [8,0; 14,0] дня. У 31 (27,2%) пациента в стационаре отмечалось нарастание дыхательной недостаточности и объема поражения легких по данным компьютерной томографии. Потребность в проведении неинвазив-ной/инвазивной вентиляции легких потребовалась 9 (7,9%) пациентам. Наиболее распространенной сопутствующей патологией являлась избыточная масса тела (27,2%) и экзогенно-конституциональное ожирение 1-й степени (15%).
В табл. 2 представлены исходные лабораторные показатели, а в табл. 3 — сердечно-сосудистые маркеры пациентов с COVID-19 при госпитализации в стационар. Лейкопения (значение лейкоцитов менее 4х109/л) отмечалась у 16 (14%) пациентов, лейкоцитоз (значение лейкоцитов более 9х109/л) — у 24 (21,1%), тромбоцитопения (значение тромбоцитов менее 150х109/л) — у 22 (19,3%), СРБ сыворотки крови более 10 мг/л — у 103 (90,4%), ИЛ-6 более 7 пг/мл — у 50 (43,9%), прокальцитонина более 0,5 мкг/л — у 2 (1,8%), PTX3 более 2 нг/мл — у 109 (95,6%) пациентов. Не отмечено повышения концентрации КФК, КФК-МВ, вчTr в день поступления.
Наблюдение за пациентами осуществлялось на протяжении 366 [365; 380] дней после выписки из COVID-госпиталя. За этот период времени НССС зарегистрированы у 19 пациентов (16,7%), в том числе зафиксировано 2 летальных исхода (1,8%) от ССП (табл. 4).
Далее для определения статистически значимых различий в отношении развития НССС пациенты были разделены на две группы: группа 0 — без развития конечных точек при долгосрочном наблюдении; группа 1 — с развитием конечных точек при долгосрочном наблюдении (табл. 5).
Приведенные данные в табл. 5 показывают, что пациенты, у которых в течение года наблюдения развились НССС, имели больший индекс массы тела, длительнее находились на стационарном этапе лечения, а также имели более высокий риск сердечно-сосудистых событий по шкале Systematic Coronary Risk Evaluation 2 (17,3% [6; 33] и 11,7% [2; 27] соответственно; p =0,006). У этих больных также достоверно выше концентрации ИЛ-6, D-димера, ЛДГ, КФК, КФК-МВ и PTX3 ( p <0,05) при поступлении в COVID-госпиталь. Не получено статистически значимых различий между группами в зависимости от тяжести течения COVID-19 ( p =0,052), объемом поражения легочной ткани по данным КТ ОГК ( p =0,418), исходными показателями SpO2 ( p =0,134).
Среди изученных параметров, с развитием НССС статистически значимо были ассоциированы повышенные уровни PTX3 (ОШ 1,28, 95% ДИ 1,13-1,45; p <0,001), ИЛ-6 (ОШ 1,01, 95% ДИ 1,0-1,02; p =0,048), D-димера (ОШ 2,05, 95% ДИ 1,16-3,6; p =0,019), ЛДГ (ОШ 1,08, 95% ДИ 1,03-1,13; p <0,001), КФК МВ (ОШ 1,19, 95% ДИ 1,02-1,39; p =0,001), а также курение (ОШ 4,05, 95% ДИ 1,1-14,95; p =0,001).
Поскольку в настоящее время отсутствуют общепринятые пороговые значения перспективного биомаркера повреждения ССС PTX3, проведен
Таблица 5
Клинико-лабораторные показатели у пациентов с COVID-19 в зависимости от развития конечных точек
|
Параметр |
Группа |
p |
|
|
0-я, n =95 (83,3%) |
1-я, n =19 (16,7%) |
||
|
Возраст, лет |
52,4 [18; 70] |
57,6 [32; 69] |
0,151 |
|
Индекс массы тела, кг/м2 |
26,0 [19,6; 40,8] |
28,4 [21,6; 40,1] |
0,040 |
|
Длительность госпитализации, дни |
11,4 [6; 41] |
14,8 [8; 49] |
0,015 |
|
Лейкоциты, х109/л |
7,3 [1,5; 19,4] |
7,1 [2,1; 13,1] |
0,822 |
|
Лимфоциты, % |
21 [6; 53] |
22 [5; 51] |
0,888 |
|
Моноциты, % |
6,1 [1; 16] |
3,6 [1; 7] |
0,001 |
|
Тромбоциты, х109/л |
218,1 [100; 475] |
192,4 [97; 358] |
0,233 |
|
Гемоглобин, г/л |
140 [99; 176] |
141 [115; 185] |
0,689 |
|
Эритроциты, *1012/л |
4,7 [3,4; 6,1] |
4,5 [3,8; 5,7] |
0,054 |
|
Скорость клубочковой фильтрации, мл/мин/м2 |
83,9 [44; 127] |
74,3 [50; 105] |
0,048 |
|
СРБ, мг/л |
65,1 [2; 465] |
69,8 [3; 196] |
0,422 |
|
Ферритин, нг/мл |
395 [18; 1560] |
416,5 [98; 1009] |
0,565 |
|
ИЛ-6, пг/мл |
18,7 [0; 254,7] |
33,2 [0; 184] |
0,019 |
|
Общий холестерин, ммоль/л |
4,2 [1,9; 6,9] |
4,6 [2; 7,5] |
0,209 |
|
D-димер, мкг/мл |
0,7 [0,05; 3,8] |
1,6 [0,2; 7,7] |
0,003 |
|
ЛДГ, Ед/л |
174,9 [160; 215] |
200 [170; 230] |
0,001 |
|
КФК, Ед/л |
61,5 [34; 95] |
77,7 [58; 150] |
0,001 |
|
КФК — МВ, Ед/л |
11,4 [5; 28] |
21 [11; 48] |
0,001 |
|
вчТгТ, нг/мл |
0,03 [0,01; 0,05] |
0,04 [0,01; 0,05] |
0,290 |
|
вчТг1, нг/мл |
0,22 [0,2; 0,25] |
0,23 [0,2; 0,3] |
0,392 |
|
PTX3, нг/мл |
5,3 [3,5; 8,1] |
9,6 [4,4; 12,4] |
0,015 |
П р и м еч а н и е : Значения p получены по результатам проведения непараметрического теста Манна — Уитни.
ROC-анализ с определением точки cut-off. Концентрация PTX3>3,1 нг/мл прогнозировала развитие НССС в отдаленный период у пациентов, перенесших COVID-19 (чувствительность 94,0%, специфичность 82,1 %; aUc 0,885; p <0,001; рисунок).
Обсуждение. Концентрация PTX3 в плазме крови здоровых людей ничтожно мала и составляет менее 2 нг/мл, при этом отмечено увеличение содержания PTX3 у возрастных пациентов женского пола. В многоэтническом исследовании 2014 г. N. S. Jenny, включавшем 2838 пациентов без анамнеза ССЗ, после корректировки на пол, возраст, этническую принадлежность, увеличение уровня PTX3 на 1,62 нг/мл было ассоциировано с наличием коронарного кальциноза (ОШ 1,05, 95% ДИ 1,01-1,08), с повышенным риском инфаркта миокарда (ОШ 1,51, 95% ДИ 1,16-1,97), сочетанных ССЗ (ОШ 1,23, 95% ДИ 1,05-1,45) и ИБС (ОШ 1,33, 95% ДИ 1,10-1,60), но не с инсультом, смертностью от ССЗ, или общей смертью от всех причин [13]. Уровень сывороточного PTX3 при поступлении был значительно выше в группе пациентов с острым инфарктом миокарда (ОИМ), чем в контрольной группе без ОИМ (2,27±0,81 и 0,86±0,50 нг/мл соответственно; р <0,001). При многофакторном анализе PTX3 был весомым независимым предиктором долгосрочной смертности от ССС после поправки на другие факторы риска (OР=1,12, 95% ДИ 1,04-1,20; p =0,001) [13].
По результатам крупных рандомизированных клинических исследований CORONA (1457 пациентов) и GISSI-HF (1233 пациента) повышение концентрации PTX3 являлось прогностическим маркером госпитализации по причине декомпенсации хронической СН, смертности от ССС и общей смертности [14].
В нашем исследовании концентрация PTX3 при госпитализации была значимо выше у пациентов с развившимися НССС при годичном наблюдении, чем у пациентов без неблагоприятных исходов (9,6 [4,4; 12,4] и 5,3 [3,5; 8,1] нг/мл соответственно; p =0,015).
Прогностическая ценность новых биомаркеров в стратификации долгосрочных неблагоприятных ССС при 2-годичном наблюдении пациентов, перенесших ОИМ с подъемом сегмента ST, наиболее высока у мультимаркерной модели с тремя биомаркерами: NT-proBNP (ОР 1,19, 95% ДИ 1,018-1,32; p <0,001); sST2 (ОР 1,000013, 95% ДИ 1,00-1,001; p =0,007); PTX3 (ОР 1,178, 95% ДИ 0,798-1,73; p =0,434), чем у одно- или двухмаркерной модели (LR=12,45; p =0,033) [15]. В проспективном исследовании 2020 г. N. Zagidullin и соавт., включавшем 147 пациентов с ОИМ с подъемом сегмента ST, было показано, что наилучшим предиктором смертности от ССП в течение двух лет после выписки был PTX3 (ОР 3,1,95% ДИ 1,63-5,39; р <0,001). При проведении ROC-анализа концентрация PTX3>169 нг/мл предсказывала смертность от ССП (чувствительность 68,4%, специфичность 82,0%; AUC 0,804; p =0,063) [16]. В настоящей работе прогностически значимым в отношении НССС было значение PTX3>3,1 нг/мл (чувствительность 94,0%, специфичность 82,1%;
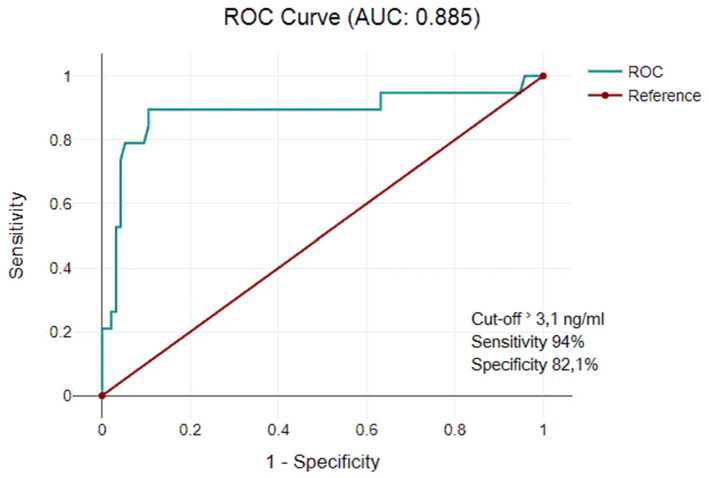
Определение точки cut-off по концентрации PTX3 для прогнозирования НССС в течение года после перенесенного COVID-19
AUC 0,885; p <0,001). Различия в результатах исследования обусловлены главным образом наличием анамнеза ССЗ (ОИМ) в работе N. Zagidullin [16] и отсутствием установленного ССЗ у пациентов на момент включения в наше исследование.
COVID-19 проявляется широким спектром клинических проявлений и различным течением инфекции от бессимптомного носительства до критических состояний. В настоящее время известно, что такие характеристики пациентов, как пожилой возраст, иммунодефицитные состояния, сопутствующие заболевания (ССЗ, сахарный диабет, СН, злокачественные новообразования) ассоциированы с тяжелым течением COVID-19 [17, 18]. Однако не существует общепринятых маркеров прогнозирования неблагоприятных исходов при наблюдении за пациентами в стационаре и после выписки. Такие маркеры были бы полезны для стратификации риска развития ранних и поздних сердечно-сосудистых событий у пациентов, госпитализированных с COVID-19. Исходя из этих данных мы предположили возможность использования PTX3 как биомаркера, связывающего активность воспалительного процесса с риском развития НССС у пациентов, перенесших COVID-19.
В международных публикациях исходный уровень PTX3 вместе с другими маркерами воспаления (ИЛ-6, СРБ) являлся надежным параметром, определяющим не только тяжесть течения, но и прогрессирование COVID-19 ( p <0,001) [4–6, 17, 18]. В данном исследовании оценивалась значимость общепринятых маркеров активности воспаления (СРБ, ферритин, ИЛ-6), маркеров повреждения ССС (ЛДГ, КФК, КФК-МВ, вчTrT, вчTrI) и перспективного биомаркера PTX3 для прогнозирования развития неблагоприятных исходов в течение года после выписки из стационара [18].
Наличие связи между уровнем PTX3 и тяжести течения COVID-19, длительным сроком пребывания в стационаре, высокими значениями D-димера, вчTrT, вчTrI, тромботическими осложнениями во время госпитализации описаны в исследованиях M. Tong и соавт. [18], A. Genç и соавт. [19], а также A. Protti и соавт. [20].
Проведенное нами исследование имело несколько ограничений. Оно проводилось на небольшой выборке пациентов одного из отделений для лечения пациентов с COVID-19. У больных не определялись другие потенциальные маркеры прогнозирования развития НССС, такие как sST-2, NT-proBNP и VCAM-1.
Заключение. Сывороточные биомаркеры (PTX3 и КФК-МВ), вероятно, могут быть использованы для прогнозирования развития НССС в отдаленные сроки наблюдения у пациентов, перенесших COVID-19. Интеграция определения PTX3 в рутинную клиническую практику может улучшить стратификацию сердечно-сосудистого риска у пациентов с перенесенным COVID-19.
Вклад авторов: Т. В. Канаева, Н. А. Кароли — концепция, дизайн, написание текста статьи, Т. В. Канаева — сбор и обработка материала, Н. А. Кароли — редактирование текста.
Список литературы Пентраксин-3: возможности и перспективы использования биомаркера у пациентов с перенесенным COVID-19
- Ingraham NE, Lotfi-Emran S, Thielen BK, et al. Immunomodulation in COVID-19. Lancet Respir Med. 2020; 8 (6): 544-6. DOI: 10.1016/S2213-2600(20)30226-5
- Miyamoto T, Qureshi RA, Heimburger O, et al. Inverse relationship between the inflammatory marker pentraxin-3, fat body mass, and abdominal obesity in end-stage renal disease. Clin J Am Soc Nephrol. 2011; 6 (12): 2785-91. DOI: 10.2215/ С JN. 02320311
- AgrawalA, Singh PP, Bottazzi B, etal. Pattern recognition by pentraxins. Adv Exp Med Biol. 2009; 653: 98-116. DOI: 10.1007/978-1 -4419-0901 -5_7
- SchallerT, Hirschbuhl K, Burkhardt K, et al. Postmortem examination of patients with COVID-19. JAMA. 2020; 323 (24): 2518-20. DOI: 10.1001/jama.2020.8907
- Tavazzi G, Pellegrini C, Maurelli M, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020; 22 (5): 911-5. DOI: 10.1002/ejhf.1828
- Ruan Q, Yang K, Wang W, et al. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020; 46 (5): 846-8. DOI: 10.1007/s00134-020-05991-x
- Shi S, Qin M, Shen B, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020; 5 (7): 802-10. DOI: 10.1001/ jamacardio. 2020.0950
- Kaufmann CC, Ahmed A, Burger AL, et al. Biomarkers associated with cardiovascular disease in COVID-19. Cells. 2022; 11 (6): 922. DOI: 10.3390/cells11060922
- Bottazzi B, Garlanda C, Teixeira MM. Editorial: The role of pentraxins: From inflammation, tissue repair and immunity to biomarkers. Front Immunol. 2019; 10: 2817. DOI: 10.3389/ fimmu. 2019.02817
- Brunetta E, Folci M, Bottazzi B, et al. Macrophage expression and prognostic significance of the long pentraxin PTX3 in COVID-19. Nat Immunol. 2021; 22 (1): 19-24. DOI: 10.1038/S41590-020-00832-x
- Schirinzi A, Pesce F, Laterza R, et al. Pentraxin 3: Potential prognostic role in SARS-CoV-2 patients admitted to the emergency department. J Infect. 2021; 82 (4): 84-123. DOI: 10.1016/j.jinf.2020.10.027
- Авдеев C.H., Адамян Л. В., Алексеева Е.И. и др. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 16 (18.08.2022). М., 2022; 249 с.
- Jenny NS, Blumenthal RS, Kronmal RA, et al. Associations of pentraxin 3 with cardiovascular disease: The Multi-Ethnic Study of Atherosclerosis. J Thromb Haemost. 2014; 12 (6): 999-1005. DOI: 10.1111/jth.12557
- Latini R, Gullestad L, Masson S, et al. Pentraxin-3 in chronic heart failure: The CORONA and GISSI-HF trials. Eur J Heart Fail. 2012; 14 (9): 992-9. DOI: 10.1093/eurjhf/hfs092
- Гареева Д.Ф., Хамитова А.Ф., Лакман И.А. и др. Прогностическая значимость комбинации новых биомаркеров в долгосрочной стратификации неблагоприятных исходов у пациентов с инфарктом миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2020; 25 (12): 3948. DOI:10.15829/1560-4071-2020-3948
- Zagidullin N, Motloch LJ, Gareeva D, et al. Combining novel biomarkers for risk stratification of two-year cardiovascular mortality in patients with ST-elevation myocardial infarction. J Clin Med. 2020; 9 (2): 550. DOI: 10.3390/jcm9020550
- Linschoten M, Asselbergs FW. CAPACITY-COVID: A European Registry to determine the role of cardiovascular disease in the COVID-19 pandemic. Eur Heart J. 2020; 41 (19): 1795-6. DOI: 10.1093/eurheartj/ehaa280
- Tong M, Xiong Y, Zhu C, et al. Elevated serum pentraxin-3 levels is positively correlated to disease severity and coagulopathy in COVID-19 patients. Mediterr J Hematol Infect Dis. 2020; 13 (1): e2021015. DOI: 10.4084/mjhid. 2021.015
- Gene AB, Yaylaci S, Dheir H, et al. The predictive and diagnostic accuracy of long pentraxin-3 in COVID-19 pneumonia. Turk J Med Sci. 2021; 51 (2): 448-53. DOI: 10.3906/sag-2011-32
- Protti A, Meessen J, Bottazzi B, et al. Circulating pentraxin 3 in severe COVID-19 or other pulmonary sepsis. Eur J Clin Invest. 2021; 51 (5):e13530. DOI: 10.1111/eci.13530


