Пептидазная активность штамма А 11 Amphibacillus alashanensis sp. Nov
Автор: Эрдынеева Е.Б., Раднагуруева А.А., Лаврентьева Е.В.
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Рубрика: Химия
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Изучена пептидазная активность у штамма А 11 Amphibacillus alashanensis sp. nov. на различных субстратах. Показано, что культуры обладают высокой субтили- зиноподобной, аминопептидазной активностью. Наблюдаемая различная специфичность, возможно, отражает метаболические особенности конкретного вида бактерии, свидетельствуя о том, что процесс гидролиза одного и того же белкового субстрата может быть выполнен с использованием разных ферментативных механизмов. Протеазы стабильны в широком диапазоне температур от 23 до 60оС и рН от6,80 до 11,98. Активность пептидазы варьирует в зависимости от субстрата в среде и времени культивирования.
Соленые озера, бадаин жаран, n-нитроанилидные субстраты, пептидазы, субтилизинподобная активность, алкали-галофильная бактерия, температурная и рн стабильность
Короткий адрес: https://sciup.org/148316661
IDR: 148316661 | УДК: 577.151.01 | DOI: 10.18101/2306-2363-2016-4-3-10
Текст научной статьи Пептидазная активность штамма А 11 Amphibacillus alashanensis sp. Nov
Изучение пептидаз бактерий, выделенных из экстремальных мест обитания, предоставляет уникальную возможность исследовать стратегии функционирования прокариотной клетки. Предполагается, что усиленный синтез гидролитических ферментов является одним из способов адаптации бактерий к агрессивным (экстремальным) условиям окружающей среды [1].
Цель данной работы — изучение внеклеточных пептидаз, алкали-галофильной бактерии Amphibacillus alashanensis sp. nov., выделенной из соленого озера пустыни Бадаин Жаран.
Объекты и методы исследования
В качестве источника секретируемых протеолитических ферментов использовали культуральную жидкость культуры А 11. Штамм А11 был выделен из песчаного осадка в восточной части соленого озера Бадаин Жаран, Внутренняя Монголия, Китай (39°33.123'N, 102°21.878'E, высота над уровнем моря 1200 м). Выделенный штамм А 11 относится к представителю рода Amphibacillus.
Определение внеклеточной пептидазной активности в культуральной жидкости у изученных культур проводили по методу Эрлангера [2], используя 5 мМ пара-нитроанилидные субстраты протеаз — трипсиноподобных, химотрипсиноподобных, субтилизиноподобных, цистеиновых и аминопептидаз (BAPA, GlpFpNA, GlpAALpNA, GlpFApNA и TpNA, ApNA, LpNA, соответственно) и на белковом субстрате азоказеине, используемым для определения общей активности. Для изучения влияния различных белков и углеводов на секрецию пептидаз к среде Пфеннига добавляли следующие белки (в конечной концентрации 1%): азоказеин, пептон и глюкозу. В работе использовались ингибиторы металлопротеаз — этилендиаминтетраацетат Na (ЭДТА), цистеиновых протеаз — иодацетамид (ИAA) и сериновых протеаз — фенилметилсульфонилфторид (ФМСФ) [3-4].
Результаты и их обсуждениеВнеклеточная протеолитическая активность штамма А 11
Наиболее важным фактором определяющим активность внеклеточных ферментов является наличие в питательной среде оптимального субстрата в процессе роста культур. Нами проведено сравнительное изучение секреции внеклеточных пептидаз в зависимости от источника белка и углеводов (пептон и глюкоза), а также времени культивирования (от 12 до 96 ч).
Установлено, что максимальная активность по азоказеину у культуры А11 как на среде с пептоном, так и с глюкозой проявляется на 48–72 ч культивирования (рис. 1).
Способность к расщеплению синтетических субстратов известного состава определяется строением субстрат-связывающего участка молекулы фермента, строением каталитического участка и является одним из наиболее важных характеризующих его свойств. Поэтому нами были проведены эксперименты по определению субстратной специфичности.
Изученная культура А11 наиболее активна в отношении субстратов, специфичных для субтилизинов и аминопептидаз.
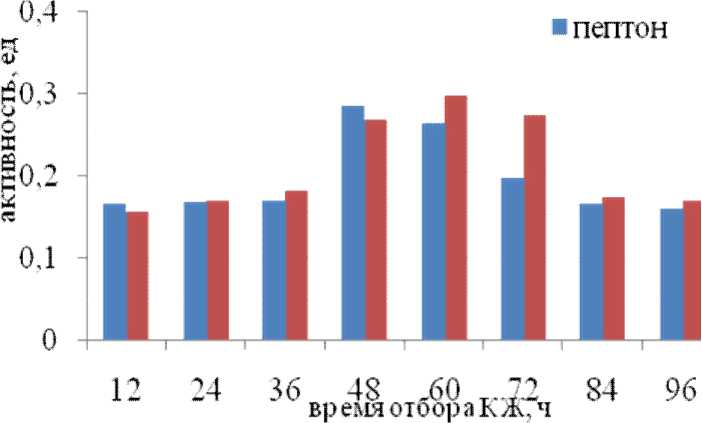
Рис. 1. Общая внеклеточная протеолитическая активность культуры А11 по субстрату азаказеин в зависимости от источника азота и углерода
Исследованная нами культура не гидролизует субстраты, специфичные для химотрипсин-подобных и цистеиновых пептидаз, независимо от времени культивирования (до 96 ч) и источников азота и углерода (рис. 2).
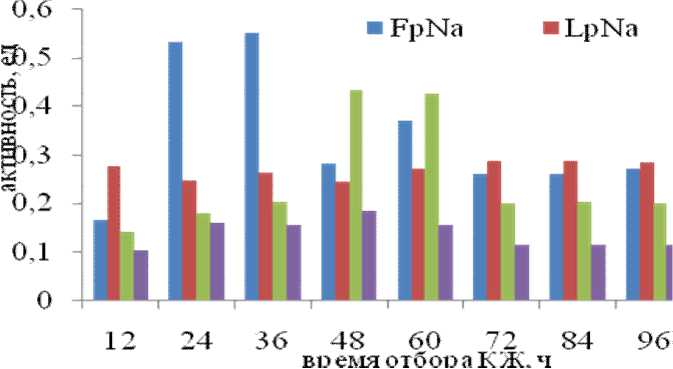
Рис. 2. Внеклеточная протеолитическая активность культуры А11 по субстратам GlpAALpNa, BAPA, FpNa, LpNa на среде с пептоном
Максимальная активность для трипсин-подобных пептидаз по субстрату ВАРА обнаружена на среде с пептоном на 48 ч культивирования и составила 0,183 ед. Изучение пептидазной активности на специфичном для субтилизин- подобных пептидаз субстрате — GlpAALpNa показало наличие у штамма наиболее высокой внеклеточной протеолитической активности на среде с пептоном, которая составила 0,433 ед (48 ч).
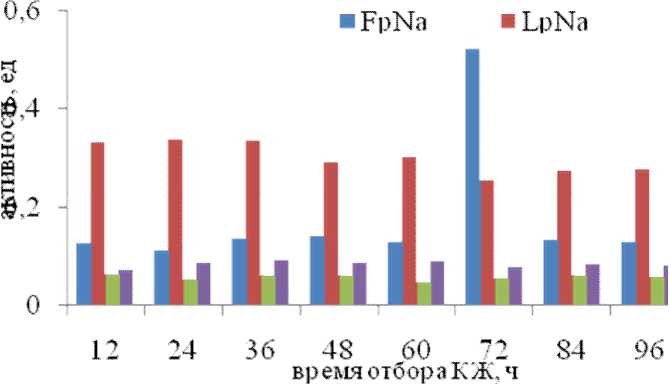
Рис. 3. Внеклеточная протеолитическая активность культуры А11 по субстратам GlpAALpNa, BAPA, FpNa, LpNa на среде с глюкозой
Показано, что кроме активности по субстрату GlpAALpNa и BAPA, культура А11 гидролизует субстраты аминопептидаз — F-pNa и L-pNa. Максимум активности по этим субстратам определены на 36 ч культивирования на среде с пептоном и 72 ч — на среде с глюкозой (рис. 3).
Полученные данные свидетельствуют о том, что пептидазы штамма активно расщепляют связи, образованные гидрофобными аминокислотами (аланин, лейцин). Таким образом, штамм А11 обладает различной субстратной специфичностью. Наблюдаемая различная специфичность возможно отражает метаболические особенности конкретного вида бактерии, свидетельствуя о том, что процесс гидролиза одного и того же белкового субстрата может быть выполнен с использованием разных ферментативных механизмов.
Результаты исследований указывают на то, что существенный вклад в пептидазную активность культуры А11, по-видимому, вносят пептидазы с субтилизин-подобной специфичностью, гидролизующие субстраты, содержащие в цепи несколько остатков аланина (GlpAALpNa, FpNa) [5].
Определение температурного оптимума и стабильности фермента
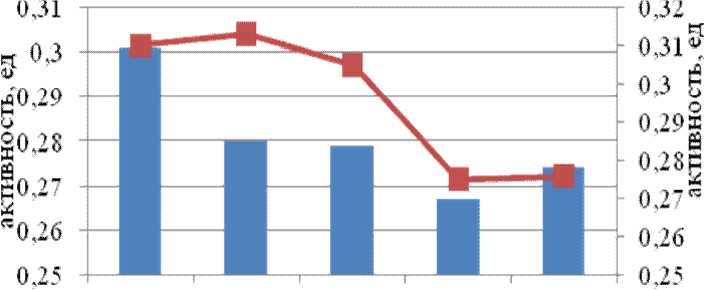
Исследуемые культуры бактерий способны расти в экстремальных условиях, связи с этим, представляло интерес выяснить, насколько адаптированы к экстремальным условиям секретируемые ими ферменты. С этой целью было изучено влияние температуры и рН на активность и стабильность наиболее представленной внеклеточной пептидазы, гидролизующей GlpAALpNa на среде с пептоном и гидролизующей FpNa на среде с глюкозой. Графики, по- лученные в эксперименте зависимости активности пептидазы Amphibacillus alashanensis штамм A11 от температуры представлены на рис. 4 и 5. Определение температурного оптимума и стабильности ферментов проведены для диапазона 25-60°С. Исследуемые пептидазы штамма А11 стабильны до 50°С.
25 30 40 50 60t оптимум ■ t аабтьность
Рис. 4. Температурные оптимум и стабильность субтилизин-подобной пептидазы Amphibacillus alashanensis штамм A11 на среде с глюкозой
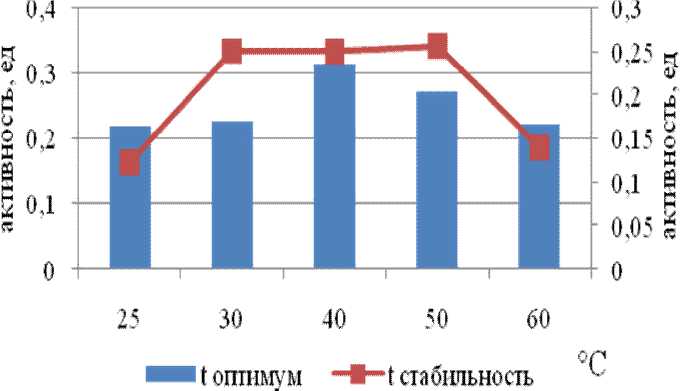
Рис. 5. Температурные оптимум и стабильность субтилизин-подобной пептидазы Amphibacillus alashanensis штамм A11 на среде с пептоном
Внеклеточные пептидазы штамма А11 по субстрату FpNa имели оптимум активности при 25°С, тогда как по субстрату GlpAALpNa при 40°С при этом сохраняла до 70% активности при 60°С. Из литературных данных известно, что субтилизин-подобные пептидазы характеризуются широким интервалом температурного оптимума и стабильности. По мнению ряда авторов, высокая стабильность пептидаз бацилл обеспечивается гидрофобными и ионными взаимодействиями, а также водородными связями и дисульфидными мостиками в белковой глобуле субтилаз [6-7].
Определение рН оптимума и стабильности фермента
Исследование рН оптимума и стабильности проведены в диапазоне рН от 1,98 до 11,82.
Ферменты штамма по субстрату FpNa активны в относительно широком диапазоне рН с оптимумом 11,82 (рис. 6). Фермент сохранял стабильность в интервале рН от 6,8 до 11,82.
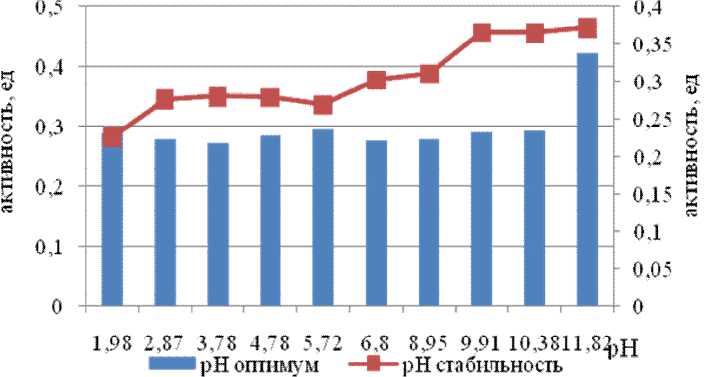
Рис. 6. рН оптимум и стабильность субтилизин-подобной пептидазы Am-phibacillus alashanensis штамм A11 на среде с глюкозой
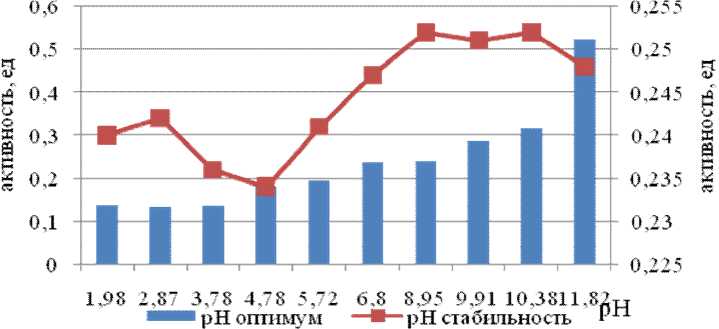
Рис. 7. рН оптимум и стабильность субтилизин-подобной пептидазы Am-phibacillus alashanensis штамм A11 на среде с пептоном
На среде с пептоном (рис. 7) пептидазы культуры А11 активны в широком интервале рН от 5,72 до 11,82, с максимумом при рН 11,82.
Из литературных данных известно, что многие бактериальные субтили-зин-подобные пептидазы сохраняют активность при высоких значениях рН. Можно предположить, что высокая щелочеустойчивость изученных белков служит адаптационным механизмом бактерий, которая позволяет им функционировать в экстремальных условиях.
Полученные нами данные указывают на то, что секретируемые пептидазы изученной бактериальной культуры Amphibacillus alashanensis штамм А11 имеют оптимум рН в щелочной области и рН стабильность, вполне покрывающую диапазон рН, свойственный местам их обитания.
Список литературы Пептидазная активность штамма А 11 Amphibacillus alashanensis sp. Nov
- Ward O. P. Proteolytic enzymes / In. M. Moo-Young Editor. -Comprehensive Biotechnology. - 1985. - V. 3.- P. 789-818.
- Erlanger B. F., Kokowsky N., Cohen W. The preparation and properties of two new chromogenic substrates of trypsin // Arch. Biochem. Biophis. - 1961. - V. 95. - P. 271-278.
- Справочник биохимика: Пер. с англ. / Р. Досон, Д. Эллиот, У.Элиот, К. Джонс - М.: Мир, 1991. - 544 с.
- Кевбрин В. В. Термофильные алкакофильные микроорганизмы / Труды Института микробиологии имени С.Н. Виноградского - М.: Наука, 2007. В. 14: Алкалофильные микробные сообщества. - С. 374-396.
- Ballinger M. D. Subtilisin / In. Handbook of proteolytic enzymes. Eds. A. J. Barrett, N. D. Rawlings, J. F. Woessner. - London: Academic Press, 1998. - Electronic version on PC CD-ROM.
- Балабан Н. П., Маликова Л. А., Марданова А. М., Руденская Г. Н., Шарипова М. Р. Получение и характеристика субтилизинподобных протеиназ, секретируемых в стационарную фазу роста Bacillus amy-loliquefaciens H2 // Биохимия. - 2007. - Т. 72, Вып. 4. - С. 568-575.
- Михайлова Е. О., Марданова А. М., Балабан Н. П., Руденская Г. Н., Шарипова М. Р. Выделение и характеристика субтилизинподобной протеиназы Bacillus intermedius, секретируемой рекомбинантным штаммом Bacillus subtilis AJ 73 на разных фазах роста бацилл // Биохимия. - 2007. - Т. 72, Вып. 2. - С. 228-235.


