Пептидный токсин, нацеленный на натриевые каналы, в модели ишемически-реперфузионной клеточной гибели
Автор: Юрова Е.В., Расторгуева Е.В., Белобородов Е.А., Сугак Д.Е., Погодина Е.С., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Инфаркт миокарда является одним из наиболее распространенных сердечно-сосудистых заболеваний в мире. Прерывание коронарного кровотока подвергает кардиомиоциты стрессу, а реперфузия повторно вводит субстрат и кислород, обеспечивая резкую нормализацию внутриклеточной среды. Все это парадоксальным образом вызывает повышение гибели клеток, в результате чего развивается ишемически-реперфузионное повреждение. Давно известно, что перегрузка натрием в миокарде является одним из наиболее важных механизмов, лежащих в основе ишемически-реперфузионного повреждения. В нашей работе для снижения притока Na+ на стадии реперфузии и, как следствие, уменьшения повреждения мы использовали мю-агатоксин-Aa1a. Цель. Изучение влияния мю-агатоксина-Aa1a на клеточную гибель кардиомиоцитов в in vitro модели ишемически-реперфузионного повреждения. Материалы и методы. Исследование проводили на культуре кардиомиоцитов H9C2. Уровни апоптоза, некроза и концентрацию ионов натрия оценивали с помощью флуоресцентной микроскопии. Для подтверждения уровня некроза использовали спектрофотометрический метод определения концентрации лактатдегидрогеназы. Модель ишемически-реперфузионного повреждения была основана на инкубации культуры в среде с частичной депривацией глюкозы, сыворотки и кислорода в течение 18 ч с последующим переносом в полную питательную среду на 2 ч. Токсин добавляли в начале стадии реперфузии. Результаты. При повышении клеточной гибели в результате апоптоза и некроза в модели ишемически-реперфузионного повреждения добавление токсина в концентрации 50 нМ вызывает рост выживаемости клеток за счет снижения концентрации ионов натрия. Выводы. Пептидный токсин мю-агатоксин-Aa1a, нацеленный на натриевые потенциалзависимые каналы и способный менять их проводимость, в концентрации 50 нМ может в значительной степени снижать гибель кардиомиоцитов при моделировании ишемически-реперфузионного повреждения in vitro.
Ишемия, реперфузия, кардиомиоциты, натриевые каналы, пептидный токсин
Короткий адрес: https://sciup.org/14132978
IDR: 14132978 | УДК: 57.053.2 | DOI: 10.34014/2227-1848-2025-1-93-103
Текст научной статьи Пептидный токсин, нацеленный на натриевые каналы, в модели ишемически-реперфузионной клеточной гибели
Введение. Инфаркт миокарда является одним из наиболее распространенных сердечнососудистых заболеваний в мире. Кардиомиоциты в значительной степени зависимы от поступления кислорода, поэтому прерывание коронарного кровотока быстро подвергает их стрессу и в конечном итоге приводит к клеточной гибели [1]. Реперфузия повторно вводит субстрат и кислород, обеспечивая резкую нормализацию внутриклеточной среды и вымывание катаболических отходов, накопленных во время ишемии. Все это парадоксальным образом вызывает повышение гибели клеток, в результате чего развивается ишемически-репер-фузионное повреждение (ИРП) [2].
Давно известно, что перегрузка миокарда натрием является одним из наиболее важных механизмов, лежащих в основе ишемически-репер-фузионного повреждения [3, 4]. После начала ишемии концентрация Na+ постепенно увеличивается. Массивный приток Na+ внутрь клетки, продолжающийся во время реперфузии за счет вытеснения избыточного количества ионов H+ через натрий-протонный насос, заставляет натрий-кальциевый насос работать нестандартно, выкачивая Na+ в обмен на Ca2+ [5, 6]. Временного накопления Ca2+ в цитоплазме достаточно, чтобы активировать кальцийзависи-мые липазы и протеазы, а также широкий спектр патофизиологических реакций [7–9], что ведет к значительному повреждению миокарда. Контролировать поступление Na+ внутрь клетки через ионные каналы можно путем применения блокаторов. Данную стратегию в медицинской практике используют уже длительное время. Так, например, известно, что блокаторы натриевых каналов применяют как мембраностабилизирующие антиаритмические препараты. Сюда относятся хинидин, новокаинамид, аймалин с умеренной блокадой натриевых каналов [10–13], а также пропафенон, этацизин, флекаинид с выраженной блокадой [14, 15]. Несмотря на то что данный тип блокаторов оказывает выраженное влияние на концентрацию ионов натрия, работ, посвященных изучению их действия при ИРП, в настоящее время мало, и все они датируются 80– 90-ми гг. XX в. [16–18].
В нашем исследовании для снижения притока Na+ на стадии реперфузии и, как следствие, уменьшения ИРП мы использовали относящийся к модуляторам потенциалзависимых натриевых каналов токсин мю-агатоксин-Aa1a [Uniprot: T5G1A_AGEAP] из яда паука Agelenopsis aperta . Модификация натриевых каналов токсином вызывает повышение их чувствительности за счет смещения кривой активации к более отрицательным потенциалам [19]. Это приводит к увеличению вероятности открытия натриевых каналов. Кроме того, пептидные токсины, к которым относится мю-агатоксин-Aa1a, по своей природе обладают рядом отличительных свойств, одно из которых – высокая селективность по отношению к определенному типу каналов, за счет чего необходимый эффект может быть достигнут с использованием незначительных доз (нано- и микромолярных).
Цель исследования. Изучение влияния токсина мю-агатоксин-Aa1a на клеточную гибель кардиомиоцитов в in vitro модели ишеми-чески-реперфузионного повреждения.
Материалы и методы. Клеточная культура и условия эксперимента. Для моделирования условий ИРП кардиомиоцитов использовалась культура H9C2, предоставленная Институтом молекулярной генетики РАН. До эксперимента она содержалась в среде DMEM с 4,5 г/л глюкозы («Панэко», Россия), 10 % FBS (Globe Kang, Китай) и пенициллина/ стрептомицина (конечные концентрации 50 ЕД/мл и 50 мкг/м; «Панэко», Россия) в CO2-инкубаторе MCO-5AC (Sanyo, Япония) при 37 °С и 5 % CO2. Пассаж культуры проводили каждые 7 дней с использованием 0,25 % раствора трипсина («Панэко», Россия).
Эксперимент проводили в 96-луночных планшетах (SPL Life Sciences, Корея). Клетки в концентрации 5000 на ячейку оставляли на 48 ч для слияния и дифференцировки. Стадию дифференцировки определяли по появлению больших многоядерных клеток. Для моделирования ИРП культуру помещали в инкубатор CB-53 (Binder, Герания) с содержанием 1 % O2 в среде DMEM с 1 г/л глюкозы и 1 % FBS на 18 ч, затем планшет переносили в CO2-ин-кубатор MCO-5AC с 5 % CO2 и 18,6 % O2 на 2 ч. Одновременно с этим в ячейки планшета добавляли токсин в конечной концентрации 50 нМ.
Флуоресцентный анализ. Для детекции апоптоза использовался краситель Yo-Pro 1, который добавлялся к культуре в точке окончания реперфузия в концентрации 1 мкМ. Клетки с красителем инкубировались 20 мин в темноте при 37 °С. Для анализа динамики некроза использовалось два способа детекции: 1) флуоресцентная микроскопия с добавлением йодистого пропидия (1 мкМ), 2) измерение концентрации лактатдегидрогеназы (ЛДГ). В случае с флуоресцентной микроскопией клетки также инкубировались с красителем в течение 20 мин в темноте при 37 °С.
Измерение концентрации ионов натрия проводили с использованием красителя ION NATRUIM Green AM по схеме, описанной выше.
Далее проводилась съемка с использованием оптической системы Nikon Ti S (Nikon, Япония) на соответствующих фильтрах. Затем данные обрабатывались в программе ImageJ, и результат представлялся в виде относительных флуоресцентных единиц.
Измерение концентрации ЛДГ. Для определения концентрации ЛДГ использовали набор LDH Abris+ (Abris, Россия) и спектрофотометр Genesys 10S UV-VIS (Thermo Fisher Scientific, США). После эксперимента забирали среду, в которой культивировались клетки, клетки смывали и подсчитывали концентрацию. Затем определяли скорректированную абсорбцию – разницу значений абсорбции испытуемого и контрольного образцов (∆E/мин) в течение 3 мин на длине волны 340 нм с длиной оптического пути 1 см. Далее в соответствии с рекомендованной формулой рассчитывали концентрацию ЛДГ. Дополнительно оценивали концентрацию ЛДГ в чистой среде и в нормальных условиях роста культуры для определения тотальной ЛДГ. Процент цитотоксичности определяли по формуле
% цитотоксичности = (Экспериментальная ЛДГ)/(Тотальная ЛДГ), где экспериментальная ЛДГ – концентрация ЛДГ в среде после эксперимента с вычетом ЛДГ в чистой среде, тотальная ЛДГ – концентрация ЛДГ в нормальных условия с учетом пересчета на концентрацию клеток и с вычетом ЛДГ в чистой среде [20].
Статистическая обработка данных. Каждый эксперимент проводили в трех повторах. Статистическую обработку проводили с использованием критерия Стьюдента для параметров флуоресцентной микроскопии. Для концентрации ЛДГ использовали тест Манна – Уитни. Данные считались достоверными при p<0,05.
Результаты. В результате моделирования ишемически-реперфузионного повреждения кардиомиоцитов при последовательном инкубировании в сменяющихся условиях без или с токсином были получены данные, представленные на рис. 1–3. Так, уровень апоптоза при детекции флуоресцентной микроскопией значительно повышался при развитии повреждения – примерно в 4 раза (рис. 1).
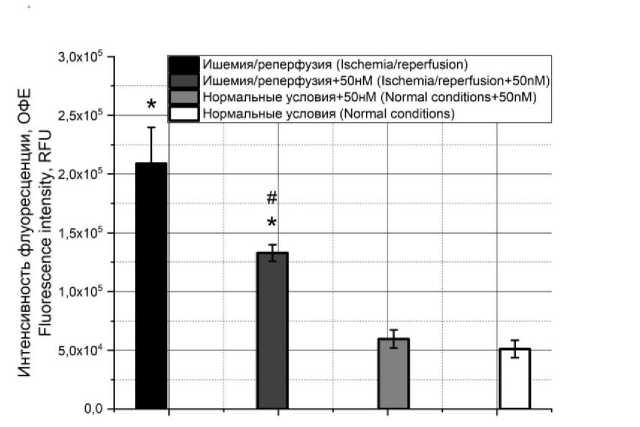
Рис. 1. Динамика апоптоза при моделировании ишемически-реперфузионного повреждения в культуре H9C2 в отсутствие токсина и при его добавлении в концентрации 50 нМ, а также влияние токсина на клеточную гибель в культуре при отсутствии повреждения (здесь и далее: * – достоверное отличие от группы с нормальными условиями, p<0,05, # – достоверное отличие от группы «ишемия/реперфузия», p<0,05)
-
Fig. 1. Dynamics of apoptosis in modeling ischemia-reperfusion injury in H9C2 culture with toxin (concentration 50 nM) and without it, and toxin effect on cell death in the culture in the absence of injury (hereinafter: * – the differences are significant compared with the norm, p<0.05;
-
# – the differences are significant compared with the ischemia/reperfusion group, p<0.05)
При добавлении токсина в концентрации 50 нМ уровень апоптоза снижался почти в два раза, однако все равно оставался повышен- ным. При этом в одиночной инкубации клеточной культуры с токсином апоптоз развивался.
При детекции развития некроза в культуре методом флуоресцентной микроскопии видно, что некроз при моделировании ИРП развивался (рис. 2). Однако добавление токсина при детекции таким методом не оказывало влияния на данный параметр.
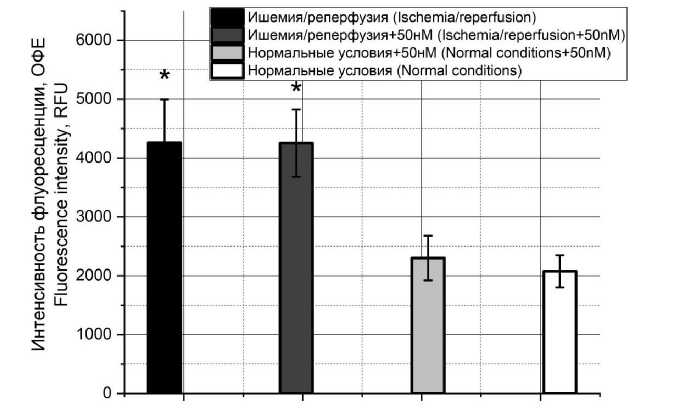
Рис. 2. Динамика некроза при моделировании ишемически-реперфузионного повреждения в культуре H9C2 в отсутствие токсина и при его добавлении в концентрации 50 нМ, а также влияние токсина на клеточную гибель в культуре при отсутствии повреждения
Fig. 2. Dynamics of necrosis in modeling ischemia-reperfusion injury in H9C2 culture with toxin (concentration 50 nM) and without it, and toxin effect on cell death in the culture in the absence of injury
С другой стороны, в экспериментальных условиях зафиксирован рост концентрации лактатдегидрогеназы, что указывает на повреждение клеток в следствие развития в т.ч. и некроза (рис. 3).
Однако добавление токсина вело к снижению уровня ЛДГ. Кроме того, непосредственно сам токсин в той же концентрации не вызывает повышение уровня лактатдегидрогеназы, что подтверждают оба метода.
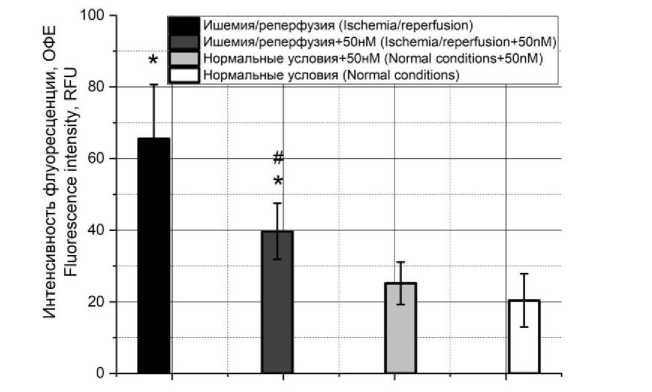
Рис. 3. Концентрация лактатдегидрогеназы при моделировании ишемически-реперфузионного повреждения в культуре H9C2 в отсутствие токсина и при его добавлении в концентрации 50 нМ, а также влияние токсина на концентрацию в культуре при отсутствии повреждения
Fig. 3. Lactate dehydrogenase concentration in modeling ischemia-reperfusion injury in H9C2 culture with toxin (concentration 50 nM) and without it, and toxin effect on cell death in the culture in the absence of injury
Ализ изменения концентрации ионов натрия при моделировании ишемически-репер-фузионного повреждения и при добавлении ток- сина показывает, что содержание ионов натрия повышалось при ИРП (рис. 4).
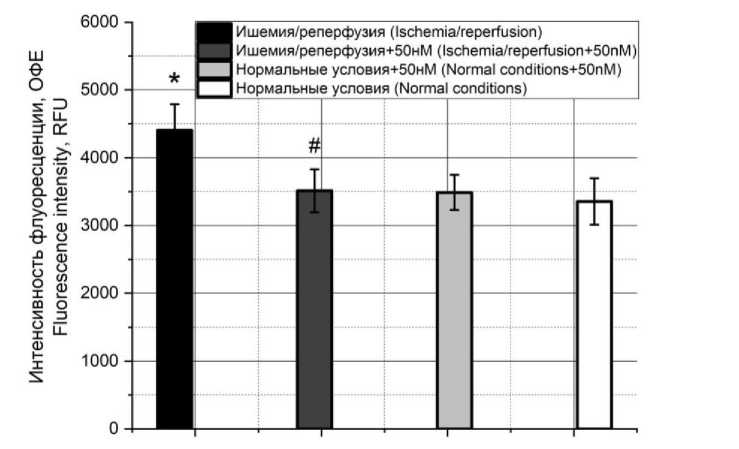
Рис. 4. Концентрация ионов натрия при моделировании ишемически-реперфузионного повреждения в культуре H9C2 в отсутствие токсина и при его добавлении в концентрации 50 нМ, а также влияние токсина на концентрацию в культуре при отсутствии повреждения
Fig. 4. Sodium ion concentration in modeling ischemia-reperfusion injury in H9C2 culture with toxin (concentration 50 nM) and without it, and toxin effect on cell death in the culture in the absence of injury
Добавление токсина вело к нормализации концентрации ионов до уровня нормальных условий. Также токсин не изменяет динамику содержания ионов натрия при отсутствии повреждения.
Обсуждение. Ишемия и последующая реперфузия вызывают функциональные и метаболические нарушения кардиомиоцитов. Ряд исследовательских работ доказывает гипотезу о ключевой роли ионов натрия в развитии повреждения. Так, пропилпарабен, противомик-робный консервант, способен значительно ингибировать потенциалзависимые натриевые каналы в изолированных кардиомиоцитах взрослых крыс, в результате чего предотвращается развитие ИРП [21]. Ингибитор сердечных потенциалзависимых натриевых каналов 3,4-дигидро-N-[(2S)-3-[(2-метоксифенил)тио]-2-метилпропил]-2H-(3R)-1,5-бензоксатиепин-3-амин продемонстрировал мощный анти-ишемический эффект в моделях in vitro и in vivo [22].
В нашей работе мы предлагаем использовать пептидный токсин, который способен модулировать проводимость потенциалзависимых натриевых каналов типа Nav1.5, – мю-агатоксин-Aa1a. Природные пептидные токсины, избирательно связывающиеся с натриевыми ионными каналами, применялись уже не раз. Например, тетродотоксин, блокатор натриевых каналов, вызывал значительное увеличение количества жизнеспособных клеток в модели изолированных кардиомиоцитов крысы [23, 24].
При использовании мю-агатоксина-Aa1a за счет изменения конформации канала снижается его чувствительность к мембранному потенциалу, благодаря чему канал остается открытым, что отражается на выживаемости клеток при развитии ишемически-реперфузи-онного повреждения.
В ходе работы были подобраны оптимальные условия для развития клеточной гибели при моделировании ИРП (18 ч глюкозной и кислородной депривации и 2 ч реперфузии в полной питательной среде) в культуре клеток, которые проявляли признаки дифференцировки. Так, после моделирования ИРП в культуре H9C2 происходит развитие как апоптоза, так и некроза, о чем свидетельствует увеличение сигнала флуоресценции (рис. 1) концентрации ЛДГ (рис. 3). Добавление токсина на стадии реперфузии значительно повышает выживаемость клеток: уровень апоптоза и концентрация ЛДГ в данном случаем значительно ниже, чем при ишемии/реперфузии. При этом токсин в одиночной инкубации при отсутствии повреждения не оказывает влияния на жизнеспособность клеток.
ИРП сопровождается изменением внутриклеточной концентрации ионов Ca2+, Na+ и K+. Так, на стадии ишемии происходит увеличение концентрации ионов Na+ в результате активации NHE и притока через натриевые каналы мембраны. На стадии реперфузии активность натрий-протонного насоса растет за счет вымывания кислой внеклеточной жидкости и восстановления градиента протонов. Повышенная активность насоса приводит к вторичному повышению концентрации Na+.
Чтобы вернуться к доишемической концентрации Na+ происходит отток ионов Na+ через Na+/Ca2+-насос за счет притока внутрь клетки ионов Ca2+. Концентрация Ca2+ увеличивается, в результате чего активируется каскад реакций, ведущий к клеточной гибели. С другой стороны, повышенные концентрации Na+ вызывают приток воды в клетку, в результате чего наблюдается набухание. Органеллы, такие как митохондрии, вакуолиру-ются, что препятствует выработке клеточной энергии и усугубляет дисбаланс жидкости и электролитов внутри клетки. В конечном итоге это может привести к гибели клеток [25, 26]. В нашем случае развитие клеточной гибели сопровождалось повышением концентрации ионов натрия (рис. 4), однако добавление токсина на стадии реперфузии приводило к нормализации их уровня.
Заключение. Таким образом, пептидный токсин мю-агатоксин-Aa1a, нацеленный на натриевые потенциалзависимые каналы и способный менять их проводимость, в концентрации 50 нМ может значимо снижать гибель кардиомиоцитов при моделировании ишеми-чески-реперфузионного повреждения in vitro .
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № FEUF-2022-0008).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Саенко Ю.В., Юрова Е.В.
Литературный поиск, участие в исследовании, обработка материала: Юрова Е.В.,
Расторгуева Е.В. Белобородов Е.А., Сугак Д.Е.
Статистическая обработка данных: Погодина Е.С.
Анализ и интерпретация данных: Юрова Е.В.
Написание и редактирование текста: Юрова Е.В., Саенко Ю.В.


