Перекисное окисление липидов дикорастущих галофитов в условиях Приэльтонья
Автор: Нестеров Виктор Николаевич, Богданова Елена Сергеевна, Табаленкова Галина Николаевна, Розенцвет Ольга Анатольевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 5 т.16, 2014 года.
Бесплатный доступ
Изучали интенсивность процессов перекисного окисления липидов (ПОЛ) - как одного из универсальных механизмов регуляции внутриклеточного метаболизма, у дикорастущих галофитов с разной стратегией соленакопления. Установлено, что для крино- и гликогалофитов процессы ПОЛ играют более существенную роль в сравнении с эугалофитами, исходя из большего количества конечных продуктов окисления (МДА). Однако у этих же типов растений выявлена и большая активность антиокислительной защиты.
Галофиты, перекисное окисление липидов, мембраны
Короткий адрес: https://sciup.org/148203314
IDR: 148203314 | УДК: 581.1
Текст научной статьи Перекисное окисление липидов дикорастущих галофитов в условиях Приэльтонья
По имеющимся оценкам одной из общих тенденций изменения биосферы является аридизация климата и расширение площади пустынных территорий, сопровождаемых, в том числе, усилением засоления почвы [7]. В этой связи засоление почв является экономической и экологической проблемой многих стран мира [17]. Засоленные в разной степени почвы и солончаки разного генезиса являются обычными местообитаниями растений галофитов. Поиск потенциально солевыносливых, наиболее продуктивных природных галофитов в различных районах мира с целью их культивирования в природоохранных, хозяйственных, медицинских интересах становится важным направлением в современной экологии, физиологии и биохимии растений [12, 13, 16].
Известно, что галофиты в зависимости от устойчивости к засолению разделяются на три группы: эугалофиты – накапливающие в своих органах соли, криногалофиты – выделяющие избыток соли на поверхность листьев и гликогалофиты – исключающие проникновение солей в надземные органы растений [3]. Некоторые исследователи выделяют еще одну группу галофитов – гиперэугалофиты [17]. Растения в этих группах используют различные механизмы адаптации в одних и тех же условиях произрастания.
Устойчивость растений к почвенному засолению обеспечивается следующими приспособлениями: избирательное накопление или исключение ионов; контроль ионного поглощения корнями и транспорта в листья; компартментализация ионов на уровне клетки и целого растения; синтез совместимых растворенных веществ; изменение пути фотосинтеза; изменение в структуре мем-
бран; индукция антиоксидантных ферментов; индукция гормонов растений [5, 18].
Одним из универсальных механизмов управления внутриклеточным метаболизмом является перекисное окисление липидов (ПОЛ), индуцированное образованием активных форм кислорода [4]. Известно, что в нормальных условиях жизнедеятельности клетки постоянно присутствует определенный уровень ПОЛ, благодаря многоуровневой антиоксидантной системе защиты [14]. Усиление этого процесса ведет к образованию избыточного количества свободных радикалов, что нарушает состояние клеточных мембран и коллоидное состояние протоплазмы [2]. Поэтому при стимуляции процессов ПОЛ в мембранах уменьшается содержание липидов, а также меняются их микровязкость и электростатический заряд. При более глубоком окислении нарушается структура липидного бислоя и появляются дефектные зоны в мембранах клеток, что нарушает не только барьерную функцию мембран, но и функциональную активность мембранносвязанных белков.
Малоновый диальдегид (МДА) является одним из конечных продуктов окисления липидов [15], а его содержание – интегральной характеристикой соотношения процессов анаболизма и катаболизма биополимеров [10]. Изменения, вызванные продуктами ПОЛ, могут рассматриваться как основа для последующих восстановительных процессов [11].
В клетках растений окислительным превращениям подвергаются полиненасыщенные жирные кислоты полярных глико- (ГЛ) и фосфолипидов (ФЛ), стерины, которые являются основными компонентами клеточных мембран, а также нейтральные липиды [2].
Цель работы – оценить интенсивность процессов ПОЛ дикорастущих галофитов, различающихся по стратегии соленакопления солей.
МАТЕРИАЛ И МЕТОДИКА
Район исследования расположен на территории Волгоградской области, характеризуется бли- зостью залегания грунтовых вод, засоленностью почвогрунтов, что обуславливает формирование солончаковости и солонцеватости почв и определенного типа растительности [1].
Растительный материал отбирали в первой половине дня в середине июня 2013 г. на 2 площадках (20 х 20 м), расположенных в устьевых участках рек Большая Смарогда (биотоп 1) (49°07´с.ш., 46°50´в.д.) и Чернавка (биотоп 2) (49°12´с.ш., 44°40´в.д.).
Объектами исследования были выбраны представители эугалофитов – однолетники Salicornia perennans Willd. (Sp), Suaeda linifolia Pall. (Sl), полукустарничек Halocnemum strobilaceum (Pall.) Bieb. (Hs) из семейства Chenopodiaceae , кринога-лофитов – травянистый многолетник Limonium gmelinii (Willd.) O. Kuntze (Lg) из семейства Plumbaginaceae , гликогалофитов – полукустарничек Artemisia santonica L. (As) из семейства Aste-raceae .
Особенности отбора растений, анализа почвы на содержание солей, а так же методы экстракции, идентификации, анализа липидов и белков в растительном материале описаны ранее [8, 9]. Тип засоления почвы определялся по составу анионов в специализированной лаборатории ФГБУ «САС «Самарская»».
Интенсивность ПОЛ в листьях и корнях растений определяли по накоплению в МДА, определяемого по цветной реакции с тиобарбитуровой кислотой [6].
Активность супероксиддисимутазы (СОД) определяли согласно рекомендациям, описанным в работе [14].
В таблицах и рисунках использованы средние арифметические значения из трех независимых биологических проб для каждого биотопа. Статистическую обработку результатов анализов проводили с использованием программ Statistica 6.0 for Windows, Microsoft Excel 2007 и Statgraphics Centurion XVI.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследованные растения в систематическом плане представляют три семейства, в которых реализованы три стратегии эу-, крино- и глико-галотолерантности. В условиях Приэльтонья растения произрастали в двух биотопах, различающихся по эдафическим характеристикам. Особенностью территории является наличие слабощелочных почв с хлоридно-сульфатным типом засоления. Но общее содержание солей в почве прикорневой зоны исследуемых растений в биотопе 1 составило 0,92 мг/мл почвенной вытяжки, для биотопа 2 – 0,49. Однако в биотопе 2 содержание сульфат аниона составляло около 2 ммоль/л, в то время как в биотопе 1 – 0,3 ммоль/л.
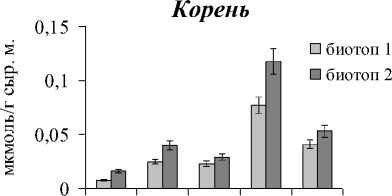
Содержание МДА в листьях варьировало от 0,014 до 0,085, в корнях – от 0,008 до 0,077 мкмоль/г сыр.м.. Причем как в листьях, так и корнях крино- и гликогалофитов уровень процессов ПОЛ был в 2 и более раз выше, чем в эугало-фитах. Кроме того, для крино- и гликогалофитов выявлено достоверно более высокое содержание МДА в растениях, произрастающих в биотопе 2, что может быть связано с более высоким содержанием сульфатов в почве.
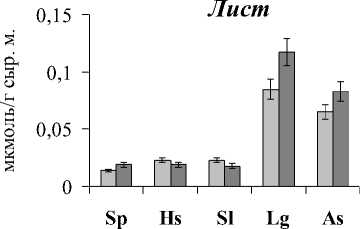
Рис. 1 . Содержание МДА в листьях и корнях дикорастущих галофитов. Обозначения: Sp - Salicornia perennans , Sl - Suaeda linifolia, Hs - Halocnemum strobilaceum, Lg - Limonium gmelinii, As - Artemisia santonica .
Sp Hs Sl Lg As
Поскольку основной вклад в структуру мембран вносят ГЛ и ФЛ, уровень процессов ПОЛ оценивался именно в этих группах липидов. Данные табл. показывают, что максимальное содержание мембранных липидов у растений в обоих биотопах наблюдали у крино- и гликогалофитов. Например, для L. gmelinii и A. santonica произрастающих в устье Б. Сморогды (биотоп 1) содержание ГЛ в листьях составило 7,4 и 7,6 мг/г сыр. м., соответственно, а для S. perennans, H. strobila- ceum и S. linifolia – 2,3, 3,4 и 2,4, соответственно. Для листьев L. gmelinii отмечено также и большее в сравнении с другими видами содержание ФЛ (2,6 мг/г сыр. м.). Аналогичная тенденция обнаружена и в суммарном содержании белков (СБ): в листьях растений биотопа 2 содержание белков было выше, чем в растениях биотопа 1. В подземной части большинства исследуемых видов растений содержалось меньше и липидов и белков. Исключением стали корни L. gmelinii, в которых обнаружено существенно более высокое галофитов содержание липидов и белков в 2-3
содержание СБ. Что касается количественных раза ниже, чем у крино- и гликогалофитов.
показателей в разных группах растений, то у эу-
Таблица. Содержание липидов и белков в листьях и корнях дикорастущих галофитов, мг/г сыр. м
|
Биотоп 1 |
Биотоп 2 |
|||||
|
ГЛ |
ФЛ 1 |
СБ |
ГЛ |
ФЛ 1 |
СБ |
|
|
Лист |
||||||
|
Sp |
2,3 |
0,8 |
4,3 |
2,6 |
1 |
6,4 |
|
Hs |
3,4 |
1,1 |
10,1 |
2,7 |
0,7 |
11,0 |
|
Sl |
2,4 |
1,0 |
8,8 |
1,8 |
0,6 |
10,0 |
|
Lg |
7,4 |
2,6 |
14,6 |
6,5 |
2,3 |
20,5 |
|
As |
7,6 |
1,8 |
109,0 |
6,3 |
1,8 |
121,0 |
|
Корень |
||||||
|
Sp |
0,1 |
0,7 |
2,5 |
0,1 |
1,1 |
4,6 |
|
Hs |
0,1 |
0,8 |
8,7 |
0,1 |
0,9 |
9,3 |
|
Sl |
0,1 |
0,8 |
7,6 |
0,2 |
1,0 |
9,0 |
|
Lg |
0,2 |
0,7 |
200,0 |
0,2 |
0,9 |
197,5 |
|
As |
0,1 |
0,9 |
60,0 |
0,1 |
1,0 |
47,6 |
Примечание: стандартная ошибка составляет не более 10%.
Расчет содержания разных типов мембранных липидов на количество МДА показал идентичную картину для ГЛ (ГЛ/МДА) и ФЛ (ФЛ/МДА), что говорит о том, что эти липиды в равной степени подвержены окислительным процессам. Анализ полученных данных показал, что самое высокое отношение липиды/МДА наблюдалось в листьях и корнях растений эугалофита S. perennans, произрастающих в биотопе 1 (рис. 2), а более низкое – в листьях и корнях криногалофита L. gmelinii и гликогалофита A. santonica в биотопе 2.
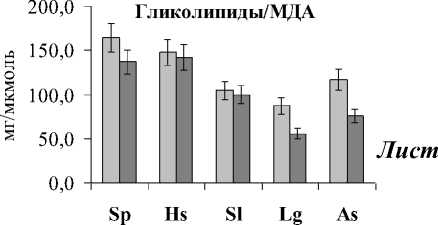
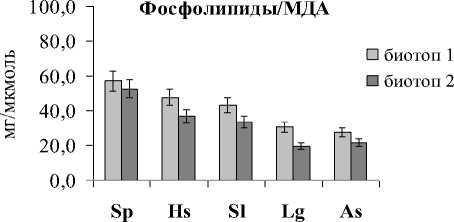
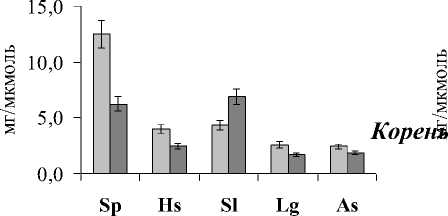
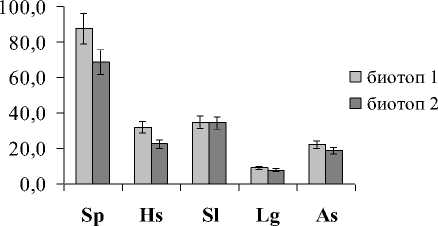
Рис. 2 . Отношение липиды/МДА в листьях и корнях галофитов. Обозначения как на рис. 1.
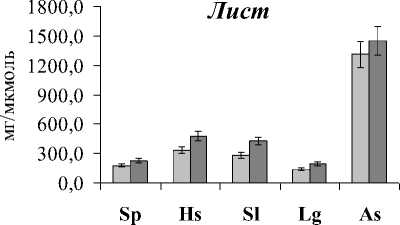
Выявленная закономерность позволяет предположить в сочетании с данными по уровню МДА, что клеточные мембраны эугалофитов более стабильны, в меньшей степени подвержены окислительным процессам, чем крино- и гликогалофитов. Анализ отношения ВБ/МДА показал прямо противоположную картину в сравнении с показателем липиды/МДА в листьях и корнях исследуемых растений (рис. 3). Отношение ВБ/МДА в целом было наибольшим у A. santonica и L. gmelinii, а наименьшим – у S. perennans. Об- щеизвестно, что ВБ растений, как правило, состоят из нескольких компонентов с антиокислитель-ной активностью (амилазной, инвертазной, каталазной, пероксидазной, фитазной, дезоксирибо-нуклеазной и цистинредуктазной), т.е. могут защищать клетки, органы и ткани от свободных радикалов и продуктов ПОЛ. Как видно в исследованных видах растений при большей деградации липидов происходит более активный синтез ВБ в листьях и корнях. Это означает, что у кри-но- и гликогалофитов более эффективна система антиоксидантной защиты. Причем у растений биотопа 2 степень окисления ГЛ и ФЛ была выше, чем биотопа 1, поэтому в листьях растений, произрастающих в переделах биотопа 2, отношение ВБ/МДА было выше для всех исследуемых видов.
3000,0 2500,0 2000,0
1500,0
1000,0
500,0 0,0
Корень
Sp Hs Sl Lg As
Рис. 3 . Отношение Водорастворимые белки/МДА в листьях и корнях галофитов.
Обозначения как на рис. 1
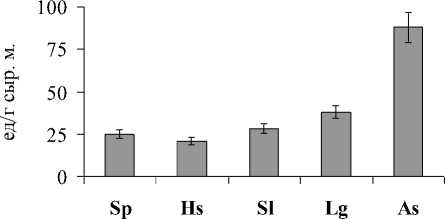
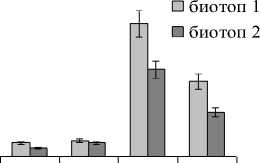
Рис. 4 . Активность СОД в листьях дикорастущих галофитов. Обозначения как на рис. 1.
Данные об активности одного из антиокисли-тельных ферментов супероксиддисмутазы (СОД) показывают, что увеличение активности СОД коррелировало с увеличением содержания МДА (рис. 4). Это подтверждает компенсаторную роль водорастворимых белков в ответ на активацию процессов ПОЛ, характерную для крино- и гликогалофитов.
Таким образом, исследованные дикорастущие виды галофитов, произрастающие в условиях Приэльтонья, различаются не только по своему систематическому положению, стратегии солена-копления, но и содержанию мембранных липидов, мембранносвязанных и цитозольных белков, а также уровню процессов ПОЛ. Для солевыде-лющих и ограничивающих поступление солей в надземную часть галофитов процессы ПОЛ играют более существенную роль, исходя из большего количества конечных продуктов окисления (МДА). Однако у этих же типов растений выявлена и большая активность антиокислительной защиты.
Работа выполнена при поддержке гранта РФФИ № 12-04-01110-а. Авторы выражают признательность к.б.н. Лысенко Т.М. за определение видов галофитов.
Список литературы Перекисное окисление липидов дикорастущих галофитов в условиях Приэльтонья
- Атлас почв СССР/под ред. И.С. Кауричева, И.Д. Громыко. М.: Колос, 1974. 168 с.
- Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах.М.: Наука, 1972. 252 с.
- Генкель П.А. Физиология жаро-и засухоустойчивости растений. М.: Наука, 1982. 280 с.
- Гонтарь О.Б., Жиров В.К., Хаитбаев А.Х., Говорова А.Ф. Возрастные аспекты адаптации растений в экстремальных условиях//Вестник МГТУ. 2006. Т. 9. № 5. С. 729-734.
- Креславский В.Д., Карпентиер Р., Климов В.В., Мурата Н., Аллахвердиев С.И. Молекулярные механизмы устойчивости фотосинтетического аппарата к стрессу//Биологические мембраны. 2007. Т. 24. № 3. С. 195-217.
- Лукаткин А.С., Голованова В.С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений//Физиология растений. 1988. Т. 35. Вып. 4. С. 773-780.
- Пьянков В.И., Мокроносов А.Т. Основные тенденции изменения растительности земли в связи с глобальным потеплением климата//Физиология растений. 1993. Т. 40. № 4. С 515-531.
- Розенцвет О.А., Нестеров В.Н., Богданова Е.С., Лысенко Т.М. Липиды Suaeda Salsa (L.) Pall.: содержание, динамика, вариабельность в естественных условиях произрастания вида//Изв. Самар. НЦ РАН. 2013. Т. 15. № 3. С. 145-150.
- Розенцвет О.А., Нестеров В.Н., Богданова Е.С. Состав мембран дикорастущих галофитов с различными механизмами регуляции солевого обмена в зависимости от абиотических факторов среды//Биологические мембраны. 2014. Т. 31. № 2. С. 137-146.
- Тарчевский И.А. Метаболизм растений при стрессе (избранные труды). Казань: Фэн, 2001. 448 с.
- Хочачка П., Сомеро Д. Биохимическая адаптация. М.: Мир, 1988. 568 с.
- Шамсутдинов З.Ш., Савченко И.В., Шамсутдинов Н.З. Галофиты России, их экологическая оценка и использование. М.: ООО Эдель-М, 2001. 399 с.
- Ahmad P., Prasad M.N.V. Environmental Adaptations and Stress Tolerance of Plants in the Era of Climate Change. Springer Science+Business Media, New York, 2012. 515 p.
- Frankel E.N. Lipid oxidation. The oily press ltd, Glasgow, 1998. pp. 79-99.
- Labudda M. Lipid peroxidation as a biochemical marker for oxidative stress during drought. An effective tool for plant breeding//E-wydawnictwo, Poland. 2013. Http://www.e-wydawnictwo.eu/Document/Document Preview/3342. P.1-12.
- Lambers H. Dry land salinity: A key environmental issue in southern Australia//Plant Soil. 2003. V. 257. P. 5-7.
- Mamedov E.Y., Esenov P.E., Durikov M.K., Zverev N.E., Tsukanova S.K. Experience of Halophyte cultivation on saline soils. Ashgabat, 2009. 44 p.
- Parida A.K., Das A.B. Salt tolerance and salinity effects on plants: a review//Ecotoxicol. Environ. Saf. 2005. V. 60. P. 324-349.


