Перекисное окисление липидов в тканях растений кукурузы и ржи при действии ионов цинка
Автор: Степанов М.Е., Белодурин Д.В., Панькина Т.А., Лукаткин А.С.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Ботаника и физиология растений
Статья в выпуске: 1, 2009 года.
Бесплатный доступ
В побегах и корнях 7-дневных растений кукурузы и ржи определяли интенсив- ность перекисного окисления липидов (ПОЛ) под действием цинка. Выявлено, что для побегов растений есть прямая зависимость интенсивности процессов ПОЛ от концентрации металла, на которой выращивалось растение. Для проростков кукуру- зы концентрация 10 ммоль / л оказалась летальной и растения не выросли. В кор- нях изменения ПОЛ более значительны, чем в листьях. Возможно, корни реагируют интенсивнее из-за того, что цинк более всего аккумулируется в семенах и корнях.
Короткий адрес: https://sciup.org/14719209
IDR: 14719209
Текст научной статьи Перекисное окисление липидов в тканях растений кукурузы и ржи при действии ионов цинка
В побегах и корнях 7-дневных растений кукурузы и ржи определяли интенсивность перекисного окисления липидов (ПОЛ) под действием цинка. Выявлено, что для побегов растений есть прямая зависимость интенсивности процессов ПОЛ от концентрации металла, на которой выращивалось растение. Для проростков кукурузы концентрация 10 ммоль / л оказалась летальной и растения не выросли. В корнях изменения ПОЛ более значительны, чем в листьях. Возможно, корни реагируют интенсивнее из-за того, что цинк более всего аккумулируется в семенах и корнях.
Растительные организмы в природных условиях часто подвергаются воздействию неблагоприятных факторов окружающей среды. Способность растений сопротивляться экстремальным условиям произрастания, приспосабливаться к ним и сохранять при этом жизненный потенциал является одним из определяющих условий существования растений и зависит от возможности реализовать защитно-приспособительные механизмы, т. е. адаптироваться к разнообразным стрессовым воздействиям [5].
Ряд авторов отводят активации процессов перекисного окисления липидов (ПОЛ) роль основного фактора в развитии стресса Г1, ^1 о ____-_________—_
Ц, AJ. и VDJl^n и ЛИМ ра^имаг ри н аллея ipn ни- следовательные фазы стресс-реакции у растений, соответствующие классическим. Во время первой фазы (фаза тревоги) происходит резкая активация лилопероксидации, На второй стадии реакции стабилизируется про- и антиокислитель и ос равновесие на уровне, близком к исходному. Ее можно охарактеризовать как стадию резистентности, в ходе которой снижается интенсивность ПОЛ за счет увеличения антиоксидантных ресурсов. Для третьей фазы реакции типична вторичная индукция ПОЛ и соответствующее снижение суммарной антиоксидантной активности. Эту стадию стресса можно рассматривать как проявление определенного истощения антиоксидантных ресурсов.
Для моделирования стрессового воздействия тяжелых металлов в лабораторных условиях использовали следующую методику выращивания растений. Семена кукурузы (Zea mays L.) камерад и ржи (Secale cereale L.) эстафета Татарстана выращивали 7 суток в факторостатных условиях (температура 21 °C, фотопериод 12 ч, освещенность 4 000 лк) в растильнях, куда наливали по 100 мл водного раствора сульфата цинка различной концентрации: 10, 1 ммоль / л, 100, 10 мкмоль / л (в контроле — дистиллированная вода).
В побегах и корнях 7-дневных растений определяли интенсивность перекисного окисления. Для оценки интенсивности процессов ПОЛ определяли накопление малонового диальдегида (МДА), так как он является одним из конечных продуктов при окислении. Содержание МДА определяли по методу [4J, в основе которого лежит цветная реакция МДА с 2-тиобарбитуровой кислотой при кислом pH и повышенной температуре. При этом образуется стойкий триметиновый комплекс с максимумом поглощения 532 нм. Оптическую плотность определяли на спектрофотометре СФ-46 с последующим пересчетом в концентрацию по велеичине молярной экстинкции (е = 1,56 х 103 см 1 моль '), Количество образовавшегося МДА рассчитывали в мкмоль на 1 г сырой массы.
Было обнаружено, что для побегов ржи есть прямая зависимость интенсивности процессов ПОЛ от концентрации металла, на ко торой выращивалось растение (рис. 1). Наибольшее содержание МДА наблюдалось в варианте с самой высокой концентрацией ионов цинка и снижалось по мере разбавления раствора соли цинка. При этом содержание МДА в опытах с миллимолярными концентрациями оказалось выше, чем в контрольном варианте. В микромолярных концентрациях уровень МДА проявлял тенденцию к снижению относительно контроля (разница с контролем недостоверна). Максимальное превышение значений контроля составило 32 % (в случае концентрации ZnSO4 10 ммоль / л). Сходная картина наблюдалась и в корнях, т. е. с ростом концентрации цинка в среде возрастала интенсивность ПОЛ (данные не показаны). Разница лишь в том, что содержание МДА в корнях во всех вариантах выше или на уровне контрольных растений.
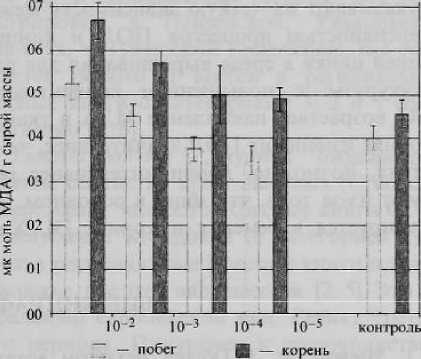
Интенсивность перекисного окисления липидов в побегах ржи в зависимости от концентрации ZnSO4
Рисунок 1
Для проростков кукурузы концентрация 10 ммоль / л оказалась летальной. Как и в опытах с рожью, перекисные процессы в тканях кукурузы активизировались по мере увеличения концентрации металла в среде выращивания (рис. 2). Кукуруза более восприимчива к росту концентрации цинка, так как содержание МДА по отношению к контролю оказалось выше. Так, максимальное повышение наблюдалось в варианте с концентрацией I ммоль / л — на 70 % в побеге и в два раза — в корнях. При наибольшем разведении сульфата цинка ПОЛ в побегах вырос на 20 %, а в корнях увеличение составило около 40 %.
Серия «Биологические науки»
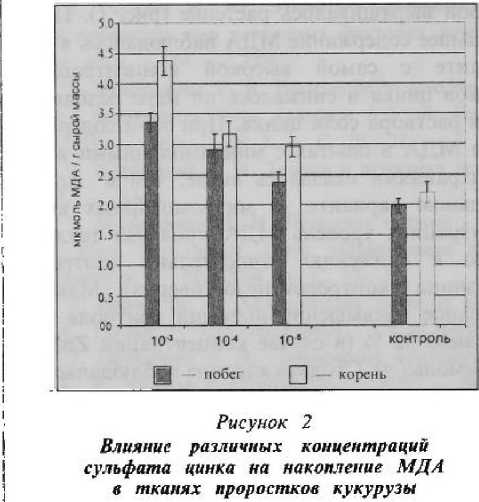
Таким образом, приведенные результаты указывают на четкую зависимость между интенсивностью процессов ПОЛ и концентрацией цинка в среде выращивания для ржи и кукурузы: с повышением концентрации ZnSO4 возрастает накопление МДА в тканях. В корнях изменения ПОЛ значительнее, чем в i листьях. Возможно, корни интенсивнее реагируют из-за того, что цинк в основном аккумулируется в семенах и корнях [3]. Хотя цинк жизненно необходим для нормальной работы большого количества ферментов (известно более 120 ферментных систем, для активации которых необходим цинк), его избыток оказывает разрушающее действие. Избыток цинка нарушает поглощение железа и его обмен, снижает интенсивность фотосинтеза (из-за нарушения электрон-транспорт-ных реакций в тилакоидных мембранах) и дыхания [3], угнетает рост, уменьшает содержание хлорофилла, индуцирует изменения в структуре хлоропластов, главным образом, уменьшение тилакоидов в гранах, снижает активность фотосистемы II [6]. Нарушения злектрон-транспортых систем, особенно в митохондриях, приводит к инактивации сукцинатдегидро геназы и ферментов, содержащих железо-серные кластеры, и супероксид-анион не утилизируется в достаточной ступени, что может приводить к нарушению функции цикла трикарбоновых кислот и работы митохондриальной дыхательной цепи [7].
Таким образом, несмотря на важность цинка для жизни растений, избыток металла приводит к значительному усилению процессов перекисного окисления липидов в тканях ржи и кукурузы, следовательно, и к изменению общего метаболизма, что негативно сказывается на функционировании клеток, тканей и организма в целом.
Список литературы Перекисное окисление липидов в тканях растений кукурузы и ржи при действии ионов цинка
- Меерсон Ф. З. Общий механизм адаптации и роль в нем стресс-реакции, основные стадии процесса/Ф. З. Меерсон//Физиология адаптационного процесса. -М.: Наука, 1986. -С. 77-123.
- Перекисное окисление и стресс/В. А. Барабой, И. И. Брехман, В. Г. Голотин, Ю. Б. Кудря-шов; [отв. ред. В. И. Чумаков]. -СПб.: Наука, С.-Петербург. отд-ние, 1992. -148 с.
- Полевой В. В. Физиология растений/В. В. Полевой. -М.: Высш. школа, 1989. -464 с.
- Стальная И. Д. Метод определения малонового диальдегида с помощью тиабарбитуровой кислоты/И. Д. Стальная, Т. Г. Гаришвили//Современные методы в биохимии/под ред. акад. АМН СССР В. Н. Ореховича. -М.: Медицина, 1977. -С. 66-68.
- Шакирова Ф. М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция/Ф. М. Шакирова/Уфа: Гилем, 2001. -160 с.
- Doncheva S. The influence of succinate on zinc toxicity of pea plants/S. Doncheva, Z. Stoyanova, V. Velikova//J. Plant Nutr. -2001. -V. 24, № 6. -Р. 789-806.
- Raha S. Mitochondria, oxygen free radicals, disease and aging/S. Raha, B. H. Robinson//Trends Biochem. Sci. -2000. -V. 25. -P. 502-508.


