Перфузия миокарда у пациентов с сахарным диабетом по данным стресс-МРТ сердца с аденозинтрифосфатом
Автор: Пивоварова А. И., Соболева Г. Н., Стукалова О. В., Терновой С. К.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Цель. Оценить особенности перфузии миокарда по данным стресс-МРТ сердца с аденозинтрифосфатом (АТФ) у пациентов с сахарным диабетом (СД) 2 типа и различной степенью поражения коронарных артерий. Материал и методы. Исследование стресс-МРТ сердца с АТФ проводилось 55 пациентам с вероятным или уже установленным диагнозом ишемической болезни сердца (ИБС), из которых 39 имели сопутствующий СД 2 типа. Всем пациентам была выполнена оценка коронарной анатомии для определения степени поражения коронарных артерий (КА) с помощью инвазивной коронарографии или МСКТ ангиографии КА. Протокол исследования включал проведение перфузии миокарда в покое и на фоне фармакологической нагрузки АТФ из расчета 160 мкг/кг/мин с продолжительностью инфузии 3-6 минут.Результаты. Обнаружение стресс-индуцированных дефектов перфузии было статистически значимо ассоциировано с наличием атеросклеротического поражения КА более 50% (p
Стресс-мрт сердца, перфузия миокарда, сахарный диабет, ишемическая болезнь сердца, аденозинтрифосфат
Короткий адрес: https://sciup.org/143182502
IDR: 143182502 | УДК: 612.172.1-06:616.633.455.623 | DOI: 10.38109/2225-1685-2024-1-86-91
Текст научной статьи Перфузия миокарда у пациентов с сахарным диабетом по данным стресс-МРТ сердца с аденозинтрифосфатом
Конфликт интересов. Автор статьи Терновой С.К. является членом редакционной коллегии журнала «Евразийский Кардиологический Журнал», но не имеет никакого отношения к решению опубликовать эту статью. Статья прошла принятую в журнале процедуру рецензирования. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов или личных отношений, связанных с публикацией настоящей статьи. Об иных конфликтах интересов авторы не заявляли.
Вклад авторов.
Концепция статьи, дизайн исследования – Соболева Г.Н., Стукалова О.В., Пивоварова А.И.
Проведение исследования и обработка материала – Стукалова О.В., Пивоварова А.И., Соболева Г.Н.
Статистический анализ – Пивоварова А.И.
Написание текста – Пивоварова А.И.
Редактирование – Соболева Г.Н., Стукалова О.В.
Утверждение окончательного варианта статьи – Соболева Г.Н., Стукалова О.В., Терновой С.К.
Все авторы соответствуют критериям авторства ICMJE, принимали участие в подготовке статьи, наборе материала и его обработке.
Финансирование статьи. Не осуществлялось
Информация и соблюдение этических норм. Исследование было одобрено комитетом по этике ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России. Все участники исследования предоставили информированное согласие на проведение стресс-МРТ сердца с АТФ.
И HL.BARBASHOVA@GMAIL.COM
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
УДК 612.172.1-06:616.633.455.623
ORIGINAL ARTICLE
Я Check for updates
*Alena I. Pivovarova1, Galina N. Soboleva1, Olga V. Stukalova1, Sergey K. Ternovoy1,2
MYOCARDIAL PERFUSION IN PATIENTS WITH DIABETES MELLITUSACCORDING TO STRESS CMR WITH ADENOSINE TRIPHOSPHATE
1E.I. Chazov National Medical Research Centre of Cardiology, st. Academician Chazova, 15 a, Moscow, 121552, Russian Federation;
2I.M. Sechenov First Moscow State Medical University (Sechenov University), Bldg. 8/2, Trubetskaya St., Moscow 119991, Russian Federation
Aim . To evaluate the features of myocardial perfusion according to stress CMR with adenosine triphosphate (ATP) in patients with type 2 diabetes mellitus (DM) and obstructive and non-obstructive coronary arteries (CA).
Materials and Methods . Stress СMR with ATP was provided in 55 patients with a suspected or known ischemic heart disease. 39 patients of them had DM type 2. All patients were provided with invasive coronary angiography or non-invasive CT angiogram to evaluate lesions of CA. Study protocol included providing myocardial perfusion in a rest and stress with ATP in dose 160 mkg/ kg/min during 3-6 min.
Results . The detection of stress-induced perfusion defects was statistically significantly associated with the obstructive CA lesions of more than 50%
(p<0,001). With non-obstructive CA lesions less than 50%, perfusion defects were found more often in patients with DM (36.4%) than in patients without DM (16.7%). Furthermore, the detection of stress-induced myocardial ischemia of patients with DM was not statistically significantly associated with obstructive CA (p=0,071) In case of positive result of stress CMR, patients with DM had a more widespread zone of stress-induced ischemia in the form of increase involved segments (6,45±3,78 (4,78-8,13) than patients without DM (3,17±1,60 (1,49-4,85), p=0,050).
Conclusion . Patients with DM and non-obstructive CA are more likely to have a myocardial perfusion disorder than patients without DM due to coronary microvascular dysfunction.
Conflict of interest: The author of the article Sergey K. Ternovoy is member of the associate editors of Eurasian heart journal, but he has nothing to do with the decision to publish this article. The article passed the peer review procedure adopted in the journal. The authors declare no apparent and potential conflicts of interest or personal relationships related to the publication of this article. The authors did not declare any other conflicts of interest.
Funding for the article . None
Authors contributions.
Concept of the article, study design – Galina N. Soboleva, Olga V. Stukalova, Alena I. Pivovarova
Providing the research and processing of material – Olga V. Stukalova, Alena I. Pivovarova, Galina N. Soboleva
Statistical processing – Alena I. Pivovarova
Text development – Alena I. Pivovarova
Editing – Galina N. Soboleva, Olga V. Stukalova
Approval of the final version of the article – Galina N. Soboleva, Olga V. Stukalova, Sergey K. Ternovoy
All authors meet the ICMJE criteria for authorship, participated in the preparation of the article, the collection of material and its processing.
Information about ethics. The study was performed in accordance with the standards of good clinical practice and the principles of the Helsinki Declaration. The study was approved by the ethics committee of the E.I. Chazov National Medical Research Centre of Cardiology. All study participants provided informed consent for stress СMR with ATP.
И HL.BARBASHOVA@GMAIL.COM
Received: 18.01.2023 | Revision Received: 04.02.2024 | Accepted: 09.02.2024
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной заболеваемости и смертности пациентов с сахарным диабетом (СД) 2 типа [1,2]. К числу таких заболеваний относится ишемическая болезнь сердца (ИБС), которая наиболее часто развивается вследствие атеросклеротического поражения коронарных артерий (КА). Однако в настоящее время существенное внимание уделяется изучению и диагностике ИБС на фоне необструктивного поражения коронарных артерий (стенозы менее 50%) вследствие коронарной микрососуди-стой дисфункции (КМД) [3].
У пациентов с СД 2 типа течение ИБС имеет особенности, которые затрудняют своевременную диагностику и лечение пациентов. Вследствие сопутствующей диабетической нейропатии ИБС часто протекает бессимптомно или имеет атипичную клиническую картину. Поражение КА часто характеризуется многососудистым, диффузным поражением с вовлечением дистальных отделов коронарного русла и выраженным кальцинозом КА [4].
Однако до развития необратимого структурного поражения КА для пациентов с СД характерна высокая распространенность (КМД) [5]. Разработка и усовершенствование новых методов визуализации является актуальным в диагностике ранних функциональных и структурных изменений сосудов микроциркуляции миокарда в развитии ИБС.
Стресс-МРТ сердца – метод с высоким пространственным разрешением, не обладающий ионизирующим излучением, позволяет безопасно и эффективно выявлять стресс-индуцированную ишемию миокарда. Высокое пространственное разрешение МРТ позволяет визуализировать субэндокардиальную ишемию миокарда, возникающую не только вследствие поражения эпикардиальных КА, но и вследствие нарушений микрососудистого коронарного русла. Стресс-МРТ сердца с вазодилататорами, в том числе с аденозином, входит в международные протоколы для диагностики ИБС [6].
Целью нашего исследования являлось выявление особенностей перфузии миокарда с помощью стресс-МРТ сердца с аденозинтрифосфатом (АТФ) у пациентов с СД 2 типа и различной степенью поражения КА.
МАТЕРИАЛ И МЕТОДЫ
Клиническая характеристика
В исследование были включены 55 пациентов с установленным диагнозом ИБС или вероятной ИБС, из которых 39 пациентов имели сопутствующий СД 2 типа. Стресс-МРТ сердца с АТФ проводилось в ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России на магнитно-резонансном томографе Magnetom Aera (Siemens) с напряженностью магнитного поля 1,5 Т за период 2022-2023 гг. Исследование было одобрено комитетом по этике ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России. Все участники исследования предоставили информированное согласие на проведение стресс-МРТ сердца с АТФ.
Большая часть включенных пациентов имела промежуточную или низкую предтестовую вероятность ИБС, однако с учётом наличия сопутствующего СД, как фактора риска ИБС, данная группа больных была направлена на исследование для исключения ИБС. Исследование не проводилось при наличии противопоказаний к проведению нагрузочных тестирований, к введению АТФ и проведению МРТ сердца с контрастированием. С учётом зависимости качества изображений от частоты и регулярности сердечного ритма пациентам с нарушениями ритма сердца исследование не выполнялось. Таким образом, критериями невключения являлись: острый коронарный синдром, острое нарушение мозгового кровообращения, острая сердечная недостаточность, наличие острого или хронического бронхообструктивного синдрома, хронической болезни почек со снижением скорости клубочковой фильтрации менее 30 мл/мин/1,73, нарушения ритма (частая экстрасистолия, постоянная или пароксизмальная форма фибрилляции и трепетания предсердий) и проводимости сердца (атриовентрикулярная блокада) и невозможность нахождения в магнитно-резонансном томографе. После выполнения исследования у всех пациентов была выполнена инвазивная коронарография или МСКТ ангиография для оценки атеросклеротического поражения КА и сопоставления степени их поражения с результатами стресс-МРТ сердца.
Протокол исследования
Исследование стресс-МРТ сердца с АТФ проводилось натощак с предварительной отменой антиангинальной терапии за 48 часов до проведения стресс-МРТ сердца, отказа от кофеин-содержащих продуктов и курения за 12 часов до исследования. АТФ вводился из расчета 160 мкг/кг/мин в течение 3-6 минут до наступления гемодинамического ответа в виде прироста ЧСС более 10 уд/мин или появления нежелательных побочных реакций, таких как затруднение дыхания, головная боль, чувство жара, тяжесть в грудной клетке. Протокол исследования включал проведение кино-последовательностей МРТ сердца (SSFP – steady-state free precession), перфузию миокарда в покое и на фоне фармакологической нагрузки АТФ, и отсроченное контрастирование для исключения рубцового поражения миокарда. Методика выполнения стресс-МРТ сердца с АТФ описана раннее [7].
Визуальный анализ
Анализ изображений проводился визуально в соответствии с 16-сегментной моделью миокарда левого желудочка Американского Общества кардиологов на уровне базальных, средних и верхушечных сегментов. За стресс-индуцированный ишемический дефект перфузии принималась зона гипоинтенсивности сигнала при первом прохождении контрастного препарата, которая сохранялась на протяжении не менее 3 последовательных изображений на фоне нагрузки, при отсутствии таковой на изображениях перфузии покоя. Критерием эффективности фармакологической нагрузки, помимо прироста ЧСС во время инфузии АТФ, являлось сохранение гипоинтенсивного сигнала от селезенки на серии изображений стресса.
Статистический анализ
Качественные данные представлены в виде абсолютного значения (n) и процентных долей (%). Количественные данные представлены в виде среднего значения, стандартного отклонения (SD) и 95% доверительного интервала (ДИ) для нормально распределенных выборок, и медианы (Me), нижнего и верхнего квартилей (25-75%; Q1-Q3) – для ненормально распределенных выборок. Нормальность распределения оценивали с помощью критерия Шапиро-Уилка. Сравнение групп по качественным признакам выполнялось методом сравнения процентных долей при анализе четырехпольных таблиц сопряженности с помощью точного критерия Фишера, если число ожидаемых явлений было менее 10. При ожидаемом числе явлений более 10 – с помощью хи-квадрата Пирсона. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента и U-критерия Maнна Уитни. Значение p<0,05 указывало на статически значимую разницу. Статистический анализ выполнен с использованием программ StatTech v. 4.0.5 (разработчик – ООО «Статтех», Россия); Jamovi (версия 2.3.28.0).
РЕЗУЛЬТАТЫ
Клиническая характеристика пациентов представлена в таблице 1.
В таблице 1 указано, что группа пациентов с СД 2 типа статистически значимо чаще имела артериальную гипертонию (94,9%), более высокие показатели глюкозы, триглицеридов в биохимическом анализе крови, а также более низкую скорость клубочковой фильтрации по сравнению с подгруппой пациентов без СД 2 типа. Лекарственная терапия статистически значимо не различалась в обеих группах пациентов, за исключе- нием приёма сахароснижающей терапии в группе пациентов с СД 2 типа. По остальным показателям группы были сопоставимы между собой. У пациентов с СД превалировали жалобы на одышку (64,1%), которая с учётом сопутствующих факторов риска ИБС была расценена как эквивалент стенокардии.
За обструктивное поражение КА принималось наличие стеноза просвета КА более 50%. Пациенты с поражением КА менее 50%, а также с установленным раннее стентом без признаков рестеноза на момент исследования, относились к группе с атеросклеротическим поражением КА менее 50%.
Таблица 1. Клиническая характеристика пациентов [составлено авторами на основе статистических данных] Table 1. Clinical characteristics of patients [compiled by the authors based on statistical data]
|
Показатели |
Пациенты без СД (n=16) |
Пациенты с СД (n=39) |
Уровень значимости p |
|
женский Пол мужской |
9 (56,2%) |
28 (71,8%) |
0,264 |
|
7 (43,8%) |
11 (28,2%) |
||
|
Возраст |
62,00 [59,00; 65,25] |
65,00 [62,00; 68,00] |
0,092 |
|
Артериальная гипертония |
11 (68,8%) |
37 (94,9%) |
0,018 |
|
Курение |
3 (18,8%) |
6 (15,4%) |
0,710 |
|
Отягощенная наследственность по сердечно-сосудистым заболеваниям |
4 (25,0%) |
16 (41,0%) |
0,262 |
|
Ожирение |
7 (43,8%) |
17 (43,6%) |
1,0 |
|
Индекс массы тела |
28,9± 3,86 |
29,9±4,07 |
0,436 |
|
Глюкоза при поступлении |
4,84 [4,76; 5,50] |
6,79 [5,71; 8,3] |
<0,001 |
|
Гликированный гемоглобин |
- |
6,75 [6,20; 7,78] |
- |
|
Общий холестерин |
4,21 [3,89;5,13] |
4,53 [3,5;5,63] |
0,993 |
|
Липопротеиды низкой плотности |
2,32 [1,98;2,75] |
2,06 [1,58;3,42] |
0,583 |
|
Триглицериды |
1,33 [1,14;2,47] |
1,94 [1,65;2,47] |
0,007 |
|
Креатинин |
70,8 [64,4;75,1] |
74,7 [63,3;86,2] |
0,331 |
|
Скорость клубочковой фильтрации |
95 [86,0; 100,0] |
86 [72,5; 96,0] |
0,008 |
|
ПТВ ИБС |
19 [12; 26] |
14 [11; 22] |
0,317 |
|
Типичная стенокардия |
7 (43,8%) |
7 (17,9%) |
0,085 |
|
Атипичная стенокардия |
4 (25,0%) |
12 (31,6%) |
0,629 |
|
Неангинозная боль |
4 (25,0%) |
18 (47,4%) |
0,145 |
|
Одышка |
6 (37,5%) |
25 (64,1%) |
0,083 |
|
Атеросклероз коронарных артерий более 50% |
7 (43,8%) |
18 (47,4%) |
1,000 |
|
Постинфарктный кардиосклероз |
1 (6,2%) |
1 (2,6%) |
0,501 |
|
Чрескожное коронарное вмешательство со стентированием в анамнезе |
4 (25,0%) |
2 (5,1%) |
0,053 |
|
Лекарственная терапия |
|||
|
Бета-блокаторы |
11 (68,8%) |
25 (64,1%) |
0,742 |
|
Блокаторы кальциевых каналов |
6 (37,5%) |
15 (38,5%) |
1,000 |
|
Ингибиторы ангиотензинпревращающего фермента |
4 (25,0%) |
11 (28,2%) |
0,808 |
|
Анатогонисты рецепторов ангиотензина |
5 (31,2%) |
20 (51,3%) |
0,237 |
|
Антиагреганты |
11 (68,8%) |
19 (48,7%) |
0,237 |
|
Статины |
12 (75,0%) |
30 (76,9%) |
1,000 |
|
Эзетемиб |
- |
1 (2,6%) |
- |
|
Бигуаниды |
2 (12,5%) |
28 (71,8%) |
<0,001 |
|
Препараты сульфонилмочевины |
- |
6 (15,4%) |
- |
|
иДПП-4 |
- |
7 (17,9%) |
- |
|
иНГЛТ2 |
- |
4 (10,3%) |
- |
|
Инсулины |
- |
7 (17,9%) |
- |
Примечание/Note: количественные данные представлены в виде медианы (Me) и нижнего и верхнего квартилей [Q1; Q3]; среднего значения (M) и стандартного отклонения (SD). Качественные данные представлены в виде абсолютного числа (n) и процентных долей (%). (Quantitative data are presented as median (Me) and low and up quartiles [Q1; Q3]; average (M) and standard deviation (SD). Qualitative data are presented as absolute number (n) and percentage (%)).
ПТВ ИБС – предтестовая вероятность ишемической болезни сердца (PTP CHD – pre-test probability of coronary heart disease, иДПП-4 – ингибиторы дипептидилпептидазы (DPP-4 inhibitors – dipeptidyl peptidase-4 inhibitors), иНГЛТ2 – ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2 inhibitors – sodium-glucose cotransport protein-2 inhibitors)
У трех пациентов исследование было прекращено досрочно по нежеланию пациентов продолжать исследование (n=2) и из-за развития брадикардии менее 50 уд/мин (n=1). У двух пациентов анализ изображений стресса не проводился в связи с недостаточной фармакологической нагрузкой, которая была оценена по отсутствию характера изменения сигнала от селезенки на полученных изображениях серии стресса. Одно исследование было исключено из анализа из-за его неудовлетворительного качества. Таким образом, визуальному анализу подверглись 49 исследований.
Из данных таблицы 2 следует, что в группе пациентов без СД выявление стресс-индуцированных дефектов перфузии было статистически значимо ассоциировано с обструктивным поражением КА более 50% (83,3%), а их отсутствие – с необструктивным поражением КА или стенозом просвета КА менее 50% (88,9%), p=0,011.
В группе пациентов с СД стресс-индуцированные дефекты перфузии чаще выявлялись на фоне отсутствия обструктивного поражения КА (36,4%), чем в группе пациентов без СД 2 типа (16,7%). У 1 пациента с СД и поражением КА менее 50% имелись жалобы на типичную стенокардию напряжения. У остальной части пациентов (n=7) обнаружение стресс-индуцированной ишемии миокарда сопровождалось атипичной клинической картиной стенокардии. Частота обнаружения дефектов перфузии в группе пациентов с СД не была статически значимо ассоциирована с наличием обструктивного поражения КА более 50% (р=0,071).
Стресс-индуцированные дефекты перфузии при необструктивном поражении КА имели субэндокардиальный циркулярный характер (рис. 1).
При анализе общей группы пациентов частота обнаружения дефектов перфузии миокарда была статистически значимо ассоциирована с наличием обструктивного поражения КА более 50% (p<0,01).
По данным таблицы 3 при положительном результате стресс-МРТ сердца у пациентов с СД отмечалось более рас- пространенное поражение в виде большего количества пораженных сегментов.
ОБСУЖДЕНИЕ
В нашем исследовании продемонстрированы возможности диагностики ишемии миокарда у пациентов с СД на стадии ранних функциональных и структурных изменений КА, обусловленных КМД, с помощью стресс-МРТ сердца с отечественным фармакологическим препаратом – АТФ.
Обнаруженные различия между группами у пациентов с СД 2 типа в виде распространенности артериальной гипертонии и снижении скорости клубочковой фильтрации связаны наличием диабетической микроангиопатии у данных пациентов. Инсулинорезистентность, хроническая гипергликемия и гиперинсулинемия вносят вклад в развитие диабетической эндотелиальной дисфункции и ранних функциональных изменений микрососудистого русла [8]. Увеличение уровня триглицеридов также является следствием свойственного для СД нарушения липидного обмена, которое помимо гипертриглицеридемии характеризуется увеличением концентрации липо-
Таблица 2. Выявление дефектов перфузии миокарда в зависимости от наличия сахарного диабета и коронарного атеросклероза [составлено авторами на основе статистических данных]
Table 2. Detection of perfusion myocardial defects in patients depending on the presence of diabetes and coronary atherosclerosis [compiled by the authors based on statistical data]
|
Наличие визуальных дефектов перфузии (%) (n=28) |
Отсутствие визуальных дефектов перфузии (%) (n=21) |
p |
||
|
Пациенты с СД (n=34) |
Атеросклероз КА более 50% (n=17) |
14 (63,6) |
3 (25,0) |
0,071 |
|
Атеросклероз КА менее 50% (n=17) |
8 (36,4) |
9 (75,0) |
||
|
Пациенты без СД (n=15) |
Атеросклероз КА более 50% (n=6) |
5 (83,3) |
1 (11,1) |
0,011 |
|
Атеросклероз КА менее 50% (n=9) |
1 (16,7) |
8 (88,9) |
||
Примечание/Note: данные представлены в виде абсолютного числа (n) и процентных долей (%). Data are presented as absolute numbers (n) and percentage (%). СД – сахарный диабет (DM – diabetes mellitus), КА – коронарные артерий (CA – сoronary arteries)
Таблица 3. Различие по количеству дефектов у пациентов с СД и без СД [составлено авторами на основе статистических данных]
Table 3. Difference by numbers of defects in patients with diabetes and without diabetes [compiled by the authors based on statistical data]
Количество дефектов p
Пациенты с СД (n=22) 6,45±3,78 (4,78-8,13)
Пациенты без СД (n=6) 3,17±1,60 (1,49-4,85) 0,050
Примечание/Note: количественные данные представлены в виде среднего значения (M), стандартного отклонения (SD) и 95% доверительного интервала. (Quantitative data are presented as median (Me) and low and up quartiles [Q1; Q3]; average (M), standard deviation (SD) and 95% confidence interval. СД – сахарный диабет (D – diabetes)
90 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2024
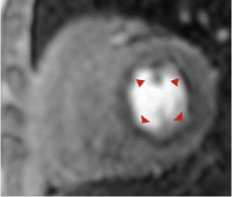
Рисунок 1. Стресс-индуцированный субэндокардиальный циркулярный дефект перфузии миокарда (указан стрелками) у пациентки 62 лет с СД 2 типа на фоне необструктивного поражения коронарных артерий [выполнен авторами]
Figure 1. Stress-induced subendocardial circular myocardial defect (shown by arrows) of patient 62 years old with diabetes mellitus with non-obstructive coronary arteries [performed by the authors]
протеидов низкой плотности (ЛПНП) и снижением концентрации липопротеидов высокой плотности (ЛПВП) [9].
Полученные нами результаты свидетельствуют о превалировании вклада обструктивного коронарного атеросклероза в выявление трансмиокардиальной ишемии миокарда независимо от наличия СД. Однако на фоне необструктивного поражения КА у пациентов с СД намного чаще выявлялись циркулярные субэндокардиальные дефекты перфузии, чем у пациентов без СД, которые, вероятно, свидетельствуют о наличии КМД на фоне СД 2 типа. В исследованиях продемонстрирована высокая распространенность КМД среди пациентов с СД, подтвержденная неинвазивными и инвазивными методами [10-12]. В то же время КМД может являться проявлением отдельной формы ИБС – микрососудистой стенокардии, которая ассоциирована с неблагоприятным прогнозом развития сердечно-сосудистых осложнений [13].
В нашем исследовании в качестве функционального визуализирующего метода оценки перфузии миокарда была выбрана стресс-МРТ сердца фармакологическом агентом АТФ. Преимуществами данного метода служат высокая диагностическая точность и прогностическая ценность, подтвержденная в крупных исследованиях, а также отсутствие лучевой нагрузки [14,15]. Благодаря высокому пространственному разрешению МРТ и визуализации субэндокардиальной зоны миокарда становится возможным выявление нарушений перфузии миокарда на стадии ранних функциональных и структурных изменений КА вследствие КМД.
Группа пациентов с СД 2 типа с положительными результатами стресс-МРТ сердца с АТФ характеризовалась более обширной зоной преходящей ишемии миокарда в виде большего количества пораженных сегментов по сравнению с пациентами без СД 2 типа. Более распространенный характер стресс-индуцированной ишемии миокарда можно объяснить наличием характерного для пациентов с СД диффузного многососудистого поражения КА, а также вкладом КМД в нарушение перфузии миокарда. Однако влияние КМД на становление ишемии миокарда при наличии стенозирующего поражения КА остается малоизученным. В настоящее время поиск оптимального метода оценки микрососудистого сопротивления на фоне коронарного атеросклероза является перспективным направлением для изучения микрососудистой дисфункции на фоне коронарного атеросклероза [16].
-
3.
-
4.
-
5.
-
6.
-
7.
-
8.
-
9.
ЗАКЛЮЧЕНИЕ
По данным стресс-МРТ сердца с АТФ у пациентов с СД и необструктивным поражением коронарных артерий стресс-индуцированная ишемия миокарда выявляется чаще, чем у пациентов без СД и, вероятно, ассоциирована с поражением микрососудистого коронарного русла. Помимо этого, пациенты с СД характеризовались более распространенным стресс-индуцированным поражением миокарда по сравнению с пациентами без СД независимо от степени поражения КА.
Список литературы Перфузия миокарда у пациентов с сахарным диабетом по данным стресс-МРТ сердца с аденозинтрифосфатом
- Чазова И.Е., Шестакова М.В., Жернакова Ю.В., Блинова Н.В., и соавт. Евразийские рекомендации по профилактике и лечению сердечно-сосудистых заболеваний у больных с диабетом и предиабетом (2021). Евразийский Кардиологический Журнал. 2021;(2):6-61. https://doi.org/10.38109/2225-1685-2021-2-6-61
- Marx N., Federici M., Schütt K., Müller-Wieland D. et al., ESC Scientific Document Group, 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes: Developed by the task force on the management of cardiovascular disease in patients with diabetes of the European Society of Cardiology (ESC), European Heart Journal. 2023;(44(39):4043-414. https://doi.org/10.1093/eurheartj/ehad192
- Qi Y., Li L., Feng G., Shao C. et al. Research Progress of Imaging Methods for Detection of Microvascular Angina Pectoris in Diabetic Patients. Front Cardiovasc Med. 2021 Sep 21;8:713971. https://doi.org/10.3389/fcvm.2021.713971
- Montone R.A., Pitocco D., Gurgoglione F.L., Rinaldi R. et al. Microvascular complications identify a specific coronary atherosclerotic phenotype in patients with type 2 diabetes mellitus. Cardiovasc Diabetol. 2022 Oct 15;21(1):211. https://doi.org/10.1186/s12933-022-01637-y
- Kibel A., Selthofer-Relatic K., Drenjancevic I., Bacun T. et al. Coronary microvascular dysfunction in diabetes mellitus. J Int Med Res. 2017 Dec;45(6):1901-1929. https://doi.org/10.1177/0300060516675504
- Le Ven F., Pontana F., Barone-Rochette G., Macron L. Editing committee. Position paper on stress cardiac MRI in chronic coronary syndrome: Endorsed by the Société Française de Radiologie (SFR) the Société Française d'Imagerie CardioVasculaire (SFICV) and the Société Française de Cardiologie (SFC). Diagn Interv Imaging. 2021 Jun;102(6):337-345. https://doi.org/10.1016/j.diii.2021.02.005
- Стукалова О.В., Пивоварова А.И., Соболева Г.Н., Терновой С.К. et al. Перфузионная магнитно-резонансная томография сердца с аденозинтрифосфатом в диагностике ишемии миокарда. REJR 2023; 13(2):63-74. https://doi.org/10.21569/2222-7415-2023-13-2-63-74
- Horton W.B., Barrett E.J. Microvascular Dysfunction in Diabetes Mellitus and Cardiometabolic Disease. Endocr Rev. 2021 Jan 28;42(1):29-55. https://doi.org/10.1210/endrev/bnaa025
- Ormazabal V., Nair S., Elfeky O., Aguayo C. et al. Association between insulin resistance and the development of cardiovascular disease. Cardiovasc Diabetol. 2018 Aug 31;17(1):122. https://doi.org/10.1186/s12933-018-0762-4
- Sara J.D., Taher R., Kolluri N., Vella A. et al. Coronary microvascular dysfunction is associated with poor glycemic control amongst female diabetics with chest pain and non-obstructive coronary artery disease. Cardiovasc Diabetol. 2019 Feb 28;18(1):22. https://doi.org/10.1186/s12933-019-0833-1
- Sørensen M.H., Bojer A.S., Broadbent D.A., Plein S. et al. Cardiac perfusion, structure, and function in type 2 diabetes mellitus with and without diabetic complications. Eur Heart J Cardiovasc Imaging. 2020 Aug 1;21(8):887-895. https://doi.org/10.1093/ehjci/jez266
- Tonet E., Pompei G., Faragasso E., Cossu A. et al. Coronary Microvascular Dysfunction: PET, CMR and CT Assessment. J Clin Med. 2021 Apr 23;10(9):1848. https://doi.org/10.3390/jcm10091848
- Shimokawa H., Suda A., Takahashi J., Berry C. et al. Clinical characteristics and prognosis of patients with microvascular angina: an international and prospective cohort study by the Coronary Vasomotor Disorders International Study (COVADIS) Group. Eur Heart J. 2021 Nov 21;42(44):4592-4600. https://doi.org/10.1093/eurheartj/ehab282
- Danad I., Szymonifka J., Twisk J.W.R., Norgaard B.L. et al. Diagnostic performance of cardiac imaging methods to diagnose ischaemiacausing coronary artery disease when directly compared with fractional flow reserve as a reference standard: a meta-analysis. Eur Heart J. 2017 Apr 1;38(13):991-998. https://doi.org/10.1093/eurheartj/ehw095
- Marcos-Garces V., Gavara J., Monmeneu J.V., Lopez-Lereu M.P. et al. Vasodilator Stress CMR and All-Cause Mortality in Stable Ischemic Heart Disease: A Large Retrospective Registry. JACC Cardiovasc Imaging. 2020 Aug;13(8):1674-1686. https://doi.org/10.1016/j. jcmg.2020.02.027
- Fan Y., Li C., Hu Y., Hu X. et. al. Angiography-based index of microcirculatory resistance (AccuIMR) for the assessment of microvascular dysfunction in acute coronary syndrome and chronic coronary syndrome. Quant Imaging Med Surg. 2023 Jun 1;13(6):3556- 3568. https://doi.org/10.21037/qims-22-961


