Перфузионная компьютерная томография в определении природы очаговой патологии легких: клинический и статистический анализ
Автор: Сергеев Николаи Иванович, Измайлов Тимур Раисович, Котляров Петр Михайлович, Лагкуева Ирина Джабраиловна, Солодкий Владимир Алексеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Введение. Современный уровень развития диагностических технологий позволяет проводить измерения большого количества параметров кровотока патологических процессов с помощью лучевых методов исследования. Одной из таких методик является перфузионная компьютерная томография (ПКТ), отработка протоколов выполнения и анализ полученных данных при различных патологиях легких - актуальная задача торакальной радиологии. Целью исследования явился анализ достоверности показателей КТ-перфузии в определении природы очаговых образований легких данными статистического анализа. Материал и методы. Проанализированы данные ПКТ 60 пациентов с доброкачественными и злокачественными изменениями в легких на 128-срезовом компьютерном томографе. Выводы. Средние показатели PS, TTP являются основными и ведущими факторами определения природы очага в легких. Комплексный анализ данных МСКТ с КТ-перфузией позволяет достоверно высказаться о природе очагов в легких. Даны практические рекомендации при проведении перфузионных КТ-исследований легких.
Статистический анализ, перфузионная компьютерная томография, легкие, очаговое образование
Короткий адрес: https://sciup.org/140254364
IDR: 140254364 | УДК: 616.24-073.756.8 | DOI: 10.21294/1814-4861-2020-19-4-24-32
Текст научной статьи Перфузионная компьютерная томография в определении природы очаговой патологии легких: клинический и статистический анализ
Первичная и дифференциальная диагностика патологии легких является актуальной проблемой современной рентгенологии, ведущим методом которой является мультиспиральная компьютерная томография [1, 2]. С внедрением скрининговых проектов для раннего выявления рака увеличивается и количество так называемых случайных находок в легких, порой ставящих врача-рентгенолога в затруднительное положение ввиду отсутствия патогномоничных признаков [3, 4]. Ответом в подобных ситуациях может служить использование дополнительных методов, позволяющих получать иные качественные или количественные характеристики объектов [5, 6].
С развитием технологий многосрезовой компьютерной томографии появилась методика КТ-перфузии, или перфузионная КТ (ПКТ), позволяющая оценивать распределение и прохождение контрастированной крови в различных тканях организма, в том числе в очаговых образованиях легких. Согласно данным литературы, с помощью ПКТ можно с высокой долей вероятности высказаться о природе очагов в легких размерами свыше 1 см, интерпретированных как неопределенные при стандартной МСКТ [7]. Полученные данные, представленные такими параметрами, как объем и скорость кровотока, проницаемость сосудистой стенки, время максимальной концентрации и др., дают представление об ангиогенезе образования и позволяют предполагать характер выявленных изменений [8, 9]. Однако большое количество измеряемых параметров (стандартный протокол включает 8), разница в гемодинамических показателях как у разных больных, так и у одного пациента при разных исследованиях, сочетание различных патологий имеют зачастую большую вариабельность и неоднозначную трактовку [10]. Полученные результаты исследований требуют комплексной оценки всех данных, достоверность которых должна быть подтверждена современными методами медицинской статистики.
Цель исследования – оценить достоверность показателей КТ-перфузии в определении природы очаговых образований легких данными статистического анализа.
Материал и методы
Перфузионная компьютерная томография (ПКТ) выполнена 60 пациентам с верифицированными доброкачественными и злокачественными изме- нениями в легких по ранее описанной методике [10]. Очаги злокачественной и доброкачественной природы верифицированы по результатам пункционной биопсии, гистологического исследования операционного материала у 44 (73 %) пациентов; лабораторных методов исследования – у 10 (16 %); а также по отсутствию динамики на протяжении длительного времени – у 6 (10 %) больных. Среди них у 16 (27 %) человек были первичные эпителиальные опухоли легкого (мелкоклеточный рак, немелкоклеточный с различными гистологическими подтипами – аденокарцинома, плоскоклеточный, крупноклеточный). У 14 (23 %) больных имело место метастатическое поражение легких различных первичных злокачественных новообразований: рак молочной железы, легкого, почки, толстой кишки, репродуктивной системы, остеогенная саркома. Доброкачественные изменения у 10 (16 %) пациентов были представлены очагами воспалительной этиологии (бактериальной – 90 %, грибковой – 10 %), у 10 (16 %) – гамартомой с разным соотношением в структуре жировой, мышечной, соединительной ткани, у 6 (10 %) – фиброзными изменениями, у 4 (6 %) – туберкулемами.
Исследования выполнялись на 128-срезо-вом компьютерном томографе фирмы «General Electric», модель «Optima CT660». Постпроцессинговая обработка данных исследования проводилась на рабочей станции Advantage Workstation (GE). Данные ранее проведенного компьютернотомографического исследования с внутривенным болюсным усилением этих пациентов были дополнены перфузионной компьютерной томографией. Размеры очагов варьировали от 1 до 4 см. В качестве количественных показателей перфузии, отображаемых разницей насыщения на цветовых картах, нами рассчитывались следующие параметры:
-
- BV, мл/100г – общий объем крови, проходящей через сосуды в выбранной зоне;
-
- BF, мл/100/г/мин – скорость прохождения определенного объема крови через заданный объем ткани за единицу времени;
-
- MTTсек – среднее время прохождения крови через весь объем опухоли;
-
- РS, мл/100/г/мин – проницаемость сосудов;
-
- TTРсек – время достижения пиковой концентрации контрастного вещества.
Статистический анализ был выполнен с помощью специализированного программного таблица 1/table 1
количественные показатели Пкт в очагах с высокими значениями перфузии (средние значения) Quantitative pCt parameters in lesions with high perfusion values (mean values)
Результаты
На основании полученных данных нативной и контрастной компьютерной томографии были определены первичные характеристики очагов – структура и плотность, размеры и наружные контуры, характер контрастирования. Затем были про- анализированы цветовые карты, а также вычислены показатели перфузии, на основании которых выделены три типа очагов: с высокими значениями – 17 (28 %) наблюдений, средними – 18 (30 %) и низкими – 25 (41 %), которые были разделены на три типа.
В процессе работы получены три основных варианта графика контрастирования для относительных величин, отражающих зависимость плотности от времени в очаге при перфузионном сканировании. К первому типу относились высокие показатели васкуляризации очагов – 17 (28 %) больных (табл. 1). Очаги злокачественной природы имели высокие значения перфузии, что объясняется опухолевым неоангиогенезом. Пик гемодинамической кривой по характеру и интенсивности был сопоставим с аортой, что
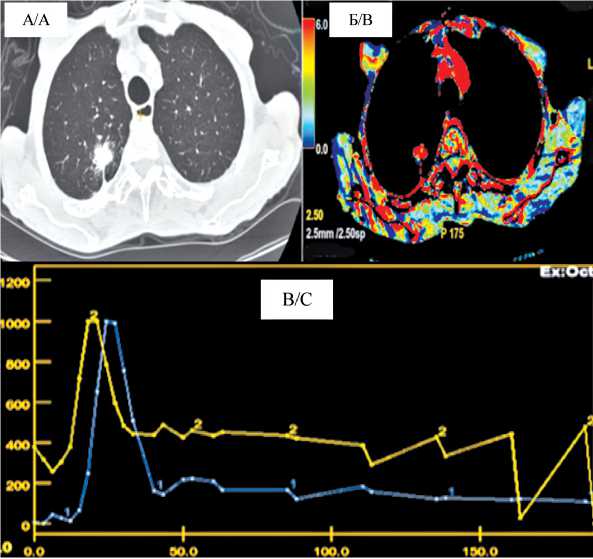
Рис. 1. Аденокарцинома правого легкого, перфузионная компьютерная томография: А) В 10 сегменте правого легкого определяется образование с признаками периферического рака;
Б) Цветовая карта демонстрирует высокий неоангиогенез в очаге: В) Кривая концентрации контрастного вещества плотность/время в аорте – высокие количественные показатели перфузии в анализируемом очаге подтверждают его злокачественный характер
Fig. 1. Adenocarcinoma of right lung, CТ perfusion: A) In the 10th segment of the right lung, a lesion with signs of peripheral cancer is visualized; B) Color map shows significant neoangiogenesis in the lesion; C) Тhe curve of the concentration of the contrast medium density/time in the aorta – high quantitative perfusion parameters in the lesion confirm its malignant nature таблица 2/table 2
количественные показатели Пкт в очагах со средними значениями перфузии (средние значения) Quantitative pCt parameters in lesions with average perfusion values (average values)
Ко второму типу были отнесены 18 очаговых изменений, у которых показатели перфузии имели средние значения, не превышающие 50 % значений артериального пика в аорте. Хотя с учетом неоднородности субстрата характер кривой мог иметь небольшие отклонения в пределах 25 % относительно своих начальных значений, в целом при анализе последующих гемодинамических фаз он оставался выше уровня аорты. Подобные варианты перфузионных кривых регистрировались как при доброкачественных, так и при злокачественных изменениях, в связи с чем этот тип представлял наибольшую сложность в проведении дифференциального диагноза (табл. 2).
К третьему типу относились очаги с низкими показателями перфузии – 25 (41 %) больных. Большая часть доброкачественных изменений (гамартомы, туберкулемы и фиброзные изменения паренхимы) имели минимальные или даже нулевые значения перфузии, при этом на гемодинамической кривой отсутствовала визуализация артериального пика в анализируемом образовании, фазовое деление было не выражено на протяжении всего паттерна (рис. 2). В очагах с низкой перфузией кривые пиковой концентрации плотность/время были минимальными, составляя не более 15 % от пика в аорте, либо вовсе имели отрицательные значения. При анализе цветовых карт в подгруппе изменений с низком типом перфузии в 17 из 25 наблюдений при стандартных настройках порога чувствительности на цветовых картах отсутствовала визуализация самих очагов (табл. 3). Как показал анализ, для их отображения необходимо уменьшать значение порога воздуха в единицах HU до уровня – 1000. При этом оценка параметров гемодинамики зоны интереса (BF, BV, PS, Tmax) производится визуально по цветовым локусам и расчету количественных и качественных показателей кинетической кривой кровотока. Актуальным примером очагов с низкой перфузией являются очаговые фиброзные измене-
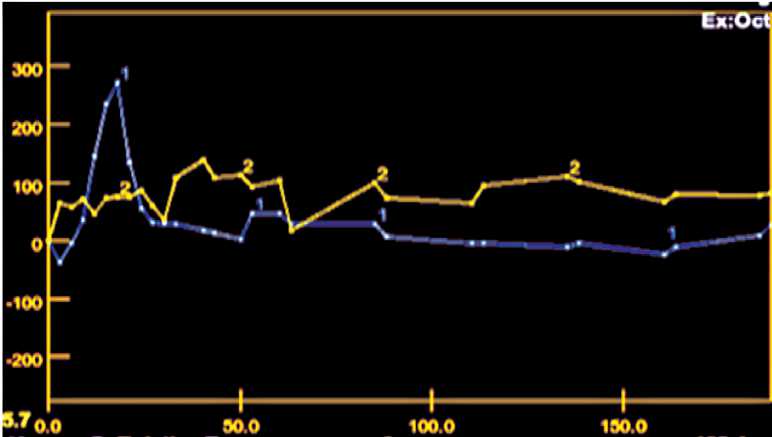
Рис. 2. Характер динамической кривой в очаге (хондрогамартома) с умеренной перфузией. На фоне артериального пика аорты (кривая 1) в образовании (кривая 2) отмечается отсутствие пика как такового, однако определяется повышенный уровень кровотока относительно аорты в последующие фазы
Fig. 2. Тhe nature of the dynamic curve in the lesion (chondrogamartoma) with moderate perfusion. Тhere is the arterial peak of the aorta (curve 1). In the lesion, there is no peak (curve 2), however, an increased level of blood flow relative to the aorta in the subsequent phases is determined таблица 3/table 3
количественные показатели Пкт в очагах с низкими значениями перфузии (средние значения) Quantitative pCt parameters in lesions with low perfusion values (average values)
t-критерии параметров кровотока у 60 пациентов с доброкачественными и злокачественными процессами в легких
t-criteria for blood flow parameters in 60 patients with benign and malignant lung tumors
Сравнительный анализ в группах больных с доброкачественными и злокачественными изменениями в легких проводился по следующим параметрам кровотока в очаговом образовании: проницаемость (PS); время достижения пиковой концентрации контрастного вещества (TTP), объемного кровотока (BV), скорость кровотока (BF). Оценивались минимальные, максимальные, средние и среднее отклонение (табл. 4). При этом отмечено, что имеются значимые различия по PS в средних значениях (р=0,038), в максимальных и минимальных значениях (р=0,017; р=0,011), а также в среднем отклонении (р=0,018). При анализе TTP также отмечены значимые отличия в минимальных, максимальных, средних и среднем отклонении значений (р=0,008; р=0,002; р=0,008; р=0,008). Стоит отметить, что при оценке BV в выбранном очаге получены значимые различия лишь в средних значениях (р=0,022). Показатель BF в минимальных значениях оказался не значимым (р=0,201), в максимальном, среднем и среднем отклонениях – достоверным (р=0,004; р=0,018; р=0,015). Показатели времени максимальной концентрации контрастного вещества в очаге (T-max) были недостоверными в минимальных числах (р=0,152), а в среднем, максимальном и среднем отклонении выявлены достоверные различия (р=0,002; р=0,004; р=0,004). Таким образом, средние показатели PS, TTP как при злокачественных, так и при доброкачественных процессах в легких являются ведущими факторами при оценке КТ-перфузии.
По данным анализа выборки и средних значений показателей оценки перфузии очагов в легких группы были сопоставимы. При анализе независимых выборок по t-критерию по показателям перфузии пациентов со злокачественными (1) и доброкачественными (0) очаговыми изменениями в легких выявлено, что значение BF и BV в исследуемой зоне статистически не значимо по всем величинам (минимальные, максимальные, средние и среднее отклонения). PSmin в доброкачественных и злокачественных очагах оказалась статистически достоверна (р=0,046; р=0,013); средние значения не оказались достоверными в обеих группах (р=0,130; р=0,053); максимальная проницаемость и средние отклонения были значимыми в группе со
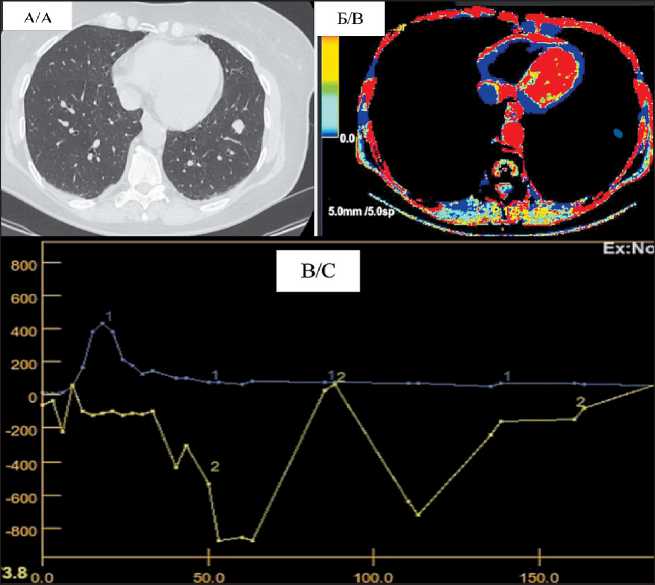
Рис. 3. Фиброзные изменения в левом легком. МСКТ органов грудной клетки с контрастным усилением: А) На границе 6 и 10 сегментов левого легкого определяется мягкотканое образование неправильной формы; Б) ПКТ зоны интереса – низкие показатели кровотока на цветовой карте; В) кривая концентрации контрастного вещества плотность/время в аорте – параметры кровотока близки к нулевой отметке
Fig. 3. Fibrous changes in the left lung. MSCТ of the chest organs with contrast enhancement: A) At the border of 6 and 10 segments of the left lung, soft tissue lesion of irregular shape is determined; B) PKТ of the area of interest – color map shows low blood flow; C) Тhe curve of the concentration of contrast medium density/time in the aorta – blood flow parameters are close to zero
таблица 5/table 5 однофакторный дисперсионный анализ
(anoVa) показателей перфузии у пациентов со злокачественными и доброкачественными очаговыми изменениями в легких univariate analysis (anoVa) of perfusion parameters in patients with malignant and benign lung tumors
Таким образом, анализ t-критерия равенства независимых выборок показателей перфузии пациентов со злокачественными и доброкачественными очагами в легких показал, что основными достоверными параметрами кровотока в обеих группах оказались TTP в очаге и Tmax, что является дифференциально диагностическим критерием для определения природы выявленных изменений.
При однофакторном дисперсионном анализе (ANOVA) показателей перфузии у пациентов в обеих группах BV и BF оказались статистически не значимыми (р>0,05) (табл. 5). Показатель PS min сосудистой стенки в сравниваемых группах оказался достоверно значим (р=0,046), а другие величины (PS max; PS ср.; PS ср. откл.) были незначимыми. TTP min, TTP max, TTP ср. были статистически достоверными (р=0,03; р=0,02; р=0,02); что касается TTP ср. откл. – различия не выявлены (р=0,06). PS min у пациентов в обеих группах был не достоверен (р=0,281), а PS max, PS ср., PS ср. откл. оказались статистически значимыми у всех пациентов (р=0,047; р=0,013; р=0,038).
Таким образом, проведенный статистический анализ данных цифровой обработки перфузионной компьютерной томографии, в том числе с помощью разработанной модели многофункционального однофакторного дисперсионного анализа (ANOVA), в ряде случаев достоверно показывает принадлежность природы очаговой патологии легких, а также выделяет наиболее значимые параметры перфузии.
Обсуждение
Определение уровня перфузии того или иного объекта заключается в анализе цветовых карт и характера кривой гемодинамики образования. Однако результаты работы показали неоднозначную корреляцию между клиническими и статистическими данными. Сложность заключается в наличии высоких показателей кровотока при воспалительных изменениях, которые могут симулировать злокачественные новообразования легких, что подтверждается и предыдущими исследованиями [11]. Анализ литературы показывает также вариабельность трактовки данных перфузионной компьютерной томографии, в некоторых работах отмечена недостоверность показателей BV, BF, PS, однако получены значимые различия показателей BF и MTT при аденокарциномах [12]. В нашем исследовании при однофакторном дисперсионном анализе показателей перфузии у пациентов со злокачественными и доброкачественными очаговыми изменениями в легких также не выявлен ведущий критерий, в котором все четыре величины были статистически значимыми, поэтому важным элементом анализа является визуализация гемодинамических кривых с визуализацией изменений на цветовой карте. Временные показатели, а именно TTP и Tmax в очаге, являются наиболее важными в диагностике образований в легких, однако мы также рекомендуем всегда оценивать скорость и объем кровотока, которые в комплексе с уровнем проницаемости (PS), нативными и контрастными данными позволят приблизиться к пониманию природы выявляемых изменений. Для формирования более четких критериев доброкачественности перфузионных показателей требуется больший объем клинических наблюдений.
Список литературы Перфузионная компьютерная томография в определении природы очаговой патологии легких: клинический и статистический анализ
- Золотницкая В.П., Тишков А.В., Агафонов А.О., Страх Л.В., Амосова О.В. Новые возможности обработки результатов радиологического исследования легких. Российский электронный журнал лучевой диагностики. 2019; 9(2): 98-106. [Zolotnitskaia VP., TishkovA.V., Agaphonov A.O., Strach L.V., Amosova O.V. New possibilities of processing the results of lungs radiological studies. Russian Electronic Journal of Radiology. 2019; 9(2): 98-106. (in Russian)].
- Котляров П.М., Сергеев Н.И. Лучевые методы исследования в дифференциальной диагностике паразитарных и опухолевых поражений легких. Сибирский онкологический журнал. 2016; 15(4): 33-39. [KotlyarovP.M., SergeevN.I. Imaging techniques in the differential diagnosis of parasitic lung diseases and lung cancer. Siberian Journal of Oncology. 2016; 15(4): 33-39. (in Russian)]. doi: 10.21294/1814-48612016-15-4-33-39.
- Sim Y.T., PoonF.W. Imaging of solitary pulmonary nodule-a clinical review. Quant Imaging Med Surg. 2013 Dec; 3(6): 316-26. doi: 10.3978/j. issn.2223-4292.2013.12.08.
- Юдин А.Л., Афанасьева Н.И., Блажко В.Д, Мясников ДА., Юматова Е.А. Одновременное выявление туберкулеза и ВИЧ-инфекции. Российский медицинский журнал. 2017; 23(1): 11-17. [YudinA.L., AfanasevaN.I., Blazhko V.D., MyasnikovD.A., YumatovaE.A. The simultaneous detection of tuberculosis and HIV-infection. Russian Medical Journal. 2017; 23(1): 11-17. (in Russian)].
- Mazzei M.A., Cioffi Squitieri N., Guerrini S., Di Crescenzo V., Rossi M., Fonio P., Mazzei F.G., Volterrani L. Quantitative CT perfusion measurements in characterization of solitary pulmonary nodules: new insights and limitations. Recenti Prog Med. 2013 Jul-Aug; 104(78): 430-7.
- Котляров П.М., Лагкуева И.Д., Сергеев Н.И., Солодкий В.А. Магнитно-резонансная томография в диагностике заболеваний легких. Пульмонология. 2018; 28(2): 217-223. [Kotlyarov P.M., Lag-kuyeva I.D., Sergeyev N.I., Solodkiy V.A. Magnetic resonance imaging for diagnostics of lung diseases. Pulmonologiya. 2018; 28(2): 217-223. (in Russian)].
- Wang Q, Zhang Z, Shan F., Shi Y, Xing W, Shi L, ZhangX. Intra-observer and inter-observer agreements for the measurement of dual-input whole tumor computed tomography perfusion in patients with lung cancer: Influences of the size and inner-air density of tumors. Thorac Cancer. 2017 Sep; 8(5): 427-435. doi: 10.1111/1759-7714.12458.
- Lv Y, Jin Y, Xu D, Yan Q, Liu G., ZhangH., Yuan D, Bao J. Assessment of 64-slice spiral computed tomography with perfusion weighted imaging in the early diagnosis of ground-glass opacity lung cancer. J BUON. 2016 Jul-Aug; 21(4): 954-957.
- Ma E., Ren A., Gao B., Yang M., Zhao Q., Wang W., Li K. ROI for outlining an entire tumor is a reliable approach for quantification of lung cancer tumor vascular parameters using CT perfusion. Onco Targets Ther. 2016 Apr 27; 9: 2377-84. doi: 10.2147/0TT.S98060.
- Petralia G., BonelloL., Viotti S., PredaL., d'Andrea G., BellomiM. CT perfusion in oncology: how to do it. Cancer Imaging. 2010 Feb 11; 10(1): 8-19. doi: 10.1102/1470-7330.2010.0001.
- Лагкуева И.Д., Сергеев Н.И., Котляров П.М., Измайлов Т.Р., Падалко В.В., Солодкий B.A. Перфузионная компьютерная томография в уточнении природы очаговой патологии легких. Лучевая диагностика и терапия. 2019; 1(10): 62-68. [Lagkueva I.D., Sergeev N.I., Kotlyarov P.M., Izmailov T.R., Padalko V.V., Solodkiy V.A. Perfusion computed tomography in refinement nature and focal lung disease. Diagnostic Radiology and Radiotherapy. 2019; 1(10): 62-68. (in Russian)]. doi: 10.22328/2079-5343-2019-10-1-62-68.
- Силантьева Н.К., Петросян А.П., Каприн А.Д., Иванов С.А., Усачева А.Ю., Мозеров С.А., Куприянова Е.И. Дифференциальная диагностика одиночных очагов легких: что дает перфузионная компьютерная томография? Russian Electronic Journal of Radiology. 2018; 8(4): 83-94. [Silanteva N.K., Petrosian A.P., Kaprin A.D., Ivanov S.A., Usacheva A.Yu., Mozerov S.A., Kupriyanova E.I. Differential diagnosis of solitary pulmonary nodule: what does ct-perfusion give? Russian Electronic Journal of Radiology. 2018; 8(4): 83-94. (in Russian)]. doi: 10.21569/2222-7415-2018-8-4-83-94.


