Перфузионная сцинтиграфия лёгких у больных с лёгочной гипертензией различной этиологии
Автор: Архипова О.А., Мартынюк Т.В., Самойленко Л.Е., Сергиенко В.Б., Чазова И.Е.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Лёгочная гипертензия (ЛГ) характеризуется повышением лёгочного сосудистого сопротивления, давления в лёгочной артерии, ремоделированием сердца и сосудов и крайне низкой выживаемостью больных. Начиная с 2009 г. в Европейских рекомендациях по диагностике ЛГ вентиляционно-перфузионная сцинтиграфия занимает центральное место в дифференциальной диагностике между различными формами лёгочной гипертензии, прежде всего в установлении хронической тромбоэмболической ЛГ. Сцинтиграфическая картина хорошо изучена у пациентов с лёгочной гипертензией, развившейся вследствие перенесённой тромбоэмболии ветвей лёгочной артерии. Данные прямого сопоставления распределения РФП и характера изменений перфузии в зависимости от генеза лёгочной гипертензии и тяжести заболевания в литературе не представлены. Вместе с тем, знание особенностей сцинтиграмм может оказаться полезным в дифференциальной диагностике и оценке прогноза у больных с лёгочной гипертензией различной этиологии.
Перфузионная сцинтиграфия лёгких, лёгочная гипертензия, количественная оценка сцинтиграмм
Короткий адрес: https://sciup.org/14342801
IDR: 14342801
Текст научной статьи Перфузионная сцинтиграфия лёгких у больных с лёгочной гипертензией различной этиологии
|
Сведения об авторах: |
|
|
Мартынюк Тамила Витальевна |
д.м.н., руководитель лаборатории лёгочной гипертензии отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-64-50 |
|
Самойленко Людмила Евгеньевна |
в.н.с, д.м.н. отдела радионуклидной диагностики ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел. 8-495-414-64-19 |
|
Сергиенко Владимир Борисович |
д.м.н., профессор, руководитель отдела радионуклидной диагностики ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел. 8-499-149-02-61 |
|
Чазова Ирина Евгеньевна |
член-корр. РАН, профессор, д.м.н., генеральный директор ФГБУ РКНПК МЗ РФ, директор ИКК им. А.Л. Мясникова, руководитель отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ |
|
Автор, ответственный за связь с редакцией: Архипова Ольга Александровна |
младший научный сотрудник отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, Адрес: 121552, Москва, ул. 3-я Черепковская, 15 а, тел.: 8-495-414-68-33, olga_ark@list.ru |
Лёгочная гипертензия (ЛГ) объединяет группу заболеваний, характеризующихся повышением лёгочного сосудистого сопротивления (ЛСС), которое приводит к ремоделированию сердца и сосудов, развитию правожелудочковой сердечной недостаточности и преждевременной гибели пациентов [1].
Диагностическими критериями ЛГ являются повышение среднего давления в лёгочной артерии (ДЛАср) более 25 mmHg в покое по данным катетеризации правых отделов сердца [2].
Современная отечественная классификация включает 5 клинических групп, такие как лёгочная артериальная гипертензия (ЛАГ), ЛГ, ассоциированная с поражением левых отделов сердца, ЛГ, ассоциированная с патологией дыхательной системы и/или гипоксемией, ЛГ вследствие хронических тромботических или эмболических заболеваний (ХТЭЛГ) и смешанные формы. Среди подгрупп больных ЛАГ наиболее часто встречающимися в клинической практике являются идиопатическая ЛГ (ИЛГ), ЛАГ, ассоциированная с врожденными пороками сердца – системно-лёгочными шунтами (ЛАГ-ВПС) и ЛАГ, ассоциированная с системными заболеваниями соединительной ткани (ЛАГ-СЗСТ).
ЛАГ, ЛГ, ассоциированная с патологией дыхательной системы и/или гипоксемией и ХТЭЛГ относятся к прекапиллярным формам и характеризуются помимо повышения среднего давления в лёгочной артерии ≥ 25 мм рт. ст. увеличением ЛСС более 3 ед. по Вуду и нормальным значением давления заклинивания лёгочной артерии (ДЗЛА ≤ 15 мм рт. ст.). Если у больных с поражением левых отделов сердца развивается ЛГ, она имеет посткапиллярний генез и, в отличие от остальных групп, ДЗЛА у таких пациентов повышено (ДЗЛА >15 мм рт. ст.).
ЛГ характеризуется неблагоприятным прогнозом. Так средняя выживаемость у больных с ИЛГ к концу первого года при отсутствии патогенетической терапии составляет примерно 68-77%, на 2-ом году – 69%, на 3-ем году – около 35-48%, на 5-ом году – 34% [3]. Даже на фоне современной терапии смертность в течение 1 года составляет 15% [4]. Двухлетняя выживаемость для больных с системной склеродермией не превышает 40% [5]. Предсказанная продолжительность жизни для больных с ХТЭЛГ составляет 6,8 года [6]. Пациенты с врожденным пороком сердца (ВПС) имеют лучший прогноз, чем больные с ИЛГ, хотя пока остаётся непонятным, связано ли это с лучшими адаптационными возможностями ПЖ у более молодых пациентов или потенциальными преимуществами имеющегося шунта. Выживаемость больных с симптом Эйзенменгера составляет 97%, 89%, и 77% за 1, 2, и 3 года, соответственно [7].
Среди факторов неблагоприятного прогноза следует отметить наличие признаков недостаточности ПЖ (в том числе наличие экссудативного перикардита, повышение уровня натрийуретического пептида), низкий функциональный класс (ФК III-IV ВОЗ), наличие обмороков, малая дистанция, пройденная в тесте 6 минутной ходьбы, снижение максимального объема потребления О2 менее 12 мл/мин/кг при проведении кардиопульмонального нагрузочного теста, увеличение давления в ПП более 15 мм рт. ст., снижение сердечного индекса менее 2,0 л/мин/м2. Вместе с тем у ряда пациентов, имеющих исходно благоприятный прогноз, заболевание достаточно быстро прогрессирует, что диктует необходимость поиска новых маркёров прогноза. В этой связи обращают на себя внимание изменения перфузии лёгочной ткани при различных формах ЛГ.
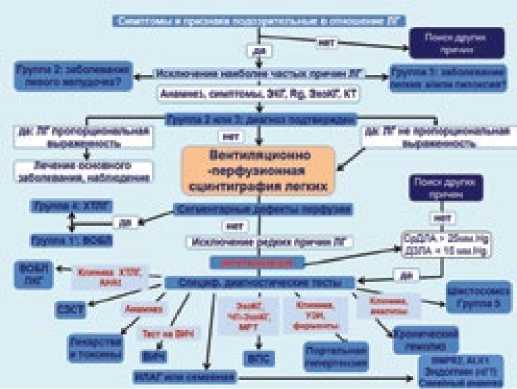
Согласно национальным рекомендациям по диагностике и лечению больных с ЛГ алгоритм диагностического поиска при верификации диагноза включает 4 этапа. Вентиляционно-перфузионную сцинтиграфию лёгких (ВПСЛ) необходимо проводить пациентам на третьем этапе, когда происходит установление клинического класса ЛГ.
По предложенному в 2009 г. Европейским обществом кардиологов алгоритму ВПСЛ занимает центральное место в дифференциальной диагностике между различными формами ЛГ (рис. 1). ВПСЛ необходимо проводить пациентам после исключения наиболее частых причин ЛГ, таких как заболевания левых отделов сердца и лёгких, а также пациентам этих групп при наличии так называемого диспропорционального повышения давления в ЛА для исключения острой или перенесённой тромбоэмболии лёгочной артерии (ТЭЛА) [1].
В связи с тем, что проведение вентиляционной сцинтиграфии возможно не во всех клиниках, допускается сопоставление данных перфузионной сцинтиграфии с рентгенографической картиной [8]. Вместе с тем, применение вентиляционной сцинтиграфии лёгких вместе с перфузионной позволяет повысить специфичность диагностической процедуры за счёт выявления гиповентиляции неэмболического происхождения, причиной которой является гипоперфузия, обусловливающая вазоконстрикцию [9,10].
Рисунок 1. Алгоритм диагностического поиска
В последние годы стали использоваться гибридные технологии, позволяющие совместить гамма-камеру и компьютерный томограф (SPECT/CT), что улучшает специфичность и чувствительность вентиляционно-перфузионной сцинтиграфии, так как способствует более точному определению локализации и размеров патологических процессов, помогает в дифференциальной диагностике между ТЭЛА и другими изменениями, например, опухолью или пневмосклерозом [11].
Метод перфузионной пульмоно-сцинтиграфии лёгких (ПСЦЛ) основан на способности макроагрегатов альбумина человеческой сыворотки крови, меченных 99m Технецием, после их внутривенного введения распределяться в функционирующих лёгочных артериолах. При отсутствии лёгочно-системных шунтов распределение РФП в лёгких отражает состояние лёгочной перфузии.
Запись изображения осуществляется по стандартному протоколу исследования в 4 или 6 проекциях (передняя и задняя прямые, правая и левая боковые, правая и левая переднекосые). Оценка изображений в различных проекциях необходима для топической диагностики выявляемых дефектов, а также визуализации изменений в отделах лёгких, экранированных сердцем. Исследование выполняется в положении больного «лежа на спине». Руки располагаются вдоль туловища в передней, задней и косых проекциях, за головой – в боковых проекциях. На каждую проекцию набирают 1 млн. импульсов в матрицу 256х256 бит. Специальной подготовки к исследованию не требуется.
Анализ пульмоносцинтиграмм состоит из визуальной и количественной оценки. При визуальном анализе оценивается наличие включения РФП в лёгкие, четкость контуров изображения лёгких, характер распределения РФП (равномерный/ неравномерный), наличие участков сниженной аккумуляции РПФ с оценкой их количества (единичные/множественные), формы, размера по отношению к размеру сегмента, локализации с указанием сегментов. Определяется наличие включения РФП вне «зоны интереса», то есть вне области проекции лёгких (в органах большого круга кровообращения).
Количественную оценку сцинтиграмм проводят, используя изображения лёгких, полученные в передней и задней проекциях, основываясь на гравитационных аспектах. Определяют интенсивность счета импульсов в каждом лёгком, которую вычисляли как среднее арифметическое значение между интенсивностью счета импульсов передней и задней проекций. Также определяют процентное соотношение накопления РФП в правом и левом лёгком. Помимо этого, рассчитывается средний процент включения РФП в верхнюю (ВЗВ), среднюю (СЗВ) и нижнюю (НЗВ) зоны Веста каждого лёгкого. Пульмо-носцинтиграммы в передней проекции отображают состояние перфузии преимущественно верхней и средней долей справа, верхней доли слева; в задней проекции наиболее полно – перфузию нижних долей лёгких. По сумме проекций в норме 53,1 ± 1,20% общего кровотока приходится на правое лёгкое и 46,9 ± 0,90% на левое лёгкое.
Тесную взаимосвязь между перераспределением лёгочной перфузии и давлением в левом предсердии у пациентов с митральным пороком сердца первыми установили W. Friedman и E. Braunwald [12]. Авторы показали, что у больных с повышенным венозным давлением в малом круге кровообращения возрастает кровоток в верхней зоне правого лёгкого и уменьшается в его нижней зоне. Позднее подобное перераспределение было обнаружено у больных с другими пороками сердца [13] и ИБС [14].
Это объясняется тем, что лёгочный кровоток определяется равновесием между альвеолярным, лёгочным артериальным, лёгочным венозным и интерстициальным давлением. В норме интенсивность включения РФП в каждом лёгком равномерно увеличивается от верхушки к основанию В вертикальном положении в верхних отделах альвеолярное давление в норме превышает давление в лёгочных артериолах. Поэтому кровоток в этих отделах снижен. В норме по различным данным перфузионный кровоток в верхних зонах правого и левого лёгких составляет 6,6-13,3% и 6,5-10,4%, в средних – 16,6-20,3% и 16,7-18,2%, в нижних – 19,6-29% и 17,8-25,2%, соответственно [9].
С учётом того, что перфузия верхушек лёгких осуществляется только посредством лёгочного артериального давления, которое может зависеть от лёгочного венозного давления, для определения степени выраженности нарушений лёгочной микроциркуляции вычисляют верхушечно-основной градиента перфузии (или апикально-базальный градиент перфузии) (U/L-Q). Градиент перфузии рассчитывается как отношение радиоактивности верхней доли к нижней. У здоровых добровольцев этот показатель составил 0,6-0,7 [15].
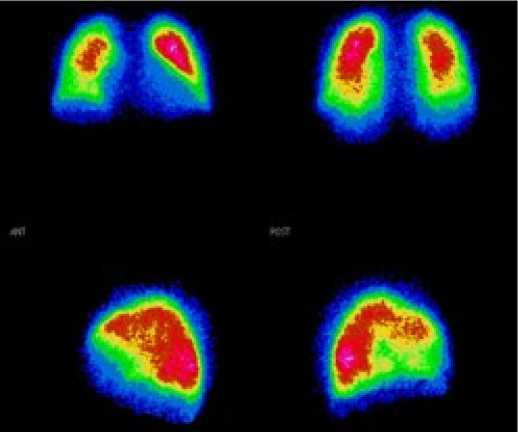
Таким образом, сцинтиграфическая картина у пациентов с ЛГ, связанной с патологией левых отделов сердца, обусловлена повышением лёгочного венозного давления, ДЗЛА и характеризуется наличием ровных четких контуров лёгких, увеличением тени сердца и усилением перфузии (интенсивности счёта) верхних отделов лёгких (рис. 2).
Основным показанием к проведению вентиляционноперфузионной сцинтиграфии лёгких является исключение острой ТЭЛА или хронической ТЭЛА у больных с ЛГ.
Рисунок 2. Перфузионная сцинтиграмма пациента с лёгочной гипертензией вследствие заболевания левых отделов сердца
Неизмененная сцинтиграфическая картина позволяет исключить ТЭЛА уже на начальном этапе диагностики, в связи с чем нет необходимости в проведении дорогостоящей муль-тиспиральной компьютерной томографии с внутривенным введением контрастного препарата, что может быть опасным из-за потенциальной возможности возникновения осложнений (например, аллергические реакции, осложнения в месте пункции, контрастная нефропатия).
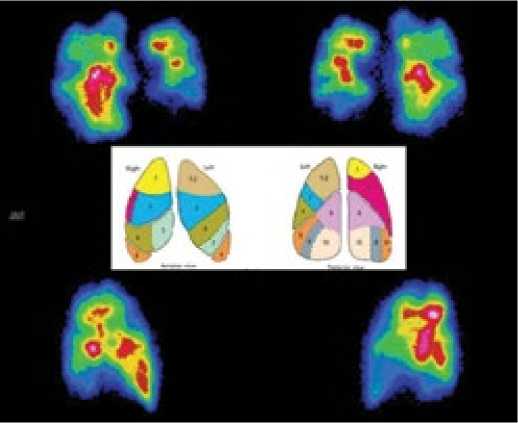
Диагноз ТЭЛА считается высоковероятным при выявлении на сцинтиграммах двух и более больших неприлегающих друг к другу сегментальных дефектов перфузии при нормальной или малоизмененной вентиляционной картине, а на обычной рентгенограмме в этой области не удаётся выявить признаков других патологических процессов, сопровождающихся локальным уменьшением кровотока (опухоль, абсцесс, полость и т.п.). В этих случаях вероятность тромбоэмболии ветвей лёгочной артерии достигает 90% (рис. 3). Также диагноз ТЭЛА высоковероятен при обнаружении двух умеренных или умеренного и большого дефектов или любого дефекта перфузии значительно превышающего рентгенографический дефект (критерии PIOPED) [16,17]. Вместе с тем, даже наличие нарушения перфузии одного сегмента ассоциируется с 88% вероятностью ТЭЛА [8].
Рисунок 3. Перфузионная сцинтиграмма пациента с лёгочной гипертензией вследствие рецидивирующей тромбоэмболии ветвей лёгочной артерии
При выявлении дефектов перфузии, не связанных с сегментом, любых дефектов при большом дефекте на рентгенограмме, соответствующих вентиляционных и перфузионных дефектов при нормальной рентгенограмме, вероятность ТЭЛА определяется как низкая (<19%), и при наличии ЛГ в первую очередь нужно думать о заболеваниях лёгких как причине ЛГ (рис. 4).
Сцинтиграфическая картина при ИЛГ (рис. 5) может быть не изменена или представлена множественными мелкими периферическими субсегментарными дефектами перфузии (мозаичность перфузии), в отличие от более крупных дефектов в долевых и сегментарных зонах при ХТЭЛГ [18,19]. При этом степень нарушения перфузии может свидетельствовать о тяжести ЛГ. Показана достоверная корреляция между U/L-Q [20] и ДЛАср (r=0.64, p<0.001), U/L-Q и ДЗЛА (r=0.63, p<0.001), а также U/L-Q и ЛСС (r=0.50, p<0.001). Кроме того, у больных ИЛГ была показана средняя корреляция между U/L-Q и фракцией выброса ПЖ (r=0,51, р<0,05).
Рисунок 4. Перфузионная сцинтиграмма пациента с лёгочной гипертензией вследствие заболевания лёгких
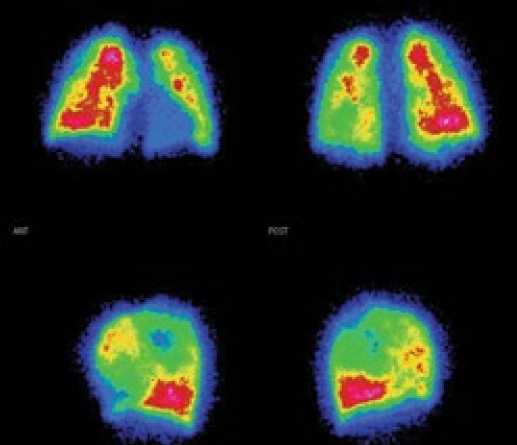
Рисунок 5. Перфузионная сцинтиграмма пациента с идиопатической лёгочной гипертензией
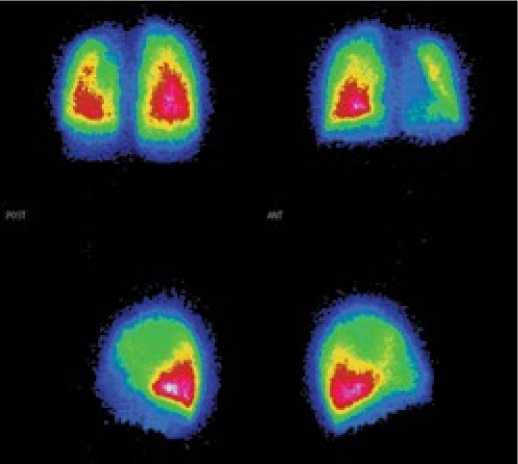
Сцинтиграфическая картина у пациентов с ЛГ-ВПС может быть не изменена. Описаны также изменения в виде одностороннего отсутствия или снижения перфузии (рис. 6), либо очаговые дефекты, связанные с перенесённой ТЭЛА [13, 21]. Однако в этих работах не представлена зависимость изменения перфузии от уровня давления в лёгочной артерии. При наличии лёгочно-системного шунта (например, ДМПП, ОАП) МАА визуализируются в капиллярах большого круга кровообращения [22].
Работ, посвященных изучению перфузии у пациентов с ЛАГ-СЗСТ в литературе практически не представлено. В единственной доступной для прочтения статье сообщается о снижении перфузии, которую авторы связывают с наличием васкулита и внутрисосудистой микрокоагуляции [23].
Рисунок 6. Перфузионная сцинтиграмма пациента с лёгочной гипертензией, ассоциированной с врожденным пороком сердца
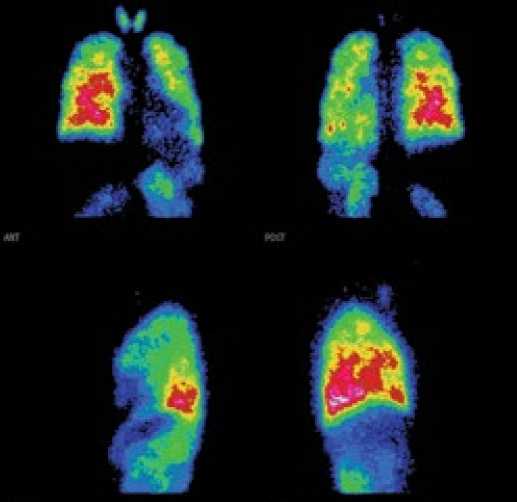
В отделе системных гипертензий Института клинической кардиологии им. А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ было выполнено исследование перфузии лёгких у 94 больных с ЛГ, из которых 20 пациентов были с ЛАГ-ВПС, 21 пациент с ХТЭЛГ, 20 пациентов с ЛАГ-СЗСТ (больные системной склеродермией) и 33 пациент с ИЛГ [24].
У всех пациентов с ЛАГ визуализировалось мозаичное нарушение перфузии, расширение тени сердца и сосудистого пучка.
Количественный анализ сцинтиграмм показал, что у пациентов с ЛАГ-ВПС выявлено перераспределение кровотока между лёгкими в виде обеднения перфузии в левом лёгком и усиления в правом. Включение РФП в левое лёгкое в этой группе было наименьшим при сравнении с ХТЭЛГ (р = 0,02) и с ЛАГ-СЗСТ (р = 0,05). Перфузия в ВЗВ левого лёгкого была увеличена, в нижних – с обеих сторон снижена. U/L-Q с двух сторон был не нарушен. При сопоставлении выявленного при проведении ЭхоКГ сброса крови при внутрисердечных дефектах и визуализации по данным ПСЦЛ включения РФП в органы большого круга кровообращения получена высокая корреляционная связь (r=0,70; р<0,0001).
У больных с ХТЭЛГ распределение РФП между лёгкими было не нарушено. Отмечалось увеличение перфузии в верхней зоне левого лёгкого, справа – по нижней границе нормы. Включение РФП в ВЗВ левого лёгкого было максимальным в сравнении с другими группами и достоверно отличалось от больных с ЛАГ-СЗСТ и ИЛГ. Обращает на себя внимание наиболее выраженное повышение U/L-Q, связанное со значительным обеднением перфузии нижних долей, в большей степени слева. Снижение перфузии в нижней доле левого лёгкого у этих пациентов было наиболее выраженным, достоверно отличалась от групп ЛАГ-ВПС и ИЛГ и обусловлено наиболее частой локализацией тромботического поражения.
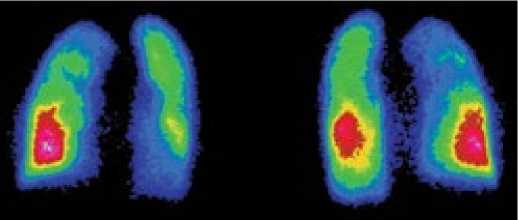
В группе ЛАГ-СЗСТ также, как в группе ХТЭЛГ, соотношение включения РФП в правое и левое лёгкие не было нарушено. Перфузия верхних сегментов правого лёгкого была значительно снижена (на 18,7%) и достоверно отличалась от больных с ЛАГ-ВПС и ХТЭЛГ; слева – находилась на верхней границе нормы (рис. 7). Определялось снижение U/L-Q справа на фоне небольшого увеличения градиента слева.
Рисунок 7. Перфузионная сцинтиграмма пациента с лёгочной гипертензией, ассоциированной с системной склеродермией
У больных с ИЛГ, как и у пациентов с ЛАГ-ВПС было выявлено перераспределение кровотока в пользу правого лёгкого. U/L-Q справа был снижен и, в сравнении с остальными группами, был минимальным. U/L-Q слева был схожим с группой ЛАГ-ВПС. В левом лёгком было выявлено небольшое увеличение (на 1,3%), а в правом – снижение перфузии (на 12,4%) ВЗВ при сравнении с нормальными значениями. В нижних от- делах левого лёгкого, также как и у других пациентов, отмечено обеднение перфузии. В отличие от больных ХТЭЛГ во всех зонах визуализировались множественные мелкие (менее % сегмента) дефекты перфузии.
При выявлении взаимосвязи между уровнем давления в ЛА и распределением РФП в лёгких были получены лишь слабые корреляции между перфузией в ВЗВ справа с СДЛА, ДЛАср, ДЗЛА, давлением в ПЖ и ПП.
Таким образом, основным показанием к применению перфузионной сцинтиграфии лёгких является исключение ТЭЛА. Вместе с тем, при анализе сцинтиграмм лёгких визуализируются изменения перфузии, отличающиеся у больных с различной этиологией ЛГ, что представляет особый научный и практический интерес. Изучение нарушений перфузии лёгких при различных формах ЛГ и функциональных классах (ВОЗ) может оказаться недостающим звеном оценки прогноза, влияющим на продолжительность жизни таких пациентов.
Список литературы Перфузионная сцинтиграфия лёгких у больных с лёгочной гипертензией различной этиологии
- Guidelines for the diagnosis and treatment of pulmonary hypertension. Update 2009. European society of cardiology. Eur Heart Journal 2009;30:2493-2537.
- Чазова И. Е., Авдеев С. Н., Царева Н. А., Волков А. В., Мартынюк Т. В., Наконечников С. Н. Терапевтический архив 2014; 9:4-23
- Vallerie V. McLaughlin, Kenneth W. Presberg et al. Prognosis of Pulmonary Arterial Hypertension: ACCP Evidence-Based Clinical Practice Guidelines. Chest 2004;126:78S-92S.
- Thenappan T., Shah S.J., Rich S., et al. A USA-based registry for pulmonary arterial hypertension: 1982-2006. Eur Respir J. 2007;30:1103-10.
- Stupi A.M., Steen V.D., Owens GR., et al. Pulmonary hypertension in the CREST syndrome variant of systemic sclerosis. Arthritis Rheum. 1986;29:515-24.
- Kunieda T., Nakanishi N., Satoh T. et al. Prognoses of primary pulmonary hypertension and chronic majorvessel thromboembolic pulmonary hypertension determined from cumulative survival curves. Intern Med. 1999;38(7):543-6.
- Hopkins W.E., Ochoa L.L., Richardson G.W., Trulock.EP. Comparison of the hemodynamics and survival of adults with severe primary pulmonary hypertension or Eisenmenger syndrome. J Heart Lung Transplant 1996;15(1 Pt 1): 100-5.
- Guidelines on the diagnosis and management of acute pulmonary embolism. European Heart Journal 2008; 29: 2276-2315.
- Радионуклидная диагностика для практических врачей. Под ред. Лишманова Ю.Б., Чернова В.И. Томск: STT, 2004:138-157.
- Брин В.Б., Вартапян И.А., Данияров С.Б. и соавт. Основы физиологии человека. Учебник для высших учебных заведений., в 2-х томах., под редакцией акад. РАМН Б.И.Ткаченко. СПб., 1994. Т.1 - 567с
- Roach P., Gradinscak D., Schembri G.P. et al. SPECT/CT in V/Q scanning. Semin Nucl Med. 2010 Nov;40(6):455-66.
- Friedman W.F., Braunwald E. Alterations in regional pulmonary blood flow in mitral valve disease studied by radioisotope scanning. A simple nontraumatic technique for estimation of left atrial pressure. Circulation 1966; 34 (3): 363-376.
- Бодров В.Е., Тюкавин А.И. Паттерны лёгочной микроциркуляции у больных с ишемической болезнью сердца. Эфферентная терапия 2006; 12 (4): 62-70.
- Авдеев С.В., Завьялов А.А., Дубоделов Е.Л. и соавт. Влияние продленной эпидуральной анальгезии на состояние вентиляции и перфузии лёгких в раннем послеоперационном периоде у больных раком лёгких. Сибирский онкологический журнал 2009; №2(32): 5-9.
- Vreim C.E. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the Prospective Investigation of Pulmonary Embolism Diagnosis (PiOpED). The PIOPED Investigators. JAMA 1990; 263:2753-2759.
- Parker J.A., Coleman R.E., Siegel B.A., et al. Procedure Guideline for Lung Scintigraphy: 1.0. J Nucl Med 1996; 37: 1906-1910.
- Lisbona R., Kreisman H., Novales-Diaz J., Derbekyan V. Perfusion lung scanning: differentiation of primary from thromboembolic pulmonary hypertension. AJR Am J Roentgenol. 1985;144(1):27-30.
- Moser K.M., Page G.T., Ashburn W.L., Fedullo P.F. Perfusion Lung Scans Provide a Guide to Which Patients With Apparent Primary Pulmonary Hypertension Merit Angiography. J Med. 1988, 148(2): 167-170.
- Fukuchi K., Hayashida K., Nakanishi N. at al.Quantitative Analysis of Lung Perfusion in Patients with Primary Pulmonary Hypertension. J Nucl Med 2002; 43:757-761.
- Boothroyd A.E., McDonald E.A., Carty H. Lung perfusion scintigraphy in patients with congenital heart disease: sensitivity and important pitfalls.Nucl Med Commun. 1996;17(1): 33-9.
- Sommer R.J., Hijazi Z.M., Rhodes J.F. Pathophysiology of congenital heart disease in the adult: Part I: Shunt lesions. Circulation 2008;117:1090-9.
- Suzuki K., Kamata N., Inokuma S., et al. Clinical significance of ventilation/perfusion scans in collagen disease patients. Ann Nucl Med. 2000,14(6):405-13.
- Архипова О.А., Мартынюк Т.В., Самойленко Л.Е., Сергиенко В.Б., Чазова И.Е. Применение перфузионной сцинтиграфии лёгких у больных с лёгочной гипертензией различной этиологии. «Медицинская радиология и радиационная безопасность» 2013г, №1:50-59


