Периимплантная инфекция у пациентов с ревматоидным артритом на примере серии случаев
Автор: Любимова Л.В., Пчелова Н.Н., Николаев Н.С., Преображенская Е.В., Любимов Е.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.30, 2024 года.
Бесплатный доступ
Актуальность. Ввиду схожести клинико-лабораторной картины перипротезной инфекции и активности воспалительного процесса у пациентов с системными заболеваниями их дифференциальная диагностика затруднена.Цель работы - оценить диагностические данные и результаты санирующего лечения периимплантной инфекции у пациентов с ревматоидным артритом на примере серии клинических случаев.Материалы и методы. Проведен ретроспективный анализ случаев хирургического лечения перипротезной инфекции у пациентов с ревматоидным артритом за период 2014-2022 гг. Перипротезную инфекцию верифицировали на основании критериев ICM. Неблагоприятным исходом лечения считали наличие клинико-лабораторных признаков инфекции при поступлении на второй этап лечения и их возобновление после успешно завершенной санации.Результаты. Среди 524 случаев перипротезной инфекции 35 (6,7 %) составили пациенты с ревматоидным артритом, 48,6 % из которых получали антибиотики на догоспитальном этапе. Культуронегативная инфекция составила 38,4 %. Перипротезная инфекция не подтверждена в пяти случаях (14,3 %). Отмечены высокие средние значения маркеров воспаления в крови (СОЭ, СРБ и Д-димер) до и после санации, статистически значимыми оказались показатели снижения СОЭ и содержания лейкоцитов в синовиальной жидкости. В 82,9 % случаев лечения перипротезной инфекции получены благоприятные результаты в среднесрочном периоде, где каждый пятый пациент вынужден жить со спейсером или с артродезом сустава.Обсуждение. По данным других авторов, частота культуро-негативной инфекции у пациентов с системными заболеваниями составляла 27-37 %. Систематический обзор литературы показал, что процент палочкоядерных нейтрофилов в синовиальной жидкости имеет чувствительность 95,2 % и специфичность 85,0 % с достаточным для верификации инфекции оптимальным порогом 78 %. Все выявленные нами неблагоприятные исходы получены в результате двух- или трехэтапного хирургического лечения. Другие авторы получили лучшие исходы в результате двухэтапной санации.Заключение. Культуронегативная инфекция явилась лидером среди случаев перипротезной инфекции у пациентов с ревматоидным артритом. Достигнуты благоприятные исходы хирургического лечения, в большинстве случаев двухэтапного. Маркеры воспаления СОЭ, СРБ и Д-димер на этапах диагностики и санации инфекции не достигали нормальных значений, что свидетельствует о неприменимости стандартных диагностических критериев перипротезной инфекции у пациентов с ревматоидным артритом.
Перипротезная инфекция, культуронегативная инфекция, ревизионное эндопротезирование, ревматоидный артрит
Короткий адрес: https://sciup.org/142242627
IDR: 142242627 | УДК: 616.728.2/.8-002.77-089.843:616-089.193.4-06:616-022.1-035] | DOI: 10.18019/1028-4427-2024-30-4-552-560
Текст научной статьи Периимплантная инфекция у пациентов с ревматоидным артритом на примере серии случаев
Эндопротезирование является современным и эффективным методом лечения выраженной патологии суставов различной локализации, позволяющим пациентам вернуться к привычному для них образу жизни. Известно, что до 24 % всех пациентов с ревматоидным артритом (РА) в течение 16–20 лет после верификации диагноза вынуждены прибегать к первичному эндопротезированию суставов [1]. Частота встречаемости РА среди пациентов, перенесших эндопротезирование, составляет 2–7 % [2–4]. При этом пациенты с РА подвержены более высокому риску развития инфекционных осложнений, которые могут иметь атипичные признаки, затрудняя диагностику и лечение перипротезной инфекции (ППИ) [5]. Исследования показали, что РА является независимым фактором риска послеоперационной инфекции протезированных суставов [6–8]. Частота заболеваемости ППИ среди пациентов с РА (3,1–4,2 %) в 1,8–4 раза выше ёе аналогичного показателя у пациентов с патологией другой этиологии [6, 8]. Иммунодепрессанты, часто используемые при лечении РА, могут увеличивать риск ППИ в связи со снижением иммунного ответа [9].
Другой не менее важной проблемой пациентов с системными заболеваниями является дифференциальная диагностика обострения РА и инфекционного процесса в протезированном суставе. Стандартные диагностические тесты и биомаркеры (СОЭ, СРБ, лейкоциты синовиальной жидкости, лейкоцитарная эстераза или альфа-дефензин) могут иметь высокие значения в обоих случаях, следовательно, могут вводить в заблуждение. В 2019 г. опубликован систематический обзор исследований биомаркеров воспаления в диагностике ППИ у пациентов с артритами, в котором авторы показали, что, несмотря на высокую чувствительность многих сывороточных и синовиальных тестов, они имеют низкую специфичность [10]. Полученные результаты формируют представление о том, что часть пациентов с системными артритами после эндопротезирования имеют обострение основного процесса, но не ППИ. Такие данные свидетельствуют о недостаточной информативности дифференциально-диагностических признаков ППИ у пациентов с РА. Описанные в литературе случаи ППИ у пациентов с воспалительными артритами в своем большинстве ограничены малочисленной выборкой. В систематический обзор литературы, выполненный S.Z. Mirza et al., включено всего 90 случаев артритов после эндопротезирования, в том числе подтвержденная ППИ имела место всего в 26 случаях [10].
Малочисленность исследований по диагностике ППИ у пациентов с системными заболеваниями и отсутствие четких дифференциальных диагностических критериев отличия фазы обострения РА и инфекции в протезированном суставе вызвали интерес к анализу случаев ППИ у данной группы пациентов в условиях федерального травматолого-ортопедического центра.
Цель работы — оценить диагностические данные и результаты санирующего лечения периимплант-ной инфекции у пациентов с ревматоидным артритом на примере серии клинических случаев.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование основано на сплошном ретроспективном анализе случаев оперативного лечения пациентов по поводу ППИ за период 2014–2022 гг. по данным медицинской информационной системы (МИС) Федерального центра травматологии, ортопедии и эндопротезирования (Центр, Чебоксары).
Критерии включения пациентов в исследование: наличие РА в анамнезе, хирургическое лечение ППИ в объеме одно-, двух- или трехэтапного ревизионного эндопротезирования.
От всех лиц, включенных в исследование, получено информированное согласие на использование обезличенных данных электронной медицинской карты.
Всем пациентам проводили антибиотикотерапию внутривенно в течение двух недель после операции, затем перорально в течение 10 недель при одноэтапном реэндопротезировании и четырех недель на каждом этапе при двухэтапном или трехэтапном лечении.
Первичные клинические критерии оценки включали: анамнез, половозрастные характеристики, сведения о приеме антибактериальных препаратов на догоспитальном этапе, данные о локализации инфицированного сустава, клинических формах и сроках от верификации диагноза РА до даты первичного эндопротезирования сустава.
Лабораторные критерии включали: результаты микробиологического исследования пунктатов синовиальной жидкости (с подсчетом лейкоцитарного состава), тканевых образцов и смывов с металлических конструкций (после ультразвуковой обработки).
К мономикробной ППИ относили наличие одного патогена в исследуемых образцах, к полимикробной ППИ — выделение двух и более возбудителей; культуронегативной ППИ считали случаи с отсутствием роста возбудителя во всех образцах биоматериала.
В гематологических исследованиях оценивали скорость оседания эритроцитов (СОЭ) в крови, уровень С-реактивного белка (СРБ) в сыворотке и Д-димера в плазме. Данные исследования проводили на этапе диагностики ППИ и перед вторым этапом санирующего лечения.
Все случаи ППИ оценены с позиций критериев диагностики ППИ, принятых на Втором консенсусном совещании ICM ( англ .: International Consensus Meeting on Prosthetic Joint Infection) 2018 г. и включающих основные и второстепенные критерии [11] (табл. 1).
Таблица 1
Критерии диагностики ППИ второго консенсусного совещания по перипротезной инфекции (Филадельфия, США, ICM)
|
Основные критерии (минимум один из следующих) |
Решение |
|||
|
Два положительных результата роста одного и того же микроорганизма при использовании стандартных методов культивирования |
Есть инфекция |
|||
|
Свищ или видимое нагноение тканей вокруг протеза |
||||
|
Малые критерии |
Пороговые значения |
Баллы |
Решение |
|
|
острая |
хроническая |
|||
|
Сывороточный СРБ, мг/л или Д-димер, мкг/л |
100 |
10 |
2 |
6 и более — есть инфекция; от 4 до 5 — результат неопределенный; 3 и менее — нет инфекции |
|
неизвестно |
860 |
|||
|
СОЭ сыворотки крови, мм/час |
неважно |
30 |
1 |
|
|
Уровень количества синовиальных лейкоцитов, клеток/мкл |
10000 |
3000 |
3 |
|
|
Уровень полиморфно-ядерных нейтрофилов, % |
90 |
70 |
2 |
|
|
Позитивная культура в одном образце |
2 |
|||
|
Гистологически: воспаление перипротезной ткани (> 5 нейтрофилов в каждом из 5-ти полей зрения при 400-кратном увеличении) |
3 |
|||
|
Визуализация гнойного содержимого во время операции |
3 |
|||
В исследовании использована классификация перипротезной инфекции по W. Zimmerli [12] с дополнениями C. Li et al. [13].
Неблагоприятным исходом лечения считали наличие клинико-лабораторных признаков инфекции на момент поступления на второй этап лечения, а также появление признаков инфекции после завершенной успешной санации. При этом к рецидивам ППИ относили выделение того же возбудителя, что и при первом эпизоде ППИ, к реинфекции — выявление иного возбудителя.
Статистическая обработка данных . Полученные данные регистрировали в виде электронных таблиц, визуализацию структуры данных и их анализ проводили с помощью программы MS Office Excel, 2007 (Microsoft, США) и программы Graf Pad. Для описания количественных показателей выполняли проверку на нормальность распределения по критерию Колмогорова – Смирнова. При нормальном распределении для описания признака использовали его среднее значение и среднеквадратичное отклонение; при распределении, отличающемся от нормального, — медиану и верхний и нижний квартили Me (Q1–Q3); в обоих случаях применяли 95 % ДИ. Значимость различий при нормальном распределении оценивали по t-критерию Стьюдента, а при отсутствии нормального распределения — по непараметрическому критерию Манна – Уитни (m–u). Категориальные данные (пол, тип ППИ, исход) описывали условными кодами не измеряемых категорий, не подлежащих упорядочиванию.
РЕЗУЛЬТАТЫ
По данным МИС первичный объем выборки включал 524 случая ППИ, среди которых 35 случаев (6,7 %) составили пациенты с РА, отобранные в исследование. В данной группе преобладали женщины в возрасте 60 лет, отмечено равное соотношение числа пациентов работоспособного, пожилого и старческого возраста. К моменту первичного эндопротезирования пациенты имели позднюю стадию РА (рентгенологически подтвержденный артрит III–IV стадии) с преобладанием серопозитивной формы заболевания (табл. 2).
В большинстве случаев хроническая ПИИ носила гематогенный характер с преобладанием инфекции в коленных суставах. По данным анамнеза, в догоспитальном периоде принимали антибактериальные препараты около 50 % пациентов. Пациенты получали различную базисную терапию по поводу РА: 10 человек (28,6 %) — комбинацию цитостатиков с гормональными препаратами, 5 (14,3 %) — только гормональные препараты, 9 (25,7 %) — цитостатики, по 2 человека (по 5,7 %) — генно-инженерные препараты и сульфасалазин, 7 человек (20 %) — только нестероидные противовоспалительные препараты. Средний срок наблюдения после проведенного ревизионного эндопротезирования составил 4,5 года.
Таблица 2
Общие характеристики группы исследования
|
Характеристики |
Показатели |
|||
|
Средний возраст, годы |
60,2 ± 10,3 |
|||
|
Средний срок от верификации диагноза РА к моменту первичного эндопротезирования, годы |
21,6 ± 9,9 |
|||
|
Средний срок наблюдения после санации, мес. |
53,2 ± 31,7 |
|||
|
абс. |
% |
|||
|
Пол |
Женщины |
30 |
86 |
|
|
Мужчины |
5 |
14 |
||
|
Возраст, годы |
Молодой возраст (18–44) |
3 |
8,5 |
|
|
Средний возраст (45–59) |
15 |
42,9 |
||
|
Пожилой возраст (60–74) |
15 |
42,9 |
||
|
Старческий возраст (75–89) |
2 |
5,7 |
||
|
Клинические формы РА |
Серопозитивный |
24 |
68,6 |
|
|
Серонегативный |
7 |
20,0 |
||
|
Ювенильный |
4 |
11,4 |
||
|
Локализация ППИ |
Коленный сустав |
26 |
74,3 |
|
|
Тазобедренный сустав |
8 |
22,8 |
||
|
Проксимальный пястно-фаланговый сустав |
1 |
2,9 |
||
|
Получали антибиотикотерапию на догоспитальном этапе, чел. |
17 |
48,6 |
||
|
Классификация перипротезной инфекции по W. Zimmerli [12] с дополнениями C. Li et al. [13] |
Послеоперационная (< 90 сут. после операции) |
острая |
5 |
14,3 |
|
хроническая |
0 |
0 |
||
|
Гематогенная (> 90 суток после операции) |
острая |
0 |
0 |
|
|
хроническая |
30 |
85,7 |
||
Согласно критериям диагностики ICM (2018), диагноз ППИ подтвержден в 85,7 % случаев ( n = 30): свищевой ход, сообщающийся с полостью эндопротеза — в 13 случаях (37,2 %), положительный культуральный рост минимум в двух исследуемых биологических образцах — в 6 случаях (17,1 %), наличие 6 и > баллов (есть инфекция) по малым критериям ППИ — в 11 случаях (31,4 %). В остальных 5 случаях (14,3 %) данные за диагноз ППИ были неубедительными или не соответствовали критериям диагностики инфекционного процесса.
Ведущая роль этиологии ППИ принадлежала культуронегативной инфекции, на втором месте — коагулазонегативные стафилококки (CoNs), одновременно превалировавшие в структуре мономикробной инфекции; на третьем — золотистый стафилококк (рис. 1).
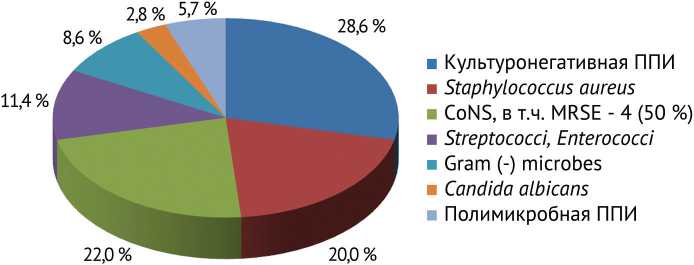
Рис. 1. Микробиологическая структура ППИ по результатам исследования пунктата синовиальной жидкости у пациентов с РА
В структуре грамотрицательных возбудителей отмечены Proteus mirabilis, Escherichia coli, Burkholderia cepacia . Микробные ассоциации представлены сочетаниями MRSE с Enterococcus faecalis и Enterococcus faecalis с Corynebacterium spp .
Среди исследуемых биологических материалов максимальное число положительных посевов ( n = 25, 71,4 %) получено в пунктате синовиальной жидкости, взятом до операции. Среди интраоперационных тканевых биоптатов положительная культура получена в 20 случаях (57,1 %), в аспирате с удаленных имплантов — в 17 случаях (48,6 %). Перед вторым этапом лечения в исследуемых биологических материалах в одном случае выявлен рост MRSE.
Все случаи ППИ пролечены хирургическим методом путем санации в сочетании с антибактериальной терапией. Одноэтапная санация с заменой вкладыша и головки эндопротеза выполнена у 4 пациентов (11,4 %); в других случаях проведена двух- и трехэтапная санация ( n = 31, 88,6 %): артикулирующий спейсер установлен у 26 (83,9 %), статический — у 5 пациентов (16,1 %).
Среди маркеров воспаления в крови СОЭ, СРБ и Д-димер показывали высокие средние значения как до санации, так и после нее, у всех пациентов, санированных в два этапа (табл. 3).
Таблица 3
Результаты лабораторных исследований пациентов с РА
|
Показатели |
До санации, n = 35 |
Перед вторым этапом санации, n = 28* |
P < 0,05 |
|
Кровь |
|||
|
СОЭ, мм/час |
45,5 (34,4–56,6) |
26,0 (16,0–36,0) |
0,0047** |
|
СРБ, мг/мл |
34,6 (22,3–46,9) |
8,2 (4,0–10,4)** |
0,4422 |
|
Д-Димер, нг/мл |
1670 (1067,9–2272,1) |
1749,5 (1161,7–2337,3) |
0,9325 |
|
Синовиальная жидкость |
|||
|
Первая проба |
|||
|
Лейкоциты, кл/мкл |
9000,0 (1905,0–18495,0)** |
320,0 (82,0–825,0)** |
0,0017* |
|
Нейтрофилы, % |
88,0 (81,4–94,6) |
63,0 (1,5–94,5) |
0,0705 |
|
Вторая проба |
|||
|
Лейкоциты, кл/мкл |
4687,0 (1450,0–9100,0)** |
180,0 (45,0–450,0)** |
0,0038*** |
|
Нейтрофилы, % |
87,0 (75,0–93,0)** |
45,0 (22,0–80,0)** |
0,1760 |
|
Третья проба |
|||
|
Лейкоциты, кл/мкл |
1355,0 (85,0–8150,0)** |
130,0 (35,0–225,0)** |
0,2637 |
|
Нейтрофилы, % |
76,0 (62,0–90,0)** |
– |
– |
Примечание : * — исключены пациенты, пролеченные одноэтапным методом ( n = 4), и пациенты с установленным спейсером ( n = 3) без последующей санации; ** — Me (Q1–Q3); *** — m–u
В динамике после санации отмечено снижение уровня всех воспалительных маркеров, однако только изменения СОЭ в крови и содержание лейкоцитов в синовиальной жидкости были статистически значимыми.
В большинстве случаев (82,9 %) лечения ППИ у пациентов с РА на среднем сроке наблюдения после санации 53,2 ± 31,7 месяца получены благоприятные результаты (табл. 4).
Таблица 4
Исходы лечения ППИ
|
Неблагоприятные, n = 6 (17,1 %) |
Благоприятные, n = 29 (82,9 %) |
|
Рецидив ППИ*, n = 2 (33,3 %) |
Реэндопротезирование**, n = 23 (79,4 %) |
|
3-этапное лечение*, n = 4 (66,7 %) |
Артродез**, n = 3 (10,3 %) |
|
Жизнь со спейсером**, n = 3 (10,3 %) |
Примечание : * — из числа неблагоприятных исходов; ** — из числа благоприятных исходов.
Среди неблагоприятных исходов в одном случае после первично обусловленной стафилококковой ППИ развилась реинфекция, вызванная микробной ассоциацией ( Acinetobacter baumannii, Enterococcus faecalis, Streptococcus mitis ). Во втором случае произошел рецидив ППИ, вызванный той же стрептококковой инфекцией. В остальных четырех случаях пациенты оперированы методом трехэтапной санации (ввиду сохраняющихся высоких цифр маркеров воспаления после второго этапа санации и неудовлетворительного состояния костной ткани, по мнению оперирующего хирурга), в том числе у одного пациента вновь выделен MRSE. Конечным результатом трехэтапной санации у данных пациентов в качестве завершающего этапа лечения явились артродез ( n = 1) и реэндопротез ( n = 2) (четвертый этап), один пациент продолжает жизнь со спейсером.
Среди благоприятных исходов каждый пятый пациент вынужден жить со спейсером или с обездвиженным в результате артродеза суставом; кроме того, в 16,1 % случаев на первом этапе санации использованы статические спейсеры, также ограничивающие подвижность в суставе.
ОБСУЖДЕНИЕ
Изучение особенностей течения перипротезной инфекции у пациентов с ревматоидным артритом интересно тем, что клиника обострения системных заболеваний может имитировать перипротезную инфекцию (поскольку имеет идентичные симптомы в виде боли в суставах, отека околосуставных тканей, лихорадки, повышения уровня СОЭ и СРБ в крови, лейкоцитов в синовиальной жидкости).
Доля пациентов с ревматоидным артритом среди всех случаев перипротезной инфекции, по данным разных авторов, составляет от 4,5 до 13,3 % [14–16], что согласуется с нашими данными (6,7 %).
В работах P.H. Hsieh et al. [14] и E.F. Berbari et al. [17] в качестве ведущего возбудителя в развитии пе-рипротезной инфекции у пациентов с ревматоидным артритом определен золотистый стафилококк, однако мы не смогли подтвердить эти данные. В нашем исследовании лидировала культуронегативная инфекция. В структуре культуропозитивной инфекции ведущую роль играли коагулазонегативные стафилококки, являющиеся условно-патогенными возбудителями и способные вызвать инфекцию (и формировать биопленки) на фоне снижения иммунного статуса организма у пациентов с ревматоидным артритом. Ряд исследований зарубежных авторов подтверждает смену ведущей роли золотистого стафилококка на коагулазонегативные штаммы в этиологии ППИ. В исследовании, опубликованном F.S. Fröschen et al., коагулазонегативные стафилококки обнаружены в 44,61 %; золотистый стафилококк — в 14,31 % случаев [18], по данным D.B.G. Tai et al. — в 37 и 24 % соответственно [19].
Среди редко встречающихся и трудноизлечимых возбудителей (DTT) в одном случае выделена Candida albicans , и это единственный случай, наблюдаемый в нашей практике.
В большинстве случаев хроническая ПИИ в нашем исследовании носила гематогенный характер, что, вероятно, обусловлено наличием очагов хронической инфекции и сниженным иммунитетом у пациентов с РА. Являясь сапрофитом, колонизирующим кожу и слизистые оболочки, Candida albicans спровоцировала развитие ППИ у пациента с ревматоидным артритом на фоне приема иммунодепрессантов и антибиотиков [20]. Таким образом, при подозрении на перипротезную инфекцию у пациентов с ревматоидным артритом следует проводить бактериологическое исследование с расширением спектра выявляемых возбудителей, в том числе грибов и кислотоустойчивых бацилл, особенно, если другие традиционные патогены не идентифицированы с помощью рутинных культуральных исследований.
По частоте выделения культуронегативной перипротезной инфекции (28,6 %) мы получили результаты, схожие с исследованиями P. Sculco et al., — 27 % [15], тогда как в работе J.C. Schrama et al. этот показатель еще выше — 37 % [21]. Отсутствие роста патогенов в исследуемых биологических материалах авторы связывают с приемом антибактериальных препаратов на догоспитальном этапе, что подтверждаем и мы, поскольку почти половина исследуемых нами пациентов получала антибиотики до верификации диагноза перипротезной инфекции. Влияние приема антибактериальных препаратов на результаты бактериологического исследования показано нами в других исследованиях [22]. Эта группа пациентов, на наш взгляд, является наиболее проблематичной для верификации диагноза перипротезной инфекции. При отсутствии свищевого хода, сообщающегося с полостью сустава, есть опасность ложно диагностировать инфекционный процесс, ориентируясь на показатели маркеров воспаления, которые могут иметь высокие значения на фоне системного воспаления.
В нашем исследовании 14,3 % случаев лечения ППИ у пациентов с ревматоидным артритом не соответствовали критериям ICM (2018), вместе с тем, эти пациенты хирургически пролечены по поводу перипротезной инфекции. В других научных работах данная цифра еще выше: так, анализ 36 случаев перипротезной инфекции у пациентов с артритами на фоне системных воспалительных заболеваний, проведенный P. Sculco et al., выявил отсутствие роста микробиологической культуры у 10 пациентов, из которых в 50 % ( n = 5) инфекция не соответствовала критериям MSIS [15, 23]. Зарубежные исследователи в сомнительных случаях предлагают использовать тест-полоски на лейкоцитарную эстеразу, которые в отношении перипротезной инфекции (в том числе у пациентов с ревматоидным артритом) обладают чувствительностью 80,6 % и специфичностью 100 % [24–26].
В Центре данный метод исследования не используют, поскольку мы более информативным считаем дифференциальный подсчет клеточного состава синовиальной жидкости. В систематическом обзоре литературы о биомаркерах синовиальной жидкости для диагностики перипротезной инфекции у пациентов с воспалительными артритами подтверждается, что процент палочкоядерных нейтрофилов имеет самую высокую чувствительность (95,2 %) и специфичность (85,0 %) с достаточным для верификации инфекции оптимальным порогом 78 % [10]. Мы считаем, что в качестве прогностических признаков эффективности санации перед вторым этапом ревизионного эндопротезирования целесообразно ориентироваться на содержание в синовиальной жидкости лейкоцитов (не более 2000 кл/мкл) и палочкоядерных нейтрофилов (не более 70 %).
Наше исследование показало, что благоприятный исход лечения перипротезной инфекции в виде эра-дикации инфекции на фоне ревматоидного артрита достигается в большинстве случаев, однако пятая часть пациентов этой группы, которым установлены статические спейсеры или выполнен артродез, в последующем имеет ограничения движения в оперированных суставах, что существенно снижает качество жизни. Применение данных методов лечения обусловлено наличием больших костных дефектов и хрупкой структуры кости на фоне остеопороза, связанного с длительным приемом кортикостероидов.
Все выявленные нами неблагоприятные исходы получены в результате двух- или трехэтапного хирургического лечения. Напротив, E.F. Berbari et al. в своем исследовании получили лучшие исходы в результате двухэтапной санации, выявив пятилетний безрецидивный период в 79 % случаев (95 % ДИ, 66–93 %) [17]. Двухэтапная санация, по данным авторов, выполнена только в 19 % случаев инфицирования протезированных суставов, в нашем же случае этот показатель составил 88,6 % случаев.
Ограничением нашего исследования является отсутствие разделения пациентов с острой и хронической перипротезной инфекцией при оценке лабораторных данных ввиду малой выборки. Исследование носило ретроспективный характер, что не позволило нам использовать гистологический метод исследования тканей для диагностики инфекции. С целью оценки данных группы больных ревматоидным артритом с предположительной перипротезной инфекцией в случае неприменимости международных диагностических критериев необходимо провести расширенное проспективное исследование на большой выборке.
ЗАКЛЮЧЕНИЕ
Диагностика перипротезной инфекции у пациентов с ревматоидным артритом и другими системными заболеваниями остается нерешенной проблемой. В 82,9 % случаев нами достигнуты благоприятные исходы хирургического лечения, в большинстве случаев двухэтапного. Культуронегативная инфекция заняла лидирующие позиции (38,4 %) среди выявленных случаев перипротезной инфекции. Лабораторные маркеры воспаления в крови (СОЭ, СРБ и Д-димер) на этапах диагностики и санации инфекции не достигали нормальных значений, что свидетельствует о неприменимости стандартных диагностических критериев у пациентов с ревматоидным артритом.
Учитывая первично-воспалительный фон, свойственный пациентам с ревматоидным артритом вследствие сниженной реактивности организма, и выявленные случаи несоответствия диагностических показателей международным критериям перипротезной инфекции, целесообразно провести проспективное исследование на большей когорте пациентов с использованием дополнительно гистологического анализа интраоперационных тканей.
Список литературы Периимплантная инфекция у пациентов с ревматоидным артритом на примере серии случаев
- Kapetanovic MC, Lindqvist E, Saxne T, Eberhardt K. Orthopaedic surgery in patients with rheumatoid arthritis over 20 years: prevalence and predictive factors of large joint replacement. Ann Rheum Dis. 2008;67(10):1412-1416. doi: 10.1136/ard.2007.086710
- Berbari EF, Hanssen AD, Duffy MC, Steckelberg JM, Ilstrup DM, Harmsen WS, Osmon DR. Risk factors for prosthetic joint infection: case-control study. Clin Infect Dis. 1998;27(5):1247-1254. doi: 10.1086/514991
- Jamsen E, Virta LJ, Hakala M, et al. The decline in joint replacement surgery in rheumatoid arthritis is associated with a concomitant increase in the intensity of anti-rheumatic therapy: a nationwide register-based study from 1995 through 2010. Acta Orthop. 2013;84(4):331-337. doi: 10.3109/17453674.2013.810519
- Хлабошина В.Н., Амирджанова В.Н. Генно-инженерные биологические препараты при эндопротезировании суставов у больных ревматоидным артритом. Современная ревматология. 2014;8(4):72-75. doi: 10.14412/19967012-2014-4-72-75
- Gabriel SE, Michaud K. Epidemiological studies in incidence, prevalence, mortality, and comorbidity of the rheumatic diseases. Arthritis Res Ther. 2009;11(3):229. doi: 10.1186/ar2669
- Bongartz T, Halligan CS, Osmon DR, et al. Incidence and risk factors of prosthetic joint infection after total hip or knee replacement in patients with rheumatoid arthritis. Arthritis Rheum. 2008;59(12):1713-1720. doi: 10.1002/art.24060
- Berbari EF, Hanssen AD, Duffy MC, et al. Risk factors for prosthetic joint infection: case-control study. Clin Infect Dis. 1998;27(5):1247-1254. doi: 10.1086/514991
- Jamsen E, Huhtala H, Puolakka T, Moilanen T. Risk factors for infection after knee arthroplasty. A register-based analysis of43,149 cases. J Bone Joint Surg Am. 2009;91(1):38-47. doi: 10.2106/JBJS.G.01686
- Doran MF, Crowson CS, Pond GR, et al. Frequency of infection in patients with rheumatoid arthritis compared with controls: a population-based study. Arthritis Rheum. 2002;46(9):2287-2293. doi: 10.1002/art.10524
- Mirza SZ, Richardson SS, Kahlenberg CA, et al. Diagnosing Prosthetic Joint Infections in Patients With Inflammatory Arthritis: A Systematic Literature Review. J Arthroplasty. 2019;34(5):1032-1036.e2. doi: 10.1016/j.arth.2019.01.051
- Parvizi J, Tan TL, Goswami K, et al. The 2018 Definition of Periprosthetic Hip and Knee Infection: An Evidence-Based and Validated Criteria. J Arthroplasty. 2018;33(5):1309-1314.e2. doi: 10.1016/j.arth.2018.02.078
- Zimmerli W. Clinical presentation and treatment of orthopaedic implant-associated infection. J Intern Med. 2014;276(2):111-119. doi: 10.1111/joim.12233
- Li C, Renz N, Trampuz A. Management of Periprosthetic Joint Infection. Hip Pelvis. 2018;30(3):138-146. doi: 10.5371/ hp.2018.30.3.138
- Hsieh PH, Huang KC, Shih HN. Prosthetic joint infection in patients with rheumatoid arthritis: an outcome analysis compared with controls. PLoSOne. 2013;8(8):e71666. doi: 10.1371/journal.pone.0071666
- Sculco P, Kapadia M, Moezinia CJ, et al. Clinical and Histological Features of Prosthetic Joint Infections May Differ in Patients With Inflammatory Arthritis and Osteoarthritis. HSS J. 2023;19(2):146-153. doi: 10.1177/15563316231153395
- Singh N, Nair R, Goto M, et al. Risk of Recurrent Staphylococcus aureus Prosthetic Joint Infection in Rheumatoid Arthritis Patients-A Nationwide Cohort Study. Open Forum InfectDis. 2019;6(11):ofz451. doi: 10.1093/ofid/ofz451
- Berbari EF, Osmon DR, Duffy MC, et al. Outcome of prosthetic joint infection in patients with rheumatoid arthritis: the impact of medical and surgical therapy in 200 episodes. Clin Infect Dis. 2006;42(2):216-223. doi: 10.1086/498507
- Fröschen FS, Randau TM, Franz A, et al. Microbiological Profiles of Patients with Periprosthetic Joint Infection of the Hip or Knee. Diagnostics (Basel). 2022;12(7):1654. doi: 10.3390/diagnostics12071654
- Tai DBG, Patel R, Abdel MP, et alJ. Microbiology of hip and knee periprosthetic joint infections: a database study. Clin Microbiol Infect. 2022;28(2):255-259. doi: 10.1016/j.cmi.2021.06.006
- Малюченко Л.И., Николаев Н.С., Любимова Л.В. и др. Случай лечения грибковой перипротезной инфекции с применением имплантата с углеродным покрытием. Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье. 2022;12(6):119-126. doi: 10.20340/vmi-rvz.2022.6.CASE.1
- Schrama JC, Lutro O, Langvatn H, et al. Bacterial findings in infected hip joint replacements in patients with rheumatoid arthritis and osteoarthritis: a study of 318 revisions for infection reported to the norwegian arthroplasty register. ISRNOrthop. 2012;2012:437675. doi: 10.5402/2012/437675
- Любимова Л.В., Божкова С.А., Пчелова Н.Н. и др. Роль культуронегативной инфекции в структуре инфекционных осложнений после эндопротезирования коленных суставов. Гений ортопедии. 2023;29(4):402-409. doi: 10.18019/1028-4427-2023-29-4-402-409
- Parvizi J, Zmistowski B, Berbari EF, et al. New definition for periprosthetic joint infection: from the Workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res. 2011;469(11):2992-2994. doi: 10.1007/s11999-011-2102-9
- Yeganeh MH, Kheir MM, Shahi A, Parvizi J. Rheumatoid Arthritis, Disease Modifying Agents, and Periprosthetic Joint Infection: What Does a Joint Surgeon Need to Know? J Arthroplasty. 2018;33(4):1258-1264. doi: 10.1016/j. arth.2017.11.031
- Parvizi J, Jacovides C, Antoci V, Ghanem E. Diagnosis of periprosthetic joint infection: the utility of a simple yet unappreciated enzyme. J Bone Joint Surg Am. 2011;93(24):2242-2248. doi: 10.2106/JBJS.J.01413
- Tischler EH, Cavanaugh PK, Parvizi J. Leukocyte esterase strip test: matched for musculoskeletal infection society criteria. J Bone Joint Surg Am. 2014;96(22):1917-1920. doi: 10.2106/JBJS.M.01591


