Периоперационная диагностика повреждений лучевого нерва при закрытых диафизарных переломах плечевой кости и оценка целесообразности его ревизии
Автор: Боголюбский Ю.А., Файн А.М., Мажорова И.И., Ваза А.Ю., Трофимова Е.Ю.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 3 (33), 2018 года.
Бесплатный доступ
Проблема повреждений лучевого нерва при диафизарных переломах плечевой кости сохраняет свою актуальность. эти осложнения встречаются достаточно часто и характеризуются длительным периодом лечения и значительным количеством неудовлетворительных исходов. Подход к диагностике и лечению таких повреждений неоднозначен, одним из дискутируемых вопросов является целесообразность первичной ревизии лучевого нерва.Цель работы - обоснование применения ультразвукового метода для периоперационной диагностики повреждений лучевого нерва при переломах диафиза плечевой кости в ранние сроки после травмы и определение показаний к ревизии поврежденного лучевого нерва при выполнении остеосинтеза.Пациентам с переломами плечевой кости, осложненными травматическим повреждением лучевого нерва, в периоперационном периоде выполняли ультразвуковое исследование лучевого нерва. Обследовано 43 пациента. Оценивали непрерывность нерва, его взаимоотношение с костными отломками и элементами металлоконструкций. На основании полученных данных принимали решение о целесообразности ревизии лучевого нерва при выполнении остеосинтеза. Результаты визуализации лучевого нерва при УЗИ совпадали с интраоперационными находками.Сделаны выводы о целесообразности выполнения ультразвукового исследования в ранние сроки после травмы, задачах, сроках и технике исследования.
Перелом диафиза плечевой кости, травматическая нейропатия лучевого нерва, ультразвуковое исследование, ревизия лучевого нерва
Короткий адрес: https://sciup.org/142221761
IDR: 142221761 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2018.3.15-22
Текст научной статьи Периоперационная диагностика повреждений лучевого нерва при закрытых диафизарных переломах плечевой кости и оценка целесообразности его ревизии
Первичная травматическая нейропатия лучевого нерва – частое осложнение переломов диафиза плечевой кости, встречающееся, по данным разных авторов, в 3,1-18,8% случаев [1,2].
Частота вторичных травматических нейропатий, возникающих на фоне лечения, составляет 3,6-19,2% [2,3]. Для травматических повреждений лучевого нерва характерны длительные сроки сохранения двигательных и чувствительных расстройств и значительное количество неудовлетворительных результатов лечения – до 22% [1,2,3].
Диагностические задачи при таких повреждениях сводятся к оценке состояния лучевого нерва в остром периоде травмы и к контролю состояния нерва в процессе лечения.
Диагностика анатомического и функционального состояния лучевого нерва в ранние сроки после повреждения дает основания для выбора тактики и метода лечения травматической нейропатии. Клинический метод позволяет установить факт повреждения нерва, но не дает представления о характере нейропатии. Поскольку выполнение электронейромиографии (ЭНМГ), дающей возможность судить о функциональном состоянии нерва, в ранние сроки после повреждения малоинформативно, максимальную ценность представляет метод визуальной диагностики [2,4]. Наибольшее распространение в этом качестве получило ультразвуковое исследование (УЗИ). Преимуществами метода являются неинвазивность, относительная простота, возможность повторных исследований в динамике, низкая стоимость исследования. К недостаткам можно отнести значительную степень субъективности в интерпретации полученных данных.
В доступной литературе, как российской, так и зарубежной, обсуждается в основном применение УЗИ на этапах реабилитации, в качестве метода контроля восстановления поврежденного нерва [2,3,5,6,7]. Между тем, именно в остром периоде травмы, визуализация лучевого нерва позволила бы получить диагностические данные, на основании которых определяется тактика лечения травматической нейропатии.
Одним из краеугольных камней в вопросах тактики лечения травматических повреждений периферических нервов, является вопрос о необходимости ревизии нерва в ранние сроки после травмы.
Ряд исследователей предлагает обязательно выполнять ревизию лучевого нерва при диагностированной травматической нейропатии, даже в том случае, когда оперативная техника остеосинтеза не требует его выделения [8,9]. Мотивом ревизии является возможное повреждение нерва, требующее его восстановления оперативным путем. В то же время, ревизия лучевого нерва сама по себе достаточно травматична для нервного ствола. При остеосинтезе плечевой кости пластиной с выделением лучевого нерва, частота ятрогенных нейропатий, по данным некоторых авторов, составляет от 5,1 до 29% [8,10,11]. Наличие на этапе планирования операции убедительных данных о целостности нерва и отсутствии продолжающегося травмирующего воздействия костных отломков могло бы избавить пациентов от ненужных ревизий лучевого нерва.
Цель работы – уточнить возможности и особенности применения ультразвукового метода для периоперационной диагностики повреждений лучевого нерва при переломах диафиза плечевой кости в ранние сроки после травмы и определить показания к ревизии поврежденного лучевого нерва при выполнении остеосинтеза.
Материал и методы
За период 2013-2017 гг. в НИИСП им. Н.В. Склифосовского оперировали 43 пациентов с указанной патологией (из них 22 мужчины и 21 женщина). Средний возраст пациентов составил 42,5 лет (min 18.0, max 89.0; М 36; СО 18,9; 95%ДИ 36,9-48,3).
Причины травмы – падение на ровной поверхности или с высоты до 1 метра – 20 человек, ДТП – 11 человек, спортивные травмы (велосипед, армрестлинг) – 8 человек, падение с высоты более 1 м – 4 человека. Таким образом, для переломов плечевой кости, осложненных нейропатией лучевого нерва, характерен как высокоэнергетический (ДТП, кататравма – 34,9%), так и низкоэнергетический (65,1%) характер травмы.
В одном случае перелом был открытый (1 тип по Gustillo-Anderson), в остальных случаях повреждения носили закрытый характер. Все переломы, за исключением одного случая, были локализованы в средней и нижней третях плеча. По классификации АО к типу А переломы относились у 28 пациентов (65,1%), к типу В – у 6 (14,0%) и к типу С - у 9 (20,9%). У 19 пациентов был выполнен остеосинтез плечевой кости блокированным штифтом, а у 24 пациентов – пластиной. У 38 пациентов была первичная травматическая нейропатия лучевого нерва, у одного пациента нейропатия развилась на пятые сутки после травмы, у четырех нейропатия являлась осложнением оперативного лечения (в двух случаях после остеосинтеза пластиной, в одном – после остеосинтеза блокированным штифтом, в одном случае – в результате компрессии проволочным серкляжем). Первичное исследование выполняли в срок от 1 до 18 суток со дня травмы (от 1 до 6 суток после поступления в стационар). При этом у 37 пациентов (86,0%) первичное исследование было выполнено в течение первых двух суток после поступления в стационар. Повторные УЗИ выполняли в послеоперационном периоде на 2-7 сутки после операции, а также в динамике в сроки от 1 до 6 месяцев. Всего было выполнено 76 исследований (без учета исследований неповрежденных конечностей).
Обследование пациентов проводили на ультразвуковых сканерах Esaote MyLab 70 линейным датчиком диапазоном частот сканирования 5-10 МГц и Esaote MyLab Class C линейным датчиком с частотой сканирования 5-13 МГц и конвексным датчиком 1-8 МГц. Для визуализации использовали режим серой шкалы (В-режим), цветовое (ЦДК) и энергетическое допплеровское (ЭД) сканирование.
Оценивали непрерывность ствола нерва, его взаимоотношение с костными отломками и элементами металлоконструкций (при исследовании в послеоперационном периоде).
Структуру нерва исследовали по стандартной методике в режиме серой шкалы с определением размеров, формы, эхогенности и эхоструктуры. При оценке структуры нервного ствола принимали во внимание такие характеристики, как четкость контуров ствола и оболочек, наличие и качество дифференцировки на пучки. В режимах ЦДК и ЭД оценивали наличие кровотока в структуре нерва и в окружающих тканях. Лучевой нерв сканировали в двух взаимно перпендикулярных плоскостях (продольное и поперечное сканирование).
На поврежденной конечности лучевой нерв исследовали на уровне повреждения, а также на проксимальном и дистальном участках сегмента. Для сравнения, при первичном исследовании оценивали лучевой нерв на неповрежденной конечности.
Как при первичном, так и при повторных исследованиях, кроме состояния собственно лучевого нерва, оценивали также мягкие ткани поврежденного сегмента: наличие отека, гематом и их возможное влияние на нерв, а также повреждение мышц.
Исследование проводили в положении пациента сидя, с согнутой под углом 90° в локтевом суставе рукой, при этом под предплечье подкладывали подушку для придания руке устойчивого положения. Как показала практика, при наличии должного контакта с пациентом и стабильном положении руки во время сканирования, болевые ощущения не возникали или были минимальными.
Для оценки чувствительности и движений использовали балльные шкалы H. Seddon, O. Nickolson в модификации К.А. Григоровича и С.П. Галича, где оценкам чувствительности S0 и движений М0 соответствуют анестезия и паралич, а S5 и М5 – нормальные чувствительность и двигательная функция.
Результаты и обсуждение
У 39 пациентов первичное обследование было выполнено в ранние сроки (до 10 суток с момента травмы). Посттравматический отек и гематома мягких тканей поврежденного сегмента, нарастающие до максимума на 3-4 сутки после травмы, затрудняли исследование, однако, лишь в трех случаях сделали визуализацию нерва невозможной (Рис. 1). Этим пациентам УЗИ было выполнено повторно, после уменьшения отека.
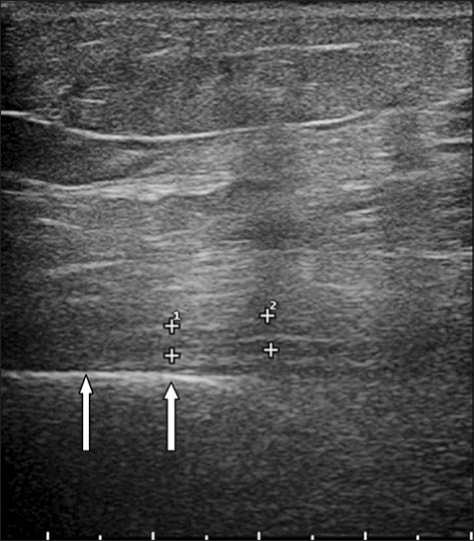
Рис. 1. Эхограмма, продольное сканирование. Лучевой нерв (++) визуализируется на фоне отека мягких тканей. Определяется непрерывность нервного ствола, взаимоотношения с плечевой костью ( ↑ ).
При исследованиях на ранних сроках после травмы были выявлены следующие закономерности.
С учетом повторных УЗИ у пациентов с выраженным отеком мягких тканей, признаки повреждения лучевого нерва были выявлены во всех случаях.
При этом полное повреждение нервного ствола было выявлено только в одном случае (2,3%) у пациента с высокоэнергетическим механизмом травмы (ДТП). При первичном УЗИ был выявлен перерыв лучевого нерва на уровне перелома плечевой кости, что было подтверждено интраоперационно. Пациенту выполнили открытый остеосинтез блокируемым штифтом, пластику лучевого нерва аутотрансплантатом из его мышечной ветви.
У остальных пациентов повреждение нерва расценивали как частичный аксонотмезис или нейропраксию.
Уровень повреждения нерва (зона максимальных изменений эхогенности и эхоструктуры) соответствовал уровню перелома плечевой кости у 42 из 43 пациентов (97,7%). Только в одном случае, при переломе верхней трети диафиза плечевой кости, локус повреждения лучевого нерва находился дистальнее, на уровне входа в спиральный канал, и повреждение было расценено нами как тракционное.
Визуализация лучевого нерва в верхней трети плеча при исследованиях, выполняемых в ранние сроки после травмы, затруднена, так как в процессе сканирования необходимо менять положение руки. Это вызывает боль в области перелома и может привести к вторичному смещению отломков. Поэтому при первичном исследовании мы осматривали лучевой нерв от уровня бифуркации до границы верхней и средней третей плеча. При повторных исследованиях, после выполнения остеосинтеза плечевой кости и уменьшения послеоперационного болевого синдрома, исследование выполняли на всем протяжении лучевого нерва на уровне плеча.
Состояние осевых цилиндров на протяжении нерва при исследовании в срок до 3 суток после повреждения, в силу незавершенности Валлеровской дегенерации, достоверно оценить не представлялось возможным. Отмечали нарушение дифференцировки интраневральных пучков, что может свидетельствовать о развивающемся распаде осевых цилиндров, у 33 из 37 пациентов (89,2%).
Во всех случаях отмечали снижение эхогенности нерва, что соответствует отеку нервного ствола. Максимальное снижение эхогенности отмечали в области предполагаемого повреждения нерва, однако, изменения распространялись и по ходу нервного ствола, в основном, дистальнее уровня повреждения (Рис. 2).
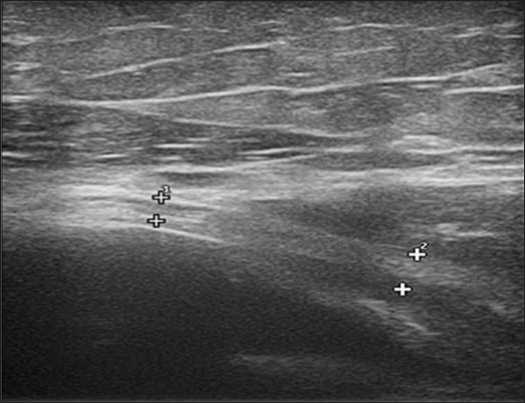
Рис. 2. Эхограмма, продольное сканирование. Изменение структуры лучевого нерва (++): нарушение дифференцировки на пучки, нечеткие контуры ствола, утолщение отдельных пучков. Нерв проходит в гематоме (1), прилежит к отломку плечевой кости (2) без признаков компрессии и натяжения.
Взаимоотношение лучевого нерва с костными отломками оценивали при каждом исследовании.
В тех случаях, когда непосредственного контакта нерва и костных отломков не было, нейропатию расценивали как тракционную. При этом отмечали снижение эхогенности ткани и утолщение нерва на значительном (до 14,2 см) протяжении. В этих случаях ревизию лучевого нерва выполняли, только если ее необходимость диктовалась хирургическим доступом к плечевой кости.
Клинический пример1. Больной В., 41 года, в результате падения на плоскости получил закрытый перелом правой плечевой кости (Рис. 3), осложненный первичной травматической нейропатией лучевого нерва (S 0-1, М 0-1).
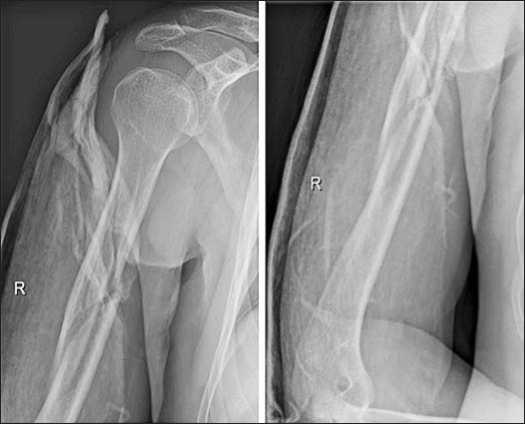
Рис. 3. Первичные рентгенограммы. Определяется закрытый оскольчатый перелом диафиза правой плечевой кости в средней трети со смещением отломков (АО 12-В1)
По результатам выполненного в предоперационном периоде УЗИ (Рис. 4) было принято решение о выполнении операции остеосинтеза по закрытой методике, без ревизии лучевого нерва.
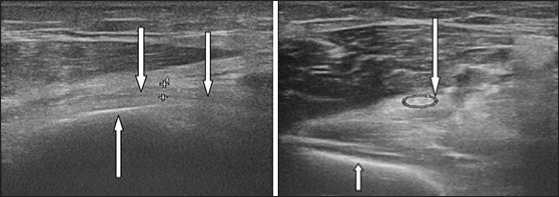
Рис.4. Эхограммы, продольное и поперечное сканирование. Выявлена анатомическая целостность нерва, признаки нейропатии на уровне перелома плечевой кости. Нерв ( ↓ ) располагался над костными отломками ( ↑ ), признаки сдавления или натяжения отсутствовали.
Выполнили закрытый остеосинтез плечевой кости блокируемым штифтом (Рис. 5).
При контрольном УЗИ также не было выявлено неблагоприятного воздействия костных отломков на лучевой нерв. В последующем на фоне проводимой терапии отметили восстановление чувствительности до уровня S4 через 6 недель, разгибание кисти до уровня M4 и отведение 1 пальца до уровня М2 через 7 недель.
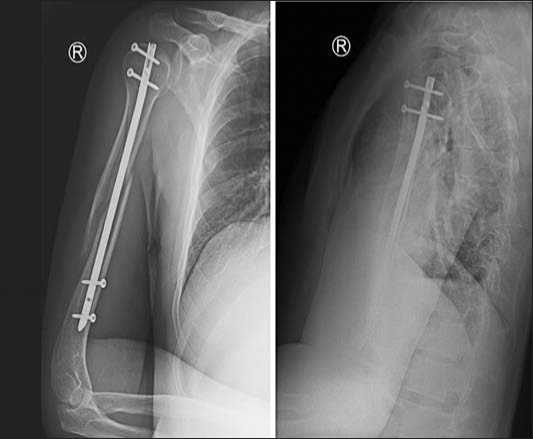
Рис.унок 5. Рентгенограммы после остеосинтеза плечевой кости блокированным штифтом.
Выявление во время первичного исследования тесного прилежания нерва к одному из основных отломков и ангуляции на этом уровне, а также снижения эхогенности нерва и уменьшения его поперечного размера, расценивали как компрессию и натяжение нервного ствола. Такие изменения были выявлены у 6 пациентов (14,0%) В двух из этих случаев перед оперативным вмешательством была выполнена закрытая репозиция отломков под УЗ-контролем положения нерва, что дало возможность устранить компрессирующее и тракционное воздействие.
Клинический пример 2. Больная С., 25 лет, при занятиях спортом получила закрытый перелом правой плечевой кости (Рис. 6), сопровождающийся первичной травматической нейропатией лучевого нерва (S0-1, M0).
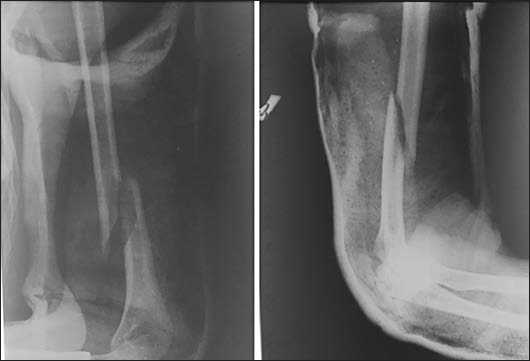
Рис. 6. Первичные рентгенограммы пациентки с винтообразным переломом нижней трети диафиза правой плечевой кости (АО 12-А1).
При первичном УЗИ были выявлены признаки натяжения и компрессии ствола лучевого нерва дистальным отломком плечевой кости. На этом же уровне отмечались характерные изменения структуры нерва: снижение эхогенности, нарушение дифференцировки на пучки (Рис. 7).
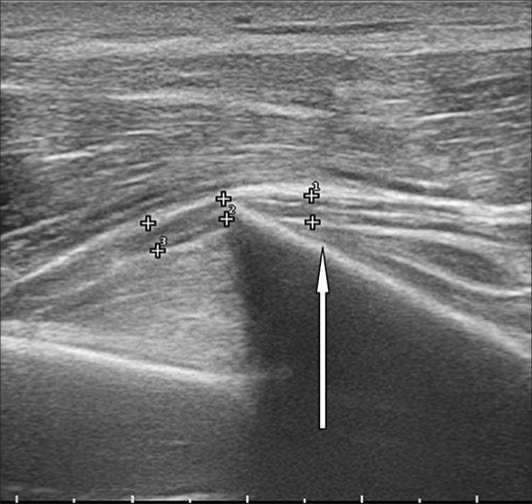
Рис. 7. Эхограмма, продольное сканирование. Отмечается сдавление лучевого нерва (++) и натяжение его над дистальным отломком плечевой кости ( ↑ ).
Непосредственно перед оперативным вмешательством, под УЗ-контролем положения нерва, была выполнена закрытая репозиция костных отломков, что позволило устранить натяжение и компрессию нервного ствола. (Рис. 8).
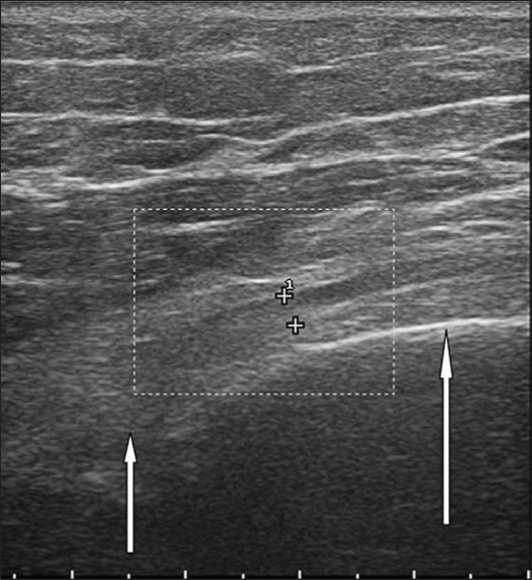
Рис. 8. Эхограмма, продольное сканирование. После репозиции отломков ( ↑↑ ) сдавление и натяжение лучевого нерва (++) устранено. Нерв находится кнаружи от отломков плечевой кости.
Такое взаиморасположение отломков и лучевого нерва позволило выполнить закрытый остеосинтез плечевой кости блокированным штифтом (Рис. 9).
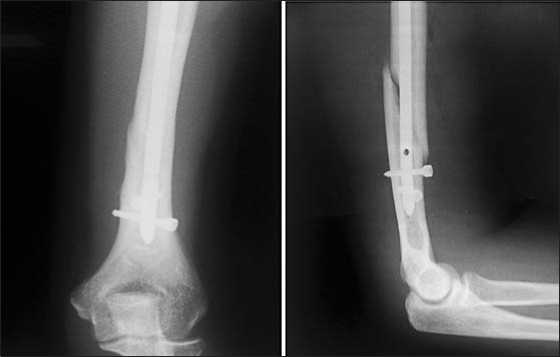
Рис. 9. Рентгенограммы после остеосинтеза плечевой кости блокированным штифтом.
При контрольном УЗИ, выполненном на 6-е сутки после операции, была подтверждена непрерывность нервного ствола, отсутствие натяжения и компрессии нерва, сохранялся отек ствола нерва. При исследовании, выполненном через 4 месяца после операции, отмечали положительную динамику в виде уменьшения толщины нерва и площади его поперечного сечения, появления четкой дифференцировки на пучки (Рис. 10).
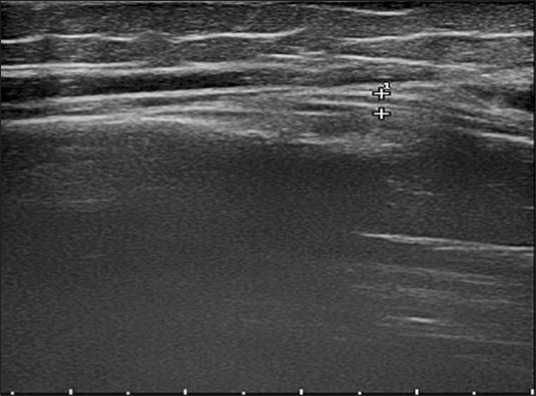
Рис. 10. Эхограмма, продольное сканирование. Лучевой нерв (++) имеет практически нормальные эхохарактеристики: контуры нерва ровные, четкие; дифференцировка пучков удовлетворительная, толщина нерва 2,5 мм.
При этом клиническое улучшение до уровня S3, M 3-4 отмечали через 2 месяца после операции. Полное восстановление (S5, M 4-5) через 4 месяца.
При выявлении УЗ-признаков прохождения лучевого нерва между костными отломками при винтообразном характере перелома плечевой кости в нижней трети (перелом Holstein-Lewis), чтобы избежать интраоперационного травмирования нерва и врастания его в костную мозоль, выполняли ревизию (10 пациентов – 23,3%).
Клинический пример 3. Больной Х, 38 лет, получил травму при любительских занятиях армрестлингом. Был диагностирован закрытый перелом диафиза правой плечевой кости (Рис. 11), травматическая нейропатия лучевого нерва справа (S 0-1, M 0-1).
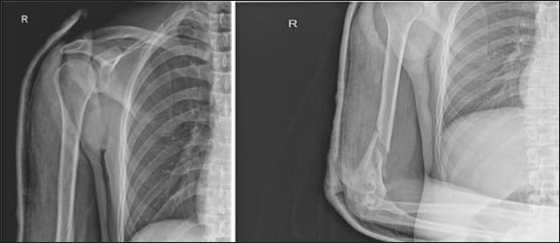
Рис. 11. Первичные рентгенограммы. Определяется оскольчатый перелом диафиза правой плечевой кости в нижней трети со смещением отломков (АО 12-В1)

Рисунок 14. Интраоперационная фотография: Интерпозиция лучевого нерва ( ↑ ) устранена.
Выполнен остеосинтез плечевой кости пластиной.
При УЗИ лучевого нерва выявили его анатомическую целостность, характерные для нейропатии изменения нервного ствола, а также прохождение нерва между костными отломками, с интимным прилеганием к одному из них (Рис. 12).
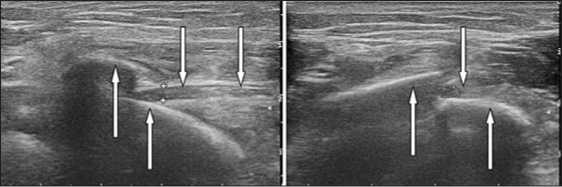
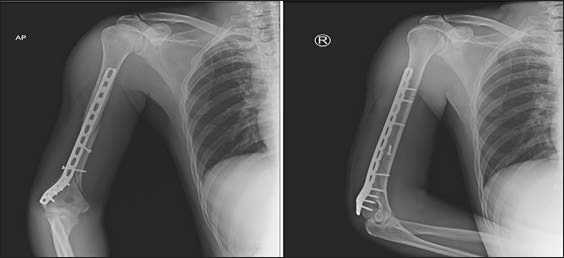
Рис. 15. Рентгенограммы после остеосинтеза плечевой кости винтами и пластиной с угловой стабильностью.
Рис 12. Эхограммы, продольное и поперечное сканирование. Лучевой нерв ( ↓ ) находится в интерпозиции между отломками плечевой кости ( ↑ )
Выполнили ревизию лучевого нерва, при которой визуально подтвердили все данные УЗИ: непрерывность нерва, наличие отека нервного ствола и внутриствольной гематомы, интерпозицию нерва (Рис. 13).

Рис.13. Интраоперационная фотография: отечный лучевой нерв ( ↓ ) располагается между костными отломками ( ↑ ).
При ревизии устранили интерпозицию, после чего произвели остеосинтез пластиной (Рис. 14, 15).
При выполненном в послеоперационном периоде УЗИ подтвердили устранение интерпозиции (Рис. 16).
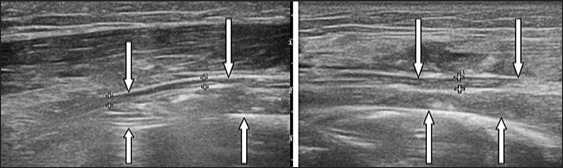
Рис. 16 . Эхограммы, продольное сканирование. Лучевой нерв ( ↓ ), проходит кнаружи от плечевой кости ( ↑ ).
Срок наблюдения пациента 3,5 месяца, восстановление до уровня S 3-4, M 3-4.
Данные УЗИ о взаиморасположении нерва с костными отломками, а также об изменении макроскопических характеристик нерва, были подтверждены у 100% пациентов, которым была выполнена интраоперационная ревизия лучевого нерва.
В послеоперационном периоде при УЗИ также оценивали взаиморасположение лучевого нерва и элементов металлоконструкций (пластины, блокирующие винты штифтов, серкляжи и т. д. ). Отчетливо визуализировали взаимоотношение лучевого нерва и пластины при остеосинтезе дистальной половины плечевой кости, а также лучевого нерва и дистальных блокирующих винтов при остеосинтезе блокированным штифтом.
Так, у пациента, оперированного по поводу закрытого перелома плечевой кости, в послеоперационном периоде клинически была диагностирована нейропатия лучевого нерва. При уль- тразвуковом исследовании выявлен конфликт нервного ствола с дистальным блокирующим винтом (Рис. 17). Винт был экстренно удален, выполнено блокирование штифта в другом направлении.
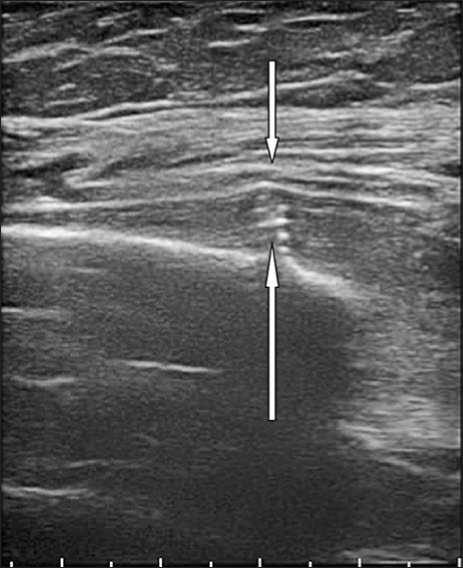
Рис. 17. Эхограмма, продольное сканирование. Винт, выстоящий за пределы плечевой кости ( ↑ ), компримирует ствол лучевого нерва ( ↓ ).
Выводы
Выполнение УЗИ лучевого нерва в остром периоде травматической нейропатии на фоне перелома плечевой кости технически возможно и тактически целесообразно.
Задачами первичного УЗИ, выполняемого в ранние сроки после травмы, являются: определение целостности нерва или выявление его анатомического повреждения; уточнение уровня повреждения; определение расположения лучевого нерва относительно костных отломков, а в случае ятрогенной послеоперационной нейропатии – и элементов металлофиксаторов.
Первичное УЗИ целесообразно проводить в максимально ранние сроки после травмы, в связи с тем, что нарастание посттравматического отека мягких тканей и параоссальной гематомы затрудняет исследование. При плохой визуализации лучевого нерва на фоне отека и гематомы исследование необходимо повторить после уменьшения отека – через 3-5 дней.
Первичное исследование целесообразно проводить на участке от бифуркации лучевого нерва, до максимально возможного проксимального уровня, с учетом вынужденного положения конечности и болевых ощущений пациента. Для осмотра лучевого нерва на протяжении всего сегмента исследование целесообразно повторить после стабилизации перелома.
Полученные при первичном УЗИ данные являются определяющими для решения вопроса о необходимости ревизии лучевого нерва в остром периоде травмы, так как достоверность этих данных визуально подтверждена во всех случаях операций с выделением лучевого нерва. Показаниями к ревизии лучевого нерва при первичной операции являются:
-
- данные УЗИ о травматическом нейротмезисе. Цель ревизии - восстановление целостности нерва (шов или пластика);
-
- данные УЗИ о неблагоприятном взаиморасположении лучевого нерва с костными отломками. Цель ревизии – устранение или предотвращение травмирующего воздействия костных отломков на нерв.
При выявлении УЗ-признаков конфликта ствола лучевого нерва с элементами имплантов в послеоперационном периоде, показано экстренное устранение конфликта хирургическим путем.
Список литературы Периоперационная диагностика повреждений лучевого нерва при закрытых диафизарных переломах плечевой кости и оценка целесообразности его ревизии
- Диагностика состояния лучевого нерва при переломах плечевой кости / В.Г. Салтыкова, И.О. Голубев, М.В. Меркулов, А.В. Шток // Ультразвуковая и функциональная диагностика. - 2012. - №3. - С. 76-88. [Diagnostics of the radial nerve at fractures of the humerus / V.G. Saltykova, I.O. Golubev, M.V. Merkulov, A.V. Shtock // Ultrasound and functional diagnostics. - 2012. - №3. - Р. 76-88. [In Russ]
- Кхир Бек М. Комплексная диагностика и оптимальный подход к лечению травматических повреждений лучевого нерва: Автореф. дис. … канд. мед. наук. - М., 2009. - 23 с. [Khir Bek M. Comprehensive diagnosis and optimal approach to the treatment of traumatic injuries of the radial nerve: Аbstract of dissertation… candidate of medical Sciences. - Moscow, 2009. - 23 p. [In Russ]
- Radial nerve pulsy associated with humeral shaft fracture: evaluation with US-initial experience / G. Bodner, W. Buchberger, M. Schocke et al. // Radiology. - 2001. - Vol. 219, N.3. - P. 811-816
- evaluation of peripheral nerves of the upper limb with ultrasonography: a comparison of ultrasonographic examination and the intraoperative findings / T. Toros, N. Karabay, K. Ozaksar et al. // J. Bone Joint Surgery Br. - 2009. - Vol.91, N.6. - P. 762-765. DOI: 10.1302/0301-620x.91B6.22284
- Sonographic detection of radial nerve entrapment within a humerus fracture / G. Bodner, B. Huber, A. Schwabegger et al. // J. Ultrasound Med. - 1999. - Vol.18, N.10. - P. 703-706
- Chen J. Ultrasonografic reference values for assessing normal radial nerve ultrasonography in the normal population / J. Chen, S. Wu, J. Ren // Neural. Regen. Res. - 2014. - Vol.9, N.20. - Р. 1844-1849.
- DOI: 10.4103/1673-5374.143433
- High-resolution ultrasonography in the diagnosis and intraoperative management of peripheral nerve lesions / F.C. Lee, H. Singh, L.N. Nazarian, J.K. Ratliff // J. Neurosurgery. - 2011. - Vol.114, N.1. - Р. 206-211.
- DOI: 10.3171/2010.2.JNS091324
- Fractures of the shaft of the humerus: systematic plate fixation. Anatomic and functional results in 156 cases and a review of the literature / H. Paris, P. Tropiano, B. Clouet D'orval et al. // Rev. Chir. Orthop. Reparatrice Appar. Mot. - 2000. - Vol.86, N.4. - Р. 346-359.
- Radial nerve palsy in mid/distal humeral fractures: is early exploration effective? / G. Keighley, D. Hermans, V. Lawton, D. Duckworth // ANZ J. Surg. - 2018. -Vol.88, N.3. - P. 228-231.
- DOI: 10.1111/ans.14259
- Plating osteosynthesis of middistal humeral shaft fractures: minimally invasive versus conventional open reduction technique / Z. An, B. Zeng, X. He et al. // Int. Orthop. - 2010. - Vol. 34, N.1. - P. 131-135.
- DOI: 10.1007/s00264-009-0753-x
- Alaqeel A. High resolution ultrasound in the evaluation and management of traumatic peripheral nerve injures: review of the literature / A. Alaqeel, F. Alshomer // Oman. Med. J. - 2014. - Vol.29, N.5. - Р. 314-319.
- DOI: 10.5001/omj.2014.86


