Периоперационная химиотерапия в режиме Flot у больных операбельной аденокарциномой желудка и кардиоэзофагеального перехода (I-III тип по классификации Siewert). Опыт НМИЦ онкологии им. Н. Н. Блохина
Автор: Авдюхин Иван Г., Перегородиев Иван Н., Хэнянь Сунь, Калинин А.Е., Неред Сергей Н., Трякин Алексей А., Бесова Наталия С., Артамонова Елена В., Титова Татьяна А., Обаревич Екатерина С., Игнатова Екатерина О., Козлов Николай А., Россомахина Олеся М., Шишкина Нина А., Колобанова Евгения С., Малихова Ольга А., Абгарян Микаэл Г., Никулин Максим П., Архири Петр П., Вашакмадзе Леван А., Сулейманов Э.А., Стилиди И.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.12, 2022 года.
Бесплатный доступ
На сегодняшний день прогноз больных раком желудка остаётся неблагоприятным. Для улучшения результатов терапии рака желудка активно изучается комбинированное лечение [2-6]. На сегодняшний день в Европе общепринятым подходом к лечению больных операбельным раком желудка является проведение периоперационной химиотерапии по схеме FLOT. В рандомизированном исследовании FLOT4-AIO было показано, что назначение режима FLOT в сравнении с ECF / ECХ позволяет значимо увеличить медиану общей выживаемости c 35 до 50 месяцев, безрецидивной выживаемости с 18 до 30 месяцев и частоту достижения R0 резекций. В данной работе мы, используя проспективную базу данных пациентов, получивших терапию в НМИЦ онкологии им. Н. Н. Блохина, провели анализ эффективности и токсичности химиотерапии по схеме FLOT в периоперационном режиме у больных операбельным раком желудка и кардиоэзофагеальным раком I-III типа T2N0M0, TN+M0.
Аденокарцинома желудка, аденокарцинома кардиоэзофагеального перехода, периоперационная химиотерапия, режим flot
Короткий адрес: https://sciup.org/140296534
IDR: 140296534 | DOI: 10.18027/2224-5057-2022-12-4-5-13
Текст научной статьи Периоперационная химиотерапия в режиме Flot у больных операбельной аденокарциномой желудка и кардиоэзофагеального перехода (I-III тип по классификации Siewert). Опыт НМИЦ онкологии им. Н. Н. Блохина
МЕТОДЫ
Дизайн исследования и условия включения
Собственные исследования
В качестве периоперационной химиотерапии использовали режим FLOT: доцетаксел 50 мг/м 2 внутривенно в день 1, оксалиплатин 85 мг/м 2 внутривенно в день 1, лейковорин 200 мг/м 2 внутривенно в день 1 и фторура-цил 2600 мг/м 2 в виде 24-часовой внутривенной инфузии начиная с 1 дня. Продолжительность курса — две недели. Перед началом каждого курса лечения производилась оценка состояния пациента с учётом его общего состояния, статуса ECOG, показателей анализов крови и токсичности химиотерапии. До операции проводилось четыре курса с последующим рентгенологическим и эндоскопическим контролем для исключения прогрессирования заболевания. В случаеувеличения опухоли и/или регионарныхлим-фатических узлов, повторно выполнялась диагностическая лапароскопия, и при отсутствии отдаленных метастазов выполняли хирургическое вмешательство. Колониестимулирующие фактора применялись в качестве вторичной профилактики нейтропении, то есть в случае регистрации снижения уровня нейтрофилов ниже 0,5 × 10 9 /л, начиная со следующего курса терапии.
Оцениваемые результаты
В работе проведён анализ непосредственных и отдалённых результатов: послеоперационная стадия ypTNM, частота выполнения R1/R2 операций, токсичность терапии, послеоперационная летальность были проанализированы в выборке оперированных пациентов. Общую выжива- емость рассчитывали от начала лечения до последнего контакта с больным или его смерти от любой причины, безрецидивную выживаемость — от начала лечения до выявления локального или системного рецидива заболевания, смерти больного от любой причины или последнего контакта с пациентом; оценивали число полных патомор-фологических ответов первичной опухоли — соотношение числа пациентов со степенью лечебного патоморфоза по Mandard TRG-1 к общему числу пациентов; корреляцию между полным патоморфологическим ответом первичной опухоли и общей, а также безрецидивной выживаемостью; токсичность лекарственной терапии.
Статистический анализ
TNM-стадирование, побочные явления и 30-дневная смертность были проанализированы у всех пациентов, вошедших в работу. Оценка объёмов хирургического вмешательства, радикальности операции была проведена после окончания набора данных. Данные были проанализированы с помощью компьютерной программы IBM SPSS Statistics 24. Значения p были рассчитаны с использованием точного критерия Фишера, если не указано иное, и все представленные значения p являются двусторонними, если не указано иное. Анализ актуриальной выживаемости, построение кривых выживаемости проводили методом Каплана-Майера.
РЕЗУЛЬТАТЫ
Десять из девяносто девяти пациентов досрочно прекратили проведение предоперационной химиотерапии. Медиана числа полученных предоперационных курсов составила четыре (1–4). Восемьдесят три (84%) пациента получили все 4 рекомендованных курса полихимиотерапии. Восемь из 83 пациентов, получивших 4 курса FLOT, не прооперированы в виду отказа от операции, прогрессирования заболевания на фоне проводимого лекарственного лечения, выявленной тяжелой сопутствующей патологии, смерти, 71 (78%) пациент из 91 был прооперирован. Пятидесяти четырём (59%) из 91 пациента начато про-
И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА (I–III ТИП ПО КЛАССИФИКАЦИИ SIEWERT). ОПЫТ НМИЦ ОНКОЛОГИИ ИМ. Н.Н. БЛОХИНА
В рамках послеоперационного стадирования произведена оценка патоморфологической стадии у 70 прооперированных пациентов: < ypT3 были выявлены у 30 (42%) пациентов, < ypN2 у 49 (69%) пациентов. Степень регрессии по Mandard оценена в 49 случаях (70% от оперированных пациентов). У 11 пациентов (22% в группе с оценкой лечебного патоморфоза) отмечена I степень регрессии
Таблица 1. Характеристика пациентов.
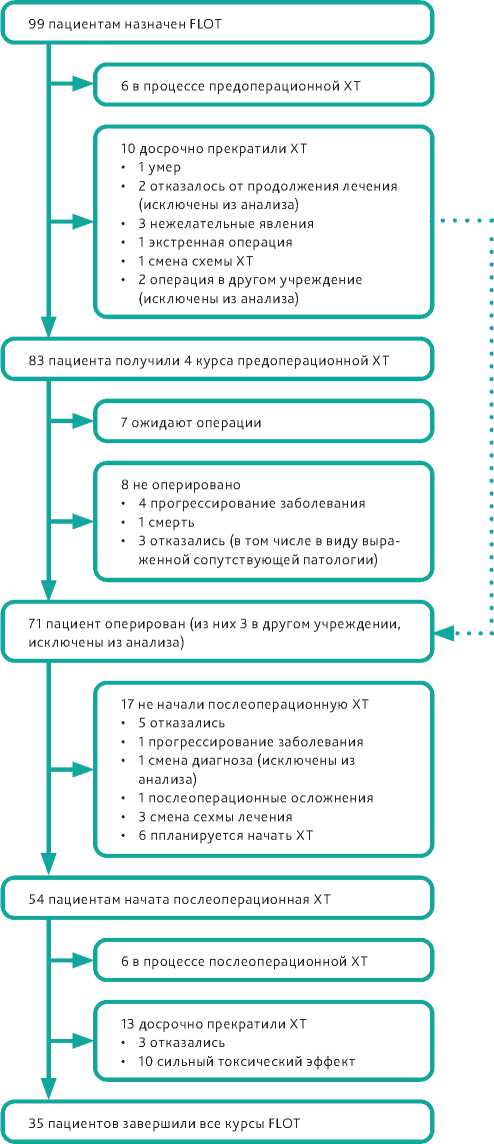
Схема 1. Схема исследования.
Собственные исследования
В 2 случаях (3%) резекции выполнены в объёме R1. В 1 случае (1%) край резекции не оценивался.
В работе исследован тип опухоли по классификации Lauren: до операции были классифицированы все 99 случаев, из них кишечный тип выявлен в 47 случаях (47%), диффузный — в 41 (41%), смешанный — в 7 (7%), не удалось чётко отнести опухоль к тому или иному типу у 4 больных (4%). Тип по Lauren в послеоперационном материале оценен в 70 случаях: кишечный тип выявлен в 23 случаях
Таблица 2. Характеристика проведенного хирургического лечения.
|
n/N/% |
||
|
Вид операции |
||
|
Чрезбрюшинный доступ |
||
|
Гастрэктомия |
48/71 |
(68%) |
|
Дистальная субтотальная резекция |
10/71 |
(14%) |
|
Проксимальная субтотальная резекция |
3/71 |
(4%) |
|
Другие |
1/71 |
(1%) |
|
Комбинированный доступ |
||
|
Операция типа Люиса |
5/71 |
(7%) |
|
Проксимальная резекция |
4/71 |
(6%) |
|
Лимфаденэктомия |
||
|
D2 |
71/71 |
(100%) |
|
Количество удалённых лимфоузлов (медиана) |
21 |
|
|
R |
||
|
R0 резекция |
68/71 |
(96%) |
|
R1 резекция |
2/71 |
(3%) |
|
Нет данных |
1/71 |
(1%) |
|
ypT |
||
|
ypT0 |
10/70 |
(14%) |
|
ypTis |
3/70 |
(4%) |
|
ypT1 |
7/70 |
(10%) |
|
ypT2 |
10/70 |
(14%) |
|
ypT3 |
28/70 |
(41%) |
|
ypT4 |
12/70 |
(17%) |
|
ypT0/ypT1 /ypT2 |
30/70 |
(42%) |
|
ypT3/ypT4 |
41/70 |
(58%) |
|
ypN |
||
|
ypN0 |
36/70 |
(51%) |
|
ypN1 |
12/70 |
(17%) |
|
ypN2 |
15/70 |
(22%) |
|
ypN3 |
7/70 |
(10%) |
|
ypN0/N1 |
49/70 |
(70%) |
|
ypN2/N3 |
22/70 |
(30%) |
|
Лечебный патоморфоз (Mandard) |
||
|
TRG-1 |
11/49 |
(22%) |
|
TRG-2 |
9/49 |
(18%) |
|
TRG-3 |
10/49 |
(20%) |
|
TRG-4 |
16/49 |
(34%) |
|
TRG-5 |
3/49 |
(6%) |
(33%), диффузный — в 24 (34%), смешанный — в 6 (9%), не удалось чётко отнести опухоль к тому или иному типу в 17 случаях (24%).
Таблица 3. Токсичность химиотерапии.
|
FLOT (n = 99) |
|||
|
Степень 1–2 |
Степень 3 |
Степень 4 |
|
|
Желудочно-кишечные расстройства |
|||
|
Тошнота |
37 (37%) |
0 |
0 |
|
Рвота |
11 (11%) |
0 |
0 |
|
Стоматит |
4 (4%) |
1 (1%) |
0 |
|
Диарея |
27 (28%) |
1 (1%) |
2 (2%) |
|
Нарушения в крови и лимфатической системе |
|||
|
Анемия |
10 (10%) |
0 |
0 |
|
Лейкопения |
1 (1%) |
1 (1%) |
0 |
|
Нейтропения |
10 (10%) |
22 (22%) |
21 (21.2%) |
|
Тромбоцитопения |
4 (4%) |
0 |
0 |
|
Фебрильная нейтропения |
1 (1%) |
0 |
1 (1%) |
|
Сердечные, легочные и тромботические события |
|||
|
ТЭЛА (один летальный исход) |
|||
|
Стенокардия |
1 (1%) |
0 |
0 |
|
Общие и другие расстройства |
|||
|
Астения |
55 (56%) |
2 (2%) |
0 |
|
Алопеция |
14 (14%) |
0 |
0 |
|
Ладонно-подошвенный синдром |
4 (4%) |
0 |
0 |
|
Полинейропатия |
21 (21%) 21 |
0 |
1 (1%) |
|
Гепатотоксичность |
8 (8%) |
1 (1%) |
0 |
И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА (I–III ТИП ПО КЛАССИФИКАЦИИ SIEWERT). ОПЫТ НМИЦ ОНКОЛОГИИ ИМ. Н.Н. БЛОХИНА
Собственные исследования
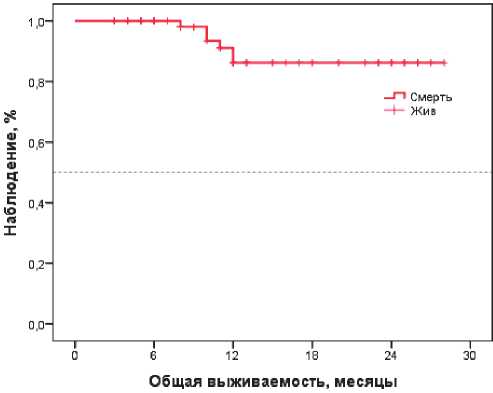
Рисунок 1. ОВ больных РЖ в общей группе.
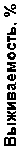

0,8- | , । ч । t .
—г1 Прогрессирование
—H Без прогрессирования
“I I I I I Г
0 6 12 18 24 30
Безрецидивная выживаемость, месяцы
Рисунок 2. ВБП больных РЖ в общей группе.
надцатимесячная безрецидивная выживаемость в группе пациентов с уровнем ответа Mandard I составила 100%, в группе Mandard II–V — 73 % (p = 0,187, рис. 4).
Нежелательные явления, связанные с химиотерапией, оценивались у всех вошедших в исследование пациентов (табл. 3). Уровень токсичности был приемлемым, ожидаемым и поддавался коррекции. Преимущественно зарегистрированные нежелательные явления не превышали 1–2 степени и были представлены астенией (56%), тошнотой (37%), диареей (28%) и полинейропатией (21%). Нейтропения любой степени выявлена у 54% пациентов, IV степени — у 21%.
ОБСУЖДЕНИЕ
В целом, можно с уверенностью говорить, что режим периоперационного лечения FLOT обладает приемлемым
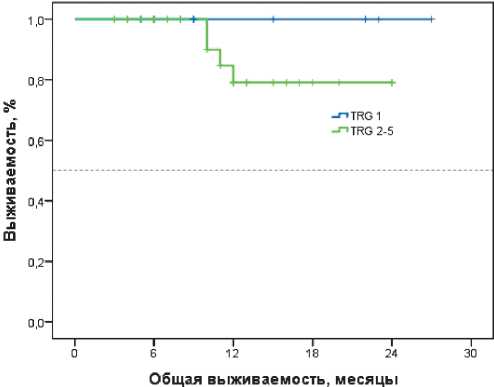
Рисунок 3. ОВ больных РЖ в зависимости от ответа
по Mandard.
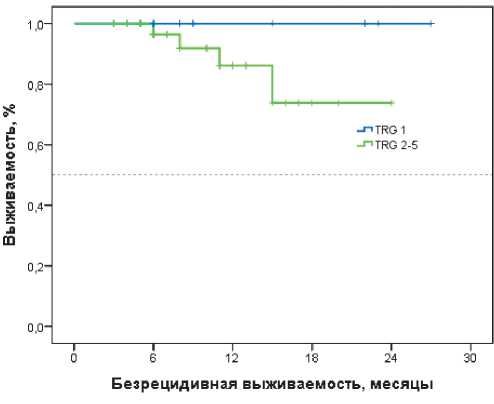
Рисунок 4. ВБП больных РЖ в зависимости от ответа по Mandard.
Собственные исследования и контролируемым спектром токсичности, что отражает как процент пациентов, полностью завершивших все запланированные курсы терапии (38%), так и количество и степень нежелательных явлений: они преимущественно не превышали 1–2 степени (56%).
и пищеводно-желудочного перехода, есть ли связь между исходной стадией заболевания и частотой полного па-томорфологического ответа. Проводимое исследование в дальнейшем, вероятно, даст ответ на этот вопрос [8–11].
В завершение хотелось бы отметить, что применение в периоперационном режиме триплета FLOT позволяет достигнуть высокого процента полных патоморфологиче-ских ответов и увеличить медианы общей и безрецидивной выживаемости при приемлемом спектре токсичности.
Список литературы Периоперационная химиотерапия в режиме Flot у больных операбельной аденокарциномой желудка и кардиоэзофагеального перехода (I-III тип по классификации Siewert). Опыт НМИЦ онкологии им. Н. Н. Блохина
- Reim D, Loos M, Vogl F, et al. Prognostic implications of the seventh edition of the International Union Against Cancer classification for patients with gastric cancer: the Western experience of patients treated in a single-center European institution. J Clin Oncol 2013 ; 31 : 263-71.
- Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006 ; 355 : 11-20.
- Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011 ; 29 : 1715-21.
- van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012 ; 366 : 2074-84.
- Ronellenfitsch U, Schwarzbach M, Hofheinz R, et al. Preoperative chemo (radio) therapy versus primary surgery for gastroesophageal adenocarcinoma: systematic review with meta-analysis combining individual patient and aggregate data. Eur J Cancer 2013 ; 49 : 3149-58.
- Schuhmacher C, Gretschel S, Lordick F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol 2010 ; 28 : 5210-18.
- Stark AP, Ikoma N, Chiang YJ et al. Characteristics and Survival of Gastric Cancer Patients with Pathologic Complete Response to Preoperative Therapy. Ann Surg Oncol. 2019 Oct ; 26 (11) : 3602-3610. https://doi.org/: 10.1245/s10434-019-07638-8. Epub 2019 Jul 26. PMID:31350645.
- Becker K, Langer R, Reim D, et al. Significance of histopathological tumor regression after neoadjuvant chemotherapy in gastric adenocarcinomas: a summary of 480 cases. Ann Surg 2011 ; 253 : 934-39.
- Alderson D, Langley RE, Nankivell MG, et al. Neoadjuvant chemotherapy for resectable oesophageal and junctional adenocarcinoma: results from the UK Medical Research Council randomised OEO5 trial (ISRCTN 01852072). Proc Am Soc Clin Oncol 2015 ; 33 (suppl) : 4002 (abstr).
- Cunningham D, Smyth E, Stenning S, et al. Peri-operative chemotherapy±bevacizumab for resectable gastro-oesophageal adenocarcinoma: results from the UK Medical Research Council randomised ST03 trial (ISRCTN 46020948). Eur J Cancer 2015 ; 51 (suppl 3) : S400.
- Donohoe CL, O'Farrell NJ, Grant T, et al. Classification of pathologic response to neoadjuvant therapy in esophageal and junctional cancer: assessment of existing measures and proposal of a novel 3-point standard. Ann Surg 2013 ; 258 : 784-92.


