Перипартальная кардиомиопатия
Автор: Муркамилов Илхом Торобекович, Айтбаев Кубаныч Авенович, Райимжанов Зафарбек Рахимович, Юсупова Турсунай, Юсупов Фуркат Абдулахатович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 5 т.9, 2023 года.
Бесплатный доступ
Цель исследования - описание клинического случая перипартальной кардиомиопатии (КМП) и проведение литературного анализа. Перипартальная КМП определяется как снижение фракции выброса левого желудочка 2,7 см/м2. При этом должны отсутствовать определяемые причины сердечной недостаточности, а также развитие сердечной недостаточности в последний месяц беременности или в течение 5 месяцев после родов. В обзоре представлены данные о возможных причинах развития перипартальной КМП. Факторами риска перипартальной КМП являются: возраст младше 20 лет и старше 30 лет, преэклампсия, артериальная гипертензия, многоплодная беременность, затяжное течение вирусной инфекции, недостаточность макро- и микронутриентов и т.д. Ведущую роль в патогенезе перипартальной КМП играют пролактин и ее 16 кДа фрагмент, а также чрезмерная активность катепсина D. Приводится пошаговый алгоритм диагностики перипартальной КМП в реальных клинических условиях. Материал и методы. Пациентка - К., 18 лет, в анамнезе: ранее сердечно-сосудистыми заболеваниями не страдала, со слов пациентки перенесла год назад пневмонию. Повышение артериального давления не отмечает. Физиологическая беременность протекала удовлетворительно, роды в сроке, самостоятельные. На 56 сутки после родов поступила в палату интенсивной терапии с жалобами на: одышку, мышечную слабость, сердцебиение, отеки на голенях. Из анамнеза: через 1 месяц после родов на следующий день после психоэмоционального перенапряжения начала отмечать одышку, отсутствие сна, мышечную слабость, уменьшение лактации. При обследовании были выявлены повышение скорости оседания эритроцитов, С-реактивного белка крови, протеинурия, гематурия, а также снижение фракции выброса левого желудочка. Результаты. На фоне стандартной терапии добавление ингибиторов секреции пролактина и стимуляторов дофаминовых рецепторов привело к существенному улучшению состояния пациентки: протеинурия ощутимо снизилась, отечный синдром прошел, а сократительная функция ЛЖ значительно восстановилась. Заключение. Клинический случай демонстрирует развитие редкого варианта перипартальной КМП, дебютирующего с протеинурией и сохранной функцией почек, а также нормальными сывороточными уровнями пролактина. По-видимому, существуют различные фенотипы перипартальной КМП.
Беременность, роды, стресс, пролактин, катепсин d, перипартальная кардиомиопатия, фракция выброса левого желудочка, прогноз, здравоохранение
Короткий адрес: https://sciup.org/14127958
IDR: 14127958 | УДК: 616.616-01/09, | DOI: 10.33619/2414-2948/90/35
Текст обзорной статьи Перипартальная кардиомиопатия
Бюллетень науки и практики / Bulletin of Science and Practice
По имеющимся сведениям, каждый день более 800 женщин погибают от осложнений, связанных с беременностью и родами [1]. В структуре причин материнской смертности болезни органов кровообращения занимают важное место, составляя 10–15% случаев. По отчетам исследователей [2], более половины случаев материнской смертности, обусловленных патологией органов кровообращения, наступают в результате ишемической болезни сердца (ИБС), перипартальной кардиомиопатии (КМП) и расслаивающей аневризмы аорты. История изучения проблемы перипартальной КМП берет начало с 1937 года, когда B. A. Gouley привел примеры заболевания миокарда у беременных, протекающих с развитием сердечной недостаточности (СН) [3]. Позже исследователи H. Seftel [4] M. Susser J [5], G. Demakis [6] и др. продемонстрировали клиническую картину миокардиальной дисфункции у беременных женщин. Перипартальная КМП относится к числу редких заболеваний (0,1%) и развивается у женщин преимущественно в последний месяц беременности или через 5 месяцев после родов, хотя по данным литературы [7, 8], описаны случаи развития перипартальной КМП и раньше, чем за один месяц до родов. В ранее опубликованных исследованиях [9–11] сообщалось также о случаях развития перипартальной КМП со II-триместра беременности. По отдельным наблюдениям [12], примерно у 20% женщин признаки СН появлялись в еще более ранние сроки, чем последний месяц беременности. Стоит подчеркнуть, что сроки 1 месяц до родов и 5 месяцев после родов определены с целью исключения ранее существующих причин СН, которые могли обостриться во время беременности. При запоздалой диагностике перипартальной КМП материнская смертность достаточно высокая — 30%. В соответствии с определением международной рабочей группы [8, 13] по изучению проблем патологии миокарда у беременных «перипартальная КМП является идиопатической КМП, представленной СН вследствие систолической дисфункции левого желудочка (ЛЖ), развившейся к концу беременности или в течение нескольких месяцев после родов, если не определена иная причина СН [8, 13]. Нужно помнить, что клинический диагноз «перипартальная КМП» всегда является диагнозом исключения. При перипартальной КМП полость ЛЖ может быть не расширена, но практически всегда регистрируется фракционное укорочение <30% или фракция выброса ЛЖ ниже 45% [8, 13–17].
Распространенность перипартальной кардиомиопатии
Накопленные данные литературы свидетельствуют [8, 13–17], что частота обнаружения перипартальной КМП зависит от географических и этнических особенностей. Как показывают результаты литературных поисков [18], в отдельных странах Африканского материка заболеваемость перипартальной КМП очень высокая и составляет 1:100 и 1:300 родов. В США, Германии и Южной Африке распространенность перипартальной КМП составляет 1:1500, 1:1000 и 1:1000 родов, соответственно [8, 13–17, 19]. В Гаити и Нигерии частота перипартальной КМП составляет 1:400 и 1:100 родов, соответственно. Ряд исследователей сообщают, что распространенность перипартальной КМП увеличивается и нозология перестала быть редким в клинической практике. Основываясь на результатах исследования U. Elkayam и соавторов, Г. П. Кузнецов (2014) сообщает, что частота перипартальной КМП у женщин различных этнических групп существенно отличается [20]. Так, наивысший показатель распространенности перипартальной КМП на территории США среди белой расы составила 67%, а у негроидной расы — 19%. По данным зарубежных исследователей [21], в южной части Индии распространенность перипартальной КМП составляет примерно 1 случай на 1374 родов. По последним данным [22], в северной
Нигерии в структуре СН важное место занимает перипартальная КМП. По-видимому, социальное положение, табакокурение, возраст матери, а также экстрагенитальные патологии играют немаловажную роль в развитии перипартальной КМП [23–26]. Сведения о распространенности перипартальной КМП в Кыргызстане в настоящее время отсутствуют.
Факторы риска перипартальной кардиомиопатии
Перипартальная КМП является классическим полифакторным с окончательно не установленной этиологией заболеванием, связанным с беременностью и/или родами (peri — около, вокруг; parturient — относящийся к беременности, родам). В соответствии с проведенными исследованиями [23–26], все факторы риска развития перипартальной КМП подразделяются на вероятные, предполагаемые и обсуждаемые [27, 28]. С увеличением возраста матери риск развития перипартальной КМП возрастает. Принадлежность к негроидной расе, наличие ожирения, анемии, дисфункции щитовидной железы, артериальной гипертензии, аутоиммунных заболеваний, злоупотребления психоактивными веществами, а также длительной токолитической терапии являются факторами риска перипартальной КМП [23–26]. К способствующим факторам перипартальной КМП относят длительное табакокурение и сниженный показатель индекса массы тела матери (<18,49 кг/м2). В последние годы [25, 26] широко обсуждается и роль генетических факторов в развитии перипартальной КМП. Наиболее вовлеченным в патологический процесс считается ген TTN [29, 30]. У женщин негроидной расы наиболее часто перипартальная КМП ассоциировалась с мутацией гена TTN, кодирующего мышечные саркомерные белки коннектин и миозин. Выдвигалась гипотеза о том [31], что более выраженное снижение сократительной функции ЛЖ и плохой прогноз при перипартальной КМП связаны с присутствием гена TTN. Известно, что мутации в гене TTN также связаны с наследственной гипертрофической КМП [32, 33] и прогрессирующей дистальной мышечной дистрофией Миоши [34–36]. Имеется сведение [37, 38], что аутоантитела против коннектина секретируются у ряда больных системной склеродермией. По-видимому, плохой прогноз перипартальной КМП при наличии мутации гена TTN объясняет его участие в процессе сокращения поперечнополосатых мышц. Отдельные исследователи отмечают [39], что при различных клинико-морфологических формах КМП выявляется мутация в гене MYH7, который кодирует β-тяжелую цепь белка миозина, одного из главных компонентов волокон сердечной мышцы. Согласно другим исследованиям [40, 41], плохой прогноз перипартальной КМП возможно связан с мутацией гена SCN5А, кодирующего α-субъединицу Na-каналов кардиомиоцитов. При этом ускоряется и/или уменьшается количество инактивированных натриевых каналов, что обусловливает гетерогенность рефрактерных периодов, вследствие чего и создаются предпосылки для развития нарушения возбудимости миокарда желудочков [41]. Природа генетических аномалий, ассоциированных с развитием перипартальной КМП, изучается активно, поскольку материнская смертность, связанная с заболеваниями миокарда неизвестного происхождения значимо различается в зависимости от географической местности и расовой принадлежности. Е. В. Рудаева, И. А. Хмелева, К. Б. Мозес и соавторы (2021), обобщая современные источники научной литературы по перипартальной КМП, подчеркивают роль многоплодной беременности и рождение нескольких детей [42]. В большинстве случаев перипартальная КМП развивается у первородящих, особенно в возрасте старше 30 лет. Тогда как, у повторнородящих и в возрасте младше 24 года распространенность перипартальной КМП сравнительно низкая [43]. В вышеупомянутых исследованиях подчеркнуто [22–24], что возраст матери младше 20 лет, тахикардия, артериальная гипотензия и фракция выброса ЛЖ <25% независимо увеличивали риск смертности при перипартальной КМП. Более высокая распространенность перипартальной КМП в некоторых странах мира возможно объясняется недостаточным поступлением в организм матери кальция, селена, витамина А, С, Е и т. д. [20, 27]. Согласно последним данным [44, 45], витамин А обладает антиоксидантной функцией и, соответственно, его роль в организме заключается в защите любых биологических мембран от повреждения активными формами кислорода. Витамин С (аскорбиновая кислота) является наиболее значимым антиоксидантом межклеточной жидкости, не синтезируется и не имеет депо в организме человека. Аскорбиновая кислота связывает и инактивирует активные формы кислорода, которые образуются в результате ферментативных реакций (не более 5%). В настоящее время стало известно [46, 47], что активные формы кислорода принимают непосредственное участие в патогенезе многих патологических процессов, обладают антигенными свойствами, запускают аутоиммунные процессы повреждения тканей и т. д. Что касается токоферола (витамин Е), то он инактивирует супероксидный радикал, угнетает липидные радикалы, защищает от токсического действия озона и обладает способностью повышать уровень природных липидных антиоксидантов [48]. Предрасполагающими факторами перипартальной КМП могут служить также анемия и окислительный стресс в дородовом или послеродовом периодах [27]. Среди многообразия факторов риска перипартальной КМП значится и преэклампсия, возникающая после 20-й недели беременности. Возможно, появление артериальной гипертензии, отеков и протеинурии в сроке от 24 до 34 недель беременности (ранняя преэклампсия) либо после 34 недели беременности (поздняя преэклампсия) [49] существенно повышает риски перипартальной КМП. Проведен ряд исследований [50–52] по изучению перипартальной КМП в группе беременных женщин с наличием преэклампсии или присутствием преэклампсии в акушерском анамнезе, а также у повторнородящих женщин. Так как, чрезмерная активация катепсина D в ранние сроки беременности, т. е. от 1 до 13 недель (I триместр) является одним из патогенетических звеньев развития КМП при преэклампсии [49, 53] и, возможно, перипартальной КМП. Подытоживая раздел факторов риска перипартальной КМП хочется подчеркнуть и роль стресса. Общеизвестно, что существует связь преобладания конкретных эмоций с предрасположенностью к определенным заболеваниям. Концепция стресса Ганса Селье (26.01.1907–16.10.1982), опубликованная в XX веке, нашла широкое подтверждение практически во всех сферах медицины [54]. Внезапность стрессорного воздействия, наличие сопутствующего фактора окружающей среды в значительной степени определяют развитие тех или иных патологических (обратимых и необратимых) изменений в организме человека. Концепция влияния психологического стресса во время беременности на внутриутробное формирование предрасположенности к развитию психосоматики изложены в исследовании [55]. Особое значение стресса в развитии патологических процессов и, в частности, перипартальной КМП продиктовано тем, что в условиях стресса у беременных женщин усиливается активность перекисного окисления липидов из-за нарушения микроциркуляции и гипоперфузии жизненно важных органов. Состояние повышенного напряжения или психоэмоциональная лабильность во время беременности оказывают негативное влияние на оксидантную и противооксидантную системы. Н. Т. Ватутин и соавторы (2014) подчеркивают, что факторы риска перипартальной КМП прежде всего связаны с возрастом матери и числом беременностей [27]. Старший возраст, длительный акушерский анамнез обусловливают снижение компенсаторных механизмов сердечнососудистой системы женщины, повышая риск перипартальной КМП. В последние годы [56–
58] в качестве провоцирующего фактора развития перипартальной КМП обсуждается также роль вирусной инфекции, дефицита в почве некоторых редких минералов (Нигерия, Гаити, Республика Нигер), формирования аутоантител, длительного применения β-симпатомиметиков и т. д.
Патогенез перипартальной кардиомиопатии
Пролактин. По современным данным [22–24], механизм развития перипартальной КМП включает несколько патофизиологических направлений. Ядром в возникновении перипартальной КМП является дисбаланс между общим пролактином (23 кДа) и ее дериватом (16 кДа). Пролактин, являющийся лактотропным гормоном, состоит из 198–199 аминокислот с молекулярной массой 23–24 кДа. Впервые пролактин был выделен у человека в 1971 году и только в начале XXI века он стал объектом внимания у исследователей как патогенетическое звено перипартальной КМП [59–62]. В настоящее время известно свыше 300 различных биологических эффектов пролактина [63, 64]. Ген пролактина расположен в 6й хромосоме, а ген рецепторов пролактина — в 5-й хромосоме [65]. Хотя рецепторы пролактина имеются во многих органах и тканях (сердце, легкие, селезенка, вилочковая железа, печень, скелетная мышца, жировая ткань и др.), большая их часть все же сосредоточена в органах репродуктивной системы женщин [66, 67]. В организме человека важнейшими регуляторами синтеза и секреции пролактина являются дофамин (подавляет) и тиреотропный гормон (стимулирует) [68]. Как показано на рис.1, в зависимости от молекулярной массы различают малый (22 000), большой (50 000) и очень большой (100 000) пролактин. Согласно исследованиям А. Л. Тихомирова и соавторов различают также гликолизированный пролактин с молекулярной массой 25 000. Как отмечено в исследовании [69], различные формы сывороточного пролактина невозможно дифференцировать с помощью радиоиммунологического метода, а существующие другие лабораторные методы определения показывают сразу весь объем сывороточного пролактина. Следует отметить, что большой пролактин и очень большой пролактин имеют более низкие степени сродства к рецепторам [70]. Этот факт, по-видимому, объясняет отсутствие клинических проявлений при высоких значениях сывороточного пролактина в результатах анализов несмотря на высокие значения сывороточного пролактина или наоборот. С другой стороны, у беременных и кормящих женщин под влиянием внешних и внутренних факторов большой сывороточный пролактин трансформируется в малый пролактин посредством потери дисульфидных связей [71].
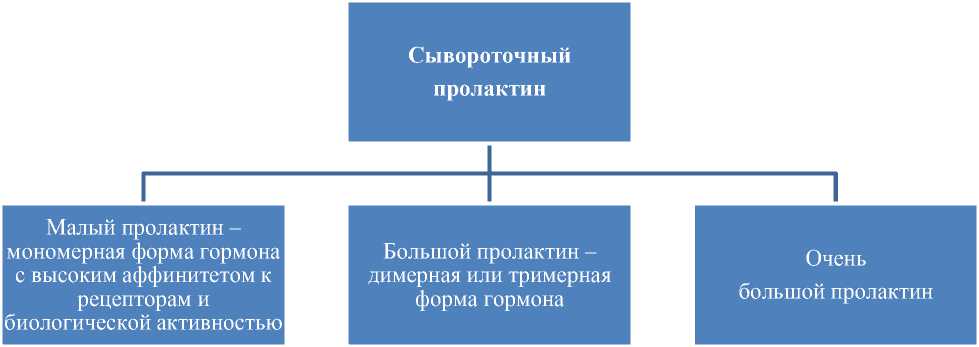
Рисунок 1. Классификация пролактина
С 28 по 40 неделю беременности (III триместр) у женщины регистрируется усиленный выброс пролактина в кровь, достигая максимума в послеродовом периоде (1–7 сутки) и во время кормления грудью. Таким образом, лактация у кормящих женщин обеспечивается секрецией пролактина аденогипофизом. Следует отметить, что продукция пролактина значимо повышается также при физической нагрузке, гипербелковой диете, половом акте, стрессовых ситуациях, во время сна [72]. После засыпания через час начинает повышаться синтез и секреция пролактина в аденогипофизе [73]. Тогда как, сразу же после пробуждения наблюдается снижение секреции пролактина. Здесь нужно подчеркнуть, что с патофизиологической точки зрения механизм обратной (отрицательной) связи для пролактина не существует. Примечательно, что наличие выделения молока во время кормления грудью свидетельствует об адекватном синтезе и секреции пролактина. Выработка пролактина зависит и от концентрации эстрогенов, серотонина, субстанции Р, гистамина, глюкокортикоидных гормонов, изменяющих число рецепторов пролактолиберина и тиреолиберина на лактотрофах.
Катепсин D. Многолетние научные изыскания показали тесное участие лизосомальных ферментов в механизмах развития перипартальной КМП. Наиболее изученным в структуре лизосомальных ферментов у лиц с перипартальной КМП значится катепсин D. В физиологических условиях роль катепсина D заключается в том, что он разрушает структурные и функциональные белки и пептиды. В научной работе И. В. Матвеевой и Ю. А. Марсяновой отмечено, что метаболическое разрушение внутриклеточных белков и ростовых факторов, активация и распад полипептидных гормонов, а также активация предшественников ферментов и т. д. принадлежит катепсину D [74]. Кроме того, катепсин D запускает процесс гидролиза белков — больших плотноупакованных субстратов с образованием пептидов. В клинике нервных болезней дисбаланс активности катепсина D проявляется возникновением тяжелых неврологических расстройств [75, 76]. Это связано с тем, что катепсин D участвует в регуляции высших мозговых функций и секреции ангиостатина. А в клинике репродуктивной системы катепсин D принимает активное участие в процессах плацентации, нормального развития и старения плаценты и т. д. [77, 78]. Изменение активности катепсина D во время беременности существенно повышает риск развития гестозов, преэклампсии [79]. А во взрослой когорте женщин избыточная активность катепсина D может приводить к различным гипер- и диспластическим процессам в эндометрии [80, 81]. Как показали исследования [82], в общей популяции стойкое повышение активности катепсина D наблюдается при злокачественных новообразованиях.
Множеством исследований установлено [83–86], что изменения в системе активности катепсина D сопровождаются развитием различных осложнений во время беременности или послеродовом периоде. Этому способствует и активация процессов свободно-радикального окисления липидов.
Приблизительно с 28 по 40 недели физиологической беременности регистрируется повышение уровня свободно-радикальных процессов на фоне увеличения активности антиоксидантной системы. Об этом свидетельствует повышение активности катепсина D у женщин с нормально протекающей беременностью [87]. В патологических условиях, чрезмерная и стойкая активация процессов перекисного окисления липидов может приводить к нарушению целостности цитоплазматических мембран. Следовательно, выход внутриклеточных гидролитических ферментов лизосом приводит к повреждению тканей. По имеющимся представлениям [88, 89], именно катепсин D является индуктором апоптоза, вызванным перекисным окислением липидов. Так, под влиянием свободных радикалов происходит повреждение структурных белков и катепсин D из лизосом перемещается в цитозоль, что сопровождаются ускорением апоптоза клеток. Отмечено, что катепсин D активирует лиганд-зависимый рецептор олигомеризации, разрушает митохондрии и цитоплазматический ретикулум, что и приводит к гибели клетки [74]. Безусловно, указанные патофизиологические процессы происходят на фоне снижения активности антиоксидантной системы, чья роль в патогенезе перипартальной КМП не вызывает сомнений. Оценивая роль катепсина D, следует отметить, что повышение его сывороточного уровня служит проявлением повреждения тканей во время беременности или послеродовом периоде. Как показывают накопленные клинические данные [90–92], повышение уровня сывороточного катепсина D отражает усиление процессов перекисного окисления липидов. В этой связи есть основание полагать, что скрининговое исследование активности катепсина D при наличии факторов риска перипартальной КМП во время беременности позволит существенно снизить риск патологии миокарда и улучшить отдаленный прогноз, поскольку физиологический рост активности катепсина D отмечается лишь к III триместру. Как утверждают исследователи [53], повышение активности сывороточного катепсина D в I триместре беременности у женщин может использоваться в качестве прогностического критерия развития гестоза, что даст возможность провести комплекс профилактических мероприятий в более ранние сроки.
Как уже было отмечено [66, 68], общий пролактин 23 кДа поддерживает процесс ангиогенеза и пролиферации клеток. Тогда как фрагмент пролактина 16 кДа обладает способностью подавлять ангиогенез, вызывать вазоспазм, апоптоз и т. д. В недавно опубликованных исследованиях подчеркивается тот факт [67, 70], что фрагмент пролактина 16кДa индуцирует эндотелиальную дисфункцию и вызывает усиление экспрессии микроРНК 146a, которая, по различным данным, оказывает токсическое влияние на миокард и развитие СН [93, 94]. Необходимость дальнейшего изучения механизмов развития перипартальной КМП продиктовано тем, что в последние годы данное заболевание стало чаще выявляться [95]. В этой связи, выдвигаются различные гипотезы, в том числе обсуждается роль растворимого рецептора фактора роста эндотелия сосудов (VEGF, vascular endothelial growth factor) [96, 97], металлопротеиназ (MMPs, matrix metalloproteinases) [98, 99], плацентарного фактора роста (PLGF, placenta growth factor) [100], а также растворимой fms-подобной тирозинкиназы-1 (sFlt-1, soluble fms-like tyrosine kinase-1) [101].
По литературным данным [102, 103], окислительный стресс в кардиомиоцитах повышает активность катепсина D, который, в свою очередь, отделяет от пролактина фрагмент 16 кДа. Как показано в исследованиях, фрагмент пролактина 16 кДа обладает апоптотическим эффектом и одновременно подавляет процесс образования кровеносных сосудов. Отмечено также, что фрагмент пролактина 16 кДа вызывает угнетение проангиогенной защиты фактора роста эндотелия сосудов. К тому же, во время беременности при перипартальной КМП существенно повышается содержание циркулирующего растворимого рецептора фактора роста эндотелия сосудов. С другой стороны, пролактин 16 кДa задерживает миграцию и пролиферацию эндотелиальных клеток, а также разрывает ранее сформированные капиллярные структуры, усиливая, тем самым, вазоконстрикцию и ухудшая функцию кардиомиоцитов [104]. Как уже было сказано, под действием фрагмента пролактина 16 кДa происходит повышение экспрессии микроРНК146а, что, в свою очередь, будет способствовать еще большему повреждению кардиомиоцитов и прогрессированию СН. Повышение сывороточного уровня катепсина D, общего пролактина и его фрагмента 16 кДа у пациента с перипартальной КМП свидетельствует о плохом прогнозе заболевания. По-видимому, в условиях выраженного снижения антиоксидантной системы повышение уровней биомаркеров повреждения тканей (катепсин D, окисленные липопротеины низкой плотности) предопределяет тяжесть течения и исход перипартальной КМП.
Как показали результаты исследовательских работ [105], производная форма пролактина 16 кДa не только ухудшает метаболические процессы и сократимость кардиомиоцитов, но и действует как кардиотоксический агент. Пролактину 16 кДа, кроме того, свойственны провоспалительный, проапоптозный и противоангиогенный эффекты [106]. Ранее также отмечалось [107], что содержание пролактина связано как с увеличением активности ангиотензина, так и снижением показателей циркулирующего эритропоэтина и артериального давления (АД).
В настоящее время всеми исследователями признано, что структурное нарушение пролактина является превалирующим патогенетическим механизмом перипартальной КМП при беременности, родах и послеродовом периоде.
Диагностика перипартальной кардиомиопатии
В клинической кардиологии используются следующие диагностические критерии, предложенные J. G. Demakis и соавторами [6, 12]:
-
- развитие симптомов в последний месяц беременности или в течение 5 месяцев после родов;
-
- отсутствие других причин для развития СН;
-
- отсутствие заболеваний сердца в период, предшествующий беременности.
В соответствии с международными рекомендациями, критериями перипартальной КМП являются [13, 15, 16]:
временной фактор (развитие симптомов СН в III триместре беременности и первые 5 месяцев после родоразрешения);
-
- отсутствие другой установленной причины кардиомегалии и СН;
-
- отсутствие какой-либо болезни сердца до последнего триместра (месяца) беременности;
-
- дисфункция ЛЖ по данным эхокардиографии (фракция выброса ЛЖ <45% и/или фракция укорочения <30% и конечный диастолический размер ЛЖ более чем 2,7 см/м2.
Электрокардиография в 12 отведениях. Невыраженная Q — волна и инверсия зубца P могут регистрироваться в III стандартном отведении. В правых грудных отведениях высота зубца R может увеличиваться, возможна фиксация отрицательного либо двухфазного зубца Т, особенно в отведении V-2. Как проявление СН, наблюдается тахикардия, различные виды нарушения возбудимости миокарда желудочков и предсердий. При значительном снижении фракции выброса ЛЖ возможны эпизоды желудочковых аритмий сердца высоких градаций. В ряде случаев, на электрокардиографии регистрируется картина субэпикардиальной ишемии — как проявление коронаритов, т. е. высокий заостренный зубец Т в грудных отведениях. У повторнородящих, старшего возраста или с сопутствующим сахарным диабетом, ожирением выявляется картина диффузной субэндокардиальной ишемии и/или блокада ножек пучка Гиса как инструментальный маркер тяжелого поражения миокарда желудочков.
Эхокардиография — широко используемый, а также безопасный для матери и плода метод ультразвуковой диагностики. Физиологические изменения параметров внутрисердечной гемодинамики при беременности изложены в аналитическом исследовании [108]. Согласно исследованиям [27], во время беременности объем циркулирующей крови увеличивается до 50% от исходных параметров, следовательно, во время физиологической беременности отмечается увеличение всех полостей сердца. В частности, на 20% увеличиваются правый желудочек и правое предсердие. Что касается левых отделов сердца, то ЛЖ увеличивается на 10%, а левое предсердие на 12%. Наряду с этим, при физиологической беременности сердечный выброс увеличивается до 50%, достигая пиковых значений к III триместру. Как следует из данных литературы [27, 108], перечисленные изменения в показателях сердца максимально выражены в течение I и II триместров физиологической беременности. Необходимо отметить, что физиологические изменения в сердечно-сосудистой системе могут сохраняться в послеродовом периоде более 40 дней. У лиц с перипартальной КМП наблюдается прогрессирующее расширение митрального и трикуспидального клапанных колец с одновременным увеличением объема регургитации крови через клапанные отверстия. Возможны эхонегативные изменения, соответствующие перикардиальному выпоту.
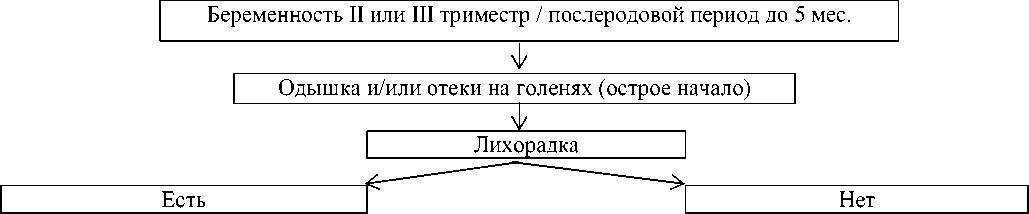
Сбор жалоб (эпидемиологический анамнез), осмотр гинеколога, ультразвуковое исследование органов малого таза, печени, почек. Рентгенография органов грудной клетки. Лабораторные исследования: СОЭ, СРБ, креатинин, альбумин, общий прокальцитонин, белок, Д-димер, калий, натрий, глюкоза, клинический анализ мочи. ПЦР тест на SARS-CoV-2.
Сбор жалоб (эпидемиологический анамнез), осмотр гинеколога, ультразвуковое исследование органов малого таза, печени, почек, щитовидной железы. Рентгенография органов грудной клетки.
Ультразвуковое исследование сосудов вен нижних конечностей. Лабораторные исследования: СОЭ, СРБ, ревматоидный фактор, АЦЦП, альбумин, общий белок, фибриноген, Д-димер, калий, натрий, глюкоза, креатинин, маркеры вирусных гепатитов, ВИЧ, ТТГ, клинический анализ мочи.
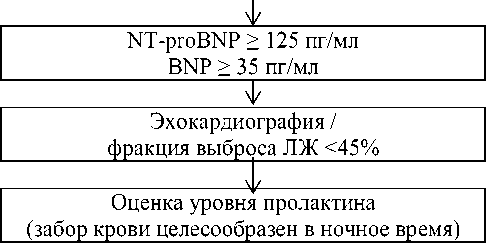
Рисунок 2. Тактика обследования пациента с подозрением на перипартальную КМП: СОЭ — скорость оседания эритроцитов; СРБ — С-реактивный белок; АЦЦП — антитела к циклическому цитруллинированному пептиду; ВИЧ — вирус иммунодефицита человека; ТТГ — тиреотропный гормон; BNP — мозговой натрийуретический пептид; ЛЖ — левый желудочек
Главным эхокардиографическим интегральным критерием перипартальной КМП является снижение фракция выброса ЛЖ <45% с и без дилатации полостей желудочков.
Снижение фракции выброса ЛЖ <30% считается плохим прогнозом. При поздней диагностике перипартальной КМП выявляются тромбы в полостях сердца. Алгоритм обследования пациента с подозрением на перипартальную КМП представлен на Рисунке 2.
В клинической практике перипартальную КМП необходимо дифференцировать со следующими заболеваниями: тромбоэмболия легочной артерий, врожденные и приобретенные пороки сердца в стадии декомпенсации, пневмония, системные заболевания соединительной ткани и т. д. В 2017 году исследователи И. В. Игнатко, Л. А. Стрижаков, Е. В. Тимохина, Н. В. Афанасьева и С. Г. Рябова детально осветили вопросы дифференциальной диагностики и тактики ведения перипартальной КМП. Многообразие клинических проявлений и скорость развития СН значительно затрудняют проведение дифференциального диагноза [109].
Ю. В. Ильина, Т. А. Федорова, Н. В. Лощиц, В. В. Ванхин (2020) подчеркивают, что перипартальную КМП сложно диагностировать в силу схожести проявлений СН в последний месяц беременности с проявлениями преэклампсии или миокардита. Отсутствие факторов риска развития ИБС в анамнезе, признаков перенесенной острой ревматической лихорадки, воздействия токсических веществ на миокард существенно суживает круг дифференциального диагноза при перипартальной КМП. Как утверждают исследователи [104], повторные беременности повышают риск рецидива перипартальной КМП даже у женщин с восстановившимися параметрами систолической функции ЛЖ.
По последним данным [110, 111], перипартальная КМП может сочетаться с различными (конкурирующими) заболеваниями после родов. Имеются сведения о развитии HELLP (внутрисосудистый гемолиз — hemolysis, H), повышение уровня печеночных трансаминаз — elevated liver enzymes, EL) и тромбоцитопения — low platelets, LP) синдрома и перипартальной КМП у 34-летней беременной в первые сутки после кесарева сечения в сроке 31–32 недели, проведенного в связи с развитием преэклампсии тяжелой степени. Как показано в таблице, симптоматология СН при перипартальной КМП классифицируется по New York Heart Association (NYHA).
Функциональные Симптомы классы
I Обычная физическая активность сохранена
II Имеет место небольшое ограничение физической активности. Сердцебиение, мышечная слабость, утомляемость, одышка наблюдаются при превышении обычной физической активности
-
III Снижение физической активности. Небольшая физическая активность
сопровождается одышкой и сердцебиением
-
IV Неспособность выполнять какую-либо нагрузку без дискомфорта. Симптомы СН
присутствуют в покое. Положение часто вынужденное.
Примечание: СН — сердечная недостаточность
В следующей части научного обзора мы решили представить клинический случай перипартальной КМП у молодой пациентки. Пациентка — К., 18 лет. В анамнезе: ранее сердечно-сосудистыми заболеваниями не страдала, со слов пациентки перенесла год назад пневмонию. Повышение артериального давления (АД) не отмечает. Физиологическая беременность протекала удовлетворительно, роды в сроке, самостоятельные. На 56 сутки после родов поступила в палату интенсивной терапии (ПИТ) с жалобами на: одышку, мышечную слабость, сердцебиение, отеки на голенях. Из анамнеза: через 1 месяц после родов (на следующий день после психоэмоционального перенапряжения) начала отмечать одышку, отсутствие сна, мышечную слабость, уменьшение лактации. В связи с чем обратилась к участковому терапевту и при лабораторном обследовании были выявлены протеинурия, ускорение скорости оседания эритроцитов (СОЭ). Объективно: общее состояние больной тяжелое, положение ортопноэ, кожа и видимые слизистые обычной окраски, отеки на голенях симметричного характера. SaО2 91% в покое на атмосферном воздухе. Частота дыхания 24 в минуту в покое. При аускультации: над легкими дыхание жесткое, не проводится в нижних отделах легких с обеих сторон. ЧСС 100 уд/мин, ритм сердца правильный, АД 120/80 мм рт. ст. Печень увеличена, нижний край закругленный, консистенция эластичная, характер гладкий и болезненный. Живот увеличен в объеме за счет толщины подкожно-жирового слоя, селезенка не пальпируется. Клинический анализ крови: гемоглобин (Hb) 110 г/л; гематокрит 32,6%, эритроциты 3,9×1012/л; лейкоциты 4,74×109/л; лимфоциты 23%, тромбоциты 351×109/л, СОЭ 30 мм/час. Клинический анализ мочи: цвет соломенно-желтый, прозрачность полная, относительная плотность 1020, реакция (рН) кислая, белок 3,2 г/л, глюкоза отрицательный, кетоновые тела отрицательный, билирубин отрицательный, уробилиноген отрицательный. Эпителий плоский 6–7–8 в поле зрения, эпителий переходной отрицательный, эпителий почечный отрицательный, лейкоциты 5–6–7 в поле зрения. Эритроциты: неизмененные большое количество, измененные большое количество в поле зрения. Цилиндры гиалиновые 0–1–1, соли не обнаружены. Суточная экскреция белка с мочой 1,5 г. Показатели биохимии крови: креатинин 60,0 мкмоль/л, расчетная скорость клубочковой фильтрации (по CKD-EPI) 127 мл/мин. Глюкоза 3,83 ммоль/л, прокальцитонин 1,0 нг/мл (менее 0,1 нг/мл), антитела к SARS-CoV-2 (COVID-19): IgG положительный, IgМ отрицательный. Тропонин I 0.18 нг/мл (норма 0–0,5 нг/мл), pH 7,347 (норма 7,32–7,43), pCO2 43,0 мм рт. ст. (норма 41,0–51,0 мм рт. ст.). Натрий 142,2 ммоль/л, калий 3,91 ммоль/л, ионизированный кальций 0,9 ммоль/л (норма 1,09–1,30 ммоль/л), общий кальций 2,19 ммоль/л (норма 2,1–2,65 ммоль/л), магний 0,77 ммоль/л (0,77– 1,03 ммоль/л), хлор 96,5 ммоль/л (норма 98,0–107,0 ммоль/л), фосфор 1,3 ммоль/л (норма 0,87–1,45 ммоль/л), HCO3 23,8 ммоль/л (норма 22,0–29,0 ммоль/л) TCO3 25,1 ммоль/л (норма 22,0–30,0 ммоль/л), лактат 3,6 ммоль/л (0,3–1,9 ммоль/л). Активность печеночных трансаминаз: АСТ 36,0 ед./л (норма 0–35 ед./л), АЛТ 30,1 ед./л (норма 0–35 ед./л), общий билирубин 10,94 мкмоль/л (норма 5–21 мкмоль/л), прямой билирубин 3,08 мкмоль/л (норма 0–5,1 мкмоль/л), альбумин 34,07 г/л (норма 35–52 г/л), общий белок 62,1 г/л (норма 66–85 г/л), мочевина 3,92 ммоль/л (норма 2,8–7,2 ммоль/л), общий холестерин 5,1 ммоль/л (норма 0–5,2 ммоль/л), С-реактивный белок 29,83 мг/л (норма 0–8 мг/л). Протромбиновый индекс по Квику 60,7% (норма 70–120%), протромбиновое время 16,7 секунд (норма 10–18 секунд), международное нормализованное отношение 1,32 ед. (норма 1,0–1,13 ед.), активированное частичное тромбопластиновое время 26,3 сек (норма 23,0–39,0 сек), фибриноген А 2,77 г/л (норма 2,0–4,0 г/л), Д-димер 2,03 мкгФЭЕ/мл (норма <0,5 мкгФЭЕ/мл), лактатдегидрогеназы 384,34 Е/л (норма 0–248,0 Е/л), мочевая кислота 453,99 мкмоль/л (норма 154,7–357 мкмоль/л), креатинкиназа 259,13 U/L (норма 30–223 U/L), протромбиновое время 14,7 секунд (норма 10–18 сек), Д-димер 0,84 мкгФЭЕ/мл (норма <0,5 мкгФЭЕ/мл), пролактин 280 мМЕ/л (норма 40–600 мМЕ/л).
В динамике наблюдения и лечения у пациентки выросла активность воспаления, т. е. концентрация С-реактивного белка стала увеличиваться, составляя 77,88 мг/л и 112,85 мг/л, при этом лихорадка не отмечалась. Нарушение тиреоидного профиля не фиксировалось. В этой связи пациентка обследовалась на предмет специфического процесса в легких. Исследование мокроты на микобактерии туберкулеза дало отрицательный результат, с помощью пробы Xpert MTB/RIF (Mycobacterium tuberculosis and its resistance to rifampicin) микобактерии туберкулеза не обнаружены. Учитывая клинику СН проведена эхокардиография, где аорта не показала изменений, диаметр аорты на уровне синусов Вальсальвы 2,9 см, в восходящем отделе 2,8 см, раскрытие аортального клапана 1,6 см. Правое предсердие не расширено, размер левого предсердия 4,1 см, индекс объема левого предсердия 53 мл/м2. Конечный систолический размер ЛЖ 3,7 см, конечный диастолический размер ЛЖ 4,8 см, фракция выброса ЛЖ 35% (по Симпсону). Конечный систолический объем ЛЖ 61 мл, конечный диастолический объем ЛЖ 85 мл, толщина межжелудочковой перегородки 0,9 см, толщина задней стенки ЛЖ 0,9 см. Диффузный гипокинез стенок ЛЖ и ПЖ. Размер правого желудочка 2,8 см, толщина передней стенки правого желудочка 0,4 см. Легочная артерия не расширена, диаметр 2,4 см. Среднее легочное давление 32 мм рт. ст. Отмечается уплотнение створок митрального и аортального клапанов. Диастолическая функция ЛЖ и тахикардия. Межпредсердная и межжелудочковая перегородки интактны, данных за наличие сброса крови нет. В полости перикарда за задней стенкой ЛЖ определяется незначительное количество жидкости (сепарация листков в диастолу 0,4 см). Учитывая показатели СОЭ пациентка осмотрена гинекологом, исключены патологии органов малого таза. При рентгенографии органов грудной клетки явление центрального венозного застоя и двусторонний плевральный выпот. На электрокардиографии — синусовая тахикардия. По результатам ультразвукового исследования внутренних органов структурной патологии выявлено не было, фиксировался плевральный выпот с обеих сторон. Установлен клинический диагноз: Перипартальная кардиомиопатия. Сердечная недостаточность функциональный класс III–IV (по NYHA). Острое повреждение почек, в стадии риска / повреждение. Проводилась терапия: низкопоточная кислородотерапия, петлевые диуретики, изосорбида динитрат, ингибиторы ангиотензинпревращающего фермента, антагонисты минералокортикоидных рецепторов, сердечные гликозиды, ингибиторы секреции пролактина и стимуляторы дофаминовых рецепторов. На фоне проводимой терапии общее состояние пациентки стабилизировалось: одышку в покое не отмечает, сердцебиение не беспокоит, положение активное, отеки на голенях исчезли, гемодинамика стабильная, расширилась физическая активность. При лабораторном исследовании нормализовались показатели СОЭ, С-реактивного белка, протеинурия исчезла, на повторном ультразвуковом исследовании значительно уменьшился объем плеврального выпота. В амбулаторных условиях пациентке рекомендованы прием ингибиторов ангиотензинпревращающего фермента, антагонистов минералокортикоидных рецепторов, а также ингибиторов секреции пролактина. Во время промежуточного контрольного осмотра фракция выброса ЛЖ существенно улучшилась (>47%) и восстановилась работоспособность. Представленный клинический случай интересен тем, что перипартальная КМП развилась на фоне воздействия внезапного стрессорного агента в послеродовом периоде. Систолическая дисфункция ЛЖ сопровождалась появлением протеинурии субнефротического уровня. Уместно будет подчеркнуть, что за небольшой период наблюдения произошло восстановление сократительной функции ЛЖ и общеклинических показателей. Обращает на себя внимание тот факт, что в нашем наблюдении у пациентки с перипартальной КМП сывороточные уровни пролактина оставалось без отклонений (пролактин 280 мМЕ/л при норме 40–600 мМЕ/л). По-видимому, внезапное воздействие стрессорного фактора привело не только к нарушению структурной последовательности аминокислотного остатка пролактина, но и ее торможение синтеза и секреции аденогипофизом в системный кровоток. Возможно определение сывороточного пролактина по классам (малый, большой, очень большой, гликолизированный пролактин) дало бы нам более полную картину патофизиологического процесса. Действительно, соответствие клинических проявлений СН с параметрами эхокардиографии повышает информативность перипартальной КМП. В доступной литературе мы не нашли полного объяснения столь быстрому улучшению глобальной функции ЛЖ на фоне стандартной терапии СН и раннего включения в схемы лечения ингибиторов секреции пролактина. Здесь стоит заметить, что согласно классическим критериям [112], на момент развития заболевания невозможно было исключить ни перипартальную кардиомиопатию, ни синдром Такоцубо и ни миокардит.
В последнее пятилетие появились сообщения [113], что физическое и/или функциональное состояние женщин находится в прямой связи с высоким уровнем стресса в период менопаузы. Очевидно, что женщины во время беременности и родов подвергаются эндогенному стрессу, а наслоение психоэмоционального перенапряжения в несколько раз повышает риски различных осложнений и перипартальной КМП, в том числе. Описание данного клинического случая служит демонстрацией того, что при выявлении снижения сократительной функции ЛЖ необходим тщательный поиск причин с целью своевременной диагностики перипартальной КМП и как можно раннего проведения терапии, модулирующей патобиологические эффекты пролактина.
Список литературы Перипартальная кардиомиопатия
- Стрижаков А. Н., Игнатко И. В., Тимохина Е. В. Имитаторы тяжелой преэклампсии: вопросы дифференциальной диагностики и мультидисциплинарного ведения // Акушерство, гинекология и репродукция. 2019. Т. 13. №1. С.70-78. https://doi.org/10.17749/2313-7347.2019.13.1.070-078
- Itoh-Satoh M., Hayashi T., Nishi H., Koga Y., Arimura T., Koyanagi T., Takahashi M., Hohda S., Ueda K., Nouchi T., Hiroe M., Marumo F., Imaizumi T., Yasunami M., Kimura A. Titin mutations as the molecular basis for dilated cardiomyopathy // Biochem. Biophys. Res. Commun.journal. 2002. February (vol. 291, no. 2). P. 385-393. https://doi.org/10.1006/bbrc.2002.6448
- Gouley B. A. Idiopathic myocardial degeneration associated with pregnancy and especially the peripartum // Am J Med Sci. 1937. V. 19. P. 185-199.
- Seftel H. C. Cardiomyopathies in Johannesburg Bant-Part II. Aetiology of idiopathic cardiomyopathy // South African medical journal. 1972. V. 46. №47. P. 1823-1828.
- Susser M., Cherry V. P. Health and health care under apartheid // Journal of Public Health Policy. 1982. V. 3. №4. P. 455-475.
- Demakis J. G., Rahimtoola S. H., Sutton G. C., Meadows W. R., Szanto P. B., Tobin J. R., Gunnar R. M. Natural course of peripartum cardiomyopathy // Circulation. 1971. V. 44. №6. P. 1053-1061. https://doi.org/10.1161/01.cir.44.6.1053
- Van Spaendonck-Zwarts K. Y., van Tintelen J.P., van Veldhuisen D.J., van der Werf R., Jongbloed J. D., Paulus W. J., Dooijes D., van den Berg M.P. Peripartum cardiomyopathy as a part of familial dilated cardiomyopathy // Circulation. 2010. V. 121. №20. P. 2169-2175. https://doi .org/10.1161/circulationaha.109.929646
- Jackson A. M., Petrie M. C., Frogoudaki A., Laroche C., Gustafsson F., Ibrahim B., ... & PPCM Investigators Group. Hypertensive disorders in women with peripartum cardiomyopathy: insights from the ESC EORP PPCM Registry // European journal of heart failure. 2021. V. 23. №12. P. 2058-2069. https://doi.org/10.1002/ejhf.2264
- Arany Z., Elkayam U. Peripartum cardiomyopathy // Circulation. 2016. V. 133. №14. P. 1397-1409. https://doi.org/10.1161/CIRCULATIONAHA.115.020491
- Lampert M. B., Lang R. M. Peripartum cardiomyopathy // American heart journal. 1995. V. 130. №4. P. 860-870. https://doi.org/10.1016/0002-8703(95)90089-6
- Honigberg M. C., Givertz M. M. Peripartum cardiomyopathy // Bmj. 2019. V. 364. https://doi.org/10.1136/bmj.k5287
- Demakis J. G., Rahimtoola S. H. Peripartum cardiomyopathy // Circulation. 1971. V. 44. №5. P. 964-968. https://doi.org/10.1161/01.CIR.44.5.964
- Regitz-Zagrosek V., Roos-Hesselink J. W., Bauersachs J., Blomström-Lundqvist C., Cifkova R., De Bonis M., Warnes C. A. 2018 ESC guidelines for the management of cardiovascular diseases during pregnancy: the task force for the management of cardiovascular diseases during pregnancy of the European Society of Cardiology (ESC) // European heart journal. 2018. V. 39. №34. P. 3165-3241. https://doi.org/10.1093/eurheartj/ehy340
- Sliwa K., Petrie M. C., van der Meer P., Mebazaa A., Hilfiker-Kleiner D., Jackson A. M., Bauersachs J. Clinical presentation, management, and 6-month outcomes in women with peripartum cardiomyopathy: an ESC EORP registry // European heart journal. 2020. V. 41. №39. P. 3787-3797. https://doi.org/10.1093/eurheartj/ehaa455
- Cífková R., Johnson M. R., Kahan T., Brguljan J., Williams B., Coca A., De Simone G. Peripartum management of hypertension: a position paper of the ESC Council on Hypertension and the European Society of Hypertension // European Heart Journal-Cardiovascular Pharmacotherapy. 2020. V. 6. №6. P. 384-393. https://doi.org/10.1093/ehjcvp/pvz082
- Mbakwem A. C., Bauersachs J., Viljoen C., Hoevelmann J., van der Meer P., Petrie M. C. Electrocardiographic features and their echocardiographic correlates in peripartum cardiomyopathy: results from the ESC EORP PPCM registry // ESC heart failure. 2021. V. 8. №2. P. 879-889. https://doi.org/10.1002/ehf2.13172
- Pfeffer T. J., Mueller J. H., Haebel L., Erschow S., Yalman K. C., Talbot S. R., RickeHoch M. Cabergoline treatment promotes myocardial recovery in peripartum cardiomyopathy // ESC Heart Failure. 2023. V. 10. №1. P. 465-477. https://doi.org/10.1002/ehf2.14210
- Королева Е. Б., Востокова А. А. Перипартальная кардиомиопатия. Диагноз, прогноз, значение для материнской смертности // Медицинский альманах. 2009. №4. С. 82-86.
- Sliwa K., Hilfiker-Kleiner D., Petrie M. C., Mebazaa A., Pieske B., Buchmann E., McMurray J. J. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy // European journal of heart failure. 2010. V. 12. №8. P. 767-778. https://doi.org/10.1093/eurjhf/hfq120
- Кузнецов Г. П. Перипартальная кардиомиопатия. ^временное состояние проблемы // Новости медицины и фармации. 2014. №1-2. С. 485-486.
- Mishra V. N., Mishra N. Peripartum cardiomyopathy // The Journal of the Association of Physicians of India. 2013. V. 61. №4. P. 268-273.
- Karay K. M. Original: Peripartum Cardiomyopathy: A Review Article: West Afr J Med. 2023 Jan 30; 40 (1): 104-113 // West Africa Journal of Medicine. 2023. V. 40. №1. P. 104-113.
- Robbins L. S., Szychowski J. M., Nassel A., Arora G., Armour E. K., Walker Z., Sinkey R. G. Geographic disparities in peripartum cardiomyopathy outcomes // American Journal of Obstetrics & Gynecology MFM. 2023. V. 5. №2. P. 100788. https://doi.org/10.1016/j.ajogmf.2022.100788
- Eva G., Budayasa A. A. G. R., Putra A. A. G. I., Bagiari K. E. Peripartum Cardiomyopathy: A Case Management Series At Sanjiwani Hospital // Andalas Obstetrics And Gynecology Journal. 2023. V. 7. №1. P. 320-329.
- Rene C., Faustin M., Bonhomme J., Deschamps M. M., Jean-Gilles M., Rosenberg R., Devieux J. G. An Adapted Self-screening Tool for Peripartum Cardiomyopathy in Haiti // Critical Pathways in Cardiology. 2023. V. 22. №1. P. 19-24. https://doi.org/10.1097/HPC.0000000000000312
- Gaikwad V., Shaikh M. D., Chigullapalli S. Expect the Unexpected-Case Series of Peripartum Cardiomyopathy // Journal of Pharmaceutical Negative Results. 2023. P. 1930-1933. https://doi.org/10.47750/pnr.2023.14.S02.231
- Ватутин Н. Т., Тарадин Г. Г., Корниенко С. М., Тараторина А. А., Риджок В. В.. Современные представления о перипартальной кардиомиопатии (часть 2): клиника, диагностика, течение, лечение // Российский кардиологический журнал. 2015. №1 (117). С. 95-103. https://doi.org/10.15829/1560-4071-2015-1-95-103
- Ватутин Н. Т., Тарадин Г. Г., Попелнухина Л. Г., Гриценко Ю. П., Сидоренко И. А. Лечение перипартальной кардиомиопатии (обзор литературы) // Архивъ внутренней медицины. 2017. Т. 7. №5. С. 340-349. https://doi.org/10.20514/2226-6704-2017-7-5-340-349
- Majdalani P., Levitas A., Krymko H., Slanovic L., Braiman A., Hadad U., Parvari R. A Missense Variation in PHACTR2 Associates with Impaired Actin Dynamics, Dilated Cardiomyopathy, and Left Ventricular Non-Compaction in Humans // International Journal of Molecular Sciences. 2023.V. 24. №2. P. 1388. https://doi.org/10.3390/ijms24021388
- Shu L., Maroilley T., Tarailo-Graovac M. The Power of Clinical Diagnosis for Deciphering Complex Genetic Mechanisms in Rare Diseases // Genes. 2023. V. 14. №1. P. 196. https://doi .org/10.3390/genes14010196
- Siu B. L., Niimura H., Osborne J. A., Fatkin D., MacRae C., Solomon S., Seidman C. E. Familial dilated cardiomyopathy locus maps to chromosome 2q31 // Circulation. 1999. V. 99. №8. P. 1022-1026. https://doi.org/10.1161/01.CIR.99.8.1022
- Sun Y., Wang H., Huang M., Li K., Song X., Xiao L., Wang D. W. Reassessment of genes associated with dilated and hypertrophic cardiomyopathy in a Chinese Han population // The Journal of Cardiovascular Aging. 2023. V. 3. №1. P. 12. https://doi.org/10.20517/jca.2022.44
- Hucke A., Gärtner A., von Frieling-Salewski M., Unger A., Koser F., Regnier M., Linke W. Study of the expression of Cronos titin in TTN-truncation cardiomyopathy and heart development // Journal of Molecular and Cellular Cardiology. 2022. V. 173. P. 71. https://doi.org/10.1016/j.yjmcc.2022.08.144
- Park J., Moon Y. J., Kim D. S. Miyoshi Muscular Dystrophy Type 1 with Mutated DYSF Gene Misdiagnosed as Becker Muscular Dystrophy: A Case Report and Literature Review // Genes. 2023. V. 14. №1. P. 200. https://doi.org/10.3390/genes14010200
- Venturelli N., Tordjman M., Ammar A., Chetrit A., Renault V., Carlier R. Y. Contribution of muscle MRI for diagnosis of myopathy // Revue Neurologique. 2023. V. 179. №1-2. P. 61-80. https://doi.org/10.1016/j. neurol.2022.12.002
- Ganassi M., Muntoni F., Zammit P. S. Defining and identifying satellite cell-opathies within muscular dystrophies and myopathies // Experimental Cell Research. 2022. V. 411. №1. P. 112906. https://doi .org/10.1016/j .yexcr.2021.112906
- Chintanaphol M., Orgil B. O., Alberson N. R., Towbin J. A., Purevjav E. Restrictive cardiomyopathy: from genetics and clinical overview to animal modeling // Reviews in Cardiovascular Medicine. 2022. V. 23. №3. P. 108. https://doi.org/10.31083/j.rcm2303108
- Treichel A. M., Boeszoermenyi B., Lee C. C. R., Moss J., Kwiatkowski D. J., & Darling T. N. Diagnosis of Mosaic Tuberous Sclerosis Complex Using Next-Generation Sequencing of Subtle or Unusual Cutaneous Findings // JID Innovations. 2023. V. 3. №2. P. 100180. https://doi.Org/10.1016/j.xjidi.2023.100180
- Morales A., Painter T., Li R., Siegfried J. D., Li D., Norton N., Hershberger R. E. Rare variant mutations in pregnancy-associated or peripartum cardiomyopathy // Circulation. 2010. V. 121. №20. P. 2176-2182. https://doi.org/10.1161/CIRCULATI0NAHA.109.931220
- Dawood M. Cardiomyopathies //Clinical and Surgical Aspects of Congenital Heart Diseases: Text and Study Guide. - Cham: Springer International Publishing, 2023. P. 131-139. https://doi.org/10.1007/978-3-031-23062-2_17
- El Hadi H., Freund A., Desch S., Thiele H., Majunke N. Hypertrophic, dilated, and arrhythmogenic cardiomyopathy: Where are we? // Biomedicines. 2023. V. 11. №2. P. 524. https://doi.org/10.3390/biomedicines11020524
- Рудаева Е. В., Хмелева И. А., Мозес К .Б., Мозес В. Г., Захаров И. С., Елгина С. И., Марцияш А. А., Колпинский Г. И., Шапкин А. А. Перипартальная кардиомиопатия: эпидемиология, патогенез, акушерская тактика // Комплексные проблемы сердечнососудистых заболеваний. 2021. Т. 10. №1. С. 73-82. https://doi.org/10.17802/2306-1278-2021-10-1-73-82
- Gunderson E. P., Croen L. A., Chiang V., Yoshida C. K., Walton D., Go A. S. Epidemiology of peripartum cardiomyopathy: incidence, predictors, and outcomes // Obstetrics & Gynecology. 2011. V. 118. №3. P. 583-591. https://doi.org/10.1097/A0G.0b013e318229e6de
- Napolitano G., Fasciolo G., Venditti P. Aging, mitochondrial dysfunctions, and vitamin E // Molecular Nutrition and Mitochondria. Academic Press, 2023. P. 131-165. https://doi.org/10.1016/B978-0-323-90256-4.00025-4
- Sawada Y., Ichikawa H., Ebine N., Minamiyama Y., Alharbi A. A. D., Iwamoto N., Fukuoka Y. Effects of High-Intensity Anaerobic Exercise on the Scavenging Activity of Various Reactive Oxygen Species and Free Radicals in Athletes // Nutrients. 2023. V. 15. №1. P. 222. https://doi.org/10.3390/nu15010222
- Hamayel M. A., Attia F. A., El-Sayed Z. H., Youness E. R., Mohamed J. A. Effect Of Vitamin E On Oxidative Stress Indicated By Serum Malondialdehyde And Paroxonase Level In Type 2 Diabetes Mellitus With Retinopathy // Journal of Pharmaceutical Negative Results. 2023. P. 737-743. https://doi.org/10.47750/pnr.2023.14.S02.90
- Gambaro R. C., Seoane A., Padula G. Vitamin E protective effects on genomic and cellular damage caused by paediatric preventive supplementation for anaemia: an experimental model // British Journal of Nutrition. 2023. V. 129. №3. P. 468-477. https://doi.org/10.1017/S0007114522001556
- Guo K., Zhang R., Luo L., Wang S., Xu W., Zhao Z. Effects of Thermal Stress on the Antioxidant Capacity, Blood Biochemistry, Intestinal Microbiota and Metabolomic Responses of Luciobarbus capito // Antioxidants. 2023. V. 12. №1. P. 198. https://doi.org/10.3390/antiox12010198
- Галеева С. А., Таджибоева Н. А. Роль микровезикул тромбоцитов в патогенезе преэклампсии // Казанский медицинский журнал. 2022. Т. 103. №4. С. 641-649. https://doi.org/10.17816/KMJ2022-641
- Prickett M. A., Howell C. M. A patient with untreated preeclampsia and peripartum cardiomyopathy // JAAPA. 2023. V. 36. №3. P. 25-27. https://doi.org/10.1097/01.JAA.0000911224.29850.f5
- Zahid S., Michos E. D. Development and validation of a machine learning risk-prediction model for acute peripartum cardiovascular complications among individuals with preeclampsia at the time of delivery admissions // Journal of the American College of Cardiology. 2023. V. 81. №8_Supplement. P. 2139-2139.
- Morales-Martínez L. C., Aguilar-Torres C., Madrid-Dour E. A., Mario-Hernández Ó., Mariñelarena-Carrillo E. O. Congestive heart failure in pregnancy secondary to peripartum cardiomyopathy. Case report // Ginecología y Obstetricia de México. 2023. V. 90. №12. P. 10001009. https://doi.org/10.1016/S0735-1097(23)02583-4
- Борзова Н. Ю., Герасимов А. М., Скрипкина И. Ю., Кузьменко Г. Н. Роль катепсина D в патогенезе гестоза // Вестник новых медицинских технологий. 2009. Т. 16. №3. С. 54-56.
- Selye H. A syndrome produced by diverse nocuous agents // Nature. 1936. V. 138. №3479. P. 32-32. https://doi.org/10.1038/138032a0
- Салехов С. А., Прошина Л. Г. Влияние стресса во время беременности на формирование предрасположенности к развитию психосоматики // Вестник Новгородского государственного университета им. Ярослава Мудрого. 2020. Т. 1. №117. С. 71-74. https://doi.org/10.34680/2076-8052.2020.1(117).71-74
- Erhabor G. E. Peripartum Cardiomyopathy: An Important Cause of Maternal Morbidity and Mortality! West Afr J Med. 2023 Jan 30; 40 (1): 1 // West Africa Journal of Medicine. 2023. V. 40. №1. P. 1-1.
- Suryawan A., Rahardjo T. M., Damario F. F., Witjaksono A. O., Sugiaman A. M., Clementine K., Rena I. M. P. Peri Partum Cardiomyopathy: A Case Report // Medical Clinical Update. 2023. V. 2. №1. P. 48-51. https://doi.org/10.58376/mcu.v2i1.33
- Baltaji S., Noronha S. F., Patel S., Kaura A. Obstetric Emergencies // Critical Care Nursing Quarterly. 2023. V. 46. №1. P. 66-81. https://doi.org/10.1097/CNQ.0000000000000438
- Hilfiker-Kleiner D., Meyer G. P., Schieffer E., Goldmann B., Podewski E., Struman I., Drexler H. Recovery from postpartum cardiomyopathy in 2 patients by blocking prolactin release with bromocriptine // Journal of the American College of Cardiology. 2007. V. 50. №24. P. 23542355. https://doi.org/10.1016/jjacc.2007.10.006
- Mujkanovic J., Qayyum A. A. Review of Randomized Controlled Trials in Patients with Peripartum Cardiomyopathy // Current Cardiology Reviews. 2022. https://doi.org/10.2174/1573403x18666220823151854
- Berliner D., Li, T., Mariani S., Hamdan R., Hanke J., König T., Schmitto J. D. Clinical characteristics and long-term outcomes in patients with peripartum cardiomyopathy (PPCM) receiving left ventricular assist devices (LVAD) // Artificial Organs. 2023. V. 47. №2. P. 417-424. https://doi.org/10.1111/aor.14406
- Freeman M. E., Kanyicska B., Lerant A., Nagy G. Prolactin: structure, function, and regulation of secretion // Physiological reviews. 2000. https://doi.org/10.1152/physrev.2000.80.4.1523
- Романцова Т. И. Репродукция и энергетический баланс: интегративная роль пролактина // Ожирение и метаболизм. 2014. №1. С. 5-18. https://doi.org/10.14341/OMET201415-18
- Wilson A. B., Whittington C. M., Meyer A., Scobell S. K., Gauthier M. E. Prolactin and the evolution of male pregnancy // General and Comparative Endocrinology. 2023. P. 114210. https://doi .org/10.1016/j.ygcen.2023.114210
- Liang Y., Cui J., Yang G., Leung F. C., Zhang X. Polymorphisms of 5' flanking region of chicken prolactin gene // Domestic Animal Endocrinology. 2006. V. 30. №1. P. 1-16. https://doi.org/10.1016/j.domaniend.2005.05.006
- Gorvin C. M., Newey P. J., Thakker R. V. Identification of prolactin receptor variants with diverse effects on receptor signalling // Journal of Molecular Endocrinology. 2022. P. JME-22.
- Solomon G., Oclon E., Hayouka Z., Gertler A. Preparation of Superactive Prolactin Receptor Antagonists // Endocrinology. 2023. V. 164. №1. P. bqac186. https://doi .org/10.1210/endocr/bqac 186
- Hannan F. M., Elajnaf T., Vandenberg L. N., Kennedy S. H., Thakker R. V. Hormonal regulation of mammary gland development and lactation // Nature Reviews Endocrinology. 2023. V. 19. №1. P. 46-61. https://doi.org/10.1038/s41574-022-00742-y
- Тихомиров А. Л., Лубнин Д. М., Олейник Ч. Г. Гиперпролактинемия: диагностика и современные методы лечения бромокриптином // Русский медицинский журнал. 2002. Т. 10. №15. С. 634-637.
- Cherubin S., Peoples T., Gillard J., Lakhal-Littleton S., Kurinczuk J. J., Nair M. Systematic review and meta-analysis of prolactin and iron deficiency in peripartum cardiomyopathy // Open Heart. 2020.V. 7. №2. P. e001430. http://dx.doi.org/10.1136/openhrt-2020-001430
- Faron-Gorecka A., Latocha K., Pabian P., Kolasa M., Sobczyk-Krupiarz I., Dziedzicka-Wasylewska M. The Involvement of Prolactin in Stress-Related Disorders // International Journal of Environmental Research and Public Health. 2023. V. 20. №4. P. 3257. https://doi .org/10.3390/ij erph20043257
- Vas S., Papp R. S., Konczol K., Bogathy E., Papp N., Adori C., Toth Z. E. Prolactin-releasing peptide contributes to stress-related mood disorders and inhibits sleep/mood regulatory melanin-concentrating hormone neurons in rats // Journal of Neuroscience. 2023. V. 43. №5. P. 846862. https://doi.org/10.1523/JNEUROSCI.2139-21.2022
- Abdulateef D. S. Correlation of serum prolactin with sleep duration, wake-up hour, and phases of the menstrual cycle in healthy adult subjects // Sleep and Biological Rhythms. 2023. P. 19. https://doi.org/10.1007/s41105-023-00448-2
- Матвеева И. В., Марсянова Ю. А. Физиологическая роль катепсина D // Биохимические научные чтения памяти академика РАН ЕА Строева. 2016. С. 12-15.
- Yu D., Cai W., Chen X., Lu D., Hu M., Lu T., Lu Z. Natural Killer Cells Disrupt Nerve Fibers by Granzyme H in Atheriosclerotic Cerebral Small Vessel Disease // The Journals of Gerontology: Series A. 2023. V. 78. №3. P. 414-423. https://doi.org/10.1093/gerona/glac173
- Hammerschmidt T. G., Encarna9ao M., Faverzani J. L., de Fatima Lopes F., de Oliveira F. P., de Sousa C. F. M., Vargas C. R. Molecular profile and peripheral markers of neurodegeneration in patients with Niemann-Pick type C: Decrease in Plasminogen Activator Inhibitor type 1 and Platelet-Derived Growth Factor type AA // Archives of Biochemistry and Biophysics. 2023. P. 109510. https://doi.org/10.1016/j.abb.2023.109510
- Markl-Hahn H., Neugebauer L., Lenke L., Ecker S., Merz T., McCook O., Triebel J. Human Placental Tissue Contains A Placental Lactogen-Derived Vasoinhibin // Journal of the Endocrine Society. 2022. V. 6. №4. P. bvac029. https://doi.org/10.1210/jendso/bvac029
- Varanou A., Withington S. L., Lakasing L., Williamson C., Burton G. J., Hemberger M. The importance of cysteine cathepsin proteases for placental development // Journal of molecular medicine. 2006. V. 84. P. 305-317. https://doi.org/10.1007/s00109-005-0032-2
- Lu F., Gong H., Lei H., Li J. Downregulation of cathepsin C alleviates endothelial cell dysfunction by suppressing p38 MAPK/NF-kB pathway in preeclampsia // Bioengineered. 2022. V. 13. №2. P. 3019-3028. https://doi.org/10.1080/21655979.2021.2023994
- Чикин В. Г., Ерохина А. А., Пчелинцев В. В. Активность лизосомальных ферментов при неосложненном послеродовом периоде и эндометрите // Российский медико-биологический вестник им. академика И.П. Павлова. 2014. Т. 22. №2. C. 31-35. https://doi .org/10.17816/PAVLOVJ2014231 -35
- Amaral A., Cebóla N., Szóstek-Mioduchowska A., Rebordao M. R., Kordowitzki P., Skarzynski D., Ferreira-Dias G. Inhibition of Myeloperoxidase Pro-Fibrotic Effect by Noscapine in Equine Endometrium // International Journal of Molecular Sciences. 2023. V. 24. №4. P. 3593. https://doi .org/10.3390/ij ms24043593
- Shen S., Tu C., Shen H., Li J., Frangou C., Zhang J., Qu J. Comparative Proteomics Analysis of Exosomes Identifies Key Pathways and Protein Markers Related to Breast Cancer Metastasis // International Journal of Molecular Sciences. 2023. V. 24. №4. P. 4033. https://doi.org/10.3390/ijms24044033
- Contractor S. F., Mason R. M., Oakey M. Purification and properties of human placental cathepsin D // Placenta. 1982. V. 3. №1. P. 45-55. https://doi.org/10.1016/S0143-4004(82)80017-9
- Arany Z., Hilfiker-Kleiner D., Karumanchi S. A. Animal models of cardiovascular complications of pregnancy // Circulation Research. 2022. V. 130. №12. P. 1763-1779. https://doi.org/10.1161/CIRCRESAHA.122.320395
- Cheng S., Huang Z., Jash S., Wu K., Saito S., Nakashima A., Sharma S. Hypoxia-Reoxygenation Impairs Autophagy-Lysosomal Machinery in Primary Human Trophoblasts Mimicking Placental Pathology of Early-Onset Preeclampsia // International Journal of Molecular Sciences. 2022. V. 23. №10. P. 5644. https://doi.org/10.3390/ijms23105644
- Ortega M. A., Fraile-Martinez O., García-Montero C., Funes Moñux R. M., Rodriguez-Martin S., Bravo C., Alvarez-Mon M. A. The placentas of women who suffer an episode of psychosis during pregnancy have increased lipid peroxidation with evidence of ferroptosis // Biomolecules. 2023. V. 13. №1. P. 120. https://doi.org/10.3390/biom13010120
- San Juan-Reyes S., Gómez-Oliván L. M., San Juan-Reyes N., Islas-Flores H., Dublán-García O., Orozco-Hernández J. M., Mejia-Garcia A. (2023). Women with preeclampsia exposed to air pollution during pregnancy: Relationship between oxidative stress and neonatal disease-Pilot study. Science of The Total Environment, 871, 161858. Women with preeclampsia exposed to air pollution during pregnancy: Relationship between oxidative stress and neonatal disease-Pilot study // Science of The Total Environment. 2023. V. 871. P. 161858. https://doi.org/10.1016/j. scitotenv.2023.161858
- Murotomi K., Umeno A., Shichiri M., Tanito M., Yoshida Y. Significance of Singlet Oxygen Molecule in Pathologies // International Journal of Molecular Sciences. 2023. V. 24. №3. P. 2739. https://doi.org/10.3390/ijms24032739
- Bastani S., Vahedian V., Rashidi M., Mir A., Mirzaei S., Alipourfard I., Akbarzadeh M. An evaluation on potential anti-oxidant and anti-inflammatory effects of Crocin // Biomedicine & Pharmacotherapy. 2022. V. 153. P. 113297. https://doi.org/10.1016/j.biopha.2022.113297
- Веселовская Н. Г., Чумакова Г. А., Николаева М. Г., Горбачева Н. С., Отт А. В. Перипартальная кардиомиопатия: патогенез, клиника, диагностика, лечение, прогноз // Русский медицинский журнал. 2021. №10. С. 44-48.
- Kim H. Y., Baek H. S. Circulating cathepsin B and D in pregnancy // Journal of Obstetrics and Gynaecology. 2019. V. 39. №1. P. 17-21. https://doi.org/10.1080/01443615.2018.1454412
- Polsinelli V. B., Hanley-Yanez K., McTiernan C. F., Elkayam U., Cooper L. T., Fett J. D., McNamara D. M. Cathepsin-D and Outcomes in Peripartum Cardiomyopathy: Results From IPAC // Circulation. 2019. V. 140. №Suppl_1. P. A14109-A14109.
- Domaszk O., Skwarek A., Wojciechowska M. In Search of the Holy Grail: Stem Cell Therapy as a Novel Treatment of Heart Failure with Preserved Ejection Fraction // International Journal of Molecular Sciences. 2023. V. 24. №5. P. 4903. https://doi.org/10.3390/ijms24054903
- Parhizkar F., Kiani A., Darzi S., Motavalli R., Dolama F. N., Yousefzadeh Y., Soltani-Zangbar M. S. The evaluation of CD39, CD73, and HIF-1 a expression besides their related miRNAs in PBMCs of women with recurrent pregnancy loss // Journal of Reproductive Immunology. 2023. V. 156. P. 103820. https://doi.org/10.1016/jjri.2023.103820
- Mebazaa A., Seronde M. F., Gayat E., Tibazarwa K., Anumba D. O., Akrout N., Sliwa K. Imbalanced angiogenesis in peripartum cardiomyopathy—diagnostic value of placenta growth factor // Circulation Journal. 2017. V. 81. №11. P. 1654-1661. https://doi.org/10.1253/circj.CJ-16-1193
- Altendahl M., Mok T., Adimkpayah E., Goldstein J., Lin J., Afshar Y. Vascular malperfusion and abruption are prevalent in placentas from pregnancies with congenital heart disease and not associated with cardiovascular risk // Scientific Reports. 2023. V. 13. №1. P. 1439. https://doi.org/10.1038/s41598-023-28011-6
- Hoes M. F., Arany Z., Bauersachs J., Hilfiker-Kleiner D., Petrie M. C., Sliwa K., van der Meer P. Pathophysiology and risk factors of peripartum cardiomyopathy // Nature Reviews Cardiology. 2022. V. 19. №8. P. 555-565. https://doi.org/10.1038/s41569-021-00664-8
- Melekoglu R., Ünüvar S., Türkmen N. B., ^etin A., ^elik N. Z., Yüce H., Ya§ar §. Evaluation of serum neopterin, periostin, Tenascin-C, tissue inhibitor of metalloproteinase-1 and matrix metalloproteinase-2 levels in obese pregnant women // Turkish Journal of Obstetrics and Gynecology. 2022. V. 19. №4. P. 257. https://doi.org/10.4274/tjod.galenos.2022.70593
- Kim C., Cathey A. L., Watkins D. J., Mukherjee B., Rosario-Pabón Z. Y., Vélez-Vega C. M., Meeker J. D. Maternal blood metal concentrations are associated with matrix metalloproteinases (MMPs) among pregnant women in Puerto Rico // Environmental Research. 2022. V. 209. P. 112874. https://doi.org/10.1016/j.envres.2022.112874
- Soldavini C. M., Di Martino D., Sabattini E., Ornaghi S., Sterpi V., Erra R., Ferrazzi E. sFlt-1/PlGF ratio in hypertensive disorders of pregnancy in patients affected by COVID-19 // Pregnancy Hypertension. 2022. V. 27. P. 103-109. https://doi.org/10.1016/j.preghy.2021.12.001
- Langen I., Langes^ter E., Almaas V., Letting A., Haugen G., Estensen M., S0rbye I. 62. Hypertensive pregnancy disorders: Is the prevalence higher among women with heart disease? // European Journal of Obstetrics and Gynecology and Reproductive Biology. 2022. V. 270. P. e31-e32. https://doi.org/10.1016/j.ejogrb.2021.11.129
- Samreen A. F. A Review Article on Peripartum Cardiomyopathy // Int Clinc Med Case Rep Jour. 2023. V. 2. №3. P. 1-12.
- Tipán Montaluisa S. E. Miocardiopatía periparto, actualización sobre diagnóstico, manejo y tratamiento. Revisión teórica: Quito: UCE, 2021.
- Ильина Ю. В., Федорова Т. А., Лощиц Н. В., Ванхин В. В. Перипартальная кардиомиопатия (клиническое наблюдение) // Сеченовский вестник. 2020. Т. 11. №1. С. 7177. https://doi.org/10.47093/2218-7332.2020.11.L71-77
- Yamac H., Bultmann I., Sliwa K., Hilfiker-Kleiner D. Prolactin: a new therapeutic target in peripartum cardiomyopathy // Heart. 2010. V. 96. №17. P. 1352-1357. http://dx.doi.org/10.1136/hrt.2009.179218
- Karamermer Y., Roos-Hesselink J. W. Pregnancy and adult congenital heart disease // Expert review of cardiovascular therapy. 2007. V. 5. №5. P. 859-869. https://doi.org/10.1586/14779072.5.5.859
- Cathepsin D-cleaved A. kDa form of prolactin mediates postpartum cardiomyopathy. Hilfiker-Kleiner D, Kaminski K, Podewski E, et al // Cell. 2007. V. 128. P. 589-600.
- Аракелянц А. А., Морозова Т. Е., Барабанова Е. А., Самохина Е. О. Структурно-функциональные изменения сердца при беременности у женщин с сердечно-сосудистыми заболеваниями // Лечащий Врач. 2021. Т. 7. №24. С. 18-23. https://doi.org/10.51793/OS.2021.24.7.004
- Игнатко И. В., Стрижаков Л. А., Тимохина Е. В., Афанасьева Н. В., Рябова С. Г. Перипартальная кардиомиопатия и «клинические маски» тяжелой преэклампсии: вопросы дифференциальной диагностики и тактики ведения // Акушерство и гинекология. 2017. №11. С. 114-22.
- Бурдули Н. М. Одновременное развитие перипартальной кардиомиопатии и HELLP-синдрома // Клиническая медицина. 2022. Т. 100. №11-12. С. 555-560. https://doi.org/10.30629/0023-2149-2022-100-11-12-555-560
- Павленко Т. А., Благова О. В. Синдром Бругада: от первичной электрической болезни сердца к морфологическому субстрату // Архивъ внутренней медицины. 2016. Т. 6. №2. С. 61-69. https://doi.org/10.20514/2226-6704-2016-6-2-61-69
- Вышлов Е. В., Цой Е. И., Демьянов С. В., Рябов В. В. Перипартальная кардиомиопатия или синдром такоцубо? Клинический случай с артериальной гипотонией и отеком легких // Кардиология. 2020. Т. 60. №7. С. 136-140. https://doi.org/10.18087/cardio.2020.7.n742
- Захарьева Н., Комкова М. Особенности физического и функционального состояния женщин с высоким уровнем стресса в период менопаузы // Российский журнал физической антропологии. 2022. №4. С. 86-108. https://doi.org/10.33876/2782-5000/2022-4-4/86-108


