Пероксидаза печеночницы благородной ( Hepatica nobilis)
Автор: Лапина Галина Петровна, Гаевская Виктория Викторовна, Лихуша Павел Сергеевич
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Проведено выделение и очистка пероксидазы из биотканей печеночницы, подтверждена гомогенность выделенного биокатализатора. Рассчитано содержание фермента (5,32 мг/мл г/г сырой ткани). Исследованы важнейшие ферментативные параметры биокатализатора в рамках разработанного многоэтапного научно-методического подхода по изучению каталитических свойств пероксидазы в модельных системах в присутствии регуляторов каталитической активности: определены значения важнейших ферментативных параметров каталитической активности пероксидазы из биотканей печеночницы благородной: K M = 2.23·10 -3 М, V max = 9,52·10 -3. Полученные характеристики согласуются с данными литературы, что указывает на достоверность полученных параметров.
Пероксидаза, печеночница благородная, кинетические параметры, зависимости d-τ, спрямление в координатах лайнуивера-берка, константа михаэлиса (k m), максимальная скорость (v max)
Короткий адрес: https://sciup.org/146116579
IDR: 146116579 | УДК: 541.647.577.1
Текст научной статьи Пероксидаза печеночницы благородной ( Hepatica nobilis)
Введение. Пероксидазы - ферменты класса оксидоредуктаз, катализирующие окисление с помощью Н2О2 в присутствии бензидина. Наиболее изучена пероксидаза из корней хрена, молекула которой состоит из одной полипептидной цепи (308 аминокислотных остатков), связанной ковалентно с 8-ю олигосахаридными цепями. Пероксидазы существует в виде нескольких форм (изоферментов), состав и соотношение между которыми зависит от состояния и вида растения (Андреева, 1988).
Пероксидаза - гликопротеид, для которого носителем соответствующей изменчивости могут быть и углеводные компоненты. Такой компонент, даже небольшой по массе, может сообщать молекуле качественно новое состояние и регулировать отношение фермента к различным изменениям среды (pH, температуре, посторонние примеси и др.). Показано и доказано, что углеводная часть придает белку гораздо большую специфичность. Это своего рода векторные группы протеидов, которые «узнают» участки других структур, иные макромолекулы и поверхность клеток (Строев, 1986). В связи с этим представляют интерес данные Несселя и Мэдера (Nessel, Mader, 1977) о том, что кислые пероксидазы, как биохимические соединения, занимают особые положения, а содержание углеводов у них достигает примерно 20%.
Реакции, катализируемые пероксидазой, характеризуются переносом водорода от молекулы субстрата к перекисям, в результате чего возникают радикалы субстратов, являющиеся сильнореакционными соединениями. Большинство субстратов этого фермента - соединения фенольной природы (бензидин). Окисляясь до хинонов, они обладают сильным окислительно-восстановительным действием. Фенолы могут также ковалентно связываться с молекулой пероксидазы, изменяя ее каталитическое действие (Srivastava, Huystee, 1977). Особенности строения молекулы и возможности ее изменения играют немаловажную роль при активации индивидуальных изопероксидаз.
Пероксидаза - двухкомпонентный фермент, представляющий собой сочетание активной группы в активном центре, вступающей в химическое взаимодействие с субстратами, и белкового «носителя», усиливающего каталитическое действие этой группы. Это глобулярный белок диаметром 50 A (Clementi, Palade, 1969), который содержит около 43% а-спиральных участков в составе белковой части молекулы (Strickland, 1968). По номенклатуре ферментов, принятой на Международном биохимическом съезде в 1979 году, пероксидаза -фермент, действующий на перекись водорода в качестве акцептора. Единственный подподкласс (1.11.1) составляют пероксидазы, где под кодовым номером семь стоит истинная пероксидаза-донор: Нг СЬ -оксидоредуктаза (КФ 1.11.1.7), что относится к растительным и животным пероксидазам.
Методика. В экспериментальной программе по исследованию пероксидазы печеночницы благородной (Hepatica nobilis} был применён многоступенчатый подход, а именно:
-
1) выделение пероксидазы из тканей растения;
-
2) очистка полученного экстракта;
-
3) определение содержания активного фермента;
-
4) расчёт ферментативных параметров;
-
5) анализ и обсуждение полученных параметров.
Поиск оптимальных условий для проведения каталитической реакции требовал исследования модельной ферментативной системы: пероксидаза печеночницы, бензидин (5-10"3 М), при варьировании концентраций Н2О2 (2-8)-(10"4М) с шагом в единицу, t=25°C, pH 5,3.
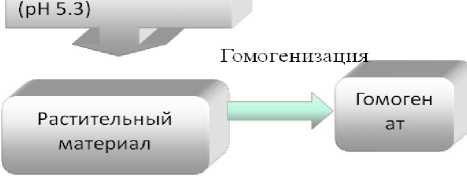
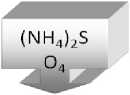
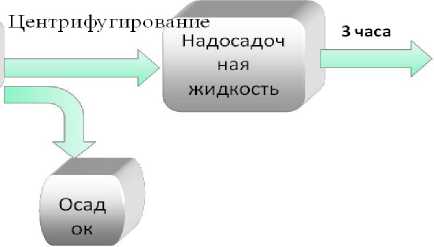
Первый этап. Выделение фермента пероксидаза печеночницы благородной (Hepatica nobilis} из биотканей (листья и стебли растений). 4 г ткани растений печеночницы гомогенизировали в 10 мл 0,1 М фосфатного буфера (1 = 0,35 М), содержащего 1,5-10 М бензойной кислоты и 1-10 М аскорбиновой кислоты (pH 5,3). Гомогенат отжимали, оставляли на 15 мин при периодическом перемешивании, центрифугировали при 10000 об/мин в течение 15 минут. Осадок отбрасывали. К надосадочной жидкости добавляли сухой (NH4)2SO4 до 20% насыщения. Через 3 часа осадок собирали центрифугированием при 5000 об/мин, его отбрасывали, в над осадочной жидкости -пероксидаза.
Метод биуретовой реакции. Готовят биуретовый реактив, растворяя последовательно в мерной колбе на 250 мл 0,375 г CuSO4-5H2O и 1,5 г сегнетовой соли (KOOC-CHOH-COONa-4 Н2О) в 150 мл воды. Приливают медленно при постоянном перемешивании 75 мг 10%-ного раствора гидроксида натрия и доводят содержимое до 250 мл водой. Биуретовый реактив не подлежит длительному хранению в стеклянной посуде.
Фосфатный буфер

3 часа
Надосадочная жидкость, содержащая пероксидазу

Рис. 1. Схема выделения и очистки пероксидазы из биоматериала печеночницы благородной (Hepatica nobiUs)
по методу В.Д. Анисимова и Т.Б. Кастальевой (1978)
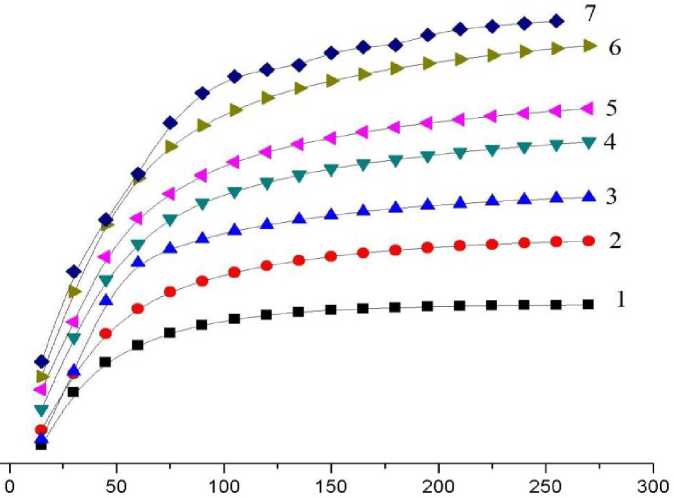
Далее определяли важнейшие ферментативные параметры - Км и Vmax. Для этого изучали кинетику хода биокаталитической реакции по изменению величины оптической плотности (D) во времени (т) для изучаемой системы. В качестве примера представлены зависимости D~t для водного раствора пероксидазы, входящего в состав изучаемой системы (рис. 2).
D
1,05 ^ 1,00 -0,95 2 0,90 -0,85 -0,80 -0,75 -0,70 -0,650,60 2 0,55 -0,50 -0,45 -0,40 -0,35 -0,30 -0,25 2 0,20 -0,15 -0,1 о -
т, с
Рис. 2. Зависимости «D-т» для изучаемой системы при варьировании концентрации пероксида водорода (2-8)-(10"4М) с шагом в единицу:
1: 2-10'4М; 2; 310"4М; 3: 4-10 4М; 4; 5-10"4М; 5: 6-10"4М; 6: 7-10"4М; 7: 8-10 4М
На втором этапе работы определены кинетические параметры каталитической активности пероксидазы в изучаемой системе: бензидин (510'3 М), при варьировании концентраций Н2О2 (2-8)-(10~4М).
Результаты и обсуждение. На основе кинетических зависимостей D-т для изучаемой системы (рис. 2) рассчитаны начальные скорости (Vo) пероксидазозависимых ферментативных реакций (Vo), далее проведено спрямление в координатах двойных братных величин: 1/V и 1/[S] (координатах Лайнуивера-Берка) (рис. 3).
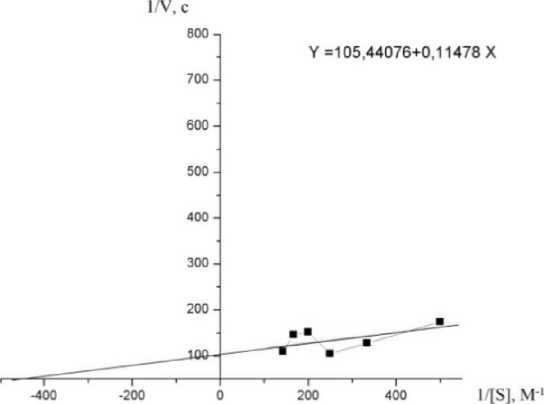
Рис. 3 . Спрямление кинетических зависимостей в координатах двойных обратных величин - координатах Лайнуивера-Берка (1/V - 1/[S]) для изучаемой системы
-33-
По отработанной схеме построены спрямленные кинетические зависимости в координатах Лайнуивера-Берка (рис. 3) и рассчитаны параметры Км и Vmax; Км = 2,23*10"3M;Vmax = 9, 52*10"3с"1.
Заключение. Экспериментально определенные значения ферментативных параметров - Км и Vmax - для исчезающего вида печеночницы благородной находятся в полном соответствии с данными литературы (Лапина, Лихуша, 2010). Это позволяет считать пероксидазу печеночницы благородной тестовым ферментом при изучении разного рода (благоприятных и неблагоприятных) воздействий на экологическое состояние лесопарковых зон.
Список литературы Пероксидаза печеночницы благородной ( Hepatica nobilis)
- Андреева В.А. 1988. Фермент пероксидаза: участие в защитном механизме растений. М.: Наука, 1988. С. 7-24.
- Лапина Г.П., Лихуша П.С. 2010. Закономерности хода ферментативной реакции, катализируемой о-дифенолоксидазой льна при варьировании ионной силы раствора//Вестн. ТвГУ. Сер.: Биология и экология. Вып. 20. № 32. С. 23-26.
- Строев Е.А. 1986. Биологическая химия. М.: Высшая школа. 479 с.
- Clementi, F., Palade, G.E. 1969. Intestinal capillaries. Permiability to peroxidase and ferritin//J. Cell. Biol. V. 41. P. 33-38.
- Nessel A., Mader M. 1977. Über die physiologische Bedeutung der Peroxidase-Isoenzymgruppen des Tabaks anhand einiger biochemischer-Eigenschaften, I. Prennung, Reinigung, chemische und physikalische//Daten. L. Pflanzenphysiol. Bd. 82. S. 235-246.
- Strickland E.H. 1968 Circular dichroism of horseradish peroxidase and its enzyme-substrate compounds//Biochim. Biophys. Acta. V. 151. P. 70-75.
- Srivastava O.P., van Huystee R.B. 1977. Evidence for close association of peroxidase, polypenol oxidase, and IAA oxidase isozyme of peanut suspension culture medium//Can. J. Bot. V. 55. P. 2630-2635.


