Персонализированная дозиметрия внутреннего облучения опухолевых образований и органов риска пациентов: разработка и реализация методического базиса для дозиметрического обеспечения клинических исследований терапевтических радиофармпрепаратов
Автор: Степаненко В.Ф., Петриев В.М., Каприн А.Д., Иванов С.А., Шегай П.В., Богачева В.В., Колыженков Т.В., Петухов А.Д., Крылов В.В., Кучеров В.В., Сигов М.А., Власова О.П., Петросян А.П., Петросян К.М., Спиченкова О.Н., Иванников А.И., Хайлов А.М., Коротков В.А., Жарова Е.П., Еремеев М.Р.
Рубрика: Научные статьи
Статья в выпуске: 1 т.32, 2023 года.
Бесплатный доступ
Разработан комплекс расчётных и инструментальных методов оценки персонифицированных доз внутреннего облучения очагов и органов риска у пациентов, проходящих терапию радиофармпрепаратами (РФП). Комплекс методов был использован для дозиметрического обеспечения клинических исследований лечебных РФП: а) 177Lu-ДОТА-ПСМА (или «Лютапрост»), предназначенный для радиолигандной терапии метастатического кастрационно-резистентного рака предстательной железы; б) микросферы альбумина 188Re 5-10 мкм (или «Артрорен»), предназначенный для радиосиновэктомии при местном лечении хронических воспалительных заболеваний суставов; и в) микросферы альбумина 188Re 20-40 мкм (или «Гепаторен»), предназначенный для внутриартериальной радионуклидной эмболизации в лечении неоперабельного рака печени. Результаты оценок абсолютных активностей РФП и их динамики при ОФЭКТ/КТ-сканировании РФП в организме пациентов верифицировали измерениями на физических фантомах человека с разной массой тела и различными стандартными активностями распределённых внутри фантомов радионуклидов. Разработанный кластер программ (для расчётов поглощённых долей энергии в биоструктурах), соответствующих баз данных и инструментальных методов послужил базисом для оценок у пациентов, включённых в клинические исследования изучаемых РФП. Установлены величины индивидуальных поглощённых доз внутреннего облучения очагов у 39 пациентов, включённых в первую фазу клинических исследований трёх РФП. Анализ распределения доз показывает, что поглощённые дозы в очагах сильно различаются не только у разных пациентов, но и в разных очагах у одного и того же пациента, что согласуется с данными литературы. Дозы облучения очагов возрастают с увеличением вводимой активности РФП и, в зависимости от объёма очагов, находятся в следующих пределах: 1) в случае «Лютапроста» - от 1,4 до 32 Гр (планируемая для введения активность - 5 ГБк), от 5,1 до 59 Гр (планируемая активность - 7,5 ГБк), от 13 до 94 Гр (планируемая активность - 10 ГБк); 2) в случае «Артрорена» - от 17,5 до 74 Гр (планируемые активности - от 0,37 до 0,925 ГБк); 3) в случае «Гепаторена» - от 10,7 до 43 Гр (планируемые активности - от 1 до 3 ГБк). Установлены величины индивидуальных доз облучения в органах риска. Распределение поглощённых доз в органах риска также существенно различаются у разных пациентов и между разными критическими органами. Эти дозы находятся в пределах от 0,01 до 7,4 Гр (39 пациентов), что многократно меньше общепринятых дозовых ограничений (“commonly applied dose constrains”) в радиотерапии.
Дозиметрия внутреннего облучения, индивидуальные поглощённые дозы, радиофармпрепараты, радионуклидная терапия, клинические исследования, ядерная медицина
Короткий адрес: https://sciup.org/170198086
IDR: 170198086 | УДК: 615.849.2.015.3 | DOI: 10.21870/0131-3878-2023-32-1-156-167
Текст научной статьи Персонализированная дозиметрия внутреннего облучения опухолевых образований и органов риска пациентов: разработка и реализация методического базиса для дозиметрического обеспечения клинических исследований терапевтических радиофармпрепаратов
Радионуклидная терапия применяется с начала сороковых годов 20-го века [1,2]. К настоящему времени лечебные радиофармпрепараты (РФП) получили широкое распространение во всём мире и заняли весьма значимое место в арсенале средств терапевтической радиологии [3, 4] как для терапии злокачественных новообразований, так и для лечения неонкологических заболеваний, например, для радиосиновэктомии. За прошедшие десятилетия подходы к планированию и обеспечению эффективности радионуклидной терапии существенно изменились, и в последние годы происходит смена парадигм в этой области - от введения пациентам заранее установленных активностей РФП к персонализированной оценке поглощённых доз внутреннего облучения опухолевых образований и органов риска пациентов [5, 6]. Причиной смены этих парадигм является осознание радиологами существенных особенностей в закономерностях формирования радиационного воздействия при внутреннем облучении организма человека радионуклидами. При введении РФП в организм радионуклиды находятся в непосредственном контакте с биологической тканью, а их накопление и выведение определяются химическими и биологическими свойствами носителей. Поэтому внутреннее облучение отличается следующими особенностями [7-12]: а) высокая степень неравномерности распределения поглощённой дозы между разными опухолевыми образованиями, органами и тканями из-за различий в их объёмах у одного и того же пациента; б) большая разница в динамике формирования и уровнях доз внутреннего облучения биологических структур организма из-за разных скоростей и уровней накопления радионуклидов в этих структурах. В результате поглощённые дозы внутреннего облучения опухолевых образований и органов риска могут многократно различаться между собой не только у разных пациентов (даже при равных массах тела пациентов и вводимых активностях РФП), но и в организме одного и того же пациента [13-15]. В свою очередь, большая вариабельность величин доз облучения может привести к различиям в терапевтической эффективности РФП. Поэтому подход, основанный на введении пациентам стандартных активностей лечебных РФП, рассматривается в настоящее время как недостаточный - как в отношении планирования радионуклидной терапии, так в отношении оценок её эффективности и возможных неблагоприятных эффектов [4-10, 15]. Необходимость дозиметрического планирования при использовании лечебных РФП подчёркивается и в недавней (2019 г.) Публикации 140 Международной комиссии по радиологической защите [16].
Исследования и разработки в этом направлении соответствуют Стратегии развития медицинской науки в Российской Федерации на период до 2025 г., а именно, в частях «Индивидуализация лечения злокачественных опухолей», «Технологии подбора схем и дозировок лекарственного и лучевого воздействия на злокачественные опухоли», «Способы предсказания и своевременного выявления тяжёлых и жизнеугрожающих побочных эффектов противоопухолевого лечения».
В данной работе представлены первые результаты разработки и применения комплекса методов для персонализированной дозиметрии внутреннего облучения опухолевых образований и органов риска пациентов на примерах дозиметрического обеспечения радионуклидной терапии при проведении первой фазы клинических исследований (изучение безопасности и переносимости) новых отечественных лечебных РФП 177Ьи-ДОТА-ПСМА (препарат «Лютапрост»), предназначенный для радиолигандной терапии метастатического кастрат-резистентного рака предстатель- ной железы, 188Re микросферы альбумина 5-10 мкм (препарат «Артрорен»), предназначенный для радиосиновэктомии при местном лечении хронических воспалительных заболевании суставов, и 188Re микросферы альбумина 20-40 мкм (препарат «Гепаторен»), предназначенный для внутриартериальной радионуклидной эмболизации при лечении неоперабельного рака печени.
Материалы и методы
Определение поглощённых доз внутреннего облучения выполняли в соответствии со схемой Медицинского комитета по дозам внутреннего облучения (MIRD) [17]. Для расчётов величин поглощённых долей энергии при внутреннем облучении радионуклидами органов и тканей мужчин и женщин различных росто-весовых категорий использовали программу стохастического моделирования взаимодействия ионизирующего излучения с веществом MCNP-5C [18]. Данные о динамике накопления и выведения активности радионуклидов в очагах, органах и тканях риска пациентов получали с применением планарной сцинтиграфии пациентов в режиме «всё тело» в передней и задней прямых проекциях и ОФЭКТ/КТ всего тела на аппарате Discovery NM/CT 670. Абсолютные активности РФП в визуализированных очагах и органах риска определяли с применением программы “Q.Metrix” при выбранных параметрах ОФЭКТ/КТ. Для инструментальных измерений поглощённых доз применяли технологию термо- и оптико-стимуляции радиационно обусловленной люминесценции синтетических и природных люминесцентных микрокристаллов с регистрацией интенсивности люминесцентного излучения в режиме считывания единичных фотонов [19, 20] с использованием установок исследовательского класса “НARSHAW 3500” и “RISO DA 20”.
Результаты
В качестве общей методологии для оценок поглощённых доз был избран подход, предлагаемый Медицинским комитетом по дозам внутреннего облучения (MIRD). Однако реализация и применение этого общего подхода, особенно для персонализированной оценки доз, является весьма специфической многокомпонентной задачей для каждого типа РФП и требует разработки комплекса специальных расчётных и инструментальных методик для получения исходной информации и её верификации [21]. Необходимо было создание соответствующих баз данных и программного обеспечения для определения величин фракций поглощённой энергии в биологических структурах (в опухолевых образованиях, в органах и тканях риска) как применительно к конкретным физическим данным используемых радионуклидов (энергия и интенсивность квантового и корпускулярного ионизирующего излучения), так и с учётом объёмов, форм биологических структур и взаимных расстояний между ними. Необходимо было также инструментальное обеспечение измерений динамики абсолютной удельной активности РФП в визуализируемых опухолевых образованиях (очагах) и органах риска пациента. Только после получения и верификации всей этой исходной информации возможна реализация заключительного этапа – определение накопленных поглощённых доз внутреннего облучения в очагах и органах риска.
В процессе исследований и разработок созданы и получили государственную регистрацию 16 баз данных, содержащих информацию о величинах фракций поглощённой энергии корпускулярного и квантового ионизирующего излучения различной энергии в органах и тканях мужчин и женщин различного возраста с различными массами тела (см., например, [21, 22]). С этой целью использовали метод стохастического моделирования взаимодействия ионизирующего излучения с веществом и математические фантомы органов и всего тела человека различного пола, возраста и массы тела.
Для нестандартных геометрий биологических структур (например, опухолей, метастазов) применили подход, основанный на аналитическом или численном интегрировании по объёму биоструктур дозовых функций точечных изотропных радиоактивных источников [11]. Для этого были созданы получившие государственную регистрацию 29 баз данных, содержащих информацию о распределении поглощённых доз в тканеэквивалентной среде от различных точечных радионуклидных источников, применяемых в ядерной медицине [22]. Разработаны и получили государственную регистрацию программы для ЭВМ, позволяющие проводить дозиметрические расчёты для различных биологических структур и опухолевых образований разных форм и размеров с использованием дозовых функций точечных изотропных источников радиоактивных источников [21].
На рис. 1 и 2 представлены полученные с применением этих программ универсальные функции (см. также нашу работу [11]) для расчётов долей поглощённой энергии внутреннего облучения в протяжённых биоструктурах различных размеров, содержащих равномерно распределённые в этих биоструктурах источники электронного и фотонного излучения с различной энергией.
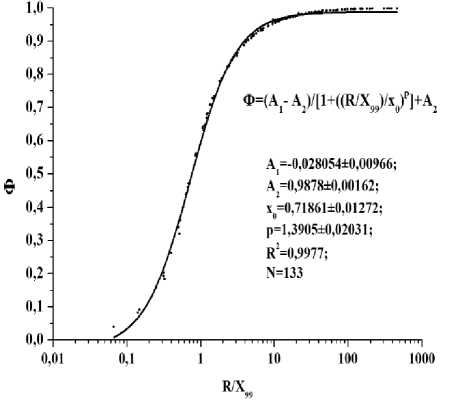
Рис. 1. Универсальная функция для расчётов доли поглощённой энергии (Ф) в протяжённых биоструктурах при внутреннем облучении электронами в зависимости от отношения эффективного радиуса биоструктур (R) к величине X 99 – радиуса тканеэквивалентной сферы, где поглощается 99% энергии, излучённой точечным источником электронов различной энергии.
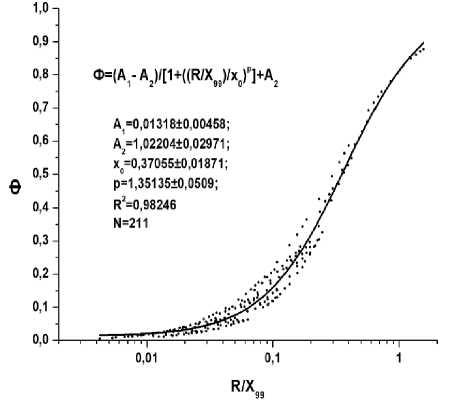
Рис. 2. Универсальная функция для расчётов доли поглощённой энергии (Ф) в протяжённых биоструктурах при их внутреннем облучении фотонами в зависимости от отношения эффективного радиуса биоструктур (R) к величине X 99 – радиуса тканеэквивлентной сферы, где поглощается 99% энергии, излученной точечным источником фотонов различной энергии.
Приведённые на рис. 1 и 2 функции могут быть использованы при расчётах поглощённых доз внутреннего облучения протяжённых биологических структур с эффективными радиусами от 10-7 до 100 см (электроны и бета-частицы) и от 0,1 до 100 см (фотоны). Диапазон энергий электронов или бета-частиц – от 0,1 кэВ до 10 МэВ, а диапазон энергий фотонов – от 10 кэВ до 4 МэВ. Величины X99 для электронного и фотонного излучений различной энергии приведены в работе [11]. При моделировании объёмов биологических структур сферами эффективный радиус совпадает с радиусом сферы, при моделировании объёмов биологических структур эллипсоидами с объёмами V и c площадями поверхностей S следует использовать эффективный радиус R=3xV/S [11].
Результаты определения абсолютных активностей РФП и их динамики при ОФЭКТ/КТ сканировании РФП в организме пациентов верифицированы измерениями с использованием физических фантомов человека с разными массами тела и распределёнными внутри фантомов различными стандартными активностями радионуклидов [22].
Созданный кластер баз данных, программ и инструментальных методов является основой для определения персонализированных доз внутреннего облучения опухолевых образований и органов риска пациентов при клинических исследованиях РФП. В результате применения разработанного комплекса методов получены данные об индивидуальных дозах внутреннего облучения очагов и органов риска у пациентов, включённых в первую фазу клинических исследований (изучение безопасности и переносимости) новых отечественных терапевтических РФП «Лютапрост» (12 пациентов), «Артрорен» (20 пациентов) и «Гепаторен» (7 пациентов на текущий период клинических исследований).
В табл. 1-3 приведены примеры с результатами оценок индивидуальных поглощённых доз внутреннего облучения пациентов, включённых в первую фазу клинических исследований этих РФП.
Таблица 1 Поглощённые дозы внутреннего облучения визуализированных очагов и органов риска
(Д±SD, Гр). Препарат «Лютапрост», первая фаза клинических исследований
|
А |
Объём, мл |
Д±SD, Гр |
Б |
Объём, мл |
Д±SD, Гр |
|
Визуализированные очаги (локализация) |
|||||
|
Поясничный позвонок, L2 |
28 |
63±7,9 |
Очаг (л/у в корне прав. лёгкого) |
34 |
20±2,6 |
|
Поясничный позвонок, L3 |
12 |
41 ±5,7 |
Плечевая кость правая |
14 |
32±3,9 |
|
Множеств. очаги в левой доле |
99 |
21 ±3,2 |
Плечевая кость левая |
8,3 |
13±1,6 |
|
печени |
|||||
|
Множеств. очаги в правой доле |
798 |
20±2,6 |
Предстательная железа |
31 |
94±11,2 |
|
печени |
|||||
|
Грудной позвонок, Th8 |
7,1 |
25±3,1 |
Головка бедренной кости прав. |
16 |
27±3,4 |
|
Предстательная железа |
25 |
14±2,2 |
Головка бедренной кости лев. |
37 |
14±1,7 |
|
Визуализированные органы риска |
|||||
|
Слёзные железы |
11 |
0,34±0,060 |
Слёзные железы |
5,9 |
0,29±0,040 |
|
Околоушные железы |
78 |
0,68±0,090 |
Околоушные железы |
18 |
0,87±0,11 |
|
Подчелюстные железы |
29 |
0,64±0,090 |
Подчелюстные железы |
8,8 |
0,66±0,092 |
|
Почки |
282 |
0,71±0,11 |
Почки |
280 |
0,99±0,11 |
|
Кишечник |
475 |
0,45±0,060 |
Печень |
1710 |
0,28±0,045 |
|
Мочевой пузырь |
179 |
2,4±0,32 |
Кишечник |
566 |
0,30±0,036 |
|
Селезёнка |
210 |
0,28±0,040 |
Мочевой пузырь |
102 |
1,85±0,24 |
|
Селезёнка |
252 |
0,17±0,022 |
|||
Примечание: А – Пациент Л.А.Л. Масса тела и рост – 79 кг, 177 см; введённая активность – 10,3 ГБк; дата введения – 17.08.2022. Б – Пациент Л.А.Л. Масса тела и рост – 79 кг, 177 см; введённая активность – 10,3 ГБк; дата введения – 17.08.2022.
Таблица 2
Поглощённые дозы внутреннего облучения визуализированных очагов и органов риска (Д±SD, Гр). Препарат «Артрорен», первая фаза клинических исследований
|
А |
Объём, мл |
Д±SD, Гр |
Б |
Объём, мл |
Д±SD, Гр |
|
Визуализированные очаги (локализация) |
|||||
|
Очаг (коленный сустав) 1 |
484 1 |
25±2,9 Очаг (коленный сустав) 1 |
116 1 |
74±9,6 |
|
|
Визуализированные органы риска |
|||||
|
Почка правая |
225 |
0,27±0,035 |
Почка правая |
181 |
0,20±0,028 |
|
Почка левая |
239 |
0,23±0,037 |
Почка левая |
202 |
0,18±0,022 |
|
Мочевой пузырь |
490 |
0,11±0,013 |
Мочевой пузырь |
440 |
0,12±0,020 |
|
Кишечник |
544 |
0,084±0,014 |
Кишечник |
166 |
0,090±0,012 |
Примечание: А – Пациент Ф.В.Е. Масса тела и рост – 103 кг, 195 см; введённая активность – 0,78 ГБк; дата введения – 23.08.2022. Б – Пациент Б.Г.А. Масса тела и рост – 58 кг, 163 см; введённая активность – 1,0 ГБк; дата введения – 25.08.2022.
Таблица 3
Поглощённые дозы внутреннего облучения визуализированных очагов и органов риска (Д±SD, Гр). Препарат «Гепаторен», первая фаза клинических исследований
|
А |
Объём, мл |
Д±SD, Гр |
Б |
Объём, мл |
Д±SD, Гр |
|
Визуализированные очаги (локализация) |
|||||
|
Очаг в печени 1 |
180 1 |
43±6,6 1 |
Очаг в печени 1 |
520 1 |
17±1,3 |
|
Визуализированные органы риска |
|||||
|
Печень вне опухоли |
1995 |
1,13±0,076 |
Печень вне опухоли |
1027 |
1,1±0,13 |
|
Селезёнка |
561 |
0,24±0,026 |
Почка правая |
318 |
0,72±0,070 |
|
Лёгкие |
3080 |
0,21±0,016 |
Почка левая |
355 |
0,52±0,060 |
|
Почка правая |
270 |
0,80±0,14 |
Селезёнка |
150 |
0,77±0,090 |
|
Почка левая |
286 |
0,57±0,068 |
Мочевой пузырь |
382 |
0,43±0,042 |
|
Желудок |
184 |
0,41±0,045 |
Лёгкие |
2324 |
0,31±0,065 |
|
Мочевой пузырь |
365 |
0,36±0,043 |
Щитовидная железа |
5,2 |
0,01±0,002 |
|
Щитовидная железа |
18 |
0,19±0,025 |
|||
|
Аорта |
140 |
0,20±0,027 |
|||
Примечание: А – Пациент Б.Ю.А. Масса тела и рост – 79 кг, 172 см; введённая активность – 1,2 ГБк; дата введения – 30.03.2022. Б – Пациент З.В.В. Масса тела и рост – 75 кг, 175 см; введённая активность – 1,1 ГБк; дата введения – 09.02.2022.
Заключение и обсуждение
Анализ распределения величин индивидуальных поглощённых доз внутреннего облучения очагов у 39 пациентов, включённых в первую фазу клинических исследований трёх изучаемых РФП показывает, что поглощённые дозы в очагах существенно различаются не только у разных пациентов, но и в разных очагах у одного и того же пациента, что соответствует данным литературы [13-15]. Дозы облучения очагов увеличиваются с увеличением вводимых активностей РФП и, в зависимости от объёма очагов, находятся в пределах: 1) для РФП «Лютапрост» (12 пациентов) – от 1,4 до 32 Гр (введённая активность около 5 ГБк), от 5,1 до 59 Гр (активность около 7,5 ГБк), от 13 до 94 Гр (активность около 10 ГБк); 2) для РФП «Артрорен» (20 пациентов) – от 17,5 до 74 Гр (активности от 0,37 до 1,1 ГБк); 3) для РФП «Гепаторен» (7 пациентов) – от 10,7 до 43 Гр (активности от 1 до 3 ГБк).
Величины индивидуальных лучевых нагрузок на органы риска также существенно различаются у разных пациентов и между различными критическими органами и находятся в пределах от 0,01 до 7,4 Гр (39 пациентов). При этом необходимо отметить, что дозы облучения органов риска оказались многократно меньше общепринятых дозовых ограничений (“commonly applied dose constrains”) при радиотерапии [23-27].
В заключение следует отметить, что погрешности персонализированных оценок поглощённых доз при внутреннем облучении терапевтическими РФП (см. примеры в табл. 1 -3) зависят, в первую очередь, от следующих факторов [16]: 1) неопределённостей измерений удельных активностей РФП и их динамики в очагах и органах риска; 2) неопределённостей в величинах поглощённых долей энергии, излучаемой радионуклидами, содержащимися в органах и тканях пациентов различных росто-весовых категорий, что обусловлено соответствующими различиями в размерах этих органов и тканей. Как отмечено в Публикации 140 МКРЗ [16], погрешности оценок поглощённых доз при внутреннем облучении терапевтическими РФП могут достигать 60%. В наших исследованиях эти погрешности удалось уменьшить до ≤20% за счёт: 1) применения набора физических фантомов человека с различными массами и распределёнными внутри фантомов стандартными активностями радионуклидов для верификации результатов определения удельных активностей РФП методом ОФЭК/КТ с программой “Q.Metrix”; 2) использования величин поглощённых долей энергии, содержащихся в разработанном кластере баз данных для различных возрастных и весовых категорий пациентов, в сочетании с антропо-морфометрическими характеристиками исследуемых органов и тканей, полученных методом КТ.
Следует также отметить, что поглощённые дозы для РФП «Артрорен» в табл. 2 приведены для объёмов очага (коленный сустав), визуализированных методом ОФЭКТ/КТ. Более реальной мишенью облучения при радиосиновэктомии являются клетки, выстилающие поверхность воспалённой синовиальной оболочки сустава. Если предположить, например [15], что площадь воспалённой синовиальной оболочки равна 250 см2, то при средней толщине слоя клеток, выстилающих оболочку, равной 0,5 мм, поглощённая доза в этом слое клеток будет равна 150 Гр (при внутреннем облучении этого слоя клеток содержащейся в нём активностью РФП, равной 1 ГБк).
Список литературы Персонализированная дозиметрия внутреннего облучения опухолевых образований и органов риска пациентов: разработка и реализация методического базиса для дозиметрического обеспечения клинических исследований терапевтических радиофармпрепаратов
- Lawrence J.H. Nuclear physics and therapy: preliminary report of a new method for the treatment of leukemia and polycythemia //Radiology. 1940. V. 35, N 1. P. 51-60.
- Hertz S., Roberts A. Radioactive iodine in the study of thyroid physiology: the use of radioactive iodine therapy in hyperthyroidism //J. Am. Med. Assoc. 1946. V. 131, N 2. P. 81-86.
- Каприн А.Д., Мардынский Ю.С. Терапевтическая радиология: национальное руководство. М.: ГЭОТАР-Медиа, 2018. 704 с.
- Treatment planning for molecular radiotherapy: potential and prospects. European Association of Nuclear Medicine. Vienna, 2017. 68 p. [Электронный ресурс]. URL: https://www.eanm.org/content-eanm/up-loads/documents/EANM_2017_iDTF-Report_online.pdf (дата обращения 06.01.2022).
- Flux G.D., Sjogreen Gleisner K., Chiesa C., Lassmann M., Chouin N., Gear J., Bardiès M., Walrand S., Bacher K., Eberlein U., Ljungberg M., Strigari L., Visser E., Konijnenberg M.W. From fixed activities to personalized treatments in radionuclide therapy: lost in translation? //Eur. J. Nucl. Med. Mol. Imaging. 2018. V. 45, N 1. P. 152-154.
- Aerts A., Eberlein U., Holm S., Hustinx R., Konijnenberg M., Strigari L., van Leeuwen F.W.B., Glatting G., Lassmann M. EANM position paper on the role of radiobiology in nuclear medicine //Eur. J. Nucl. Med. Mol. Imaging. 2021. V. 48, N 11. P. 3365-3377.
- Brans B., Bodei L., Giammarile F., Linden O., Luster M., Oyen W.J.G, Tennvall J. Clinical radionuclide therapy dosimetry: the quest for the “Holy Gray” //Eur. J. Nucl. Med. Mol. Imaging. 2007. V. 34, N 5. P. 772-786.
- Gear J., McGowan D., Rojas B., Craig A.J., Smith A.-L., Scott C.J., Scuffam J., Aldridge M., Tipping J. The internal dosimetry user group position statement on molecular radiotherapy //Br. J. Radiol. 2021. V. 94, N 1126. P. 20210547. DOI: 10.1259/bjr.20210547.
- Sudprasert W., Belyakov O.V., Tashiro S. Biological and internal dosimetry for radiation medicine: current status and future perspectives //J. Radiat. Res. 2022. V. 63, N 2. P. 247-254.
- Li W.B. Internal dosimetry. A review of progress //Hoken Butsuri. 2018. V. 53, N 2. P. 72-99.
- Степаненко В.Ф., Яськова Е.К., Белуха И.Г., Петриев В.М., Скворцов В.Г., Колыженков Т.В., Петухов А.Д., Дубов Д.В. Расчёты доз внутреннего облучения нано-, микро- и макро-биоструктур электронами, бета-частицами и квантовым излучением различной энергии при разработках и исследованиях новых РФП в ядерной медицине //Радиация и риск. 2015. Т. 24, № 1. C. 35-60.
- Stepanenko V., Kaprin A., Ivanov S., Shegay P., Bogacheva V., Sato H., Shichijo K., Toyoda Sh., Kawano N., Ohtaki M., Fujimoto N., Endo S., Chaizhunusova N., Shabdarbaeva D., Zhumadilov K., Hoshi M. Microdistribution of internal radiation dose in biological tissues exposed to 56Mn dioxide microparti-cles //J. Radiat. Res. 2022. V. 63, N S1. P. i21-i25.
- Kurth J., Heuschkel M., Tonn A., Schildt A., Hakenberg O.W., Krause B.J., Schwarzenböck S.M. Stream-lined schemes for dosimetry of 177Lu-labeled PSMA targeting radioligands in therapy of prostate cancer //Cancers. 2021. V. 13, N 15. P. 3884. DOI: 10.3390/cancers13153884.
- Okamoto S., Thieme A., Allmann J., D’Alessandria C., Maurer T., Retz M., Tauber R., Heck M.M., Wester H.-J., Tamaki N., Fendler W.P., Herrmann K., Pfob C.H., Scheidhauer K., Schwaiger M., Ziegler S., Eiber M. Radiation dosimetry for 177Lu-PSMA I&T in metastatic castration-resistant prostate cancer: absorbed dose in normal organs and tumor lesions //J. Nucl. Med. 2017. V. 58, N 3. P. 445-450.
- Torres M., Ayra E., Albuerne O., Montano Delgado M.A. Absorbed dose profiles for (32)P, (90)Y, (188)Re, (177)Lu, (153)Sm and (169)Er: radionuclides used in radiosynoviortheses treatment //Rev. Esp. Med. Nucl. 2009. V. 28, N 4. P. 188-192.
- ICRP, 2019. Radiological protection in therapy with radiopharmaceuticals. ICRP Publication 140 //Ann. ICRP. 2019. V. 48, N 1. P. 5-95.
- Bolch W.E., Eckerman K.F., Sgouros G., Thomas R. MIRD pamphlet No. 21: a generalized schema for radiopharmaceutical dosimetry – standardization of nomenclature //J. Nucl. Med. 2009. V. 50, N 3. P. 477-484.
- Briesmeister F. MCNP – A General Monte Carlo N-Particle Transport Code. Version 4C. Los-Alamos: LANL, 2000.
- Zhumadilov K., Ivannikov A., Apsalikov K., Zhumadilov Zh., Zharlyganova D., Stepanenko V., Skvortsov V., Berekenova S., Toyoda S., Endo S., Tanaka K., Miyazawa C., Hoshi M. Results of tooth enamel EPR dosimetry for population living in the vicinity of the Semipalatinsk nuclear test site //Radiat. Meas. 2007. V. 42, N 6-7. P. 1049-1052.
- Степаненко В.Ф., Бирюков В.А., Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардынский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепилина О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточ-никами 125I российского производства //Радиация и риск. 2017. Т. 26, № 1. С. 44-59.
- Степаненко В.Ф., Каприн А.Д., Иванов С.А., Шегай П.В., Петриев В.М., Давыдов Г.А., Крылов В.В., Кучеров В.В., Богачева В.В., Колыженков Т.В., Петухов А.Д., Спиченкова О.Н., Сигов М.А., Петросян А.П., Бирюков В.А., Власова О.П. Определение персонализированных доз внутреннего облучения опухолевых образований и органов риска пациентов при применении новых терапевтических РФП //Евразийский онкологический журнал. 2022. Т. 10, № 2 (приложение (online)). С. 969-970.
- Степаненко В.Ф., Петриев В.М., Давыдов Г.А., Крылов В.В., Кучеров В.В., Карякин О.Б., Боры-шева Н.Б., Колыженков Т.В., Богачева В.В., Петухов А.Д., Яськова Е.К., Спиченкова О.Н., Сигов М.А., Гарбузов П.И., Кочетова Т.Ю., Шуринов А.Ю., Петросян К.М., Петросян А.П., Бирюков В.А., Еремеев М.Р., Власова О.П., Иванов С.А., Шегай П.В., Каприн А.Д. Разработка и реализация комплекса методов для определения персонализированных доз внутреннего облучения опухолевых образований и органов риска пациентов при клинических испытаниях и применении новых терапевтических РФП //Радиация и организм 2021: материалы итоговой научно-практической конференции. Обнинск: МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. С. 69-71.
- Deasy J.O., Moiseenko V., Marks L., Chao K.S., Nam J., Eisbruch A. Radiotherapy dose-volume effects on salivary gland function //Int. J. Radiat. Oncol. Biol. Phys. 2010. V. 76, N 3 (Suppl.). P. S58-S63.
- Grundmann O., Mitchell G.C., Limesand K.H. Sensitivity of salivary glands to radiation: from animal models to therapies //J. Dent. Res. 2009. V. 88, N 10. P. 894-903.
- Jeong S.Y., Kim H.W., Lee S.W., Ahn B.C., Lee J. Salivary gland function 5 years after radioactive iodine ablation in patients with differentiated thyroid cancer: direct comparison of pre- and postablation scintigraphies and their relation to xerostomia symptoms //Thyroid. 2013. V. 23, N 5. P. 609-616.
- Sandström M., Garske-Román U., Granberg D., Johansson S., Widström C., Eriksson B., Sundin A., Lundqvist H., Lubberink M. Individualized dosimetry of kidney and bone marrow in patients undergoing 177Lu-DOTA-octreotate treatment //J. Nucl. Med. 2013. V. 54, N 1. P. 33-41.
- ICRU, 2022. ICRU Report 96, Dosimetry-guided radiopharmaceutical therapy //J. ICRU. 2022. V. 21, N 1. P. 1-212.


