Персонализированный подход к диагностике и лечению пациентов с посттравматическими и дегенеративными поражениями шейного отдела позвоночника
Автор: Островский В.В., Щаницын И.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 2 т.14, 2018 года.
Бесплатный доступ
Цель; разработка персонализированного подхода к хирургической реабилитации путем создания лечебно-диагностического алгоритма для улучшения результатов лечения пациентов с дегенеративными и травматическими поражениями шейного отдела позвоночника. Материал и методы. В нейрохирургическом отделении с января 2009 г. по январь 2016 г. обследовано и проведено лечение 520 пациентов с поражением шейного отдела позвоночника (из них 227 больных с дегенеративными изменениями и 293 пациента с посттравматическими деформациями) в возрасте от 15 до 80 лет. Осуществлен сравнительный анализ двух групп пациентов, пролеченных в период с 2009 по 2012 г. (группа 1: 235 пациентов) и в период с 2013 по 2016 г. (группа 2: 285 пациентов). При предоперационном планировании у пациентов группы 2 использовался разработанный алгоритм диагностики. Результаты. Частота всех осложнений оказалась значительно ниже в группе 2. При анализе осложнений выявлено, что чаще в группе 1 встречались: дисфагия; дисфония; выраженные послеоперационные боли в области шеи и верхних конечностей; поломка/мальпозиция винта, трансплантата или пластины. Заключение. Разработанные алгоритмы диагностики и лечения пациентов с цервикальными посттравматическими и дегенеративными поражениями позвоночника, учитывающие их индивидуальные морфометрические и функциональные данные, позволяют сформировать эффективную персонализированную программу хирургической реабилитации данной категории пациентов, тем самым снижая количество периоперационных осложнений с 35 до 9%.
Алгоритм, лечение, хирургическое лечение, шейный отдел позвоночника
Короткий адрес: https://sciup.org/149135084
IDR: 149135084
Текст научной статьи Персонализированный подход к диагностике и лечению пациентов с посттравматическими и дегенеративными поражениями шейного отдела позвоночника
Выбор правильной тактики при поражении шейного отдела позвоночника является ключевым моментом в получении положительных результатов лечения.
Цель: разработка персонализированной программы хирургической реабилитации путем создания лечебно-диагностического алгоритма для улучшения результатов лечения пациентов с дегенеративными и травматическими поражениями шейного отдела позвоночника.
Материал и методы. В нейрохирургическом отделении НИИ травматологии, ортопедии и нейрохирургии с января 2009 г. по январь 2016 г. обследовано и проведено лечение 520 пациентов с поражением шейного отдела позвоночника (из них 227 больных с дегенеративными изменениями и 293 пациента с посттравматическими деформациями) в возрасте от 15 до 80 лет. Мы провели сравнительный анализ двух групп пациентов, пролеченных в период с 2009 по 2012 г. (группа 1: 235 пациентов) и в период с 2013 по 2016 г. (группа 2: 285 пациентов). При предоперационном планировании у пациентов группы 2 использовался разработанный алгоритм диагностики. Характеристики групп представлены в табл. 1 и 2. Группы не различались по основным параметрам.
Проверка распределения на нормальность проводилась при помощи критериев Шапиро — Уилка и Колмогорова — Смирнова. Распределение большинства параметров не соответствовало нормальному. Для характеристики количественных признаков определяли медиану и квартили. Качественные признаки представлены в абсолютных значениях и процентах. При сравнении групп по количественным признакам применяли методы непараметрической статистики:
Таблица 1
|
Параметр |
Группа 1 (2009–2012) (n=235) |
Группа 2 (2013–2016) (n=285) |
р* |
|
Диагноз |
|||
|
Травма |
158 |
153 |
0,201 |
|
Дегенерация |
77 |
132 |
|
|
Возраст (лет) |
46 (39-56) |
47 (39-56) |
0,112 |
|
ИМТ (кг/м2) |
27 (24-33) |
26 (23-30) |
0,071 |
|
Мужчины |
195 |
228 |
0,06 |
|
Срок после травмы/появления жалоб, мес. |
7,5 (4-72) |
9 (7-87) |
0,061 |
|
ВАШ исходно |
7 (6-8) |
8 (7-8) |
0,283 |
ASIA исходно
|
A |
29 |
34 |
|
|
B |
22 |
35 |
|
|
C |
65 |
75 |
0,135 |
|
D |
46 |
51 |
|
|
E |
73 |
90 |
|
|
Классификация SLIC (>5 баллов) |
23 |
14 |
0,719 |
|
Классификация ASA |
|||
|
1–2-я степень |
94 |
126 |
0,067 |
|
Уровни поражения |
|||
|
1 уровень |
184 |
207 |
|
|
2 уровня |
42 |
57 |
0,145 |
|
3 уровня |
9 |
21 |
|
|
С0 |
0 |
4 |
0,13 |
|
С1 |
1 |
10 |
0,59 |
|
С2 |
11 |
23 |
0,153 |
|
С3 |
14 |
17 |
0,562 |
|
С4 |
38 |
48 |
0,814 |
|
С5 |
121 |
154 |
0,481 |
|
С6 |
83 |
98 |
0,926 |
|
С7 |
26 |
26 |
0,558 |
П р и м еч а н и е : ИМТ — индекс массы тела; р* — расчет критерия χ² (точный критерий Фишера) или критерия U Манна — Уитни для независимых выборок; для количественных признаков определены: медиана, 25-й и 75-й перцентили.
Таблица 2
|
Сопутствующая патология и факторы риска |
Группа 1 (2009–2012) (n=235) |
Группа 2 (2013–2016) (n=285) |
р* |
Сердечно-сосудистые заболевания
|
Атеросклероз артерий нижних конечностей |
3 |
4 |
0,782 |
|
Ишемическая болезнь сердца |
15 |
22 |
0,801 |
Окончание табл. 2
|
Сопутствующая патология и факторы риска |
Группа 1 (2009–2012) (n=235) |
Группа 2 (2013–2016) (n=285) |
р* |
|
Нарушения ритма сердца |
7 |
5 |
0,561 |
|
Инфаркт миокарда в анамнезе |
0 |
2 |
0,199 |
|
Артериальная гипертензия |
25 |
37 |
0,324 |
|
ОНМК в анамнезе |
1 |
2 |
0,547 |
|
Легочные заболевания |
|||
|
ХОБЛ |
27 |
50 |
0,12 |
|
Курение |
25 |
53 |
0,117 |
|
Заболевания почек |
|||
|
ХБП |
6 |
9 |
0,106 |
|
Креатинин >120 мкмоль/л |
8 |
15 |
0,433 |
|
Заболевания ЖКТ |
|||
|
Гепатиты (В/С/алкогольный) |
4 |
11 |
0,043 |
|
Хронический панкреатит |
12 |
22 |
0,651 |
|
Гастрит/язва ЖКТ |
64 |
31 |
0,012 |
|
Другие |
|||
|
Сахарный диабет |
12 |
21 |
0,421 |
|
Варикозное расширение вен нижних конечностей |
54 |
35 |
0,03 |
|
Возраст > 60 лет |
20 |
28 |
0,564 |
|
Избыточная масса тела (ИМТ>25 кг/м2) |
74 |
101 |
0,901 |
|
Анемия (гемоглобин < 110 г/л) |
27 |
24 |
0,081 |
|
Открытая/инфицированная рана |
2 |
4 |
0,589 |
П р и м еч а н и е : ИМТ — индекс массы тела; ОНМК — острое нарушение мозгового кровообращения; ХБП — хроническая болезнь почек; ХОБЛ — хроническая обструктивная болезнь легких; ЖКТ — желудочно-кишечный тракт; шкала ASA — шкала Американской ассоциации анестезиологов (шкала оценки физического состояния больных перед операцией); р* — критерий χ² (точный критерий Фишера).
Общая характеристика пациентов в первой и второй группах
Сравнение сопутствующей патологии и факторов риска в первой и второй группах
для независимых выборок U-критерий Манна — Уитни (двусторонний тест), для связанных выборок критерий Мак-Немара. Сравнение групп по качественным признакам проводили путем оценки таблиц сопряженности и расчета критерия хи-квадрат. При числе наблюдений в ячейках таблицы менее пяти использовали точный критерий Фишера, двусторонний тест. Для всех применяемых методов статистически значимым считали значение р<0,05.
Результаты. Нами предложен алгоритм диагностики, основанный на анамнестических данных, данных неврологического статуса и инструментальных методов исследования. В ходе исследования определены особенности изменения морфотопометрических параметров позвонков при дегенеративных и посттравматических цервикальных поражениях. С учетом использования полученных морфометрических показателей в зависимости от пола и возраста и изучения данных рентгенологического исследования, КТ и МРТ выявлены наиболее значимые рентгенологические, КТ- и МРТ-критерии для точного определения характера поражения и выбора соответствующей хирургической тактики у пациентов с травматическим и дегенеративным поражением шейного отдела позвоночника. Использование данных показателей позволяет с высокой точностью определить стабильность повреждения шейного отдела и разработать дизайн оперативного лечения. В дальнейшем, с 2012 г., применяли разработанный алгоритм диагностики (рис. 1).
Применение алгоритма диагностики позволило повысить чувствительность и точность комплекса диагностических методов. При сравнении визуализирующих данных предоперационного обследования с интраоперационными выявлено повышение соответствия по предложенным параметрам для всех методов. Для спондилографии установлено повышение с 49 до 67%, для КТ — с 75 до 82% (р=0,04). Отмечена также тенденция к повышению точности МРТ (с 85 до 88%), однако различия не были статистически значимыми (р=0,076).
Повышение точности диагностики влияло на результат лечения и уменьшение частоты интраоперационных технических осложнений. Мы обнаружили, что помимо КТ и спондилографии проведение МРТ шейного отдела позвоночника позволило выявить дополнительную информацию у 15% (42/282) пациентов с наличием неврологического дефицита (с признаками миелопатии), у которых КТ данную патологию не зафиксировала. МРТ явно превосходит КТ в выявлении травмы мягких тканей в шейном отделе позвоночника. В группе 2 поражение связок не диагностировано при КТ-сканировании у 12% (34/282) пациентов. В нашей работе у 10,6% (30/282) пациентов данные МРТ изменили тактику лечения в сторону более агрессивного комбинированного хирургического подхода. Хотя МРТ является высокочувствительным методом визуализации, но специфичность его снижена из-за большой частоты ложноположительных результатов (выявление изменений без клинических симптомов).
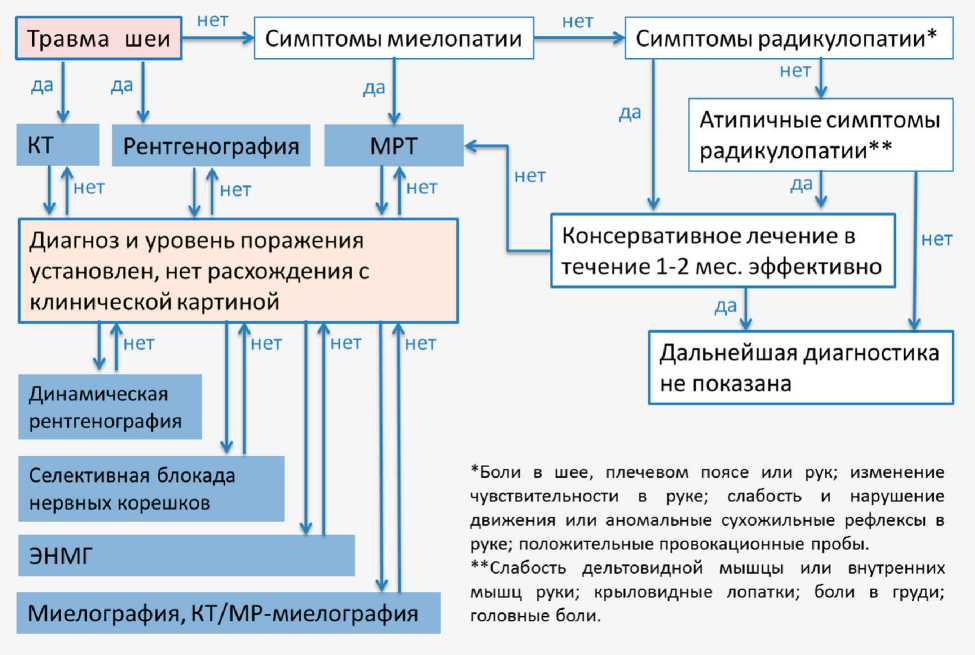
Рис. 1. Алгоритм диагностики при дегенеративном и посттравматическом повреждении шейного отдела позвоночника
На рис. 2–4 представлены разработанные нами тактические алгоритмы лечения пациентов с травмой верхнешейного и нижнешейного отделов позвоночника, а также при дегенеративных поражениях.
В большинстве случаев выполнено хирургическое вмешательство в виде передней декомпрессии спинного мозга и коррекции деформации с использованием различных имплантатов с учетом мор-
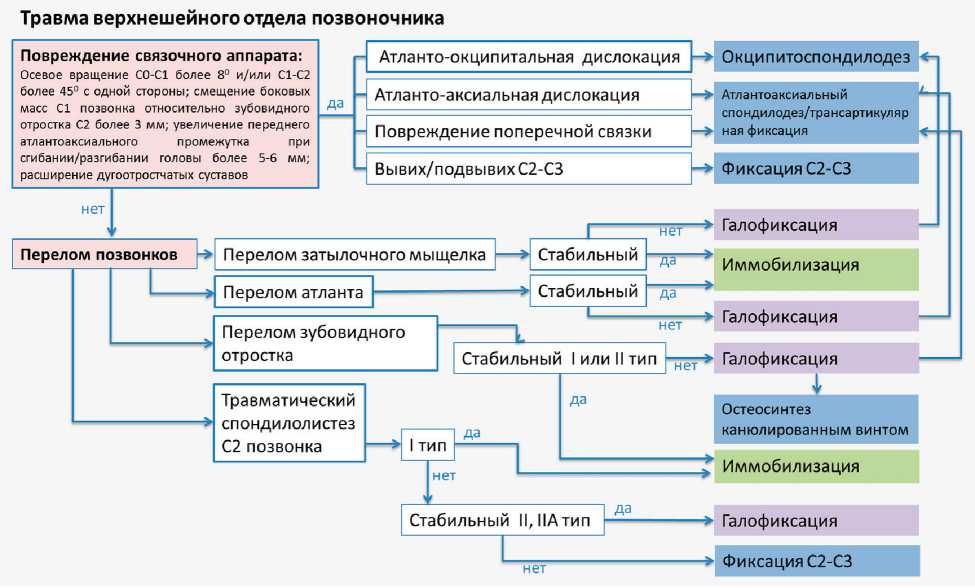
Рис. 2. Алгоритм лечения пациентов с травмой верхнешейного отдела позвоночника
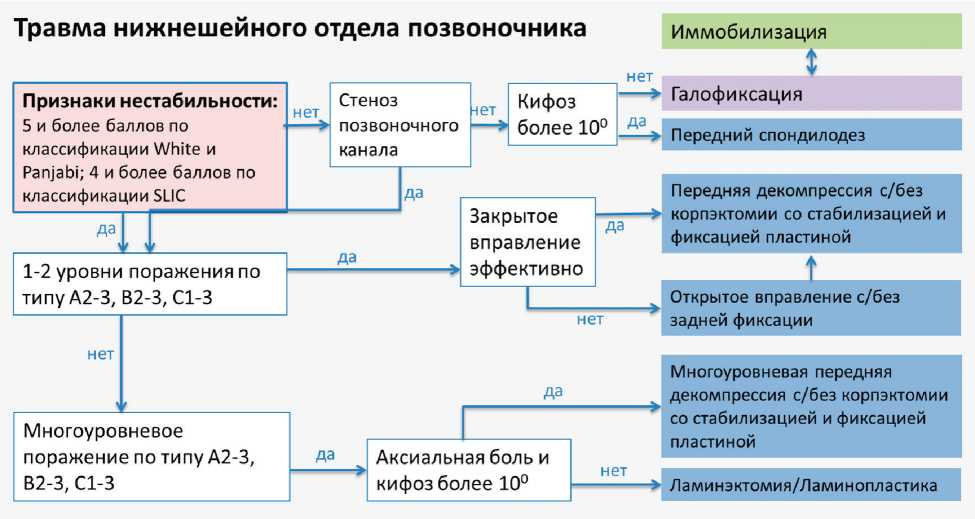
Рис. 3. Алгоритм лечения пациентов с травмой нижнешейного отдела позвоночника
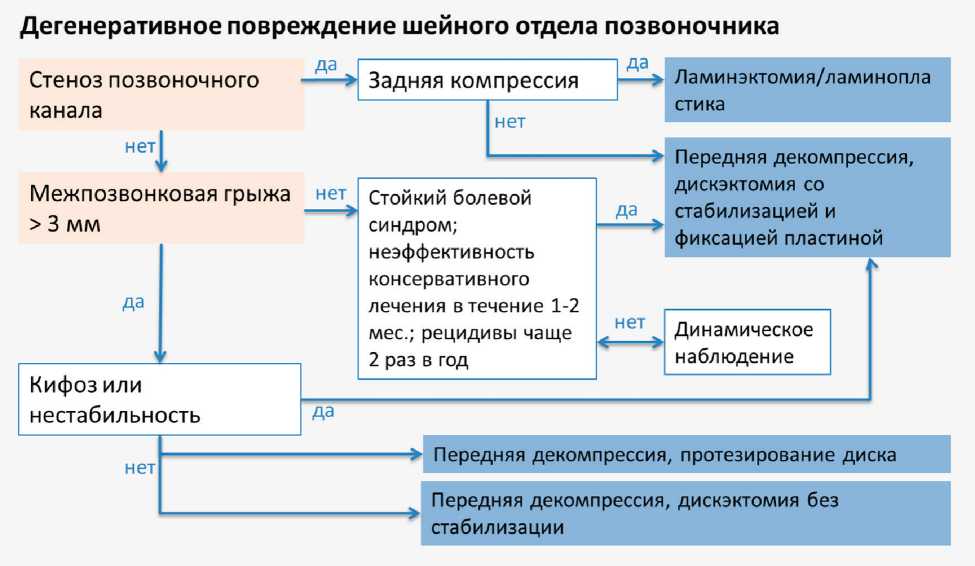
Рис. 4. Алгоритм лечения пациентов с дегенеративным повреждением шейного отдела позвоночника
фометрических особенностей шейных позвонков. При выраженной нестабильности цервикальных позвоночно-двигательных сегментов вентральный доступ был более предпочтительным. Исключения составляли операции у пациентов с застарелыми (более 1 года) посттравматическими деформациями шейного отдела позвоночника, где задний доступ применялся в качестве этапа для мобилизации позвоночного столба, и грубое повреждение заднего лигаментозного комплекса, где выполнялась двухэтапная циркулярная фиксация. Ламинэктомию или ламинопластику через задний доступ выполняли при наличии протяженной задней компрессии на фоне оссификации задней продольной связки (болезнь или синдром Форестье).
Для определения эффективности разработанного алгоритма диагностики и обоснования рациональности комплексного и дифференцированного применения хирургических методов лечения у пациентов с дегенеративным и посттравматическим поражением шейного отдела позвоночника проведено ретроспективное исследование. Оценили клинические, функ- циональные и рентгенологические результаты лечения пациентов, прооперированных с 2009 по 2012 г. и с 2012 до 2016 г. Кроме того, провели сравнение групп по количеству всех осложнений и подгрупп больных с травматическими и дегенеративными поражениями, получивших различные виды хирургического вмешательства.
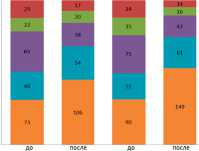
Отмечался более выраженный размер положительного эффекта в группе 2, по данным шкал ВАШ и ASIA (рис. 5). Частота всех осложнений, в том числе и «больших» (требовали ревизионного вмешательства, длительного, в том числе стационарного лечения), оказалась значительно ниже в группе 2 в период с 2013 по 2016 г. При анализе осложнений выявлено, что статистически значимо чаще в группе 1 встречались: дисфагия; дисфония; выраженные послеоперационные боли в области шеи и верхних конечностей; поломка/мальпозиция винта, трансплантата или пластины. На рис. 6 представлена частота всех осложнений в группах 1 и 2 и в подгруппах травматических и дегенеративных цервикальных поражений.
Обсуждение. Хирургическое лечение при травматических и дегенеративных поражениях шейного отдела позвоночника в настоящее время включает весь спектр доступов и различных вариантов декомпрессии и стабилизации. Однако применяемые клинико-рентгенологические критерии для определения тактики хирургического лечения сильно разнятся. Несмотря на технический успех операций, клинические и рентгенологические результаты не всегда оказываются удовлетворительными [4]. Средняя частота развития периоперационных осложнений составила 23,3%; при этом минимальная частота составила 3%, максимальная достигала 51 %, что совпадает с данными большого обзора, представленного Nasser и соавт. в 2010 г. (8,9%) [5]. Прогнозирование послеоперационных осложнений и разработка стандартизованных алгоритмов тактики диагностики и лечения на основе демографических показателей, клинической картины и данных визуализирующих методов обследования становятся все более насущной проблемой [6].
Тактика лечения поражений шейного отдела позвоночника до сих пор остается неопределенной. Правильное принятие решения по выбору метода лечения предопределяет не только клинический исход, но и выживаемость пациента. Основной задачей нашего исследования являлась разработка персонализированной программы хирургической реабилитации путем создания лечебно-диагностического алгоритма для улучшения результатов лечения пациентов с дегенеративными и травматическими поражениями шейного отдела позвоночника.
При цервикальном дегенеративном поражении компрессия нервного корешка и/или спинного мозга приводит к развитию выраженного болевого синдрома, миелопатии, двигательного дефицита и, как следствие, инвалидности. Декомпрессирующая операция может уменьшить боль и вернуть трудоспособность, но связана с определенным риском осложнений. Nikolaidis и соавт. [1] провели мета-анализ для сравнения результатов хирургических и консервативных методов лечения при шейной радикуломиелопатии. Включенные в исследование работы имели низкую степень доказательности, и, таким образом, остается неясным, компенсируется ли долгосрочная выгода от операции рисками развития периоперационных осложнений. Авторы сделали вывод, что при шейной радикулопатии и легкой форме миелопатии хирурги-
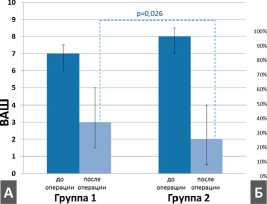
Рис. 5. Динамика изменения неврологического статуса после операции у пациентов, пролеченных до и после 2012 г.: А — интенсивность боли по шкале ВАШ; Б — неврологический статус по шкале ASIA
ASIA "А ВВ «С ■□ ЯЕ р<0,001
операции операции операции операции
Группа 1 Группа 2
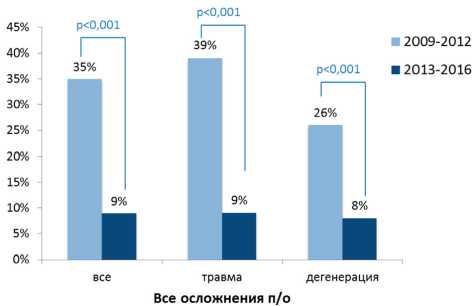
Рис. 6. Частота всех осложнений в подгруппах «травма» и «дегенерация» у пациентов, оперированных до и после 2012 г.
ческое вмешательство быстрее облегчает боль, чем физиотерапия или иммобилизация жестким воротником; но разница в отдаленных результатах не была существенной.
Sampath и соавт. [7] провели нерандомизированное проспективное многоцентровое сравнительное исследование хирургических и нехирургических методов лечения. В группу консервативной терапии (160 пациентов) были включены: медикаментозное лечение, стероиды, постельный режим, физические упражнения, тракция, иммобилизация ортезами, инъекции, мануальная терапия, иглоукалывание и гомеопатические препараты. Хирургическое лечение (80 пациентов) включало: фораминотомию, переднюю декомпрессию с фиксацией и без. Авторы пришли к выводу, что хирургическое вмешательство дает больший положительный эффект. Однако срок наблюдения в исследовании был короткий, и у значительной части пациентов сохранялся болевой неврологический синдром (уровень доказательности III).
Мы считаем, что при шейной радикулопатии показанием для операции являются следующие критерии:
-
— клинические признаки радикулопатии;
-
— прогрессирующие парезы верхних конечностей;
-
— подтвержденная инструментальными методами исследования компрессия нервного корешка;
— сохраняющиеся корешковые боли, несмотря на длительное консервативное лечение (6–12 недель).
Шейная миелопатия может серьезно ухудшить качество жизни больного. Симптомы миелопатии прогрессируют медленно и часто не проявляются, пока не приобретут потенциально необратимый характер. В связи с тем что обратный регресс неврологическо- го дефицита при шейной миелопатии маловероятен, основной целью хирургического вмешательства является предотвращение дальнейшего прогрессирования неврологических симптомов.
Мы в нашей работе придерживаемся следующих показаний к операции при шейной миелопатии:
-
— подтвержденное инструментальными методами исследования сдавление спинного мозга с выраженными симптомами миелопатии;
-
— кифотическая деформация позвоночника с прогрессивным ухудшением неврологического статуса;
-
— наличие выраженной миелопатии и стеноза позвоночного канала по данным визуализирующих методов исследования даже без корреляции с клиникой;
-
— острое начало и прогрессирование неврологического дефицита.
Остается спорным вопрос о тактике лечения пациентов с рентгенологическими признаками стеноза позвоночного канала, компрессии спинного мозга и оссификации задней продольной связки без клинических признаков миелопатии [8]. Wilson и соавт. [8] провели систематический обзор с целью выяснить частоту и факторы риска развития миелопатии у асипмтомных пациентов. На основе литературы авторы сделали следующие выводы: 1) у асимптомных пациентов со стенозом позвоночного канала и сдавлением спинного мозга на фоне спондилеза клинические признаки миелопатии развиваются примерно в 8% случаев в течение 1 года и в 23% в течение 44 месяцев наблюдения; 2) у асимптомных пациентов со стенозом позвоночного канала и сдавлением спинного мозга на фоне спондилеза клинические признаки радикулопатии и изменения данных по ССВП и ДВП, без изменения интенсивности сигнала на Т2 взвешенных изображений при МРТ, являются предикторами развития миелопатии в течение 12 месяцев. Повышение интенсивности МР-сигнала является независимым предиктором развития миелопатии в позднем периоде (в среднем 44 мес.); 3) у пациентов с оссификацией задней продольной связки без миелопатии достоверных данных по течению и прогнозу развития миелопатии не получено.
Тактика лечения пациентов с цервикальной травмой зависит от стабильности повреждения и от степени неврологических нарушений. При нестабильных переломах дальнейшее механическое повреждение спинного мозга при вторичной дислокации может привести к тяжелому повреждению спинного мозга. Исследователи разделились во мнении о необходимости ранней (<72 часов) декомпрессии спинного мозга. Ряд авторов не выявил преимуществ ранней операции [9], в то время как другие считают, что выполненная в ближайшие сроки после травмы декомпрессия является безопасной и позволяет улучшить неврологические исходы [10]. Однако существуют исследования, показывающие, что восстановление функции спинного мозга после отсроченной декомпрессии происходит даже через месяцы и годы после травмы [11]. Таким образом, в настоящее время нет общего стандарта в отношении срока декомпрессии при остром повреждении спинного мозга. Немедленное хирургическое вмешательство рекомендуется у больных с неполным повреждением спинного мозга или с прогрессирующим неврологическим ухудшением при сдавлении спинного мозга фрагментами позвонка или межпозвонкового диска [10].
По нашим данным, показаниями к хирургическому лечению при травме нижнешейного отдела позвоночника являлись, кроме наличия нестабильности повреждения (более 4 баллов по классификации SLIC): сдавление спинного мозга; смещение позвонков более чем на 25%; кифотическая деформация более 11º; неспособность восстановления нормальной оси позвоночника; повреждение связок и капсулы дуго-отростчатых суставов; компрессионно-оскольчатый перелом 40% и более тела позвонка.
Таким образом, нами разработан алгоритм диагностики, основанный на анамнестических данных, состоянии неврологического статуса и результатах инструментальных методов исследования. При анализе эффективности предложенного алгоритма оказалось, что частота всех осложнений, в том числе «больших», значительно ниже в группе пациентов, лечение которых проводилось по разработанной лечебно-диагностической программе.
Заключение. Разработанные алгоритмы диагностики и лечения пациентов с цервикальными посттравматическими и дегенеративными поражениями позвоночника, учитывающие их индивидуальные морфометрические и функциональные данные, позволяют сформировать эффективную персонализированную программу хирургической реабилитации данной категории пациентов, тем самым снижая количество периоперационных осложнений с 35 до 9%.
Список литературы Персонализированный подход к диагностике и лечению пациентов с посттравматическими и дегенеративными поражениями шейного отдела позвоночника
- Nikolaidis I, Fouyas IP, Sandercock PA, Statham PF. Surgery for cervical radiculopathy or myelopathy. Cochrane Database Syst Rev 2010; 20 (1): CD001466
- Bertalanffy H, Eggert HR. Complications of anterior cervical discectomy without fusion in 450 consecutive patients. Acta Neurochir (Wien) 1989; 99 (1-2): 41-50
- Saunders RL, Bernini PM, Shirreffs TG Jr, Reeves AG. Central corpectomy for cervical spondylotic myelopathy: a consecutive series with long-term follow-up evaluation. J Neurosurg 1991; 74 (2): 163-70
- Boos N, Aebi M. Spinal Disorders: Fundamentals of Diagnosis and Treatment. 2008; 1166 p.
- Nasser R, Yadla S, Maltenfort MG, et al. Complications in spine surgery. J Neurosurg Spine 2010; 13 (2): 144-57
- Karpova A, Arun R, Davis AM, et al. Predictors of surgical outcome in cervical spondylotic myelopathy. Spine (Phila Pa 1976) 2013; 38 (5): 392-400
- Sampath P, Bendebba M, Davis JD, DuckerTB. Outcome of patients treated for cervical myelopathy: A prospective, multicenter study with independent clinical review. Spine (Phila Pa 1976) 2000; 25 (6): 670-6
- Wilson JR, Patel AA, Brodt ED, et al. Genetics and heritability of cervical spondylotic myelopathy and ossification of the posterior longitudinal ligament: Results of a systematic review. Spine (Phila Pa 1976) 2013; 38 (22 Suppl 1): 123-46
- Vaccaro AR, Daugherty RJ, Sheehan TP, et al. Neurologic outcome of early versus late surgery for cervical spinal cord injury. Spine (Phila Pa 1976) 1997; 22 (22): 2609-13
- Fenlings MG, Perrin RG. The role and timing of early decompression for cervical spinal cord Injury: Update with a review of recent clinical evidence. Injury 2005;36 (Suppl 2): 13-26
- Anderson PA, Bohlman HH. Anterior decompression and arthrodesis of the cervical spine: long-term motor improvement. Part II: Improvement in complete traumatic quadriplegia. J Bone Joint Surg Am 1992; 74 (5): 683-92


