Перспективные скрещивания видов в роде Crataegus L. (Rosaceae)
Автор: Яндовка Л.Ф., Козлова А.А., Фирсов Г.А., Старицын М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Улучшение сортов растений
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
Боярышник - уникальное растение, использующееся человеком в пищу и как лекарственное сырье. В разных регионах России создаются формы боярышника, адаптированные к местным условиям и дающие хороший урожай. Новые формы получают посредством гибридизации, поэтому актуально выявление видов, наиболее пригодных для межвидовой гибридизации с целью улучшения признаков и адаптивности растений. В настоящей работе в условиях Ботанического сада Петра Великого (г. Санкт-Петербург) впервые были установлены 13 наиболее удачных межвидовых скрещиваний в роде Crataegus , определены универсальные опылители - C. maximowiczii , C. caucasica , изучены фертильность и жизнеспособность пыльцы исследуемых видов. Нашей целью было выявление наиболее перспективных скрещиваний между представителями рода Crataegus в условиях г. Санкт-Петербург, при которых образуется максимальное количество полноценных плодов и семян, а также оценка морфологической сформированности пыльцы и ее способности к росту посредством проращивания на искусственной питательной среде. Объектами исследования были растения видов Crataegus Tourn. ex L. из коллекции открытого грунта Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН (г. Санкт-Петербург): североамериканские виды C. horrida Medik., C. prunifolia (Lam.) Pers., C. macracantha Lodd., C. submollis Sarg., дальневосточные виды C. maximowiczii C.K. Schneid., C. chlorosarca Maxim., C. chlorosarca Maxim. var. atrocarpa (E. Wolf) Cinovskis, C. pinnatifida Bunge, европейско-азиатские виды C. monogyna Jacq., C. lasiocarpa Lange, C. chlorocarpa Lenne et C. Koch., C. media Becht. Rosa Flore Plena и среднеазиатские виды C. almaatensis Pojark., C. caucasica C. Koch. Морфологию пыльцевых зерен изучали на растровом электронном микроскопе Tescan Vega 2 («Tescan», Чехия) в режиме низкого вакуума при давлении в камере 15 Па и ускоряющем напряжении 15 кВ. Фертильность пыльцы оценивали окрашиванием ацетокармином. Жизнеспособность пыльцы определяли проращиванием на искусственной питательной среде (агар-агар - 0,8 г, сахароза - 15 г, борная кислота - 0,003 г, растворенные в 100 мл дистиллированной воды). Для выяснения способности к гибридизации использовали принудительное опыление по типу ксеногамии. Чтобы установить оптимальные межвидовые скрещивания, также применили принудительное опыление. Цветки кастрировали на стадии белых бутонов. После кастрации и опыления цветков побег покрывали марлевым мешочком. Число побегов, отводимых для каждого варианта скрещивания, было не менее 10. Результативность скрещивания оценивали по числу цветков и плодов. Наряду с нормальной формой пыльцевых зерен у каждого вида были выявлены нарушения их морфологической структуры. Наибольшее количество деформированной пыльцы было у C. horrida (~ 30 %), наименьшее - у C. almaatensis (4,5 %). Пыльца разных видов боярышника хорошо окрашивалась ацетокармином, что свидетельствовало о ее морфологической сформированности (от 63,3 % у C. lasiocarpa до 92,6 % у C. almaatensis . Несмотря на это, часть пыльцы (51,7-90,6 %) не прорастала на искусственной питательной среде. Пыльцы, прорастающей длинными или средней длины пыльцевыми трубками (наиболее пригодной для гибридизации), больше всего оказалось у C. prunifolia (28,3 %), немного меньше - у C. horrida (10-13 %), C. chlorosarca Maxim. var. atrocarpa и C. macracantha (12 %), C. submollis (~ 11 %). Все исследованные растения были перекрестноопыляемыми. Завязываемость плодов и семян при ксеногамии составляла от 63,2 % ( C. submollis ) до 96,2 % ( C. maximowiczii ). Виды были способны скрещиваться между собой. В некоторых случаях при реципрокных скрещиваниях имела место различная степень завязываемости плодов, когда один и тот же вид в одном случае служит материнским растением, а в другом - отцовским растением (например, в скрещивании C. prunifolia × C. maximowiczii ). Однако в большинстве скрещиваний при разных комбинациях материнских и мужских форм разница в завязываемости плодов была несущественной. Выявлены наиболее удачные комбинации межвидовых скрещиваний: C. maximowiczii × C. submollis, C. maximowiczii × C. horrida , C. maximowiczii × C. prunifolia , C. submollis × C. chlorosarca , C. horrida × C. submollis , C. caucasica × C. monogyna , C. pinnatifida × C. caucasica , C. chlorosarca × C. macracantha , C. chlorosarca × C. caucasica , C. chlorosarca × C. almaatensis, C. chlorosarca × C. pinnatifida , C. macracantha × C. chlorosarca , C. macracantha × C. caucasica . Установлено, что наиболее универсальными опылителями, при использовании которых образовывалось максимальное число завязей, были C. maximowiczii и C. caucasica .
Crataegus, rosaceae, ксеногамия, межвидовая гибридизация, фертильность пыльцы, жизнеспособность пыльцы
Короткий адрес: https://sciup.org/142242460
IDR: 142242460 | УДК: 634:581.6:575.222.7 | DOI: 10.15389/agrobiology.2024.3.537rus
Текст научной статьи Перспективные скрещивания видов в роде Crataegus L. (Rosaceae)
Боярышник — уникальное растение, которое издавна используется человеком. Плоды употребляют в пищу. Биологически активные вещества плодов, цветков, почек, коры боярышника применяют при изготовлении тонизирующих и лекарственных средств для лечения сердечно-сосудистой системы и печени (1-3). Показаны антиоксидантные и противомикробные свойства боярышника (4, 5). Благодаря глубокой разветвленной корневой системе, ростовой активности надземной части и декоративности, растения выращивают в качесвте живой изгороди (6).
Растения рода Crataegus — крупные листопадные кустарники или деревья высотой до 12 м, в природе размножаются семенами, в культуре — семенами, отводками и прививкой (7-9). Цветки обоеполые, околоцветник 5-членный, соцветия — щитки 6-12-цветковые, плод — пиренарий с 1-5 трехгранными косточками. Опыление цветков обычно энтомофильное (9, 10). На возможность опыления сортов и видов между собой у представителей Crataegus влияет различная протяженность периода цветения (10-12).
В связи с повышением потребности в получении полноценных плодов боярышников в разных регионах России создаются сорта, адаптированные к местным условиям. Селекция ведется по таким критериям, как сроки цветения и плодоношения, морозостойкость, засухоустойчивость, урожайность, отделимость мякоти от косточки (13, 14). Следует отметить, что разные виды боярышников при интродукции показывают нестабильное состояние вегетативных структур (15, 16). Интродуцированные виды имеют низкую полнозернистость и различия в качестве семян, собранных в разных регионах (17-19). В связи с этим актуально выявление форм, наиболее приспособленных к конкретным условиям среды.
Для получения адаптивных образцов часто используют межвидовые и межсортовые скрещивания. Исследования межвидовых скрещиваний у Crataegus в литературе представлены фрагментарно (20-23). Гибридизация разных видов боярышников не всегда успешна.
В настоящей работе в условиях Ботанического сада Петра Великого (г. Санкт-Петербург) впервые были установлены 13 наиболее удачных межвидовых скрещиваний в роде Crataegus , определены универсальные опылители — C. maximowiczii , C. caucasica , изучены фертильность и жизнеспособность пыльцы исследуемых видов.
Нашей целью было выявление наиболее перспективных скрещиваний между представителями рода Crataegus в условиях г. Санкт-Петербург, при которых образуется максимальное количество полноценных плодов и семян, а также оценка морфологической сформированности пыльцы и ее способности к росту при проращивании на искусственной питательной среде.
Методика. Объектами исследования были растения видов Crataegus Tourn. ex L. из коллекции открытого грунта Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН (г. Санкт-Петербург): североамериканские виды — C. horrida Medik., C. prunifolia (Lam.) Pers., C. macracantha Lodd., C. submollis Sarg., дальневосточные виды — C. maxi-mowiczii C.K. Schneid., C. chlorosarca Maxim., C. chlorosarca Maxim. var. atro-carpa (E. Wolf) Cinovskis, C. pinnatifida Bunge, европейско-азиатские виды — C. monogyna Jacq., C. lasiocarpa Lange, C. chlorocarpa Lenne et C. Koch., C. media Becht. Rosa Flore Plena (у растений формируются недоразвитые пыльники, размножаются вегетативно, поэтому использовались только в качестве женских особей), среднеазиатские виды — C. almaatensis Pojark., C. caucasica C. Koch.
Морфологию пыльцевых зерен изучали с помощью растрового электронного микроскопа Tescan Vega 2 («Tescan», Чехия) в режиме низкого вакуума, давление в камере — 15 Па, ускоряющее напряжение — 15 кВ.
Фертильность пыльцы оценивали окрашиванием ацетокармином (24). Метод основан на способности пыльцевых зерен по-разному адсорбировать это химическое вещество, следовательно, по-разному окрашиваться. Окрашенная ацетокармином пыльца считается фертильной. Жизнеспособность пыльцы определяли проращиванием на искусственной питательной среде, включающей агар-агар (0,8 г), сахарозу (15 г) и борную кислоту (0,003 г), растворенных в 100 мл дистиллированной воды (24). Жизнеспособность пыльцы в настоящем исследовании предварительно оценивалась при разных концентрациях сахарозы. Выбранный процентный состав компонентов питательной среды обеспечивал наиболее высокую степень жизнеспособности пыльцы у исследуемых растений. Фертильность пыльцы оценивали при помощи микроскопа Leica («Leica Microsystems GmbH», Германия).
Для выяснения способности к гибридизации использовали принудительное опыление по типу ксеногамии (перекрестное опыление, при котором цветки одного растения опыляются пыльцой цветков других растений того же вида). Чтобы установить оптимальные межвидовые скрещивания, также применяли принудительное опыление. Цветки кастрировали на стадии белых (полураскрытых) бутонов. Использовали только свежую пыльцу со сроком хранения не более 10 сут. После кастрации и опыления цветков побег покрывали марлевым мешочком. Число побегов, отводимых для каждого варианта скрещивания, было не менее 10. Результативность скрещивания оценивали по числу цветков и плодов (25, 26).
Зрелая пыльца у изученных видов образуется в разные сроки, поэтому не все взятые в эксперимент растения удалось скрестить между собой. В зависимости от сроков цветения растения разделили на две группы: раноцветущие (20-25 мая) — C. prunifolia , C. horrida , C. submollis , C. chlorosarca , C. maximowiczii ; позже цветущие (28 мая-5 июня) — C. caucasica , C. almaaten-sis , C. lasiocarpa , C. media , C. monogyna , C. pinnatifida , C. chlorosarca , C. mac-racantha .
Статистическую обработку полученных результатов осуществляли в программе Microsoft Excel 2003. Вычисляли средние значения показателей ( M ) и стандартные ошибки средних (±SEM).
Результаты. Климатические условия г. Санкт-Петербург относительно близки к условиям Дальнего Востока, и отчасти — к условиям Северной Америки, поэтому наблюдалось нормальное развитие всех исследованных видов. Зрелая пыльца у изученных видов образуется в разные сроки, поэтому не все взятые в эксперимент растения удалось скрестить между собой. Скрещивания проводили в пределах групп образцов со сроком цветения 20-25 мая или 28 мая-5 июня.
Пыльцевые зерна у исследуемых растений Crataegus в основном были нормально развиты, скульптура их поверхности струйчатая (рис. 1, а), форма пыльцы эллипсоидная, пыльца бороздно-оровая (см. рис. 1, а, б, г). Ора — внутренняя часть сложной апертуры, округлая, незначительно превышающая по диаметру ширину экзоапертуры (борозды), немного возвышалась над бороздой (см. рис. 1, а). Ора располагалась в борозде, ближе к полюсам (см. рис. 1, б, г). Пыльца трехбороздная, борозды не доходили до полюсов (см. рис. 1, б).
Используемые в работе методы оценки качества пыльцы ранее хорошо себя зарекомендовали (27-30). Фертильность (морфологическая сфор-мированность) пыльцы различалась у разных видов (табл. 1) (см. рис. 2, а, б). Следует также отметить различия пыльцы по размеру в пределах вида, поэтому ее разделили на три группы: крупная, средняя и мелкая. Наряду с нормальной формой, у каждого вида были выявлены нарушения морфологической структуры пыльцевых зерен, чаще всего деформации сжатия (см. рис. 1, в) и чрезмерно крупная пыльца .

Рис. 1. Морфология пыльцевых зерен у некоторых видов рода Crataegus. А — C. caucasica C. Koch (увеличение ½2000), Б — C. maximowiczii C.K. Schneid. (увеличение ½800), В — C. horrida Medik. (увеличение ½400), Г — C. prunifolia (Lam.) Pers. (увеличение ½800); п — полюс, б — борозда, сп — сморщенная пыльца, о — ора, ссп — струйчатая скульптура поверхности (растровый электронный микроскоп Tescan Vega 2 «Tescan», Чехия) (Ботанический сад Петра Великого Ботанического института им. В.Л. Комарова РАН, г. Санкт-Петербург).
Такая пыльца морфологически не сформирована и не способна к прорастанию. Больше всего деформированной пыльцы обнаружили у C. horrida ( ∼ 30 %), наименьший процент — у C. almaatensis (4,5 %) (см. табл. 1). Слишком крупная пыльца обычно не прорастает. Крупной пыльцы у исследуемых видов оказалось немного (2-14 %). У всех была выявлена мелкая пыльца, которая, как и крупная, часто не способна к росту. У многих видов процент мелкой пыльцы оказался достаточно высоким — от 22,3 % у C. pin-natifida до 27,2 % у C. monogyna . Максимальное количество мелкой пыльцы выявили у C. pinnatifida , C. monogyna , C. horrida , C. prunifolia , C. chlorosarca. Чаще всего мелкая пыльца была деформированной. Начав расти, она быстро останавливалась в росте, образуя короткие пыльцевые трубки, или вообще не прорастала.
Пригодной для оплодотворения в основном была пыльца средних размеров. Морфологически сформированная пыльца средних размеров составляла большую часть у всех видов — 63-86 % (см. табл. 1).
-
1. Фертильность пыльцевых зерен у представителей рода Crataegus, произрастающих в условиях г. Санкт-Петербург (M±SEM, Ботанический сад Петра Великого Ботанического института им. В.Л. Комарова РАН, г. Санкт-Петербург)
Вид
Пыльцевые зерна
всего, шт.
окрашенные
крупные
средние
мелкие
с измененной формой
шт.
%
шт.
%
шт.
1 %
шт.
1 %
шт.
] %
C. horrida Medik. (растение 1)
315
240
76,2±2,40
29
9,2±0,90
255
81,0±2,21
75
23,8±2,40
99
31,4±2,61
C. horrida Medik. (растение 2)
307
270
87,9±1,86
56
18,2±2,20
196
63,8±2,74
55
17,9±2,19
92
30,0±2,53
C. maximowiczii C.K. Schneid.
224
196
87,0±2,25
5
2,2±0,98
192
85,7±2,34
27
12,1±2,18
16
7,1±1,72
C. chlorosarca Maxim. var. atrocarpa
(E. Wolf) Cinovskis
325
292
89,8±1,67
20
6,2±1,33
281
86,5±1,90
24
7,4±1,45
61
18,8±2,16
C. prunifolia (Lam.) Pers.
340
299
87,9±1,76
8
2,4±0,82
245
72,1±2,43
87
25,6±2,36
39
11,5±1,73
C. almaatensis Pojark.
310
287
92,6±1,49
11
3,5±1,05
251
81,0±2,23
28
9,0±1,63
14
4,5±1,18
C. pinnatifida Bunge
312
231
74,5±2,47
41
13,2±1,92
222
71,6±2,55
69
22,3±2,35
31
10,0±1,70
C. monogyna Jacq.
312
265
84,9±2,02
23
7,4±1,48
204
65,4±2,69
85
27,2±2,52
22
7,1±1,45
C. caucasica C. Koch
300
270
90,0±1,73
24
8,0±1,56
235
78,3±2,38
41
13,7±1,98
22
7,3±1,50
C. lasiocarpa Lange
313
198
63,3±2,72
30
9,6±1,66
230
73,5±2,49
53
16,9±2,12
111
35,5±2,70
C. chlorosarca Maxim.
281
240
85,4±2,11
38
13,5±2,04
172
61,2±2,91
71
25,3±2,59
35
12,5±1,97
C. macracantha
289
259
89,6±1,79
13
4,5±1,22
235
81,3±2,29
41
14,2±2,05
13
4,5±1,22
C. submollis Sarg.
310
207
66,8±2,67
44
14,2±1,98
195
62,9±2,74
62
20,0±2,27
33
10,6±1,75
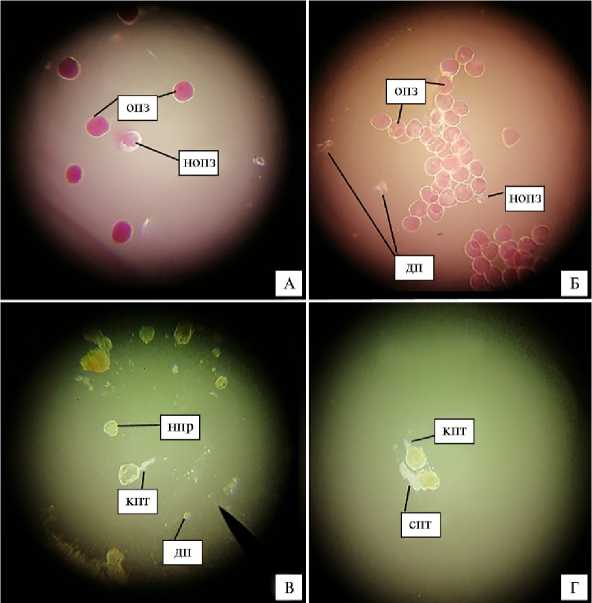
Рис. 2. Оценка качества пыльцы видов рода Crataegus. А, Б — пыльца C. chlorosarca Maxim. var. atrocarpa (E. Wolf) Cinovskis, окрашенная ацетокармином, В, Г — пыльца C. horrida Medik, пророщенная на искусственной питательной среде; опз — окрашенные пыльцевые зерна, нопз — неокрашенные пыльцевые зерна, дп — мелкая или сморщенная, деформированная пыльца, нпр — непроросшая пыльца, кпт — прорастание пыльцевого зерна короткой пыльцевой трубкой, спт — прорастание пыльцевого зерна пыльцевой трубкой средней длины (увеличение ½400, микроскоп Leica M320 Value, «Leica Microsystems GmbH», Германия) (Ботанический сад Петра Великого Ботанического института им. В.Л. Комарова РАН, г. Санкт-Петербург).
-
2. Жизнеспособность пыльцевых зерен у представителей рода Crataegus , произрастающих в условиях г. Санкт-Петербург ( M ±SEM, Ботанический сад Петра Великого Ботанического института им. В.Л. Комарова РАН, г. Санкт-Петербург)
Вид
Пыльцевые зерна
всего, шт.
проросшие пыльцевыми трубками
не проросшие
короткими
средними и длинными
шт.
%
шт. %
шт. %
C. maximowiczii C.K. Schneid.
104
13
12,5±3,25
10
9,6±2,90
80
76,9±4,15
C. horrida Medik. (растение 1)
120
18
15,0±3,27
16
13,3±3,11
86
71,7±4,13
C. horrida Medik. (растение 2)
236
12
5,0±1,42
24
10,0±1,95
200
84,8±2,34
-
3. Результаты скрещивания разных видов рода Crataegus , произрастающих в условиях г. Санкт-Петербург ( M ±SEM, Ботанический сад Петра Великого Ботанического института им. В.Л. Комарова РАН, г. Санкт-Петербург)
Число завязей, 1-я
Число плодов,
Опылено
ревизия, III декада
2-я ревизия, I
Вид ¥
Вид 0
цветков, шт.
июня
декада сентября
шт.
%
шт.
%
C. maximowiczii
C. maximowiczii
92
64
69,6±4,82
48
52,2±5,23
C.K. Schneid.
C. submollis
100
88
88,0±3,26
52
52,0±5,02
C. horrida (растение 1)
120
56
46,7±4,57
34
28,3±4,13
C. horrida (растение 2)
96
88
91,7±2,83
60
62,5±4,96
C. prunifolia
80
64
80,0±4,50
48
60,0±5,51
C. chlorosarca var. atrocarpa
124
92
74,2±3,94
72
58,1±4,44
C. submollis Sarg.
C. submollis
76
48
63,2±5,57
40
52,6±5,76
C. maximowiczii
108
92
85,2±4,43
64
59,3±4,75
C. horrida (растение 1)
92
72
78,6±4,32
44
47,8±5,23
C. horrida (растение 2)
136
100
73,2±3,79
92
67.7±4.02
Crataegus prunifolia
100
76
76,0±4,29
60
60,0±4,92
C. chlorosarca var. atrocarpa
120
100
83,3±3,41
84
70,0±4,20
Crataegus horrida
C. horrida (растение 1)
88
64
72,7±4,77
48
54,5±5,33
Medik.
C. horrida (растение 2)
108
92
85,2±3,43
40
37,0±4,66
(растение 1)
C. maximowiczii
112
104
92,5±2,44
40
35.7±4.54
C. submollis
120
100
83,3±3,41
56
46,7±4.57
C. prunifolia
128
96
75,0±3,84
80
62,5±4,29
C. chlorosarca var. atrocarpa
96
72
75,0±4,44
64
66,7±4,83
Crataegus
C. horrida (растение 1)
104
72
69,2±4,54
56
53,8±4,91
horrida Medik.
C. horrida (растение 2)
104
80
76,9±4,15
72
69,2±4,54
(растение 2)
C. maximowiczii
112
88
78,6±3,89
68
60,7±4,63
C. submollis
96
76
79,6±4,16
60
62,5±4,96
Crataegus prunifolia
100
60
60,0±4,92
36
36,0±4,82
C. chlorosarca var. atrocarpa
116
96
82,8±3,52
88
75,9±3,99
C. prunifolia
C. prunifolia
80
52
65,0±5,36
44
55,0±5,59
(Lam.) Pers.
C. maximowiczii
132
76
57,6±4,31
68
51,5±4,36
C. submollis
112
64
57,1±4,69
64
57,1±4,69
C. horrida (растение 1)
104
76
73,1±4,37
68
65,4±4,68
C. horrida (растение 2)
112
92
82,1±3,63
88
78,6±3,89
C. chlorosarca
C. chlorosarca var. atrocarpa
112
80
71,4±4,28
60
53,6±4,73
Maxim. var.
C. maximowiczii
128
100
78,1±3,66
76
59,4±4,35
atrocarpa
C. submollis
140
104
74,3±3,70
80
57,1±4,19
(E. Wolf)
C. horrida (растение 1)
72
48
66,7±5,59
36
50,0±5,93
Cinovskis
C. horrida (растение 2)
104
76
73,1±4,37
64
61,5±4,79
C. prunifolia
92
68
73,9±4,60
56
60,9±5,11
C. caucasica C.
C. caucasica
112
88
78,7±3,89
80
71,4±4,28
Koch
C. almaatensis
140
112
80,0±3,39
100
71,4±3,83
C. pinnatifida
112
84
75,0±4,10
84
75,0±4,10
C. monogyna
92
80
87,0±3,56
72
78,3±4,32
C. almaatensis
C. almaatensis
104
88
84,6±3,55
–
–
Pojark.
C. caucasica
76
56
73,7±5,08
–
–
C. pinnatifida
80
60
75,0±4,87
16
20,0±4,50
C. monogyna
136
92
67,6±4,02
–
–
C. pinnatifida
C. pinnatifida
108
84
77,8±4,01
72
66,7±4,55
Bunge
C. caucasica
112
96
85,7±3,32
56
50,0±4,74
C. almaatensis
104
80
76,9±4,15
48
46,2±4,91
C. monogyna
112
72
64,3±4,54
36
32,1±4,43
C. media Becht.
C. caucasica
120
88
73,3±4,05
68
56,7±4,54
Rosa Flore Plena
C. almaatensis
116
84
72,4±4,16
60
51,7±4,65
C. pinnatifida
108
56
51,9±4,83
40
37,0±4,66
C. monogyna
104
48
46,2±4,91
28
26,9±4,37
Продолжение таблицы 3
C. monogyna
C. monogyna
80
72
81,8±4,34
–
–
Jacq.
C. caucasica
124
60
48,4±4,50
28
22,6±3,76
C. almaatensis
108
48
44,4±4,80
16
14,8±3,43
C. pinnatifida
112
56
50,0±4,74
24
21,4±3,89
C. lasiocarpa
C. lasiocarpa
100
72
72,0±4,51
52
52,0±5,02
Lange
C. chlorosarca
104
80
76,9±4,15
44
42,3±4,86
C. macracantha
116
80
69,0±4,31
48
41,4±4,59
C. caucasica
84
68
81,0±4,31
24
28,6±4,95
C. almaatensis
112
84
75,0±4,10
64
57,1±4,69
C. pinnatifida
140
112
80,0±3,39
68
48,6±4,23
C. monogyna
80
64
80,0±4,50
28
35,0±5,36
C. chlorosarca
C. chlorosarca
76
68
89,5±3,54
44
57,9±5,70
Maxim.
C. lasiocarpa
144
88
61,1±4,07
68
47,2±4,17
C. macracantha
112
104
92,9±2,44
84
75,0±4,10
C. caucasica
100
84
84,0±3,68
48
48,0±5,02
C. almaatensis
100
88
88,0±3,26
64
64,0±4,82
C. pinnatifida
108
100
92,6±2,53
48
44,4±4,80
C. monogyna
112
84
75,0±4,10
64
57,1±4,69
C. macracantha
C. macracantha
104
100
96,2±1,89
88
84,6±3,55
Lodd.
C. lasiocarpa
124
96
77,4±3,77
68
54,8±4,48
C. chlorosarca
112
96
85,7±3,32
96
85,7±3,32
C. caucasica
108
104
96,3±1,82
84
77,8±4,01
C. almaatensis
112
92
82,1±3,63
72
64,3±4,54
C. pinnatifida
100
68
68,0±4,68
64
64,0±4,82
C. monogyna
116
76
65,5±4,43
48
41,4±4,59
Примечан
и е. Прочерки означают,
что ветка была сломана.
C. media Becht. «Rosa Flore Plena» исполь-
зовали только в качестве материнской формы ввиду недоразвития у растений мужских генеративных структур.
Результаты гибридизации разных видов боярышника как в форме ксеногамии, так и при межвидовых скрещиваниях показали, что при низкой жизнеспособности пыльцы, определяемой проращиванием на искусственной питательной среде, процент завязываемости плодов и семян в условиях in situ был выше (см. табл. 2, 3). Мы связываем это с большим количеством пыльцы, используемым при принудительном опылении. В природных условиях на рыльце пестика попадает не более 100 пыльцевых зерен (экспериментально установлено авторами), приносимых либо энтомофильными, либо анемофильными агентами. При принудительном опылении растений на рыльце пестика размещаются одновременно до нескольких сотен пыльцевых зерен. Следует отметить, что во многих работах по гибридизации разных видов плодово-ягодных растений, проводившихся в Центральной генетической лаборатории им. И.В. Мичурина (1970-1980 годы), также было показано положительное влияние большого количества пыльцы на результаты гибридизации (31, 32).
Несмотря на высокий процент фертильной пыльцы, она или не прорастала, или прорастала короткими пыльцевыми трубками, которые, начав рост, быстро останавливались (см. рис. 2, в, г). Не прорастало 51,7-90,6 % пыльцы исследуемых видов (табл. 2). Пыльца, прорастающая длинными или средней длины пыльцевыми трубками (см. рис. 2, г), считается наиболее пригодной для оплодотворения (гибридизации). Больше всего такой пыльцы было у C. prunifolia (28,3 %). Немного меньше по сравнению с C. prunifolia длинных и средних пыльцевых трубок образовывалось при прорастании пыльцы C. horrida (10-13 %), C. chlorosarca var. atrocarpa и C. macracantha (12 %), C. submollis ( ∼ 11 %).
Продолжение таблицы 2
C. chlorosarca Maxim. var.
|
atrocarpa (E. Wolf) Cinovskis |
152 |
19 |
12,5±2,69 |
18 |
11,8±2,62 |
115 |
75,7±3,49 |
|
C. prunifolia (Lam.) Pers. |
120 |
24 |
20,0±3,66 |
34 |
28,3±4,13 |
61 |
51,7±4,58 |
|
C. almaatensis Pojark. |
113 |
7 |
6,2±2,27 |
4 |
7,1±2,42 |
102 |
87,6±3,11 |
|
C. pinnatifida Bunge |
244 |
14 |
5,7±1,49 |
10 |
4,1±1,26 |
216 |
90,6±1,87 |
|
C. monogyna Jacq. |
210 |
19 |
9,0±1,98 |
10 |
4,8±1,47 |
183 |
87,1±2,31 |
|
C. caucasica C. Koch |
80 |
4 |
5,0±2,45 |
4 |
5,0±2,45 |
72 |
90,0±3,37 |
|
C. lasiocarpa Lange |
204 |
8 |
3,9±1,36 |
6 |
2,9±1,18 |
189 |
92,6±1,83 |
|
C. chlorosarca Maxim. |
291 |
17 |
5,8±1,37 |
26 |
8,9±1,67 |
235 |
85,2±2,08 |
|
C. macracantha Lodd. |
186 |
8 |
4,3±1,49 |
22 |
11,8±2,37 |
147 |
85,0±2,62 |
|
C. submollis Sarg. |
225 |
9 |
4,0±1,30 |
24 |
10,7±2,06 |
192 |
80,0±2,67 |
В ряде проведенных нами реципрокных скрещиваний была выявлена различная завязываемость плодов, когда один и тот же вид в одном случае служил материнским, в другом — отцовским растением (см. табл. 3). Например, при скрещивании C. prunifolia ½ C. maximowiczii , где C. prunifolia выступал в качестве материнского растения, завязываемость плодов (1-я ревизия) составила 57,6 %. В случае, когда C. maximowiczii был отцовской формой, завязываемость плодов (1-я ревизия) составила 80 %. В скрещивании C. almaatensis ½ C. monogyna , когда C. almaatensis — отцовское растение, за-вязываемость плодов была 44 %; если C. almaatensis — женская особь, завя-зываемость составила 67,6 %. Возможно, подобный эффект объясняется результатами исследования плодовых растений, проведенного В.И. Остапенко (31, 32). Автор изучал активность полифенолоксидаз, пероксидазы и pH пыльцы. Было показано, что мужские ткани полового аппарата отличаются от женских семязачатков большей активностью окислительных процессов, поэтому в разных вариантах реципрокных скрещиваний завязываемость семян различается.
В то же время в ряде скрещиваний мы получили достаточно большое число завязей, независимо от того, какой формой (отцовской или материнской) было растение (см. табл. 3). Например, в скрещиваниях C. maxim-owiczii ½ C. horrida, C. submollis ½ C. chlorosarca, C. pinnatifida ½ C. monogyna, C. submollis ½ C. horrida разница в степени завязываемости плодов при разных комбинациях материнских и мужских форм была несущественной.
Перекрестное опыление доминировало у всех исследованных растений (см. табл. 3). Завязываемость плодов и семян при ксеногамии была высокой: от 63,2 % ( C. submollis ) до 96,2 % ( C. maximowiczii ). Все изученные виды боярышников были способны скрещиваться между собой с образованием достаточно большого количества плодов и семян (см. табл. 3). Наиболее удачными межвидовыми скрещиваниями оказались C. maximowiczii ½ C. submollis , C. maximowiczii ½ C. horrida Medik., C. maximowiczii ½ C. prunifolia , C. submollis ½ C. chlorosarca , C. horrida Medik. ½ C. submollis , C. caucasica ½ C. mono-gyna , C. pinnatifida ½ C. caucasica , C. chlorosarca ½ C. macracantha , C. chloro-sarca ½ C. caucasica , C. chlorosarca ½ C. almaatensis , C. chlorosarca ½ C. pin-natifida , C. macracantha ½ C. chlorosarca , C. macracantha ½ C. caucasica . Наиболее универсальными опылителями, при использовании которых образовывалось максимальное число завязей, следует считать C. maximowiczii и C. caucasica.
Полученные нами результаты согласуются с сообщениями других авторов. Способность к гибридизации достаточно хорошо проявляется у многих видов боярышников. Имеющиеся в литературе фрагментарные данные о результатах гибридизации разных видов боярышников подтверждают возможность как свободного, так и принудительного скрещивания с образованием новых форм (20, 33). При этом отмечается, что морфологическая изменчивость создает сложности для внутривидовой идентификации боярышников (34). Современные методы молекулярно-генетического анализа позволяют определить гибридные экземпляры (33, 35, 36). Так, A.A. Donmez (33), проводя филогенетический анализ рода Crataegus , указывал, что в Турции распространена гибридизация между видами Crataegus . Кроме того, автор предоставил информацию о биогеографическом распространении и родителях обнаруженных гибридов. Имеются и другие сведения о некоторых спонтанных скрещиваниях в природе, например C. laevigata ½ C. monogyna (34) . Оба вида обитают в Западной и Восточной Европе. Там, где их ареалы перекрываются, виды образуют наиболее распространенный в природе гибрид, который занимает промежуточное морфологическое положение по отношению к обоим родителям. При этом указывалось, что в ненарушенных природных насаждениях гибридизация скрещенных видов обычно незначительная (20). Следует отметить, что вопрос о происхождении того или иного гибрида в ряде случаев вызывает дискуссии. Например, указанный выше гибрид C. laevigata ½ C. monogyna некоторые исследователи считают результатом гибридизации C. monogyna ½ C. macrocarpa . Другие рассматривают этот гибрид как отдельный вид C. media (35) .
Показано, что боярышники склонны к гибридизации с образованием полиплоидов, при этом многие полиплоиды возникают в результате гибридизации между представителями разных внутриродовых групп (37-41).
Таким образом, в условиях г. Санкт-Петербурга у исследуемых растений Crataegus наблюдалось нормальное развитие пыльцевых зерен, при этом у каждого вида встречалась пыльца с нарушениями морфологической структуры. Больше всего деформированной пыльцы зафиксировали у C. horrida (∼ 30 %), меньше всего — у C. almaatensis (4,5 %). Пыльца хорошо окрашивалась ацетокармином, была морфологически сформированной и фертильной, однако большая часть пыльцы (51,7-90,6 %) не прорастала на искусственной питательной среде. Наибольшее количество пригодной для гибридизации пыльцы (прорастающей длинными или средней длины пыльцевыми трубками) оказалось у C. prunifolia (28,3 %), немного меньше — у C. horrida (10-13 %), C. chlorosarca и C. macracantha (12 %), C. submollis
( ∼ 11 %). Все изученные формы Crataegus способны скрещиваться между собой с образованием плодов и семян. Завязываемость при ксеногамии составляла от 63,2 % ( Crataegus submollis ) до 96,2 % ( C. maximowiczii ). Некоторые виды при реципрокных скрещиваниях показывали разную степень за-вязываемости плодов. В то же время у ряда видов при реципрокных скрещиваниях разница оказалась несущественной. Наиболее удачными межвидовыми скрещиваниями в роде Crataegus были C. maximowiczii ½ C. submollis , C. maximowiczii ½ C. horrida , C. maximowiczii ½ C. prunifolia , C. submollis ½ C. chlor-osarca , C. horrida ½ C. submollis , C. caucasica ½ C. monogyna , C. pinnatifi-da ½ C. caucasica , C. chlorosarca ½ C. macracantha , C. chlorosarca ½ C. cau-casica , C. chlorosarca ½ C. almaatensis , C. chlorosarca ½ C. pinnatifida , C. mac-racantha ½ C. chlorosarca , C. macracantha ½ C. caucasica . К универсальным опылителям были отнесены C. maximowiczii и C. caucasica.
Список литературы Перспективные скрещивания видов в роде Crataegus L. (Rosaceae)
- Al Humayed S. Protective and therapeutic effects of Crataegus aronia in non-alcoholic fatty liver disease. Archives of Physiology and Biochemistry, 2016, 123(1): 23-30 (doi: 10.1080/13813455.2016.1205097).
- Belkhir M., Rebai O., Dhaouadi K., Sioud B., Amri M., Fattouch S. Antioxidant and antimicrobial activities of Tunisian azarole (Crataegus Azarolus L.) leaves and fruit pulp/peel polyphenolic extracts. International Journal of Food Properties, 2013, 16(6): 1380-1393 (doi: 10.1080/10942912.2011.586080).
- Maldonado-Cubas J., Albores-Méndez E.M., Martín-Martínez E.S., Quiroz-Reyes C.N., González-Córdova G.E., Casañas-Pimentel R.G. Mexican hawthorn (Crataegus gracilior J.B. Phipps) stems and leaves induce cell death on breast cancer cells. Nutrition and Cancer, 2019, 72(8): 1411-1421 (doi: 10.1080/01635581.2019.1678657).
- Edwards J.E., Brown P.N., Talent N., Dickinson T.A., Shipley P.R. A review of the chemistry of the genus Crataegus. Phytochemistry, 2012, 79(6): 5-26 (doi: 10.1016/j.phytochem.2012.04.006).
- Cloud A., Vilcins D., McEwen B. The effect of hawthorn (Crataegus spp.) on blood pressure: a systematic review. Advances in Integrative Medicine, 2020, 7(3): 167-175 (doi: 10.1016/j.aimed.2019.09.002).
- Ameray A., Castro J.P., Castro M. Potential greenhouse gas emissions mitigation through increased grazing pressure: a case study in North Portugal. Carbon Management, 2022, 13(1): 142-153 (doi: 10.1080/17583004.2022.2029575).
- Лихитченко М.А. Боярышники Приморского края, их роль в лесных биогеоценозах и хозяйственное значение. Автореф. канд. дис. Уссурийск. 2004.
- Özyurt G., Yücesan Z., Ak N., Oktan E., Üçler A.O. Ecological and economic importance of studying propagation techniques of common hawthorn Crataegus monogyna Jacq. Сибирский лесной журнал, 2019, 4: 63-67.
- Li R., Luan F., Zhao Y., Wu M., Lu Y., Tao C., Zhu L., Zhang C., Wan L. Crataegus pinnatifida: a botanical, ethnopharmacological, phytochemical, and pharmacological overview. Journal of Ethnopharmacology, 2023, 301: 115819 (doi: 10.1016/j.jep.2022.115819).
- Александров В.Г. Анатомия растений. М., 1966.
- Vašková D., Kolarčik V. Breeding systems in diploid and polyploid hawthorns (Crataegus): evidence from experimental pollinations of C. monogyna, C. subsphaerica, and natural hybrids. Forests, 2019, 10(12): 1059 (doi: 10.3390/f10121059).
- Dickinson T.A., Yan B.X., Han S., Zarrei M. Niche shifts, hybridization, polyploidy and geographic parthenogenesis in Western North American hawthorns (Crataegus subg. Sanguineae, Rosaceae). Agronomy, 2021, 11(11): 2133 (doi: 10.3390/agronomy11112133).
- Фисун М.Н., Егорова Е.М., Цороев А.Х., Саракуева Ф.Ж., Кагазежева Н.Х. Урожайность и качество плодов древесных и кустарниковых дикоплодовых растений в Нижнегорном поясе Центрального Предкавказья. Естественные науки, 2012, 1(167): 37-40.
- Бессонова А.В. Биологические особенности роста и плодоношения перспективных форм боярышника для промышленных насаждений. Автореф. канд. дис. Мичуринск, 2019.
- Škvareninová J., Lukasová V., Borsányi P., Kvas A., Vido J., Štefková J., Škvarenina J. The effect of climate change on spring frosts and flowering of Crataegus laevigata — the indicator of the validity of the weather lore about “The Ice Saints”. Ecological Indicators, 2022, 145: 109688 (doi: 10.1016/j.ecolind.2022.109688).
- Sargsyan M.V. The genus Crataegus (Rosaceae) in Armenia (an updated review). Biosystems Diversity, 2022, 30(3): 270-273 (doi: 10.15421/012229).
- Семенютина А.В., Панов В.Н., Кащенко Е.В. К вопросу интродукции видов родового комплекса Crataegus. для озеленения населенных пунктов. Мат. Межд. науч.-практ. конф. «Защитное лесоразведение, мелиорация земель, проблемы агроэкологии и земледелия в россий-ской федерации». Волгоград, 2016, 376-380.
- Fichtner A., Wissemann V. Biological flora of the British Isles: Crataegus monogyna. Journal of Ecology, 2021, 109(1): 541-571 (doi: 10.1111/1365-2745.13554).
- Вафин Р.В. Биологические особенности интродуцированных видов рода Crataegus L. Автореф. канд. дис. Уфа, 2002.
- Liston A., Weitemier1 K.A., Letelier L., Podan J., Zong Y., Liu L., Dickinson T.A. Phylogeny of Crataegus (Rosaceae) based on 257 nuclear loci and chloroplast genomes: evaluating the impact of hybridization. PeerJ, 2021, 9: e12418 (doi: 10.7717/peerj.12418).
- Christensen K.I., Zarrei M., Kuzmina M., Talent N., Lin C., Dickinson T.A. Crataegus ½ninae-celottiae and C. ½ cogswellii (Rosaceae, Maleae), two spontaneously formed intersectional nothospecies. PhytoKeys, 2014, 36: 1-26 (doi: 10.3897/phytokeys.36.6784).
- Lo E.Y.Y., Stefanović S., Christensen K.I., Dickinson T.A. Evidence for genetic association between East Asian and western North American Crataegus L. (Rosaceae) and rapid divergence of the eastern North American lineages based on multiple DNA sequences. Molecular Phylogenetics and Evolution, 2009, 51(2): 157-168 (doi: 10.1016/j.ympev.2009.01.018).
- Phipps J.B. Studies in Mespilus, Crataegus, and ½Crataemespilus (Rosaceae), i. differentiation of Mespilus and Crataegus, expansion of ½Crataemespilus, with supplementary observations on differences between the Crataegus and Amelanchier clades. Phytotaxa, 2016, 257(3): 201-229 (doi: 10.11646/phytotaxa.257.3.1).
- Романова Н.П., Шелаботин Г.П., Леонченко В.Г., Ханина Н.П., Никольский Б.В., Расторгуев С.Л., Туровский И.И. Методические рекомендации по применению цитологических методов в плодоводстве. М., 1988.
- Вайнагий И.В. О методике изучения семенной продуктивности растений. Ботанический журнал , 1974, 58(6): 826 831.
- Левина Р.Е. Репродуктивная биология семенных растений. М., 1981.
- Sharafi V. Suitable in vitro medium for studying pollen viability in some of the Iranian hawthorn genotypes. Journal of Medicinal Plants Research, 2010, 4(19): 1967-1970 (doi: 10.5897/JMPR10.419).
- Яндовка Л.Ф., Барабанов И.В. Строение пыльцевого зерна и опыление у представи-телей рода Ribes L. (Grossulariaceae). Ботанический журнал, 2023, 108(1): 37-50 (doi: 10.31857/S000681362301009X).
- Wang H.-G., Huang J.-C., Jauh G.-Y. Pollen germination and tube growth. In: Advances in botanical research, vol. 54 /J.C. Kader, M. Delseny (ed.). Academic Press, Cambridge, 2010: 1-52 (doi: 10.1016/S0065-2296(10)54001-1).
- Patel R.G., Mankad A.U. In vitro pollen germination — a review. International Journal of Science and Research, 2014, 5(3): 358.
- Остапенко В.И. Вопросы физиологии сексуализации, оплодотворения и гибридизации плодовых растений и некоторые биофизические методы управления этими процессами. Автореф. канд. дис. Харьков, 1968.
- Остапенко В.И. Программа и методика биофизических исследований плодовых растений. Мичуринск, 1978.
- Dönmez A.A. The genus Crataegus L. (Rosaceae) wih special reference to hybridisation and biodiversity in Turkey. Turkish Journal of Botany, 2004, 28(1): 29-37.
- Каталог растений для ландшафтного дизайна. Боярышник гибридный (crataegus ½ media). Режим доступа: https://catalog.greenmaster.by/listvennie_derevya/crataegus/media. Без даты.
- Lo E.Y.Y., Stefanović S., Dickinson T.A. Population genetic structure of diploid sexual and polyploid apomictic hawthorns (Crataegus; Rosaceae) in the Pacific Northwest. Molecular Ecology, 2009, 18(6): 1145-1160 (doi: 10.1111/j.1365-294X.2009.04091.x).
- Phipps J.B. A review of hybridization in North American hawthorns — another look at the Crataegus problem. Annals of the Missouri Botanical Garden, 2005, 92: 113-126.
- Coughlan J.M., Han S., Stefanović S., Dickinson T.A. Widespread generalist clones are associated with range and niche expansion in allopolyploids of Pacific Northwest Hawthorns (Crataegus L.). Molecular Ecology, 2017, 26(20): 5484-5499 (doi: 10.1111/mec.14331).
- Lo E.Y.Y., Stefanović S., Dickinson T.A. Reconstructing reticulation history in a phylogenetic framework and the potential of allopatric speciation driven by polyploidy in an agamic complex in Crataegus (Rosaceae). Evolution, 2010, 64(12): 3593-3608 (doi: 10.1111/j.1558-5646.2010.01063.x).
- Zarrei M., Stefanović S., Dickinson T.A. Reticulate evolution in North American black-fruited hawthorns (Crataegus section Douglasia; Rosaceae): evidence from nuclear ITS2 and plastid sequences. Annals of Botany, 2014, 114(2): 253-269 (doi: 10.1093/aob/mcu116).
- Dickinson T.A., Belaoussoff S., Love R.M., Muniyamma M. North American black-fruited hawthorns: I. Variation in floral construction, breeding system correlates, and their possible evolutionary significance in Crataegus sect. Douglasii Loudon. Folia Geobotanica, 1996, 31: 355-371 (doi: 10.1007/BF02815380).
- Talent N., Dickinson T.A. Polyploidy in Crataegus and Mespilus (Rosaceae, Maloideae): evolutionary inferences from flow cytometry of nuclear DNA amounts. Canadian Journal of Botany, 2005, 83(10): 1268-1304 (doi: 10.1139/b05-088).


