Перспективы использования низкомодульных сплавов системы Ti-(15-20)Nb-(5-10)Ta для создания имплантатов в травматологии и ортопедии. Доклиническое исследование
Автор: Ошкуков Сергей Александрович, Баикин Александр Сергеевич, Галкин Анатолий Гериевич, Глазкова Полина Александровна, Шавырин Дмитрий Александрович, Волошин Виктор Парфентьевич, Шевырев Константин Васильевич, Бирюкова Татьяна Александровна, Дементьев Иван Михайлович, Петрицкая Елена Николаевна, Колмаков Алексей Георгиевич, Насакина Елена Олеговна, Конушкин Сергей Викторович, Каплан Михаил Александрович, Сергиенко Константин Владимирович, Севостьянов Михаил Анатольевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.28, 2022 года.
Бесплатный доступ
Цель. Изучение механических и биологических свойств пяти вариантов сплавов системы Ti-Nb-Ta. Материалы и методы. Получены пять сплавов из системы: Ti-(15-20)Nb-(5-10)Ta (ат. %). Проведены их механические испытания путем растяжения на универсальной испытательной машине INSTRON 3382 в соответствии с ГОСТ 1497-84. Произведена оценка биологоческих свойств полученных сплавов в экспериментах in vivo на белых аутбредных мышах-самцах JCR. Гистологическое исследование тканей оперированной конечности с имплантатом, почек и печени проводилось в трех временных точках: на 1, 4, 12 неделе после операции. Результаты. Образцы показали пластичность от 11,5 до 14,6 %, прочность от 549 до 673 МПа и модуль Юнга от 42 до 50 ГПа. Предел текучести также изменяется в зависимости от состава сплава в пределах 188 - 572 МПа. Воспалительная реакция была наименее выражена в группах, где имплантировали сплавы Ti-20Nb-5Ta и Ti-15Nb-10Ta. Дискуссия. В сравнении с широко используемым сплавом TiAl6V4 полученные сплавы примерно соответствуют по пластичности и обладают примерно в 2 раза меньшим модулем Юнга, что должно обеспечить лучшую биомеханическую совместимость между имплантатом и окружающими его биологическими тканями, препятствуя эффекту защиты от стресса и, соответственно, резорбции кости. Относительно низкий предел прочности полученных сплавов не снижает обозначенного выше преимущества перед TiAl6V4, так как данной прочности вполне хватает для предлагаемого применения. При гистологическом исследовании интенсивность локальной воспалительной реакции в новых сплавах выше, чем при применении TiAl6V4, что требует дальнейшего изучения и могло быть связано с малым количеством наблюдений. Выводы. Путь создания титановых сплавов с низким модулем Юнга может решить проблему биомеханической совместимости имплантата с окружающими тканями. Полученные и описанные сплавы системы Ti-Nb-Ta показали требуемые механические и, по первичной оценке, приемлемые биологические свойства, требующие дальнейшего более широкого исследования.
Титановый сплав, система ti-nb-ta, биосовместимость, механические свойства, исследования in vivo, модуль юнга, биомеханическая совместимость
Короткий адрес: https://sciup.org/142236811
IDR: 142236811 | УДК: 616-77-092.9:620.17:539.32 | DOI: 10.18019/1028-4427-2022-28-6-830-836
Текст научной статьи Перспективы использования низкомодульных сплавов системы Ti-(15-20)Nb-(5-10)Ta для создания имплантатов в травматологии и ортопедии. Доклиническое исследование
Стремление увеличить качество и продолжительность жизни человека в свою очередь предполагает изобретение биосовместимых материалов, из которых будет возможно создание искусственных органов и тканей. Особую актуальность приобретают материалы для оперативного лечения различных заболеваний или травм (переломов), позволяющие поддерживать оптимальные условия для регенерации костной ткани. В настоящее время в качестве материалов для травматологии и ортопедии применяют чаще всего металлы и их сплавы [1].
Важное значение в травматологии и ортопедии имеет интеграция материала в кость с целью улучшения стабильности и выживаемости имплантатов [2].
Потеря костной массы, вызванная защитой от напряжения металлических имплантатов, вызывает беспокойство, поскольку потенциально может привести к дестабилизации имплантата. Покрытие поверхности и снижение структурной жесткости имплантатов – два способа улучшить прорастание кости и остеоинтеграцию. Аддитивное производство посредством селективного лазерного спекания (SLS) или электронно-лучевого плавления (EBM) металлических сплавов позволяет производить пористые имплантаты с участками врастания кости, которые улучшают остеоинтеграцию и, как следствие, клинические результаты [3].
Сплавы на основе кобальта являются одними из первых биоматериалов для применения в эндопротезировании тазобедренного сустава. Однако данные сплавы имеют ряд недостатков, а именно: высокий модуль упругости, биологически токсичны, дорогие по себестоимости [4].
Сплавы на основе магния обладают хорошей биосовместимостью, низким модулем упругости, а также являются биоразлагаемыми. Не стоит забывать о недостатках данного материала – низкая коррозионная стойкость, выделение водорода при деградации, а также возможность их применения лишь на отделах скелета, не несущих нагрузку [5, 6].
Среди металлов также используют нержавеющую стальв различных металлофиксаторах. Несмотря на ряд недостатков (высокий модуль упругости, часто встречающиеся аллергические реакции), нержавеющая сталь является привлекательным материалом за счет низкой стоимости, легкодоступности, а также приемлемой биосовместимости [7].
Титан (Ti, чистый титан – 98-99,6 %) характеризуется высокой коррозионной стойкостью и биосовместимостью. Чистый титан более вязкий, применяется для пористых покрытий, тотального эндопротезирования суставов, металлофиксаторов, однако имеет недостатки, связанные с низкой износостойкостью, высоким модулем упругости [8, 9]. Высокий модуль упругости чистого титана (102-105 Гпа) по сравнению биологическими тканями (например – с костными – 4-30 Гпа) может обусловливать низкий уровень биомеханической совместимости между материалами имплантата и окружающими его биологическими тканями и даже вызвать отторжение имплантата [10].
Добавление специальных легирующих элементов к титану снижает модуль упругости. К таким легирующим элементам относятся тантал, ниобий, цирконий, ванадий, алюминий и др. Взаимодействие имплантата с тканями и внутренней средой человеческого организма может приводить к высвобождению легирующих элементов, которые, в свою очередь, могут вызывать аллергическую реакцию, что приводит зачастую к необходимости удаления такого имплантата [11-13].
Сплав Ti6Al4V является одним из первых биоматериалов на основе титана для изготовления имплантатов и до сих пор относится к одним из наиболее часто используемых материалов для этой цели благодаря лучшим механическим характеристикам по сравнению с чистым титаном и некоторыми сплавами на его основе. Однако существует огромный недостаток сплава Ti6Al4V, связанный с цитотоксичным эффектом, который вызван выбросами ионов алюминия и ванадия, являющимися ядовитыми и неблагоприятно влияющими на здоровье человека. Стоит отметить, что Ti6Al4V имеет более высокий модуль упругости по сравнению с костной тканью, что провоцирует эффект защиты от стресса, который вызывает резорбцию кости, соприкасающейся с имплантатом, что, в свою очередь, приводит к выходу его из строя [14].
Одними из новых претендентов на лидирующие позиции по созданию имплантатов являются разрабатываемые титановые сплавы вследствие их очень хорошей механической и коррозионной устойчивости и биосовместимости [15], которые содержат только нетоксичные элементы и удовлетворяют потребностям имплантата по механическим, антикоррозионным и биосовместимым свойствам, проявляют высокую механическую прочность и сопротивление усталости, имеют низкий модуль упругости, хорошую износостойкость и т.д.
Например, тантал и ниобий обладают высокой коррозионной стойкостью и биосовместимостью [16, 17]. Также они используются в качестве β -стабилизаторов в титановых сплавах, способствующих уменьшению модуля упругости [10]. В работе Huifeng Wang и др., 2014,. за основу взяли ниобий, а титан применялся в качестве легирующего элемента [18]. Исследования показали хорошую биосовместимость, но недостаточный модуль упругости, из чего можно сделать вывод, что для обеспечения механических свойств имплантата основным компонентом должен являться титан. Также следует выделить статью Jue Liu и др., 2017, в которой полученный сплав Ti-Nb-Ta показал низкий модуль упругости и более высокую коррозионную стойкость по сравнению со сплавом Ti-6Al-4V [19].
Таким образом, разработка и исследование материала «сплав-системы Ti-Nb-Ta» представляет интерес для дальнейшего развития материалов для травматологии и ортопедии.
Цель исследования : изучение механических и биологических свойств пяти вариантов сплавов системы Ti-Nb-Ta.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено исследование пяти сплавов системы Ti-Nb-Ta.
Для исследований в данной работе были выбраны сплавы из следующего диапазона составов: Ti-20Nb-10Ta, Ti-20Nb-7,5Ta, Ti-20Nb-5Ta, Ti-15Nb-10Ta, Ti-15Nb-5Ta (ат. %). В качестве шихтовых материалов использовались йодидный титан, ниобий марки Нб-1 и тантал марки ТВЧ. Плавка навесок проводилась в электродуговой вакуумной печи с нерас-ходуемым вольфрамовым электродом L200DI фирмы LEYBOLD-HERAEUS (Германия). Получали слитки массой 30 г, которые сплавляли в единый слиток весом 180 г. Большие слитки дополнительно подвергали гомогенизирующему отжигу в вакууме 5 × 10-5 мм рт. ст. при температуре 850 °С в течение 12 ч. Деформацию литых заготовок толщиной 10-12 мм проводили методом теплой прокатки при температуре 600 °С на двухвалковом стане ДУО-300 до конечной толщины заготовки – 1 мм.
Исследование механических свойств осуществлялось путем растяжения на универсальной испытательной машине INSTRON 3382 со скоростью растяжения 1 мм/мин. Плоские образцы с головками получали из плоских пластин и вырезались с помощью электро-эрозионной резки. Испытание образцов проводились по методикам ГОСТ 1497-84. Обработка результатов испытаний при определении характеристик механических свойств проводилась в соответствии с ГОСТ 149784 с помощью программного обеспечения INSTRON Bluehill 2.0. На одну экспериментальную точку испытывали по 5 образцов. Определялись значения относительного удлинения, условного предела текучести, предела прочности и модуля Юнга.
Биологические свойства оценивали в экспериментах in vivo. Эксперименты in vivo проводили на белых аутбредных мышах-самцах JCR, масса животных на момент включения в эксперимент 20-25 граммов, воз- раст 2-3 месяца (n = 72). Животные были поделены на 6 групп (по 12 мышей в группе), всем животных проводилась операция по вживлению имплантатов в мышцы бедра (табл. 1). Имплантат представлял собой образец сплава цилиндрической формы размером 1 × 1 × 8 мм (высота × ширина × длина).
Таблица 1 Типы имплантатов, вживляемых разным группам животных
|
Группа |
Тип имплантата |
Количество животных |
|
1 |
Ti-20Nb-10Ta |
12 |
|
2 |
Ti-20Nb-7,5Ta |
12 |
|
3 |
Ti-20Nb-5Ta |
12 |
|
4 |
Ti-15Nb-10Ta |
12 |
|
5 |
Ti-15Nb-5Ta |
12 |
|
6 |
TiAl6V4* |
12 |
* – данный сплав часто применяется в медицине и выступал в качестве контрольного материала
Хирургическая подготовка животных
Операция проводилась под общей анестезией: зо-летил 8 мг/кг (действующие вещества — золазепама гидрохлорид, тилетамина гидрохлорид в равных пропорциях) и ксила 0,42 мл/кг (действующее вещество — ксилазина гидрохлорид 2 % раствор) внутрибрюшинно. Перед имплантацией шерсть в периоперационной области удалялась при помощи крема Veet, кожа обрабатывалась антисептиком.
Антибиотикотерапия: непосредственно перед операцией всем животным вводили 0,4 мг цефтриаксона внутрибрюшинно, после операции – 0,8 мг цефтриаксона внутрибрюшинно.
Производился разрез кожи и фасции бедра по наружной поверхности. Раздвигались мышечные волокна и глубоко в рану помещались экспериментальные образцы, после чего рана ушивалась и обрабатывалась антисептиком (рис. 1).
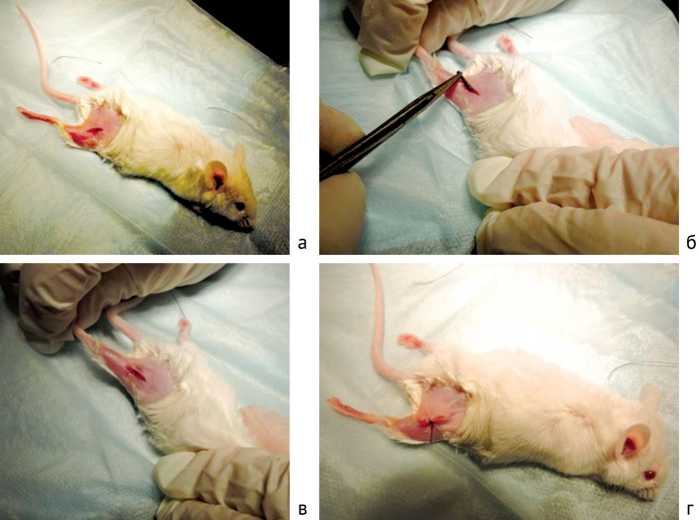
Рис. 1. Этапы имплантации
Гистологическое исследование
Для проведения гистологического исследования осуществлялась эвтаназия путем введения летальной дозы анестетика Золетил – 200 мг/кг массы тела.
Оперированная конечность с имплантатом, почки и печень отправлялись на гистологическое исследование.
Гистологическое исследование тканей проводилось в трех временных точках: на 1, 4, 12 неделе после операции, что соответствует ранней, средней и поздней фазам после имплантации. На точку наблюдения приходилось 3 мыши.
Материал, подлежащий исследованию (конечность, почки, печень), фиксировали в 10 % нейтральном (забуфе-ренном) формалине в течение 10-24 часов. После вырезки фрагменты ткани обрабатывались в гистопроцессоре Leica TP1020 (производитель Leika Microsystems, Германия) по стандартному протоколу, после чего производилась заливка в парафиновые блоки. Гистологические срезы толщиной 3-5 мкм получали при помощи микротома Leica RM2245 (производитель Leika Mikrosystems, Германия). Изготовленные гистологические препараты окрашивали гематоксилином и эозином в гистостейнере Leica Autosteiner XL (производитель Leika Microsystems, Германия), проводилась дополнительная окраска по Ван-Гизону, для изучения структуры соединительной ткани, а также оценки стадий фибрина. Полученные гистологические препараты исследовались в световом микроскопе Leika DFS 295 (производитель Leika Microsystems, Германия).
РЕЗУЛЬТАТЫ
Механические свойства полученных сплавов
Усредненные результаты испытаний приведены в таблице 2.
Таблица 2
Механические свойства сплавов
|
Вид сплава |
Отн. удл. (%) |
Предел текучести (МПа) |
Предел прочности (МПа) |
Модуль Юнга (ГПа) |
|
Ti-15Nb-5Ta |
11,6 ± 0,5 |
572 ± 7 |
673 ± 8 |
42 ± 2 |
|
Ti-15Nb-10Ta |
14,6 ± 0,5 |
212 ± 3 |
608 ± 6 |
50 ± 2 |
|
Ti-20Nb-5Ta |
11,5 ± 0,5 |
189 ± 3 |
592 ± 6 |
48 ± 2 |
|
Ti-20Nb-7,5Ta |
12,4 ± 0,5 |
188 ± 3 |
569 ± 6 |
44 ± 2 |
|
Ti-20Nb-10Ta |
11,8 ± 0,5 |
296 ± 4 |
549 ± 6 |
49 ± 2 |
|
TiAl6V4 (материал сравнения) |
11,5 ± 6,5 |
900 ± 20 |
925 ± 25 |
108,5 ± 4,5 |
На основании полученных данных можно сделать вывод, что все образцы обладают хорошей пластичностью (от 11,5 до 14,6 %), прочностью (от 549 до 673 МПа) и модулем Юнга, колеблющемся от 42 до 50 ГПа. Предел текучести также изменяется в зависимости от состава сплава в пределах 188-572 МПа.
Наиболее высокой прочностью обладает сплав Ti-15Nb-5Ta, который также имеет минимальный модуль Юнга, высокий предел текучести и хорошую пластичность. Также следует отметить сплав Ti-15Nb-10Ta следующим по прочности сплавом с показателем пластичности выше, чем у Ti-15Nb-5Ta.
Также можно заметить, что при увеличении доли ниобия падает предел прочности материала, т.е. сплавы с содержанием 20 % ниобия обладают наименьшей прочностью.
В сравнении с TiAl6V4 полученные сплавы примерно соответствуют по пластичности и обладают примерно в 2 раза меньшим модулем Юнга, что должно обеспечить лучшую биомеханическую совместимость между имплантатом и окружающими его биологическими тканями, препятствуя эффекту защиты от стресса и, соответственно, резорбции кости. Относительно низкий предел прочности полученных сплавов не снижает обозначенного выше преимущества перед TiAl6V4, так как данной прочности вполне хватает для предполагаемого применения.
Оценка биологических свойств сплавов in vivo
Хирургическое лечение и послеоперационный период
Операции были успешно завершены на всех животных. В раннем послеоперационном периоде отмечен 1 летальный исход в группе Ti-20Nb-7,5Ta, связанный с анестезиологическим пособием, что составило 1,4 %.
В 4-х случаях смерть наступила на фоне воспаления с развитием сепсиса в группах Ti-20Nb-10Ta, Ti-20Nb-7,5Ta, Ti-20Nb-5Ta, Ti-15Nb-10Ta. Общая летальность составила 6,9 %. Гистологические препараты тканей животных, погибших на фоне воспалительной реакции, представлены на рисунке 2.
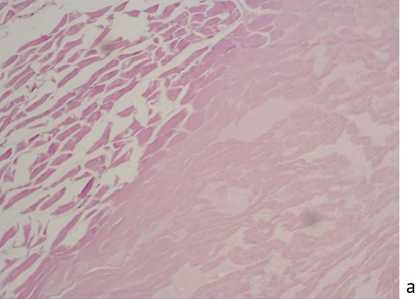
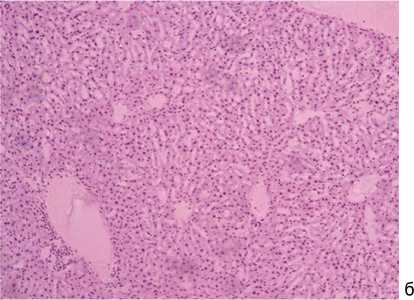
Рис. 2. Гистологические препараты: а – мягкие ткани бедра с колликвационным некрозом. Гематоксилин-эозин, ×200; б – признаки острой сердечной недостаточности в ткани печени (дистрофия гепатоцитов, центролобулярное полнокровие). Гематоксили-эозин, ×100. Гематоксилин-эозин, ×400; г – миелоз красной пульпы, реактивные фолликулярные центры в септической селезенке. Гематок-силин-эозин, ×200
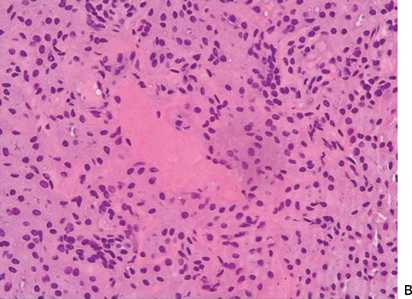
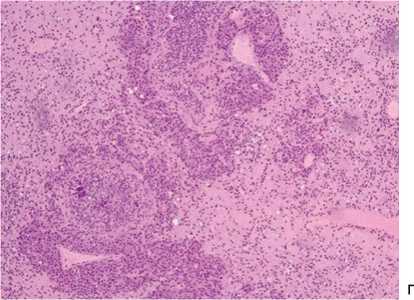
Продолжение рис. 2. Гистологические препараты: в – признаки острой сердечной недостаточности в ткани почки (дистрофия эпителия почечных канальцев, венозное полнокровие, очаги кровоизлияний в интерстиции). Гематоксилин-эозин, ×400; г – миелоз красной пульпы, реактивные фолликулярные центры в септической селезенке. Гематоксилин-эозин, ×200
Гистологическое исследование
По результатам исследования биологических свойств in vivo образцов листов сплава системы Ti-Nb-Ta, основанных на полуколичественной оценке активности воспаления, выявлялись следующие признаки: для первой недели эксперимента активность воспаления разной степени выраженности (от низкой до высокой) отмечалась во всех экспериментальных группах, кроме контрольной (рис. 3-6).
При оценке исследования биологических свойств in vivo образцов листов сплава системы Ti-Nb-Ta, предпочтение можно отдать сплавам Ti-20Nb-5Ta и Ti-15Nb-10Ta, так как выраженность воспаления в динамке уменьшалась (табл. 3).
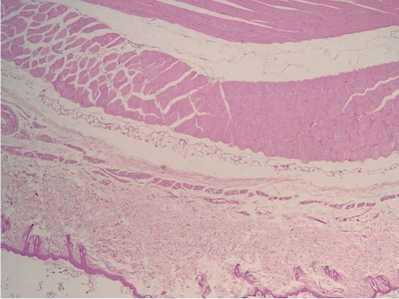
Рис. 5. 12-я неделя наблюдений. Мягкие ткани бедра, фаза регенерации. Гематоксилин-эозин, ×200
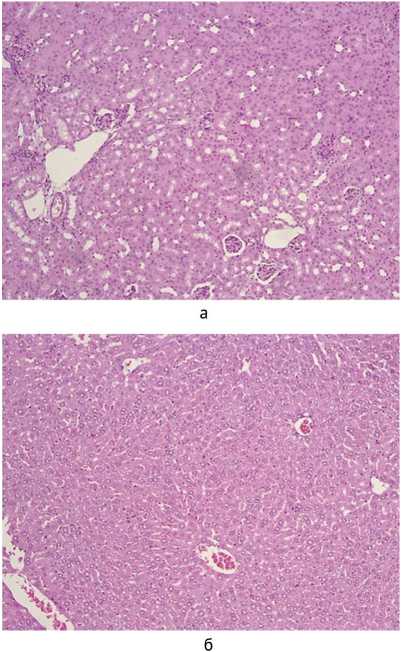
Рис. 6. Дистрофия паренхиматозных органов: почек (а), печени (б). Гематоксилин-эозин, ×200
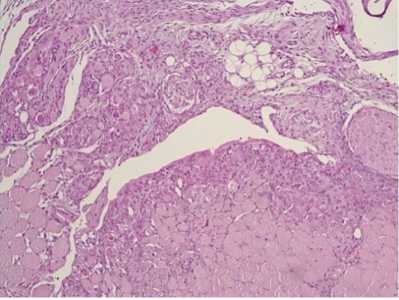
Рис. 3. Образцы Ti-20Nb-5Ta через 1 неделю от начала имплантации: в зоне, прилежащей к имплантату, мышцы бедра имеют признаками острого воспаления. Гематоксилин-эозин, ×200
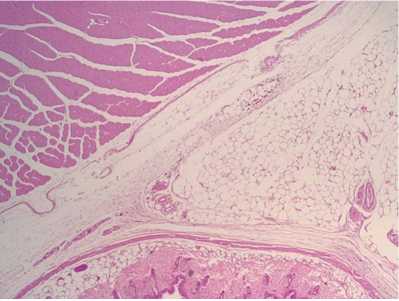
Рис. 4. Мягкие ткани бедра с морфологическими признаками воспаления в фазе пролиферации. Гематоксилин-эозин, ×200
Табица 3
Критерии полуколичественной оценки выраженности активности воспаления:
– низкий «+» – менее 10 нейтрофилов в поле зрения;
– умеренный «++» – больше 10, но меньше 30 ней-
трофилов в поле зрения;
– высокий «+++» – более 30 нейтрофилов в поле зрения
– отсутствие активного воспаления «–»;
– преобладание хронического воспаления «+/–».
Биологические свойства in vivo образцов листов сплава системы Ti-Nb-Ta
|
Сплав / неделя |
Первая |
Четвертая |
Двенадцатая |
|
Ti-20Nb-10Ta |
+++ |
+/– |
– |
|
Ti-20Nb-7,5Ta |
++ |
++ |
– |
|
Ti-20Nb-5Ta |
++ |
+ |
– |
|
Ti-15Nb-10Ta |
+ |
– |
– |
|
Ti-15Nb-5Ta |
+++ |
– |
– |
|
TiAl6V4 (контроль) |
– |
– |
– |
ОБСУЖДЕНИЕ
Увеличение количества операций первичного эндопротезирования тазобедренного и коленного суставов приводит к росту ревизионных операций. Причины ревизионного эндопротезирования связаны с осложнениями, возникающими интраоперационно, в раннем и позднем послеоперационном периоде. Различают раннюю и позднюю асептическую нестабильность. К ранней асептической нестабильности эндопротеза относят все случаи асептической нестабильности, выявляемые в сроки до 5 лет после установки искусственного сустава. К поздней асептической нестабильности относятся все случаи, выявляемые в сроки свыше пяти лет после первичной операции эндопротезирования. Доля ревизий, выполненных в течение 5 лет после предшествующего эндопротезирования, в общей структуре ревизионных операций составляет до 33 %. Через 5-10 лет после первичной операции ревизионное эндопротезирование показано в 25-60 % случаев от общего количества выполненных операций [20].
Осложнения, возникающие в раннем послеоперационном периоде, как правило, связаны с ошибками предоперационного планирования, обусловленными недооценкой качества кости и анатомических особенностей проксимального отдела бедренной кости и вертлужной впадины; неадекватным учетом массы
пациента и его физической активности, неправильным выбором имплантата и технологии его фиксации.
В позднем послеоперационном периоде осложнения связаны с эксплуатацией и техническими свойствами эндопротеза (качество материала и допущенные дефекты при изготовлении эндопротеза, конструктивные особенности, трибологические характеристики пары трения, разрушение элементов эндопротеза, потеря прочной фиксации компонентов к подлежащей кости) [21].
Решение проблемы разрушения элементов эндопротеза лежит в плоскости материаловедения и производства эндопротезов. Причины потери прочной фиксации компонентов многофакторны, а процессы многогранны и не до конца изучены [22].
В сравнении с широко используемым сплавом TiAl6V4 полученные сплавы примерно соответствуют по пластичности и обладают примерно в 2 раза меньшим модулем Юнга, что должно обеспечить лучшую биомеханическую совместимость между имплантатом и окружающими его биологическими тканями, препятствуя эффекту защиты от стресса и, соответственно, резорбции кости. Относительно низкий предел прочности полученных сплавов не снижает обозначенного выше преимущества перед TiAl6V4, так как данной прочности вполне хватает для предполагаемого применения.
ЗАКЛЮЧЕНИЕ
Путь создания титановых сплавов с низким модулем Юнга может решить проблему биомеханической совместимости имплантата с окружающими тканями. Полученные и описанные сплавы системы Ti-Nb-Ta показали требуемые механические и, по первичной оценке, приемлемые биологические свойства, требующие дальнейшего более широкого исследования. Наиболее высокой прочностью обладает сплав Ti-15Nb-5Ta, который также имеет минимальный модуль Юнга, высокий предел текучести и хорошую пластичность. Сплав Ti-15Nb-10Ta был следующим по прочности сплавом с показателем пластичности выше, чем у Ti-15Nb-5Ta,
и продемонстрировал лучшие биологические свойства in vivo – низкая активность воспаления на первой неделе и полное его отсутствие к четвертой. Кроме того, следует отметить, что в группе с имплантированным сплавом Ti-20Nb-5Ta была зафиксирована умеренная воспалительная реакция на первой неделе, с постепенным ее исчезновением к двенадцатой.
При гистологическом исследовании через 1, 4 и 12 недель было показано, что интенсивность локальной воспалительной реакции в новых сплавах выше, чем при применении TiAl6V4, что требует дальнейшего изучения и могло быть связано с малым количеством наблюдений.
Список литературы Перспективы использования низкомодульных сплавов системы Ti-(15-20)Nb-(5-10)Ta для создания имплантатов в травматологии и ортопедии. Доклиническое исследование
- Metallic powder-bed based 3D printing of cellular scaffolds for orthopaedic implants: A state-of-the-art review on manufacturing, topological design, mechanical properties and biocompatibility / X.P. Tan, YJ. Tan, C.S.L. Chow, S.B. Tor, W.Y. Yeong // Mater. Sci. Eng. C. Mater. Biol. Appl. 2017. Vol. 76. P. 1328-1343. DOI: 10.1016/j.msec.2017.02.094.
- Biomechanical analysis of the osseointegration of porous tantalum implants / D. Fraser, P. Funkenbusch, C. Ercoli, L. Meirelles // J. Prosthet. Dent. 2020. Vol. 123, No 6. Р. 811-820. DOI: 10.1016/j.prosdent.2019.09.014.
- Novel adaptive finite element algorithms to predict bone ingrowth in additive manufactured porous implants / V.S. Cheong, P. Fromme, A. Mumith, M.I. Coathup, G.W. Blunn // J. Mech. Behav. Biomed. Mater. 2018. Vol. 87. P. 230-239. DOI: 10.1016/j.jmbbm.2018.07.019.
- Aherwar A., Singh A.K., Patnaik A. Cobalt based alloy: A better choice biomaterial for hip implants // Trends Biomater. Artif. Organs. 2016. Vol. 30, No 1. Р. 50-55.
- Hybrid fracture fixation systems developed for orthopaedic applications: A general review / L. Tian, N. Tang, T. Ngai, C. Wu, Y. Ruan, L. Huang, L. Qin // J. Orthop. Translat. 2018. Vol. 16. Р. 1-13. DOI: 10.1016/j.jot.2018.06.006.
- Magnesium and its alloys as orthopedic biomaterials: а review / M.P. Staiger, A.M. Pietak, J. Huadmai, G. Dias // Biomaterials. 2006. Vol. 27, No 9. P. 1728-1734. DOI: 10.1016/j.biomaterials.2005.10.003.
- Results of titanium locking plate and stainless steel cerclage wire combination in femoral fractures / B.F. El-Zayat, S. Ruchholtz, T. Efe, J. Paletta, D. Kreslo, R. Zettl // Indian J. Orthop. 2013. Vol. 47, No 5. P. 454-458. DOI: 10.4103/0019-5413.118200.
- New developments of Ti-based alloys for biomedical applications / Y. Li, C. Yang, H. Zhao, S. Qu, X. Li, Y. Li // Materials (Basel). 2014. Vol. 7, No 3. Р. 1709-1800. DOI: 10.3390/ma7031709.
- The processing of pure titanium through multiple passes of ECAP at room temperature / X. Zhao, X. Yang, X. Liu, X. Wang, T.G. Langdon // Materials Science and Engineering: A. 2010. Vol. 527, No 23. P. 6335-6339. DOI: 10.1016/j.msea.2010.06.049.
- Microstructure and mechanical behavior of metal injection molded Ti-Nb binary alloys as biomedical material / D. Zhao, K. Chang, T. Ebel, M. Qian, R. Willumeit, M. Yan, F. Pyczak // J. Mech. Behav. Biomed. Mater. 2013. Vol. 28. Р. 171-182. DOI: 10.1016/j.jmbbm.2013.08.013.
- Titanium alloy mini-implants for orthodontic anchorage: Immediate loading and metal ion release / L.S. Morais, G.G. Serra, C.A. Muller, L.R. Andrade, E.F. Palermo, C.N. Elias, M. Meyers // Acta Biomater. 2007. Vol. 3, No 3. P. 331-339.
- Ghosh S.K., Saha R., Saha B. Toxicity of inorganic vanadium compounds // Research on Chemical Intermediates. 2014. Vol. 41. P. 4873-4897. DOI: 10.1007/s11164-014-1573-1.
- Birchall J.D., Chappell J.S. Aluminium, chemical physiology, and Alzheimer's disease // Lancet. 1988. Vol. 2, No 8618. P. 1008-1010. DOI: 10.1016/ s0140-6736(88)90754-4.
- Chao Q., Hodgson P.D., Beladi H. Ultrafine grain formation in a Ti-6A1-4V alloy by thermomechanical processing of a martensitic microstructure // Metallurgical and Materials Transactions A. 2014. Vol. 45, No 5. DOI: 10.1007/s11661-014-2205-5.
- Niinomi M. Mechanical biocompatibilities of titanium alloys for biomedical applications // J. Mech. Behav. Biomed. Mater. 2008. Vol. 1, No 1. P. 30-42. DOI: 10.1016/j.jmbbm.2007.07.001.
- Development of bio-compatible refractory Ti/Nb(/Ta) alloys for application in patient-specific orthopaedic implants / M. Weinmann, C. Schnitter, M. Stenzel, J. Markhoff, C. Schulze, R. Bader // International Journal of Refractory Metals and Hard Materials. 2018. Vol. 75. DOI: 10.1016/j. ijrmhm.2018.03.018.
- Niinomi M. Recent research and development in titanium alloys for biomedical applications and healthcare goods // Science and Technology of Advanced Materials. 2003. Vol. 4, No 5. P. 445-454. DOI: 10.1016/j.stam.2003.09.002.
- Fabrication, characterization and in vitro biocompatibility evaluation of porous Ta-Nb alloy for bone tissue engineering / H. Wang, J. Li, H. Yang, C. Liu, J. Ruan // Mater. Sci. Eng. C. Mater. Biol. Appl. 2014. Vol. 40. P. 71-75. DOI: 10.1016/j.msec.2014.03.031.
- Microstructure, mechanical behavior and biocompatibility of powder metallurgy Nb-Ti-Ta alloys as biomedical material / J. Liu, L. Chang, H. Liu, Y. Li, H. Yang, J. Ruan // Mater. Sci. Eng. C. Mater Biol. Appl. 2017. Vol. 71. P. 512-519. DOI: 10.1016/j.msec.2016.10.043.
- Применение индивидуальных вертлужных компонентов в эндопротезировании тазобедренного сустава при посттравматическом коксар-трозе / Н.С. Николаев, Л.И. Малюченко, Е.В. Преображенская, А.С. Карпухин, В.В. Яковлев, А.Л. Максимов // Гений ортопедии. 2019. Т. 25, № 2. С. 207-213.
- Что изменилось в структуре ревизионного эндопротезирования тазобедренного сустава в последние годы? / И.И. Шубняков, Р.М. Тихилов, А.О. Денисов, М.А. Ахмедилов, А.Ж. Черный, З.А. Тотоев, А.А. Джавадов, А.С. Карпухин, Ю.В. Муравьёва // Травматология и ортопедия России. 2019. Т. 25, № 4. С. 9-27.
- Аддитивные технологии у пациентов с обширными дефектами костей нижних конечностей / В.П. Волошин, А.Г. Галкин, С.А. Ошкуков, С.А. Санкаранараянан, Е.В. Степанов, А.А. Афанасьев // Гений ортопедии. 2021. Т. 27, № 2. С. 227-231.


