Перспективы эпигенетических исследований нейрофиброматоза 1-го типа
Автор: Мустафин Р.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Актуальность. Нейрофиброматоз 1-го типа (НФ1) является моногенной болезнью с выраженным клиническим полиморфизмом. При НФ1 определяется повышенный риск развития злокачественных опухолей из оболочек периферических нервов, лейкоза, стромальных опухолей желудочно-кишечного тракта, рака молочной железы, рабдомиосаркомы, карционоидов и феохромацитомы. Мутации в гене NF1 служат драйверами различных спорадических злокачественных опухолей. Цель исследования – оценить механизмы влияния эпигенетических факторов на развитие НФ1 и возможность их использования в диагностике и лечении болезни. Материал и методы. Поиск соответствующих источников проводился в системах Scopus, Web of Science, PubMed, Elibrary, включая публикации с февраля 1995 по февраль 2025 г. Из 1 432 найденных научных статей 56 были использованы для написания систематического обзора. Результаты. Анализ литературы показал, что мРНК гена NF1 является мишенью 13 микроРНК, участвующих также в канцерогенезе спорадических опухолей нервной системы (miR-9, miR-10b, miR-16, miR-21, miR-27a, miR-27b-3p, miR-34a, miR-125a-3p, miR-128-3p, miR-137-3p, miR-147a, miR-193b, miR204-5p). Кроме того, имеются свидетельства эволюционной и функциональной взаимосвязи гена NF1 с ретроэлементами: образование 12 псевдогенов NF1 на 7 разных хромосомах с помощью ферментов ретроэлементов, в интронах гена содержатся Alu и LINE, являющиеся источниками альтернативного сплайсинга и рекомбинаций, наличие горячих точек инсерционного мутагенеза. Заключение. Генетические исследования не подтвердили роль генов-модификаторов в качестве провоцирующих факторов развития и прогрессирования опухолевого синдрома при НФ1. Однако определена роль изменений экспрессии специфических микроРНК при формировании кожных, подкожных и плексиформных нейрофибром, злокачественных опухолей из оболочек периферических нервов. Данный факт позволяет предположить перспективность исследования роли эпигенетических факторов в патогенезе болезни с целью таргетной терапии развивающихся опухолей. Сделано предположение, что дальнейшее исследование взаимосвязей гена NF1 с ретроэлементами позволит определить новые пути лечения НФ1 и спорадических опухолей с воздействием на «порочный круг», описанный в отношении взаимосвязи других генов-супрессоров опухолей с ретроэлементами. В частности, предполагается использование произошедших от ретроэлементов микроРНК, мишенями которых является мРНК гена NF1.
Ген NF1, злокачественные опухоли, микроРНК, нейрофибромы, нейрофибромин, псевдогены, эпигенетические факторы
Короткий адрес: https://sciup.org/140312770
IDR: 140312770 | УДК: 616.833-006-056.7 | DOI: 10.21294/1814-4861-2025-24-5-128-139
Текст научной статьи Перспективы эпигенетических исследований нейрофиброматоза 1-го типа
Нейрофиброматоз 1-го типа (НФ1) является одним из самых распространенных моногенных заболеваний с аутосомно-доминантным типом наследования и встречается с частотой 1:2 500 новорожденных [1]. Нейрофиброматоз 1-го типа характеризуется развитием доброкачественных неоплазм (нейрофибром) и повышенным по сравнению с общей популяцией на несколько порядков (рис. 1) риском развития различных злокачественных новообразований (ЗНО): опухолей оболочек периферических нервов (MPNST), лейкоза [2], стромальных опухолей желудочно-кишечного тракта, рака молочной железы, рабдомиосаркомы, карционоидов и феохромацитомы [3]. Кроме того, анализ научной литературы показал, что мутации в гене NF1 являются частым событием в канцерогенезе спорадических ЗНО (рис. 2), способствующим химиорезистентности [4].
Ген NF1 является супрессором опухолей, локализован на 17q11.2 и состоит из 57 экзонов. Белковый продукт гена NF1, нейрофибромин [5], экспрессируется преимущественно в нейронах, олигодендроцитах, клетках Шванна и лейкоцитах. Нейрофибромин является крупным белком, регулирующим различные внутриклеточные процессы, главным образом RAS-циклической АМФ, ERK/MAP киназный каскад [6]. Поэтому для лечения плексиформных нейрофибром разработан и введен в клиническую практику ин-
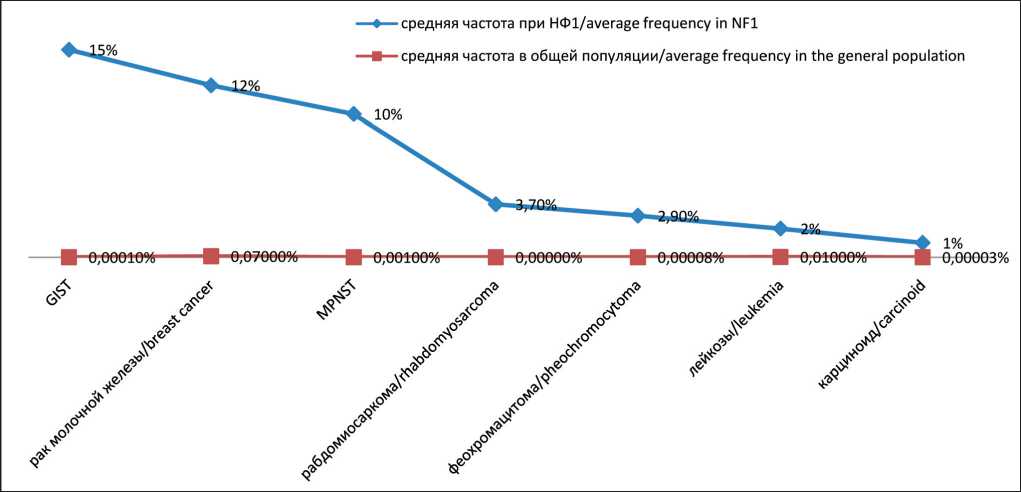
Рис. 1. Сравнительная характеристика частоты злокачественных новообразований при НФ1 и в общей популяции (по данным Z. Lim et al., 2024 [1], P. Saharafi et al., 2024 [2], S. Patil et al., 2012 [3]). Примечания: GIST – стромальные опухоли желудочнокишечного тракта, MPNST – злокачественные опухоли из оболочек периферических нервов; рисунок выполнен автором
Fig. 1. Comparative characteristics of the incidence of malignant neoplasms in NF1 and in the general population (according to Z. Lim et al., 2024 [1], P. Saharafi et al., 2024 [2], S. Patil et al., 2012 [3])). Notes: GIST – gastrointestinal stromal tumors, MPNST –malignant peripheral nerve sheath tumors; created by the author
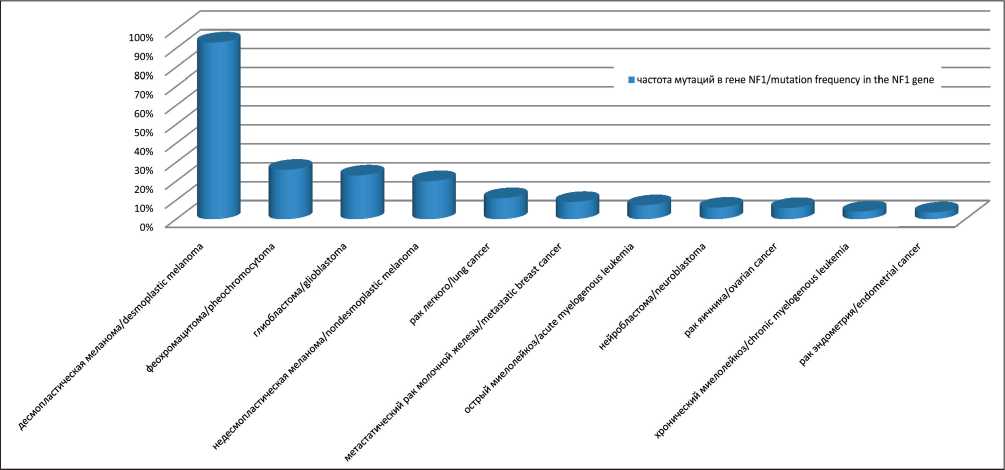
Рис. 2. Роль мутаций в гене NF1 в развитии спорадических злокачественных опухолей. Примечание: рисунок выполнен автором
Fig. 2. The role of mutations in the NF1 gene in the development of sporadic malignant tumors. Note: created by the author
гибитор митоген-активируемой протеинкиназы селуметиниб. Однако он назначается строго по показаниям детям до 18 лет при наличии у них неоперабельных плексиформных нейрофибром [7]. Актуальным остается вопрос по разработке новых способов лечения НФ1, не только плексиформных нейрофибром, но также когнитивного дефицита и множественных опухолей на теле. Нейрофиброматоз 1-го типа характеризуется также выраженным клиническим полиморфизмом и наличием атипичных форм [8]. Более чем у 70 % больных НФ1 развивается поражение ЦНС, включая различные доброкачественные и злокачественные опухоли, а также аномалии без неопластических процессов [9]. Согласно проведенному систематическому обзору, в литературе нет достоверных данных о роли генов-модификаторов в патогенезе болезни [8]. Однако описаны эпигенетические особенности механизмов развития опухолевого синдрома, исследование которых перспективно как для прогнозирования течения болезни, так и для таргетной терапии НФ1.
Клиническая значимостьэпигенетических факторов при НФ1
В ряде клинических исследований определено изменение эпигенетических факторов при развитии опухолей у больных НФ1. Кожные и плексиформ-ные нейрофибромы при НФ1 характеризуются идентичной гистологией, но разной скоростью роста и риском злокачественной трансформации. Однако исследование профилей метилирования показало, что данные типы опухолей являются эпигенетически различными. Также определена корреляция между метилированием CpG и размером опухоли [10]. По характеру метилирования
ДНК глиомы подразделены на 2 подгруппы. Для 1-й подгруппы «пилоцитарной астроцитомы, возникающей на фоне НФ1» с вялотекущим клиническим течением определена уникальная эпигенетическая сигнатура с биаллельной инактивацией гена NF1. Для 2-й подгруппы с агрессивным течением высокозлокачественной астроцитомы выявлены дополнительные онкогенные изменения, такие как гомозиготная делеция супрессора опухоли CDKN2A и мутации гена ATRX [11]. Показана роль гиперметилирования энхансера NF1 в образцах высокозлокачественной астроцитомы с пилоидными признаками как при спорадическом типе опухоли, так и у больных НФ1 с данным типом астроцитомы [12].
Исследование образцов MPNST у больных НФ1 позволило идентифицировать эпигенетическую инактивацию второго аллеля NF1, а также биал-лельную инактивацию генов-супрессоров опухолей CDKN2A, ТР53, PRC2 и уникальный статус триметилирования H3K27. MPNST с потерей H3K27me3 развивались путем значительных хромосомных перестроек с низким уровнем инфильтрации иммунными клетками [13]. Описано изменение ландшафта метилирования ДНК, характерное для MPNST у больных НФ1. При полногеномном профилировании метилирования ДНК у больных с MPNST и клеточных линий MPNST выявлено 73 кандидатных CpG, метилирование которых специфично для данного ЗНО и значимо отличалось от обычных нейрофибром при НФ1. Чувствительность данных оказалась >88 %, специфичность >91 %. Более того, в ДНК образцов плазмы больных НФ1 с MPNST определено 15 дифференциально метилированных CpG-островков, отличающих от больных НФ1 без MPNST. Это свидетельствует о возможности применения полученных данных для раннего выявления MPNST при НФ1 [14]. В то же время исследование атипичных нейрофибром, которые характеризуются высокой частотой малигнизации, показало, что, несмотря на гистологические отличия, они обладают особенностями метилирования ДНК, сходными с доброкачественными нейрофибромами. Поэтому эпигенетические особенности могут служить более специфическими диагностическими маркерами, чем результаты гистологического анализа [15].
Эпигенетические нарушения у больных НФ1 могут служить также причинами патологии ЦНС без неопластических изменений. Например, развивающиеся не менее чем у 4 % пациентов кисты головного мозга [16] могут представлять собой беловатые желеобразные массы из веретенообразных клеток (напоминающих трабекулярные клетки паутинной оболочки) и не отличаться по данным электронной микроскопии от нормальных клеток паутинной оболочки. Однако анализ метилирования ДНК показал, что данные поражения отличаются от здоровых мозговых оболочек, что свидетельствует о роли нарушений метилирования в таких процессах [9]. Можно предположить, что эпигенетические нарушения могут также лежать в основе когнитивных нарушений и психических расстройств у больных НФ1. Исследование процессов, лежащих в основе данных нарушений, перспективно в связи с обратимостью изменений и возможностью таргетного воздействия с использованием микроРНК в качестве инструментов и мишеней. Это связано с тем, что микроРНК оказывают ингибирующий эффект на экспрессию генов не только путем связывания со специфическими последовательностями мРНК и блокируя трансляцию, но также служат гидами для ДНК-метилтрансфераз, вызывая таким образом эффект на метилирование ДНК в специфических участках генома. Данный механизм, называемый РНК-зависимое метилирование ДНК (RdDM – RNA-de-pendent DNA methylation), ранее описанный только у растений, открыт также в клетках человека [17, 18]. МикроРНК относятся к некодирующим РНК (нкРНК), которые принадлежат к эпигенетическим факторам, регулирующим экспрессию генов на транскрипционном и посттранскрипционном уровнях, ремоделирующим хроматин и изменяющим сигнальную трансдукцию. К нкРНК относятся также длинные нкРНК и кольцевые РНК.
Систематические обзоры научной литературы свидетельствуют о вовлеченности ряда микроРНК и длинных нкРНК в развитие опухолей при НФ1 [19]. Дисрегуляция микроРНК играет решающую роль в инициировании и развитии MPNST у больных НФ1 [20]. Данные изменения могут служить причинами описанных специфических изменений метилирования ДНК при MPNST [13, 14], поскольку микроРНК являются гидами для
ДНК-метилтрансфераз в механизмах RdDM [17, 18]. Определено влияние повышенной экспрессии специфических микроРНК, регулирующих онкогены и онкосупрессоры, на развитие плекси-формных нейрофибром и MPNST. В клинических исследованиях в плексиформных нейрофибромах больных НФ1 был определен повышенный уровень miR-486-3p, а также нарушение экспрессии miR-143, miR-145, miR-181a, miR-370, регулирующих RAS-MAK. В образцах MPNST, взятых от больных НФ1, в клинических исследованиях определено значительное нарушение экспрессии miR-19a, miR-106b, miR-301a (регулируют PTEN ), miR-10b, miR-195, let-7b (вовлечены в управление RAS-MAPK), miR-9, miR-135a, miR-135b, miR-200c, let-7b (регулируют мезенхимальный переход), miR-9, miR-10b, miR-210, miR-196b (ингибируют гены HOX ), miR-20a, miR-106b, miR-129-3p, miR-195, miR-449a, let-7b (регулируют клеточный цикл) [21].
В образцах MPNST, взятых у больных НФ1, выявлена сниженная экспрессия miR-143-3p, miR-145-5p, let-7b-5p, а также повышенная – miR-135b-5p, miR-889-3p [22]. Повышенные уровни в образцах плексиформных нейрофибром определены для miR-143 (влияет на KRAS ), miR-145 (влияет на RREB1 ), miR-181, miR-181a (влияет на KRAS и ATM ), miR-193a-5p, miR-362-5p, miR-370 (влияет на M AP3K8 ), miR-483-5p, miR-486-3p (влияет на PTEN ). В дальнейшем в исследованиях in vivo и in vitro выявлено, что развитию MPNST способствуют miR-9 (мишени – CDH1, CDX2 ), miR-10a (мишень – HOXD10 ), miR-10b (мишени – HOXA3, HOXD10, NF1 ), miR-18a, miR-19a (мишени – PTEN, CCND1 ), miR-19b, miR-20a (мишени – CCND1, E2F1 ), miR-31, miR-93, miR-106b (мишени – PTEN, CCND1, E2F1 ), miR-129-3p (мишень – CDK6 ), miR-130b, miR-135a, miR-135b (мишень – APC ), miR-137, miR-148a, miR-192, miR-196b (мишень – HOXB8 ), miR-210 (мишени – HOXA1, HOXA3, HOXA9, E2F3 ), miR-224, miR-301a, miR-301b (мишень – PTEN), miR-425, miR-452, miR-454, miR-484, miR-449a (мишени – CCND1, HDAC1 ) [23]. Таким образом, в развитии плексиформных нейрофибром и MPNST в клинических и экспериментальных исследованиях обнаружено эпигенетическое влияние микроРНК на различные гены-супрессоры опухолей (табл. 1). Определена роль повышенной экспрессии miR-155, регулирующей RAS/MAPK, в развитии плексиформных нейрофибром. Фармакологическое и генетическое ингибирование miR-155 уменьшало количество сфер в данных опухолях, а делеция miR-155 in vivo снижала количество и объем плекси-формных нейрофибром [24]. Достоверно сниженный уровень miR-612 определен в MPNST больных НФ1. Данная микроРНК подавляет пролиферацию и миграцию клеток и вызывает апоптоз клеток. Мишенью miR-612 является мРНК гена FAIM2 [20].
Помимо микроРНК перспективно исследование влияния различных препаратов на эпигенетиче-
Роль специфических микроРНК в развитии опухолей у больных НФ1
the role of specific microRnas in tumor development in patients with nF1
Таблица 1/table 1
|
Опухоль/Tumor |
микроРНК/miRNA |
Эффект воздействия/Impact effect |
|
Плексиформные |
miR-143, miR-145, miR-181a, miR-370 |
Регулируют RAS-MAK/Regulate RAS-MAK [21, 23] |
|
нейрофибромы/ |
miR-193a-5p, miR-362-5p, miR-370 |
Регулируют MAP3K8/Regulate MAP3K8 [23] |
|
Plexiform neurofibromas |
miR-483-5p, miR-486-3p |
Регулируют PTEN/Regulate PTEN [23] |
|
miR-19a, miR-106b, miR-301a |
Регулируют PTEN/Regulate PTEN [21] |
|
|
miR-10b, miR-195, let-7b, miR-155 |
Регулируют RAS-MAPK/Regulate RAS-MAPK [21, 24] |
|
|
miR-9, miR-135a, miR-135b, miR-200c, |
Регулируют мезенхимальный переход/ |
|
|
let-7b |
Regulate mesenchymal transition [21–23] |
|
|
miR-9, miR-10a, miR-10b, miR-210, miR-196b |
Ингибируют гены HOX /inhibit HOX genes [21–23] |
|
|
miR-20a, miR-106b, miR-129-3p, miR-195, miR-449a, let-7b |
Регулируют клеточный цикл/Regulate the cell cycle [21–23] |
|
|
Ингибирование генов LZTS1, SYT2, SMIM13, NR3C2, |
||
|
miR-135b-5p |
TMEM168, FOXN3, CPLX2, RUNX2, B3GLCT, CPLX1/ Inhibits LZTS1, SYT2, SMIM13, NR3C2, TMEM168, FOXN3, |
|
|
CPLX2, RUNX2, B3GLCT, CPLX1 genes [22] |
||
|
miR-889-3p |
Ингибируют гены TMC1, RPS6KA6, FLII, PHF6, DDX3X, ABI1/ inhibits RPS6KA6, FLII, PHF6, DDX3X, ABI1 genes [22] |
|
|
MPNST |
miR-9 |
Ингибирует гены CDH1, CDX2 / Inhibits CDH1 and CDX2 genes [23] |
|
miR-18a, 19a, miR-224, miR-301a, miR- |
Ингибируют гены PTEN, CCND1/ |
|
|
301b |
Inhibit PTEN and CCND1 genes [23] |
|
|
miR-19b, miR-20a |
Ингибируют гены CCND1, E2F1/ Inhibit CCND1 and E2F1 genes [23] |
|
|
miR-31, miR-93, miR-106b |
Ингибируют гены PTEN, CCND1, E2F1/ Inhibit PTEN, CCND1 and E2F1 genes [23] |
|
|
miR-130b, miR-135a, miR-135b |
Ингибируют ген APC /Inhibit APC gene [23] |
|
|
miR-137, miR-148a, miR-192, miR-196b |
Ингибируют ген HOXB8/ Inhibit HOXB8 gene [23] |
|
|
miR-210 |
Ингибирует гены HOXA1, HOXA3, HOXA9, E2F3/ Inhibits HOXA1, HOXA3, HOXA9, E2F3 genes [23] |
|
|
miR-425, miR-452, miR-454, miR-484, |
Ингибируют гены CCND1, HDAC1/ |
|
|
miR-449a |
Inhibit CCND1 and HDAC1 genes [23] |
|
|
miR-612 |
Ингибирует ген FAIM2/ Inhibits FAIM2 gene [20] |
Примечание: таблица составлена автором.
Note: created by the author.
Взаимосвязь гена NF1 с микроРНК
Изменение экспрессии NF1 оказывает свое влияние на канцерогенез не только непосредственным снятием контроля активации онкогенов RAS, но также эпигенетическими путями за счет изменения взаимодействия белка нейрофибромина с различными субстратами (в связи с наличием множества функциональных доменов (рис. 3)) [6]. Кроме того, мРНК гена NF1 взаимодействует со специфическими микроРНК. В тканях глиомы определена повышенная экспрессия miR-9, мишенями которой являются гены NF1 и CREB [28]. NF1 является мишенью miR-16, которая комплементарно связывается с кольцевой РНК circNF1 (образуется путем обратного сплайсинга экзонов
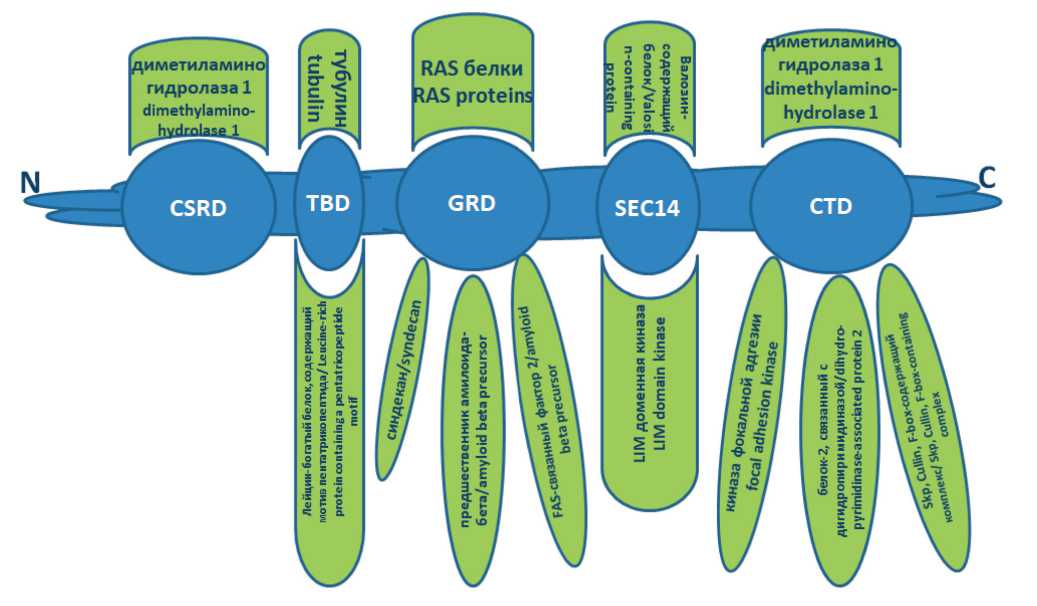
Рис. 3. Схема строения белка нейрофибромина и взаимодействия его доменов с различными белками. Примечание: CSRD – цистеин-серин-богатый домен, TBD – тубулин-связывающий домен, GRD – GAP-связанный домен, SEC14 – Sec14 домен, CTD – С-концевой домен; рисунок выполнен автором
Fig. 3. Schematic diagram of the structure of the neurofibromin protein and the interaction of its domains with various proteins. Notes: CSRD – cysteine-serine-rich domain, TBD – tubulin-binding domain, GRD – GAP-associated domain, SEC14 – Sec14 domain, CTD – C-terminal domain; created by the author
2‒8 гена NF1). Мишенями miR-16 являются также гены AKT3, MAP7 [29]. Также в тканях глиомы по сравнению с контрольными образцами определен повышенный уровень miR-27a-3p, которая подавляла мРНК гена NF1. В то же время усиление экспрессии NF1 отменяло регуляторные эффекты miR-27a-3p резистентных клеток глиомы [30]. miR-27a-3p и miR-27b-3p способствуют развитию НФ1 путем воздействия на мРНК гена NF1 . В клетках Шванна кожных и плексиформных нейрофибром, а также в линиях клеток MPNST определены повышенные уровни miR-27a-3p и miR-27b-3p. В экспериментах миметики этих микроРНК способствуют пролиферации, миграции и инвазии опухолевых клеток. Ингибиторы miR-27a-3p и miR-27b-3p оказывали противоположный эффект [31]. Ген NF1 является также мишенью miR-147a, повышенная экспрессия которой определена при прогрессирующем надъядерном параличе [32].
Транскрипт гена NF1 является также мишенью различных специфических микроРНК (рис. 4), таких как miR-10b [33], miR-21, miR-34a, miR-204-5p [34], miR-103 miR-128-3p, miR-137-3p [35], miR-193b [36], повышенные уровни которых подавляют экспрессию нейрофибромина и способствуют избыточной пролиферации клеток. Согласно анализу репортера люциферазы, ген NF1 является мишенью miR-125a-3p [37]. Помимо участия в канцерогенезе при НФ1, вышеперечисленные микроРНК, мишенью которых является ген NF1, участвуют в развитии спорадических злокачественных новообразований нервной системы. miR-16 характеризуется низкой экспрессией в астроцитомах головного мозга, подавляя пролиферацию клеток и стимулируя апоптоз [38]. Онкосупрессорная miR-21 ингибирует развитие глиомы путем нацеливания на S100A10 [39]. miR-27b-3p подавляет прогрессирование глиомы за счет регуляторного воздействия на YAP1 [40]. Определены низкие уровни miR-34a при мультиформной глиобластоме. Данная микроРНК связывается с 3’UTR гена SV2B (кодирует гликопротеин синаптических везикул) [41]. В тканях глиомы miR-125a-3p проявляла функцию супрессора опухоли за счет ингибирования пути p38/MAPK [42].
В экспериментах in vivo и in vitro показано, что miR-128-3p в клетках глиобластомы ингибирует экспрессию мРНК NUSAP1 (nucleolar and spindle-associated protein 1), участвующего в развитии глиобластомы. Соответственно, данная микроРНК проявляет онкосупрессорные свойства [43]. miR-137-3p, ингибирующая мРНК гена MITF (microphthalmia-associated transcription factor) и Wnt сигнальные пути, подавляет развитие пролактиномы [44]. В тканях глиобластомы снижены уровни miR-147a. Эксперименты на клеточных линиях глиобластомы показали, что miR-147a ингибирует SLC40A1, нарушая опосредованный белком SLC40A1 экспорт железа и индуцируя таким образом ферроптоз [45]. В сыворотке крови больных глиомами, а также в тканях и клеточных линиях глиомы определена повышенная экспрессия miR-193b [46]. Анализ экспрессии miR-204-5p в тканях глиомы показал значительное снижение уровней данной микроРНК, которая является мишенью длинной нкРНК XIST, проявляющей онкогенные свойства [47]. Повы-
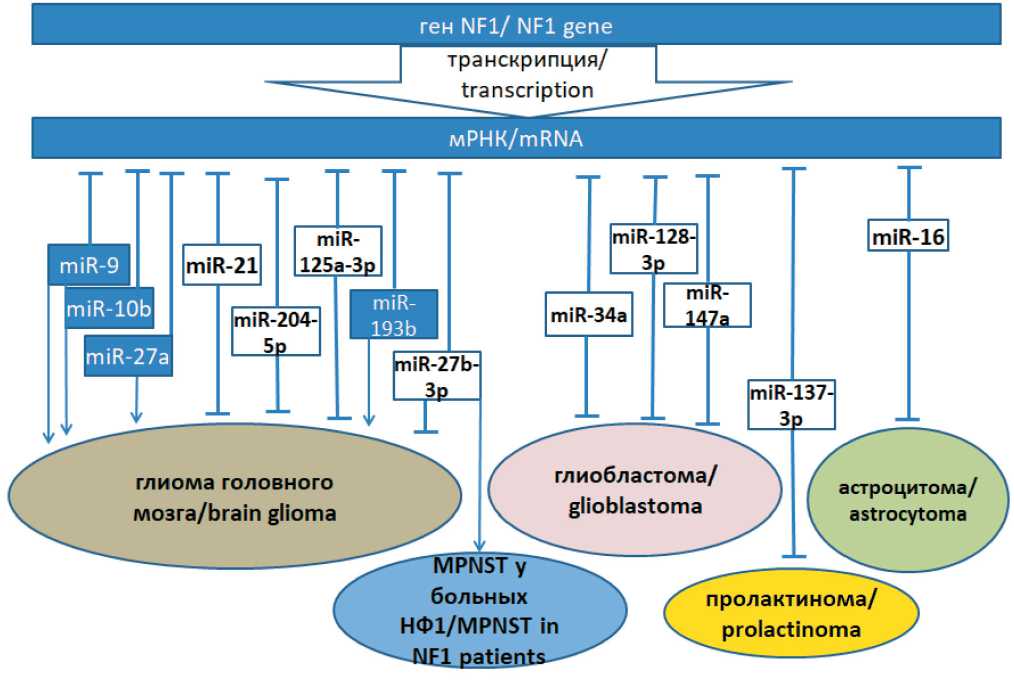
Рис. 4. Схема участия взаимодействующих с мРНК гена NF1 в канцерогенезе спорадических злокачественных новообразований головного мозга (знаком ┬ обозначено ингибирование экспрессии и подавление развития опухоли, знаком ↓ – стимулирование развитие опухоли). Синим цветом обозначены микроРНК, онкогенные в отношении спорадических новообразований, белым цветом – онкосупрессорные микроРНК. Примечание: рисунок выполнен автором
Fig. 4. Scheme of participation of NF1 gene mRNA interacting with carcinogenesis of sporadic malignant neoplasms of the brain (the ┬ sign indicates inhibition of expression and suppression of tumor development, the ↓ sign indicates stimulation of tumor development). MicroRNAs that are oncogenic in relation to sporadic neoplasms are shown in blue, and tumor suppressor microRNAs are shown in white. Note: created by the author
шенная экспрессия miR-10b-5p оказалась наиболее повышенной в глиоме головного мозга высокой степени злокачественности. В экспериментах снижение уровня miR-10b-5p приводило к снижению инвазии в линиях клеток данного типа глиомы [48]. На рис. 4 представлены данные об участии в канцерогенезе спорадических ЗНО микроРНК, взаимодействующих с мРНК гена NF1.
Интересно отметить, что из 13 микроРНК, взаимодействующих с мРНК гена NF1, 9 микроРНК проявляют свойства супрессоров опухолей, хотя в путях ингибирования NF1 они являются онкогенными (поскольку подавляют экспрессию нейрофибромина). Таким образом, при использовании специфических микроРНК в качестве мишеней для воздействия в таргетной терапии опухолевого синдрома при НФ1 нужно учитывать многостороннее влияние данных молекул. Одни и те же микроРНК могут проявлять как онкогенные свойства при НФ1 (miR-21, miR-27b-3p, miR-125a-3p, miR-204-5p, miR-34a, miR-128-3p, miR-147a, miR-137-3p, miR-16) за счет подавления экспрессии нейрфромина, так и онкосу-прессорные свойства при спорадических опухолях головного мозга за счет связывания с мРНК онкогенов. Данный факт свидетельствует о необходимости глубоких биоинформационных исследований для проектирования таргетной терапии опухолевого синдрома при НФ1 с использованием микроРНК в качестве инструментов или мишеней.
Взаимосвязь гена NF1 с ретроэлементами
Вышеописанная роль микроРНК в патогенезе опухолей при НФ1, а также участие взаимодействующих с мРНК гена NF1 микроРНК в канцерогенезе спорадических опухолей позволяют предположить значение ретроэлементов в данных процессах. Поскольку гены-супрессоры опухолей, такие как ATM, BRCA1, р53, RB1, VHL, характеризуются свойством ингибировать РЭ, тем самым предотвращая геномную нестабильность, а также формированием «порочного круга» вследствие наличия в них горячих точек инсерционного мутагенеза [49], можно предположить наличие подобных свойств в отношении гена NF1. Действительно, интроны NF1 обогащены полиморфными инсерциями LINE и SINE. Для гена NF1 выявлена повышенная частота мутабельности вследствие инсерций. Определено, что инсерции ретроэлементов в ген NF1 являются причинами НФ1 более чем в 0,4 % случаев (выявлено 14 инсерций Alu и 3 инсерции LINE1), что свидетельствует о наличии горячих точек инсерционного мутагенеза гена NF1 . Кроме того, обогащение локуса NF1 ретротранспозициями способствует повышенной частоте делеций вследствие рекомбинаций с РЭ на других хромосомах [50].
РЭ представляют собой участки генома, способные к перемещениям в новые локусы с помощью кодируемых собственными (автономные РЭ) генами ферментов или с помощью ферментов других РЭ
(неавтономные РЭ). К автономным РЭ относятся содержащие длинные концевые повторы (LTR) РЭ, главным образом, представленные эндогенными ретровирусами человека (HERV), которые занимают 8 % генома человека [49]. LINE1 представляют собой автономные ретроэлементы, не содержащие длинные концевые повторы (LTR). В геноме человека они занимают около 17 % всех нуклеотидных последовательностей, составляя около 500 000 копий, из которых полностью сохранили свою активность около 100. Среди неавтономных не содержащих LTR элементов SINE наиболее распространены в геноме человека Alu. Они занимают около 10 % всех последовательностей ДНК. Alu используют ферменты LINE1 для своих транспозиций, представлены более 1 млн копий, из которых 100 000 способны к перемещениям [51]. Известны также составные РЭ, такие как SVA (SINE-VNTR-Alu), которые представляют 0,2 % генома человека [52].
Большинство LINE1 утратили способность к транспозициям благодаря накоплению точковых мутаций, 5’-укорочения, делеций и других перестроек [50]. Такие LINE1 состоят из 6 000 пар нуклеотидов, содержат 3’-поли-А хвост и две открытые рамки считывания, которые кодируют белки pORF1 и pORF2. Из них pORF2 состоит из обратной транскриптазы и интегразы – ферментов, необходимых для образования кДНК из РНК и ее встраивания в новый локус генома. При этом данные ферменты не отличаются высокой специфичностью, поэтому, помимо собственных мРНК LINE1, они могут образовывать копии кДНК неавтономных РЭ и даже мРНК белок-кодирующих генов (в том числе NF1 ) с их инсерцией [50]. Этим можно объяснить формирование 12 псевдогенов NF1 в геноме человека, распределенных по 7 хромосомам: 2, 12, 14, 15, 18, 21 и 22. Большинство из них локализуются в перицентромерных областях, а на хромосоме 2 в локусе остатка предковой центромеры (2q21). Вследствие отсутствия селективного давления псевдогены могут аккумулировать мутации и рекомбинировать с функциональным NF1 путем межхромосомной генной конверсии (нереципрокного обмена нуклеотидами) [5].
В некоторых случаях причиной НФ1 могут быть мутации в областях интронов гена NF1 (создающие альтернативные сплайсинговые варианты) и структурные перестройки повторяющихся последовательностей. Поскольку Alu-элементы являются важными источниками сайтов альтернативного сплайсинга [53], инсерции РЭ являются источниками глубоких интронных вариантов мутаций, приводящих к аберрантному сплайсингу, являющихся причинами НФ1 [53]. Опубликованы результаты исследования семьи с НФ1, который обусловлен вставкой LINE1 в интрон 15 гена NF1, что привело к пропуску экзона 15. Данный вариант обнаружен с помощью комбинированного подхода оптического картирования генома, WGS (whole- genome sequencing) и исследования кДНК [50]. Последовательности Alu являются источниками полиморфных сайтов сплайсинга [54]. О роли РЭ в регуляции функционирования гена NF1 свидетельствует существование нескольких сплайсинговых вариантов продуктов экспрессии гена. Это связано со способностью РЭ образовывать альтернативные сайты сплайсинга с включением 4 нормальных внутрирамочных изоформ альтернативного сплайсинга продукта гена NF1 [53].
РЭ также играют роль в формировании протяженных делеций в локусе 17q11.2 с охватом гена NF1, которые определяются у 5–10 % больных НФ1 и происходят в повторяющихся (рекуррентных) точках разрыва вследствие неаллельной гомологичной рекомбинации (NAHR) между высокогомологичными дуплицированными последовательностями в области гена NF1. Около 70–80 % случаев делеций (1-го типа) имеют размеры 1,4 мегабаз с точками разрывов в низкоко-пийных повторах NF1-REPa и NF1-REPc. Делеции 2-го типа, размером 1,2 мегабаз, представлены точками разрывов в гене SUZ12 и его псевдогене SUZ12P, определяются в 10–20 % случев. Делеции 3-го типа происходят в точках разыва в пределах NF1-REPb и NF1-REPc и наблюдаются в 1,4–4 % случаев. Описанные три типа делеций являются рекуррентными у множества больных НФ1. Рекомбинирующие в точках разрывов низкокопийные повторы, такие как NF1-REPa и NF1-REPc, характеризуются высокой гомологией последовательностей в пределах 50 килобаз [19]. РЭ являются важными источниками NAHR в канцерогенезе [55] и поэтому могут быть важными причинами делеций NF1 с инактивацией гена как при НФ1, так и в спорадическом канцерогенезе. Хотя подобно другим генам-супрессорам опухолей (ATM, BRCA1, р53, RB1, VHL), напрямую ингибирующим ретроэлементы [49], для гена NF1 пока не описано таких свойств, имеются опосредованные данные такого влияния. Это связано с взаимодействием транскрипта NF1 со специфическими микроРНК, образующимися из последовательностей РЭ. Анализ баз данных mRDB и MDTE о происхождении микроРНК от ретроэлементов [56] позволил выявить 24 таких микроРНК, среди которых 12 микроРНК произошли от LINE, 12 – от SINE (табл. 2).
Заключение
НФ1 обусловлен мутациями в гене NF1 и характеризуется выраженным повышением риска развития специфических ЗНО. В то же время во многих спорадических ЗНО обнаруживаются мутации в гене NF1 , играющие роль драйверов канцерогенеза и участвующие в формировании фармакорезистентности. У больных НФ1 определяется выраженная клиническая вариабельность с разной степенью проявлений опухолевого синдрома и
Таблица 2/table 2
Произошедшие от line и sine микроРНК, мишенями которых является NF1 line and sine derived microRnas targeting NF1 gene
|
No № |
Название микроРНК/ |
Ретроэлемент-источник микроРНК/ |
Характеристика ретроэлемента/ |
|
miRNA name |
Retroelement source of miRNA |
Characteristics of a retroelement |
1. miR-374c-5p LINE2
|
2. |
miR-552-3p |
LINE1 |
Автономный ретроэлемент, не содержащий LTR/ Autonomous non-LTR retroelement |
|
3. |
miR-576-5p |
LINE1 |
|
|
4. |
miR-582-5p |
LINE-CR1 |
|
|
5. |
miR-625-5p |
LINE1 |
|
|
6. |
miR-1271-5p |
LINE2 |
|
|
7. |
miR-1285-3p |
SINE-Alu |
|
|
8. |
miR-3163 |
SINE-MIR |
|
|
9. |
miR-3168 |
SINE-MIR |
Неавтономный ретроэлемент, не содержащий LTR/ Nonautonomous non-LTR retroelement |
|
10. |
miR-3617-5p |
SINE-MIR |
|
|
11. |
miR-4452 |
SINE-Alu |
|
|
12. |
miR-4457 |
LINE1 |
Автономный ретроэлемент, не содержащий LTR/ |
|
13. |
miR-4676-3p |
LINE2 |
Autonomous non-LTR retroelement |
|
14. |
miR-4797-3p |
SINE-5S-Du-L2 |
|
|
15. |
miR-4801 |
SINE-MIR |
|
|
16. |
miR-5003-3p |
SINE-MIR |
Неавтономный ретроэлемент, не содержащий LTR/ Nonautonomous non-LTR retroelement |
|
17. |
miR-5584-5p |
SINE-MIR |
|
|
18. |
miR-5684 |
SINE-Alu |
|
|
19. |
miR-6887-5p |
LINE2 |
Автономный ретроэлемент, не содержащий LTR/ |
|
20. |
miR-7151-3p |
LINE1 |
Autonomous on-LTR retroelement |
|
21. |
miR-7851-3p |
SINE-Alu |
Неавтономный ретроэлемент, не содержащий LTR/ Nonautonomous non-LTR retroelement |
|
22. |
miR-8084 |
LINE1 |
Автономный ретроэлемент, не содержащий LTR/ |
|
23. |
miR-9985 |
LINE1 |
Autonomous non-LTR retroelement |
|
24. |
miR-10523-5p |
SINE-MIR |
Неавтономный ретроэлемент, не содержащий LTR/ Nonautonomous non-LTR retroelement |
Примечание: таблица составлена автором.
Note: created by the author.
развития ЗНО. Поэтому выяснение причин, провоцирующих развитие нейрофибром, может стать основой для их прогнозирования, профилактики и таргетной терапии. Значение генов-модификаторов в данных процессах не доказано. Однако определена роль специфических микроРНК. В обзоре описано участие специфических микроРНК в развитии плексиформных нейрофибром и MPNST, которые могли бы быть использованы в качестве прогностических маркеров и мишеней в таргетной терапии. Анализ литературы позволил найти 13 специфических микроРНК, нацеленных на мРНК гена NF1 и участвующих в канцерогенезе других спорадических опухолей нервной системы, что свидетельствует о возможности модулирования экспрессией гена при НФ1 и спорадических ЗНО с использованием этих микроРНК. Поскольку для генов-супрессоров опухолей характерна взаимо-регуляция с ретроэлементами, приводящая к про- грессированию канцерогенеза, проведен поиск данных о влиянии ретроэлементов на ген NF1. Обнаружено, что в гене NF1 находятся горячие точки инсерционного мутагенеза, сам ген содержит полиморфные интеграции LINE и SINE. С помощью ферментов LINE в эволюции сформировано 12 псевдогенов, распределенных по 7 различным хромосомам. Расположенные в интронах гена NF1 ретроэлементы также являются причиной мутаций вследствие рекомбинаций с гомологичными последовательностями. Кроме того, определено 24 произошедших от LINE и SINE микроРНК, мишенью которых является мРНК гена NF1. Описанные взаимосвязи гена NF1 с ретроэлементами свидетельствуют о возможности воздействия на развитие опухолевого синдрома при НФ1 с помощью модулирования активности ретроэлементов, в том числе с использованием в качестве объектов вышеописанных 24 микроРНК.


