Перспективы комплексного использования сафлора красильного (Carthamus tinctorius L.)
Автор: Харисова Алина Владиславовна, Куркин Владимир Александрович, Милхин Алексей Викторович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: флора
Статья в выпуске: 1-9 т.14, 2012 года.
Бесплатный доступ
Проведено сравнительное фитохимическое исследование различных органов сафлора красильного ( Carthamus tinctorius L.) с использованием тонкослойной хроматографии и спектрофотомерии, а также количественное определение суммы флавоноидов. Предложены методики качественного и количественного анализа флавоноидов в цветках сафлора красильного. Обоснована целесообразность использования в медицинской практике надземной части (листья, цветки, плоды) сафлора красильного.
Сафлор красильный, цветки, флавоноиды
Короткий адрес: https://sciup.org/148201064
IDR: 148201064 | УДК: 615.32:
Текст научной статьи Перспективы комплексного использования сафлора красильного (Carthamus tinctorius L.)
В настоящее время на мировом фармацевтическом рынке проявился большой интерес к известной масличной культуре cафлору красильному ( Carthamus tinctorius L.). Это однолетнее растение с ярко-жёлтыми (ярко-оранжевыми) цветками из семейства Астровые, или Сложноцветные ( Astera-ceae ) [4]. Сафлор красильный не встречается в дикорастущем виде, однако его широко культивируют на Кавказе, Нижнем Поволжье, в настоящее время cафлор вводиться в культуру на территории Самарской области [1, 4, 8]. Семена сафлора красильного используют в пищевой, химической промышленности и косметологии в качестве источника масла, цветки используют для получения красителей всех оттенков желтого и оранжевого цветов, в том числе и пищевых [7]. На сегодняшний день отечественная официальная медицина допускает использование сафлора красильного только в качестве компонента для БАД [6]. В тоже время сафлор находится в списке лекарственных растений в Европейской, Французской и Британской Травяной фармакопей [2, 3, 8]. Данное растение широко используется в восточной народной медицине как ангиопротектор, средство, сокращающее матку, при послеродовых кровотечениях. Описаны его контрацептивные и антисептические свойства. Цветки cафлора обладают мочегонным, слабительным, противовоспалительным и желчегонным действием, а жирное масло из семян может применяться в медицине наравне с подсолнечным [9]. Следовательно, сафлор красильный является перспективным отечественным лекарственным сырьем.
Цель работы: изучение перспективности использования сафлора красильного, культивируемого в Самарской области.
Материалы и методы. Объектом исследования служили цветки, трава и семена сафлора красильного, культивируемого в ГНУ «Самарский НИИ сельского хозяйства Россельхозакадемии» (дата сбора 2010-2011 гг.). Для проведения качественного химического анализа использовали хроматографию в тонком слое сорбента на пластинках «Сорбфил ПТСХ-АФ-А-УФ», «Сорбфил ПТСХ-ПА-УФ» с использованием различных систем растворителей: хлороформ – этанол - вода (26:16:3), н-бутанол-ледяная уксусная кислота-вода (4:1:2). Для проявления веществ использовали детекцию в УФ-свете при длине волны 254 и 366 нм, а также обработку хроматограмм растворами диазобензолсульфокислоты (фенольные соединения).
Результаты и обсуждение. По визуальной оценке хроматограммы водно-спиртовых извлечений из различных частей сафлора красильного видно, что в цветках и листьях преобладают различные вещества, преимущественно фенольной природы (рис. 1).
В ходе изучения спектральных характеристик проведено обоснование целесообразности использования метода спектрофотометрии для определения подлинности цветков сафлора красильного и количественного определения суммы флавоноидов. Определено, что характер кривой поглощения раствора водно-спиртовых извлечений из цветков сафлора красильного обусловлен в основном флавоноидами (рис. 2).
При разработке методики количественного определения суммы флавоноидов использовали реакцию комплексообразования с раствором алюминия хлорида для исключения вклада в значение оптической плотности других групп соединений, основной максимум поглощения которых в области 412-420 нм. В условиях комплексообразования наблюдается батохромный сдвиг длинноволновой полосы флавоноидов [4], который обнаруживается в УФ-спектре в виде максимума поглощения в области 400-412 нм (рис. 2), что находит подтверждение в условиях дифференциальной спектрофотометрии.

Рис. 1. Хроматографический профиль водноспиртовых извлечений из различных органов сафлора красильного:
1 – извлечение из цветков сафлора красильного; 2 – извлечение из листьев сафлора красильного; 3 – извлечение из стеблей сафлора красильного; 4 – извлечение из корней сафлора красильного
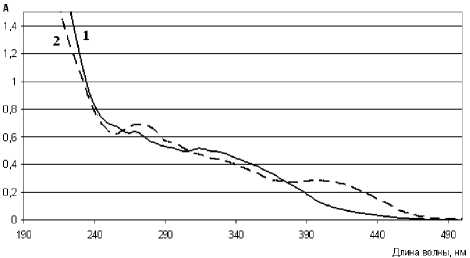
Рис.2 . Электронные спектры водно-спиртовых извлечений из цветков сафлора красильного: 1 – исходный раствор извлечения; 2 – спектр извлечения в присутствии AlCl 3
С целью разработки методики количественного определения суммы флавоноидов нами определены оптимальные условия экстракции цветков сафлора красильного: экстрагент 70% этиловый спирт; соотношение сырье-экстрагент – 1:30; время экстракции – извлечение на водяной бане при температуре 85-90ºС в течение 60 мин (табл. 1).
|
№ п/п |
Экстрагент |
Соотношение сырье: экстрагент |
Время экстракции, мин. |
Содержание суммы флавоноидов в пересчете на рутин и абсолютно сухое сырье (в %) |
|
1 |
40% этиловый спирт |
1:30 |
60 |
0,28±0,05 |
|
2 |
50% этиловый спирт |
1:30 |
60 |
0,26±0,03 |
|
3 |
60% этиловый спирт |
1:30 |
60 |
0,34±0,02 |
|
4 |
70% этиловый спирт |
1:30 |
60 |
0,36±0,06 |
|
5 |
80% этиловый спирт |
1:30 |
60 |
0,34±0,03 |
|
6 |
70% этиловый спирт |
1:20 |
60 |
0,50±0,03 |
|
7 |
70% этиловый спирт |
1:50 |
60 |
0,22±0,04 |
|
8 |
70% этиловый спирт |
1:30 |
45 |
0,26±0,03 |
|
9 |
70% этиловый спирт |
1:30 |
75 |
0,42±0,02 |
|
10 |
70% этиловый спирт |
1:30 |
120 |
0,26±0,03 |
Методика количественного определения суммы флавоноидов в цветках сафлора красильного. В колбу со шлифом вместимостью 50 мл помещают около 1 г (точная навеска) измельченного сырья (пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм), приливают 30 мл спирта 70% и взвешивают на тарирных весах с точностью до ±0,01 г. Колбу с содержимым присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 1 ч. После охлаждения до комнатной температуры колбу взвешивают, доводят ее содержимое спиртом 70% до первоначальной массы, перемешивают и фильтруют через бумажный фильтр (красная полоса). Содержимое колбы тщательно перемешивают (испытуемый раствор А). 1 мл извлечения А помещают в мерную колбу вместимостью
25 мл, прибавляют 2 мл 3% раствора хлорида алюминия в 95% спирте и доводят объем раствора 95% спиртом до метки (испытуемый раствор Б). В качестве раствора сравнения используют раствор, состоящий из 1 мл испытуемого раствора А, 1 капли разведенной уксусной кислоты, доведенной до метки 95% этиловым спиртом в мерной колбе, вместимостью 25 мл (раствор сравнения Б). Измерение оптической плотности проводят на спектрофотометре при длине волны 412 нм. Параллельно измеряют оптическую плотность раствора ГСО рутина при длине волны 412 нм, приготовленного по аналогии с испытуемым раствором (см. примечание).
Приготовление раствора рутина-стандартного образца (ФС 42-2508-87). Около 0,02 (точная навеска) рутина помещают в мерную колбу вместимостью 100 мл, растворяют в 50 мл 70% этилового спирта при нагревании на водяной бане. После охлаждения содержимого колбы до комнатной температуры доводят объем раствора 70% этиловым спиртом до метки (раствор А рутина). 1 мл раствора А рутина помещают в мерную колбу на 25 мл, прибавляют 1 мл 3% спиртового раствора алюминия хлорида и доводят объем раствора 95% этиловым спиртом до метки (испытуемый раствор Б рутина). В качестве раствора сравнения используют раствор, который готовят следующим образом: 1 мл раствора А рутина помещают в мерную колбу на 25 мл, прибавляют 2-3 капли раствора уксусной кислоты и доводят объем раствора до метки 95% этиловым спиртом (раствор сравнения Б рутина). Измерение оптической плотности проводят при длине волны 412 нм через 40 мин после приготовления всех растворов. Содержание суммы флавоноидов в пересчете на рутин и абсолютно сухое сырье в процентах (X) вычисляют по формуле:
D ∗ m 0 ∗ 30 ∗ 1 ∗ 25 ∗ 100 ∗ 100
= D0 ∗m ∗50∗1∗25∗(100-W) , где D – оптическая плотность испытуемого раствора; Do – оптическая плотность раствора ГСО рутина; m – масса сырья, г; mо – масса ГСО рутина, г; W – влажность сырья, %.
Установлено, что ошибка единичного определения методики количественного анализа составляет ±1,53%.
Выводы:
-
1. Проведено сравнительное фитохимиче-ское исследование различных органов сафлора красильного ( Carthamus tinctorius L.) c использованием тонкослойной хроматографии и
- спектрофотометрии. Определены оптимальные условия экстракции из цветков сафлора красильного.
-
2. Разработаны методики качественного и количественного анализа флавоноидов в цветках сафлора красильного, а также количественное определение суммы флавоноидов.
-
3. Обоснована целесообразность использования в медицинской практике надземной части (листья, цветки, плоды) сафлора красильного.
Список литературы Перспективы комплексного использования сафлора красильного (Carthamus tinctorius L.)
- Государственная фармакопея СССР: Вып. 2. Общие методы анализа. Лекарственное растительное сырье/МЗ СССР. 11-е изд., доп. -М.: Медицина, 1990. 400 с.
- Государственный реестр лекарственных средств. Официальное издание по состоянию на 1 апреля 2009 года: в 2-х т. Т.1. -М.: Медицинский совет, 2009. 1315 с.
- Киселева, Т.Л. Лекарственные растения в мировой медицинской практике: государственное регулирование номенклатуры и качества/Т.Л. Киселева, Ю.А. Смирнова. -М.: Изд-во Профессиональной ассоциации натуротерапевтов, 2009. 132 с.
- Куркин, В.А. Основы фитотерапии: учебное пособие для студентов фармацевтических вузов/В.А. Куркин. -Самара: ООО «Офорт», ГОУ ВПО «СамГМУ Росздрава», 2009. 732 с.
- Куркин, В.А. Фармакогнозия: учебник для студентов фармацевтических вузов (факультетов.)/2-е изд., перераб. и доп. -Самара: ООО «Офорт», ГОУ ВПО «СамГМУ Росздрава», 2007. 1239 с.
- Минкевич, И.А. Масличные культуры/И.А. Минкевич, В.Е Борковский. 3 изд. -М., 1955. 212 с.
- Сарафанова, Л.А. Энциклопедия. Пищевые добавки. 2-е изд. -СПб.: ГИОРД, 2004. 410 с.
- European Pharmacopoeia. 6-th Ed. Rockville: United States Pharmacopoeial Convention. Inc., 2008. P. 2851-2852.
- Golkar, P. Inheritance of flower colour and spinelessness in safflower (Carthamus tinctorius L.)/P. Golkar, A. Arzani, A.M. Rezaei//Journal of Genetics. 2010. Vol. 89, No. 2. Р. 259-262.


