Перспективы комплексной переработки каолиновых концентратов гидрохимическим методом
Автор: Римкевич Вячеслав Сергеевич, Пушкин Александр Андреевич, Гиренко Ирина Витальевна, Леонтьев Михаил Андреевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-1 т.18, 2016 года.
Бесплатный доступ
В результате проведенных теоретических и экспериментальных исследований выявлены оптимальные физико-химические условия комплексной переработки каолиновых концентратов в водных растворах фторидов аммония и аммиака. Разработан эффективный гидрохимический метод извлечения гидроксида алюминия, глинозема, нанодисперсного аморфного кремнезема и других полезных компонентов.
Каолиновый концентрат, гидрохимическая переработка, комплексное извлечение, полезные компоненты
Короткий адрес: https://sciup.org/148204432
IDR: 148204432 | УДК: 662.7.004.18
Текст научной статьи Перспективы комплексной переработки каолиновых концентратов гидрохимическим методом
Силикаты и алюмосиликаты широко распространены в природе, составляют более 95% массы земной коры и являются практически неисчерпаемым источником глинозема, кремнезема, алюминия, кремния и других полезных компонентов [1]. В России и за рубежом существующие методы переработки силикатов и алюмосиликатов, в том числе и каолиновых концентратов, основаны на использовании щелочей и минеральных кислот, применяются для выделения отдельных полезных компонентов и характеризуются существенными недостатками в области экологической безопасности.
В последнее время важное значение принимает переработка минерального сырья фторидными методами. Еще недавно фториды использовали, в основном, в атомной промышленности для производства гексафторида урана, а сейчас крупнейшей областью их использования является производство фторполимеров. Условием рентабельности фторидных методов является многократное использование газообразного фтора, фтористого водорода и плавиковой кислоты, которые характеризуются множеством недостатков в области экологии и требуют повышенного обеспечения технологической безопасности. В настоящее время получило развитие фторидное обогащение силикатов и алюмосиликатов путем твердофазных реакций под действием гидродифторида (NH 4 HF 2 ) и фторида (NH 4 F) аммония, которые в нормальных условиях представляют собой экологически и технологически безопасные вещества для приготовления реакционных смесей [2, 3].
Цель исследований: разработка эффективного гидрохимического метода обогащения каолиновых концентратов в водных растворах фторидов аммония и аммиака, который позволяет проводить их переработку с комплексным извлечением различных полезных
Методика экспериментальных исследований. Объектами исследования являлись каолиновые концентраты марок КМ-1 состава, мас.%: SiO 2 – 46,83; Al 2 O 3 – 37,00; Fe 2 O 3 – 0,46; TiO 2 – 0,35; Na 2 O – 0,11; K 2 O – 1,33; MgO, CaO и P 2 O 5 не обнаружены; п.п.п. – 12,83, КН-73 состава, мас. %: SiO 2 – 50,28; Al 2 O 3 – 33,88; Fe 2 O 3 – 0,71; TiO 2 – 0,47; Na 2 O – 0,14; K 2 O – 1,20; MgO, CaO и P 2 O 5 не обнаружены; п.п.п. – 12,86 из Чалганского месторождения кварц-каолин-полевошпато-вого сырья (Амурская область) и каолинсодержащие техногенные отходы состава, мас.%: SiO 2 – 51,65; Al 2 O 3 – 31,58; Fe 2 O 3 – 1,93; TiO 2 – 0,59; Na 2 O – 0,01; K 2 O – 1,01; MgO - 0,01; CaO - 0,19; P 2 O 5 - не обнаружен; п.п.п. – 13,27 из хво-стохранилища Чалгановского каолинового комбината. В состав каолиновых концентратов входит, в основном, минерал каолин Al 4 [Si 4 O 10 ](OH) 8 , который относится к подклассу слоистых силикатов и алюмосиликатов с добавочными анионами. Содержание глинозема в каолиновых концентратах достигает 37 мас.%, что сопоставимо с его содержанием в бокситовых рудах среднего качества [4].
Для переработки каолиновых концентратов применялись водные растворы NH 4 HF 2 и NH 4 F. Реакции идут в нормальных условиях даже без перемешивания реакционной смеси, подогрев которой существенно уменьшает продолжительность фторидного обогащения. Исходные каолиновые концентраты растирали и помещали в тефлоновые тигли или чашки. Затем приливали водные растворы фторидов аммония и выдерживали в термостате при заданных температурах и временах продолжительности опытов. Полученные продукты разделяли путем фильтрования. Синтез аморфного кремнезема и гидроксида алюминия проводили в водных растворах аммиачной воды (NH 4 OH) в гидролизном аппарате, выполненном из фторопласта. Регенерацию аммиачной воды осуществляли в лабораторном устройстве из фторопласта, восстановление NH 4 HF 2 проводили в лабораторном выпаривателе-кристаллизаторе. Синтез глинозема осуществляли в электропечи специальной конструкции.
Исходное сырье, промежуточные фазы и конечные продукты исследовали химическим, рентгенофазовым, спектральным и электронно-микроскопическим методами анализов, применяемыми в Аналитическом центре минералого-геохимических исследований Института геологии и природопользования ДВО РАН. Химический анализ на содержание элементов (Si, Al, Fe, Na, K и другие) в пробах проводили на спектрометре
BRUKER S4 PIONEER. Определение содержания фтора и аммиака осуществляли после отгонки H 2 SiF 6 и NH 3 титрованием полученных растворов нитратом тория и серной кислотой, соответственно. Для рентгенофазового анализа применяли рентгеновский дифрактометр MAXIMA XRD-700 (CuK α -излучение, λ=1,54060 Å) с базой данных для фазового анализа ICDD PDF 2008. Эмиссионный спектральный анализ микропримесей проводили на спектрографе СТЭ-1 со скрещенной дисперсией со стандартным определением 44 элементов. Электронно-микроскопи-ческие исследования проводили на сканирующем электронном микроскопе GSM-6390 LV JEOL с определением породообразующих элементов. Размеры наночастиц определяли на атомносиловом микроскопе SOLVER Р47 в Институте автоматики и процессов управления ДВО РАН (г.Влади-восток).
Перед проведением экспериментальных работ были проведены термодинамические расчеты возможности прохождения процессов гидрохимического выщелачивания в системах исходное сырье – водные растворы NH4HF2 или NH4F, вероятности протекания химических реакций гидролиза образовавшихся фторидно-аммониевых солей, кальцинации глинозема и регенерации дополнительных компонентов. Расчеты проводили с использованием данных [5, 6]. По результатам термодинамических расчетов реакции идут в сторону образования конечных продуктов (табл. 1). Кинетическими опытами установлены оптимальные физико-химические параметры (концентрации растворов, время выдержки, температура и другие) с определением констант скоростей и энергий активации прохождения химических реакций. Расчеты термодинамических и кинетических параметров осуществлялись с применением программ, разработанных нами на основе приложения Microsoft Access 2007.
Таблица 1. Расчетные значения изменений энергии Гиббса (ΔG, кДж) для реакций гидрохимической переработки каолиновых концентратов
|
№ реакции |
T, °C |
25 |
50 |
75 |
100 |
|
1 |
½Al 4 [Si 4 O 10 ](OH) 8 + 12NH 4 HF 2 = 2(NH 4 ) 2 SiF 6 + 2(NH 4 ) 3 AlF 6 + 2NH 3 + 9H 2 O |
||||
|
ΔG |
-376,0 |
-392,1 |
-408,3 |
-424,4 |
|
|
1.1 |
½Al 4 [Si 4 O 10 ](OH) 8 + 24NH 4 F = 2(NH 4 ) 2 SiF 6 + 2(NH 4 ) 3 AlF 6 + 14NH 3 + 9H 2 O |
||||
|
ΔG |
-4,0 |
-8,1 1 |
-12,3 |
-16,4 |
|
|
2 |
(NH 4 ) 2 SiF 6 + 4NH 4 OH = SiO 2 ↓ + 6NH 4 F + 2H 2 O |
||||
|
ΔG |
-176,8 |
-179,2 |
-181,6 |
-184,0 |
|
|
3 |
(NH 4 ) 3 AlF 6 + 3NH 4 OH = Al(OH) 3 ↓ + 6NH 4 F |
||||
|
ΔG |
-43,0 |
-52,4 |
-61,7 |
-71,1 |
|
|
4 |
NH 3 + H 2 O = NH 4 OH |
||||
|
ΔG |
-9,6 1 |
-7,5 1 |
-5,5 |
-3,4 |
|
|
5 |
2NH 4 F = NH 4 HF 2 + NH 3 ↑ |
||||
|
ΔG |
0,5 |
-3,7 1 |
-7,8 1 |
-12,0 |
|
|
6 |
2Al(OH) 3 = Al 2 O 3 ↓ + 3H 2 O↑ |
||||
|
ΔG |
64,0 |
51,8 |
39,6 |
27,5 |
|
На основании полученных экспериментальных данных по образованию массы гексафторалюмината аммония за определенные промежутки времени при заданных параметрах и по данным химических анализов на элементы в продуктах реакций вычисляли кинетические значения процессов – константы скорости и энергии активации. Степень образования продуктов реакций, необходимую для дальнейших расчетов, определяли по формуле: α = m/m 0 , где m – масса образовавшегося продукта, m 0 – теоретически возможное его количество. Для расчетов константы скорости использовали топохимическое уравнение Ерофеева-Авраами, которое подвергали линеаризации методом двойного логарифмирования и далее обрабатывали методом наименьших квадратов. Энергию активации рассчитывали по уравнению Аррениуса методом наименьших квадратов по линеаризированной форме этого уравнения. Ошибки при расчетах кинетических параметров не превышали 2,5 относительных процента.
Обсуждение результатов экспериментов. Гидрохимическое выщелачивание каолиновых концентратов (табл.1, реакции 1 и 1.1) проводилось при температурах 25-80°С, исходных концентрациях (мас.%) 13,3; 26,7 и 40,0 NH4HF2 или NH4F в водных растворах и временах выдержки от 10 мин до 72 ч. Количество фторидов аммония в растворах соответствует стехиометрическому по реакциям 1 и 1.1. Обе реакции являются экзотермическими и сопровождаются выделением тепла.
В результате прохождения процессов (реакции 1 и 1.1) гексафторалюминат аммония ((NH 4 ) 3 AlF 6 ) выпадает в осадок при pH=5,5-6,5. Анализ экспериментальных и кинетических (табл. 2) данных свидетельствует, что при температуре 25°C и концентрации исходного водного раствора 13,3 мас.% NH 4 HF 2 реакция 1 имеет длительный период прохождения, и превращение као-линсодержащих кислородных связей во фторидные происходит через 48 ч; для аналогичных условий (T=25°C и C=13,3 мас.% NH4F) равновесие в реакции 1.1 не было достигнуто. При повышении температуры до 80 °C и 13,3 мас. % концентрации NH 4 HF 2 максимальная степень образования гексафторалюмината аммония (более 98% по массе) достигается через 2,5 ч, а для раствора NH 4 F – через 7,5 ч. Процессы характеризуются низкими константами скоростей и высокими значениями энергии активации (табл. 2). При температуре 80°C повышение концентрации NH 4 HF 2 до 26,7 и 40 мас. % приводит к замедлению процесса гидрохимического разложения каолинового концентрата и увеличению времени образования гексафторалюмината аммония – 98% извлечение достигается через 7,5 ч при концентрации 40 мас.% NH 4 HF 2 . После окончания процесса гидрохимического выщелачивания хорошо растворимый в воде гексафторсиликат аммония
((NH 4 ) 2 SiF 6 ) отделяется путем фильтрования от шламового осадка (NH 4 ) 3 AlF 6 . Отделенный раствор (NH 4 ) 2 SiF 6 выпаривается с образованием кристаллического гексафторсиликата аммония, а летучие компоненты NH 3 и H 2 O улавливаются в устройстве, заполненном водным раствором, с образованием аммиачной воды (NH 4 OH) по реакции 4.
Таблица 2. Значения констант скорости (К с ) и энергии активации (Е а ) реакций гидрохимической переработки каолиновых концентратов 13,3 мас.% растворами гидродифторида и фторида аммония
|
Обработка раствором NH 4 HF 2 |
Обработка раствором NH 4 F |
||
|
Т, °С |
К с , мин-1 |
Т, °С |
К с , мин-1 |
|
25 |
0,000230 |
20 |
0,000071 |
|
80 |
0,005519 |
80 |
0,002209 |
|
Е а , Дж/моль |
45,52 |
49,20 |
|
В процессе гидрохимической переработки образовавшиеся гексафторферрат аммония ((NH 4 ) 3 FeF 6 ) и фторид кальция (CaF 2 ), труднорастворимые в воде, выпадают в осадок и отделяются от реакционной массы. Растворимый в воде гексафтортитанат аммония ((NH 4 ) 2 TiF 6 ) и примесные соединения щелочных металлов, которые при гидрохимическом выщелачивании образуют фториды NaF и KF, хорошо растворимые в воде, на разных этапах также выделяются из реакционной массы.
По данным рентгенофазового, химического и спектрального анализов образовавшиеся кристаллические фазы (NH 4 ) 2 SiF 6 и (NH 4 ) 3 AlF 6 содержат незначительное количество примесей – менее 10-2 мас.% (Fe, Ti, Na, K и другие). На следующем этапе гексафторсиликат и гексафторалюминат аммония подвергаются гидролизу в водно-щелочных растворах. Водный раствор гексафторсиликата аммония (3-33 мас.% (NH 4 ) 2 SiF 6 ) взаимодействует с аммиачной водой (25% мас. NH 3 ) при температурах 25-80°С до образования суспензии при pH=8-9, которую выдерживали при заданной температуре в течение 1 ч (табл. 1, реакция 2). Затем суспензия путем фильтрования отделяется от раствора фторида аммония, который поступает на стадию регенерации NH 4 HF 2 (табл. 1, реакция 5).
В результате прохождения процесса (табл. 1, реакция 2) происходит синтез нанодисперсного аморфного кремнезема высокой химической чистоты со средним размером наночастиц 17-89 нм. По данным анализа на атомно-силовом микроскопе наименьшего среднего значения (17 нм) размер наночастиц достигает в условиях синтеза при исходной концентрации 3 мас.% (NH 4 ) 2 SiF 6 и температуре 80°C; наночастицы увеличиваются до средних размеров 61 нм и 89 нм при концентрациях 20 и 33 мас.% (NH 4 ) 2 SiF 6 соответственно для аналогичной температуры. При концентрации 3 мас.% (NH 4 ) 2 SiF 6 понижение температуры синтеза до 25°C способствует увеличение среднего размера наночастиц до 33 нм.
В разбавленных растворах при концентрации 3 мас.% (NH 4 ) 2 SiF 6 и температуре 80°C достигается максимальное извлечение аморфного кремнезёма, равное 92,36мас. %, которое уменьшается до 71,47 мас.% при концентрации 33 мас.% (NH 4 ) 2 SiF 6 для аналогичной температуры. При концентрации 3 мас.% (NH 4 ) 2 SiF 6 и температуре 25С степень извлечения аморфного кремнезёма составляет 82,35 мас.%, и она уменьшается до
68,53 мас.% с повышением концентрации (NH 4 ) 2 SiF 6 до 20 мас.% для аналогичной температуры.
Спектральный анализ нанодисперсных порошков аморфного кремнезема подтверждает наличие в них минимального количества примесей (менее 10-2 мас.%); на дифрактограммах наблюдается рентгеноаморфное гало с отсутствием кристаллических фаз. По данным химического анализа в аморфном кремнеземе содержится 99,99 мас.% SiO 2 и обнаружены следы фтора.
В водном растворе (0,5-3 мас.% (NH 4 ) 3 AlF 6 ) гек-сафторалюминат аммония взаимодействует с аммиачной водой (25 мас.% NH 3 ) при температурах 25-80°C до образования осадка гидроксида алюминия при pH=7-9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония, который поступает на стадию регенерации NH 4 HF 2 (табл. 1, реакция 5). В результате прохождения процесса (табл. 1, реакция 3) происходит образование микрочастиц гидроксида алюминия с размерами фракций по данным седиментационного анализа от 1 до 10 мкм 2-10%, от 10 до 50 мкм 10-60%, микрочастицы крупнее 50 мкм – более 30% по массе. Спектральный анализ микрочастиц гидроксида алюминия показал наличие в них минимального количества примесей (менее 10-1 мас.%), на ди-фрактограммах фиксируется кристаллическая фаза гиббсит. По данным химического анализа в гидроксиде алюминия содержится 64,98 мас.% Al 2 O 3 , суммарное содержание щелочей (Na 2 O+K 2 O) не превышает 0,1 мас.%. В разбавленных растворах при концентрации 0,5 мас.% (NH 4 ) 3 AlF 6 и температуре 80°C достигается максимальное извлечение гидроксида алюминия, равное 97,10 мас.%, которое уменьшается до 88,91 мас.% при концентрации 3 мас.% (NH 4 ) 3 AlF 6 для аналогичной температуры. При концентрации 0,5 мас.% (NH 4 ) 3 AlF 6 и температуре 25°C степень извлечения гидроксида алюминия составляет 91,88 мас.%, и она уменьшается до 77,62 мас.% с повышением концентрации (NH 4 ) 3 AlF 6 до 2 мас.% для аналогичной температуры.
Математическая обработка результатов экспериментов проводилась в предположении о том, что массовая степень извлечения аморфного кремнезема или гидроксида алюминия зависит от температуры по уравнению Аррениуса [7]: а = а 0 ехр (- Е а / RT ), а энергия активации вычислялась по формуле: E а = R∆ln а / ∆ (1/ Т ). Средняя величина E а составляет 1,6 кДж/моль для реакции 2 и 1,75 кДж/моль для реакции 3, что свидетельствует о протекании этих реакций в диффузионной области.
Далее гидроксид алюминия подвергается кальцинации (табл. 1, реакция 6) при температурах 1100– 1200°C в течение 20-40 мин с получением кондиционного металлургического глинозема, содержащего по данным рентгенофазового анализа 60-80% γ-Al 2 O 3 и 2040% α-Al 2 O 3 . По данным химического, электронномикроскопического и спектрального анализов, полученный глинозем содержит 99,8 мас.% Al 2 O 3 и следующие примеси (мас.%): SiO 2 – 0,02; Fe 2 O 3 – 0,03; TiO 2 – следы; CaO, MgO, Na 2 O и K 2 O не обнаружены, соответствует маркам ГО и Г1 [8], и из него путем электролитического восстановления извлекается технический алюминий марок А5–А85.
Был произведен расчет материального баланса и определены расходные коэффициенты для всех химических соединений, участвующих в реакциях гидрохимической переработки каолинового концентрата с применением водных растворов гидродифторида аммония и аммиака. Материальные потоки показаны на рис. 1, где под формулами химических соединений приведены расходные коэффициенты на 100 кг исходного каолинового концентрата стехиометрического состава. Применяемые дополнительные компоненты (NH4HF2 и NH4OH) практически полностью регенерируются (реакции 4 и 5) и поступают на стадии переработки исходного сырья и промежуточных продуктов. Приведенная технологическая схема (рис. 1) наглядно показывает замкнутость материальных потоков с высокой степенью извлечения глинозема и нанодисперс-ного аморфного кремнезема.
Среднемировая стоимость (долл. США/кг) каолиновых концентратов составляет 0,05, гидродифторида аммония – 2, аммиачной воды – 0,1, а конечных продуктов гидроксида алюминия - 0,2, глинозема – 0,45 и аморфного кремнезема – 5. Из 100 кг каолинового концентрата марки КМ-1 извлекается 35 кг глинозема и 43 кг нанодисперсного аморфного кремнезема с практически полной регенерацией дополнительных компонентов.
Гидроксид алюминия используется при очистки воды, так как обладает способностью адсорбировать различные вещества, в медицине в качестве антацидного средства, как антипрен для подавления горения в пластиковых материалах, для производства металлургического и неметаллургического глиноземов и в других отраслях промышленности. Глинозем широко применяется для производства технического алюминия электролитическим способом, специальных видов керамики и электрокерамики, изготовления конструкционных и диэлектрических материалов для машиностроительной, энергетической и электронной отраслей промышленности. Аморфный кремнезем широко используется в строительной, резинотехнической, медицинской и косметических отраслях промышленности, для производства полупроводникового кремния, основы оптоволоконного кабеля и других целей.
Каолин 100 кг
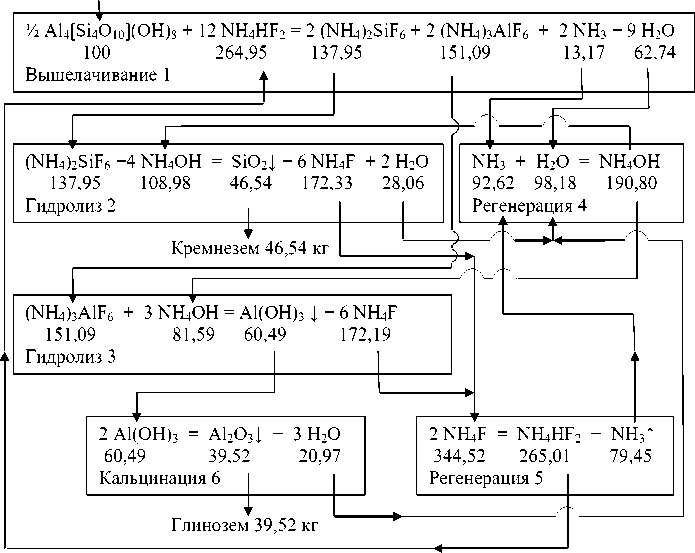
Рис. 1. Технологическая схема материальных потоков при гидрохимической переработке каолиновых концентратов
Выводы: теоретическими и экспериментальными исследованиями выявлены оптимальные физико-химические условия обогащения каолиновых концентратов в водных растворах фторидов аммония и аммиака. В результате разработан эффективный гидрохимический метод извлечения гидроксида алюминия, глинозема и нанодисперсного аморфного кремнезема, который позволяет значительно уменьшить материальные и энергетические затраты и обеспечивает более экологически чистое и технологически безопасное получение конечной продукции по сравнению с существующими способами. При комплексной переработке каолиновых концентратов разработанный метод может конкурировать с широко применяемым извлечением глинозема из высококачественных бокситовых руд способом Байера. Гидрохимический метод можно применять для комплексной переработки кианитовых и нефелиновых концентратов и высококремнистых техногенных отходов – золы от сжигания углей тепловых электростанций.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 14-05-00239а).
Список литературы Перспективы комплексной переработки каолиновых концентратов гидрохимическим методом
- Берри, Л. Минералогия/Л. Берри, Б. Мейcон, Р. Дитрих. -М.: Мир, 1987. 592 с.
- Римкевич, В.С. Комплексная переработка каолиновых концентратов способом фторидной металлургии/В.С. Римкевич, А.А. Пушкин, Ю.Н. Маловицкий и др.//Известия ВУЗов. Цветная металлургия. 2010. № 2. С. 29-36.
- Римкевич, В.С. Изучение процессов фторидной переработки кианитовых концентратов/В.С. Римкевич, И.В. Гиренко, А.А. Пушкин//Журнал прикладной химии. 2013. Т. 86. Вып. 10. С. 1511-1518.
- Лепезин, Г.Г. Минералы группы силлиманита как новое перспективное сырье для алюминиевой промышленности России/Г.Г. Лепезин, С.А. Каргополов, В.Ю. Жираковский//Геология и геофизика. 2010. Т. 51. № 12. С. 1605-1617.
- Лидин, Р.А. Справочник по неорганической химии/Р.А. Лидин, Л.П. Андреева, В.А. Молочко. -М.: Химия, 1987. 320 с.
- Равдель, А.А. Краткий справочник физико-химических величин/А.А. Равдель, А.М. Пономарева. -Л.: Химия, 1983. 234 с.
- Стромберг, А.Г. Физическая химия/А.Г. Стромберг, Д.П. Семченко. -М.: Химия, 1999. 528 с.
- Лайнер, А.И. Производство глинозема/А.И. Лайнер, Н.И. Еремин, Ю.А. Лайнер, И.З. Певзнер. -М.: Металлургия, 1978. 344 с.


