Перспективы комплексной переработки высококремнистых техногенных отходов тепловых электростанций
Автор: Римкевич Вячеслав Сергеевич, Пушкин Александр Андреевич, Гиренко Ирина Витальевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Полезные ископаемые
Статья в выпуске: 5-1 т.17, 2015 года.
Бесплатный доступ
На основе теоретических и экспериментальных исследований процессов гидрохимической переработки высококремнистых техногенных отходов тепловых электростанций выявлены оптимальные условия получения нанодисперсного аморфного кремнезема, глинозема, красного железооксидного пигмента и других товарных продуктов. Разработан эффективный метод комплексного извлечения различных полезных компонентов из электромагнитной фракции угольной золы.
Высококремнистые техногенные отходы, гидрохимическая переработка, комплексное извлечение, аморфный кремнезем, глинозем
Короткий адрес: https://sciup.org/148204037
IDR: 148204037 | УДК: 662.7.004.18
Текст научной статьи Перспективы комплексной переработки высококремнистых техногенных отходов тепловых электростанций
В настоящее время в Российской Федерации ежегодно на тепловых электростанциях (ТЭЦ) сжигается 650 млн. т. угля, вследствие чего образуется 300 млн. т высококремнистых техногенных отходов в виде золы и шлаков. Хранение золошлаковых отходов представляет серьезную экологическую и экономическую проблему. Под хранение золошлаковых отходов ТЭЦ в России отчуждено более 20 тыс. км2 земельных участков, на которых находится 1,3-1,5 млрд. т. этих техногенных отходов. Содержащие различные полезные компоненты, золошлаковые отвалы переполнены, и проблема по утилизации является весьма актуальной. Существующие методы переработки позволяют извлекать незначительные количества ценных компонентов, содержащихся в золошлаковых отвалах. В то же время по вещественному составу высококремнистые техногенные отходы можно рассматривать как комплексное месторождение нерудных и рудных полезных ископаемых. Оно находится на поверхности, не требует расходов на добычу из недр, запасы значительны и постоянно увеличиваются.
Цель работы: теоретическое и экспериментальное изучение процессов переработки высококремнистых техногенных отходов и разработка гидрохимического метода комплексного извлечения различных полезных компонентов.
Методика экспериментальных исследований. Большими перспективами для комплексной переработки высококремнистых техногенных
отходов обладает золоотвал Благовещенской ТЭЦ, расположенный в 3 км западнее ТЭЦ в пади Горбу-ниха, которая использована в качестве естественного резервуара для хранения золы. Четыре котла Благовещенской ТЭЦ потребляют ежегодно около 1 млн. т угля, годовое поступление зольных отходов на золоотвал составляет 150 тыс. т, и в настоящее время их объем превышает 3 млн. т. Для экспериментального изучения из золоотвала были отобраны 3 пробы общим весом 141 кг, которые после сушки были разделены на магнитную, электромагнитную и немагнитную фракции. Средняя влажность проб составляла 39,5% по массе. Среднее содержание магнитной фракции составляет 9,1%, электромагнитной – 88,7%, немагнитной – 2,2% по массе. Магнитная фракция на 50-70% представлена шариками магнетита сизоваточерного цвета; в электромагнитной фракции преобладают прозрачные и полупрозрачные частицы раскристаллизованого пузырчатого стекла силикатного состава и их шлакоподобные агрегаты, присутствуют зерна полевых шпатов и кварца с включениями магнетита и гематита; в немагнитной фракции наблюдаются зерна кварца, полевых шпатов и частицы несгоревшего угля.
Объектом исследования являлась электромагнитная фракция золы состава, мас. %: SiO2 – 54,27; Al2O3 – 21,01; Fe2O3 – 8,09; TiO2 – 0,66; CaO – 8,24; MnO – 0,30; MgO – 2,49; Na2O – 0,40; K2O – 1,23; P2O5 – 0,08; SO3 – 0,27; п.п.п. – 2,91. Перед опытами исходный материал измельчался до размеров менее 0,25 мм. Для переработки электромагнитной фракции золы, состоящей по данным рентгенофазового анализа в основном из минералов кварца (SiO2) и муллита (Al6Si2O13), применялись водные растворы гидродифторида (NH4HF2) и фторида (NH4F) аммония, аммиачная вода (NH4OH) и соляная кислота (35% HCl). Исходный материал растирали и помещали в тефлоновые тигли или чашки. Затем приливали водные растворы фторидов аммония и выдерживали в термостате при заданных температурах и времени продолжительности опытов. Полученные продукты разделяли путем фильтрования. Выщелачивание оксида железа осуществляли разбавленной соляной кислотой в аппарате из нержавеющей стали, пирогидролиз проводили в лабораторной установке. Синтез аморфного кремнезема, гидроксида алюминия и оксида железа проводили в гидролизном аппарате, выполненном из фторопласта. Регенерацию аммиачной воды осуществляли в устройстве из фторопласта, восстановление NH4HF2 и соляной кислоты проводили в лабораторном выпаривателе-кристаллизаторе. Для синтеза глинозема применяли электропечь специальной конструкции.
Исходное сырье, промежуточные фазы и конечные продукты исследовали химическим, рентгенофазовым, спектральным и электронно-микроскопическим методами анализов, применяемыми в Аналитическом центре минералого-геохимических исследований ИГиП ДВО РАН. Химический анализ на содержание элементов (Si, Al, Fe, Na, K и др.) в пробах проводили на спектрометре BRUKER S4 PIONEER. Определение содержания фтора и аммиака осуществляли после отгонки H2SiF6 и NH3 титрованием полученных растворов нитратом тория и серной кислотой, соответственно. Для рентгенофазового анализа применяли рентгеновский дифрактометр MAXIMA XRD-700 (CuKα-излучение, λ=1,54060Å) с базой данных для фазового анализа ICDD PDF 2008. Эмиссионный спектральный анализ микропримесей проводили на спектрографе СТЭ-1 со скрещенной дисперсией со стандартным определением 44 элементов. Электронно-микроскопические исследования проводили на сканирующем электронном микроскопе GSM-6390 LV JEOL с определением породообразующих элементов. Размеры наночастиц определяли на атомно-силовом микроскопе SOLVER Р47 в Институте автоматики и процессов управления ДВО РАН (г. Владивосток). Расчеты термодинамических параметров, констант скорости и энергии активации химических реакций осуществляли с применением программ, разработанных на основе приложения Microsoft Access 2007.
Обсуждение результатов экспериментов. Перед проведением экспериментальных работ был проведен термодинамический расчет вероятности протекания химических реакций комплексной переработки электромагнитной фракции угольной золы. Термодинамические расчеты проводились с использованием данных [4, 5]. По данным расчетов (табл. 1) реакции протекают в сторону образования конечных продуктов.
Таблица 1. Расчетные изменения энергии Гиббса (Δ G, кДж) для гидрохимических реакций переработки высококремнистых техногенных отходов
|
№ п/п |
T, °С |
25 |
50 |
75 |
100 |
|
1 |
SiO 2 + 3NH 4 HF 2 = (NH 4 ) 2 SiF 6 + 2H 2 O + NH 3 |
||||
|
Δ G |
-34,4 |
-46,0 |
-57,7 |
-69,3 |
|
|
2 |
Al 2 O 3 + 6 NH 4 HF 2 = 2(NH 4 ) 3 AlF 6 + 3H 2 O |
||||
|
Δ G |
-340,4 |
-340,0 |
-339,5 |
-339,1 |
|
|
3 |
Fe 2 O 3 + 6NH 4 HF 2 = 2(NH 4 ) 3 FeF 6 + 3H 2 O |
||||
|
Δ G |
-287,6 |
-288,3 |
-290,0 |
-289,7 |
|
|
4 |
CaO + NH 4 HF 2 = CaF 2 + H 2 O + NH 3 |
||||
|
Δ G |
-157,9 |
-165,3 |
-172,8 |
-180,2 |
|
|
5 |
MgO + NH 4 HF 2 = MgF 2 + H 2 O + NH 3 |
||||
|
Δ G |
-1694,0 |
-1735,0 |
-1775,0 |
-1816,0 |
|
|
6 |
(NH 4 ) 2 SiF 6 + 4NH 4 OH = SiO 2 ↓ + 6NH 4 F + 2H 2 O |
||||
|
Δ G |
-48,7 |
-38,8 |
-29,0 |
-19,1 |
|
|
7 |
2NH 4 F = NH 4 HF 2 + NH 3 ↑ |
||||
|
Δ G |
0,5 |
-4,1 \ |
-7,8 \ |
-12,0 |
|
|
8 |
(NH 4 ) 3 AlF 6 + 3NH 4 OH = Al(OH) 3 ↓ + 6NH 4 F |
||||
|
Δ G |
-153,2 |
-146,3 |
-139,5 |
-132,6 |
|
|
9 |
2(NH 4 ) 3 FeF 6 + 3H 2 O = Fe 2 O 3 + 6NH 3 ↑ + 6HF↑ |
||||
|
Δ G |
797,3 |
734,3 |
637,8 |
608,4 |
|
|
10 |
Fe 2 O 3 + 6HCl = 2 FeCl 3 + 3H 2 O |
||||
|
Δ G |
-40,0 |
-31,1 |
-21,9 |
-13,0 |
|
|
11 |
2FeCl 3 + 6NH 4 ОН = Fe 2 O 3 ↓ + 6 NH 4 Сl + 3H 2 O |
||||
|
Δ G |
-476,2 |
-495,9 |
-515,7 |
-535,4 |
|
|
12 |
NH 4 Cl =HCl↑ + NH 3 ↑ |
||||
|
Δ G |
93,0 |
86,0 |
79,1 |
72,1 |
|
На основании полученных экспериментальных данных по массе образовавшегося гексафторсиликата аммония за определенные промежутки времени при заданных температурах и концентрациях растворов гидродифторида и фторида аммония, а также по данным химических анализов на элементы в продуктах реакций вычисляли кинетические параметры процессов – константы скорости и энергии активации. Степень образования продуктов реакций, необходимую для дальнейших расчетов, определяли по формуле: α = m/m расч , где m – масса образовавшегося продукта в момент времени t, m расч – теоретически возможное его количество. Расчет констант скоростей реакций гидрохимической переработки проводился в предположении о следовании экспоненциальному закону изменения концентрации от времени. Энергию активации рассчитывали по уравнению Аррениуса для констант скоростей методом наименьших квадратов по линеаризированной форме этого уравнения. Ошибки при расчетах кинетических параметров не превышают 2,0% относительных.
Экспериментально исследованы кинетические кривые гидрохимического выщелачивания при температурах 25, 75 и 100оС, исходной концентрации 25 мас.% NH 4 HF 2 или NH 4 F в водных растворах и временах выдержки от 0,5 до 7,5 ч. Реакции идут в нормальных условиях даже без перемешивания реакционной смеси, подогрев которой существенно уменьшает продолжительность фторидного выщелачивания. Температура кипения концентрированных водных растворов фторидов аммония составляет 108оС. Количество фторидов аммония в растворах соответствует стехиометрическому. Уменьшение их концентрации приводит к интенсивному кипению растворов, а увеличение – к образованию избытка водного раствора аммиака и ухудщению качества конечного продукта. По экспериментальным данным хорошо растворимый в воде гексафторсиликат аммония ((NH 4 ) 2 SiF 6 ) отделяется путем фильтрования от выпадающего при рН = 5,5-6,0 шламового осадка, состоящего из гексафторалюмината и гексафторфер-рата аммония ((NH 4 ) 3 FeF 6 ), фторидов кальция, магния и других примесей.
В табл. 2 приведены значения констант скоростей и энергий активации для различных температур при 25 мас.% концентраций водных растворов гидродифторида и фторида аммония. Анализ экспериментальных и кинетических данных (табл. 2) свидетельствует, что максимальное извлечение гексафторсиликата (более 98,5 мас.%) достигается при температуре 100оС, времени выдержки 3 ч и при концентрации в водном растворе 25 мас.% NH4HF2. При уменьшении температуры и времени выдержки степень извлечения (NH4)2SiF6 уменьшается. Замена гидродифторида на фторид аммония в водном растворе при аналогичной концентрации также приводит к уменьшению степени извлечения гексафторсиликата аммония. В 25 мас.% водном растворе фторида аммония при температуре 100оС и времени выдержки 3 ч степень извлечения (NH4)2SiF6 составляет 86,3 мас.%, и достигает максимума (более 98 мас.%) при выдержке 6,5 ч.
Таблица 2. Значения констант скорости (К с ) и энергии активации (Е а ) реакций гидрохимической переработки высококремнистых техногенных отходов 25 мас.% раствором гидродифторида и фторида аммония
|
Обработка раствором NH 4 HF 2 |
Обработка раствором NH 4 F |
||
|
Т,оС |
К с , мин-1 |
Т,оС |
К с , мин-1 |
|
25 |
0,001155 |
25 |
0,0005470 |
|
75 |
0,005882 |
75 |
0,003607 |
|
100 |
0,010565 |
100 |
0,009737 |
|
Е а , кДж/моль |
27,4 |
34,9 |
|
При гидрохимическом выщелачивании осуществляются реакции 1-5 основных компонентов с водными растворами гидродифторида аммония (табл. 1). Отделенный раствор (NH 4 ) 2 SiF 6 выпаривается с образованием кристаллического гексафторсиликата аммония, а летучие компоненты NH 3 и H 2 O улавливаются в устройстве, заполненном водным раствором, с образованием аммиачной воды. Далее из шламового осадка выщелачивается растворимый в воде (NH 4 ) 3 AlF 6 при рН=6-6,5, который путем фильтрования отделяется от труднорастворимого гексафторферрата аммония, фторидов кальция и магния. Примесные соединения щелочных металлов при гидрохимическом выщелачивании образуют фториды натрия и калия, хорошо растворимые в воде, которые на разных этапах также выделяются из реакционной массы. Отделенный раствор (NH 4 ) 3 AlF 6 выпаривается с образованием кристаллического гексафторалюмината аммония. По данным рентгенофазового, химического и спектрального анализов образовавшиеся кристаллические фазы (NH 4 ) 2 SiF 6 и (NH 4 ) 3 AlF 6 содержат незначительное количество примесей – менее 10-2 мас. % (Fe, Ti, Na, K и другие). На следующем этапе гексафторсиликат и гексафторалю-минат аммония подвергаются гидролизу в воднощелочных растворах.
Водный раствор гексафторсиликата аммония (3–33 мас. % (NH4)2SiF6) взаимодействует с аммиачной водой (25 % мас. NH3) при температурах 20-80°С по реакции 6 до образования осадка при pH=8–9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония, который поступает на регенерацию гидродифторида аммония по реакции 7. В результате происходит синтез нанодисперсного аморфного кремнезема высокой химической чистоты со средним размером наночастиц 17-89 нм. По данным анализа на атомно-силовом микроскопе наименьшего среднего значения (17 нм) размер наночастиц достигает в условиях синтеза при исходной концентрации 3 мас.% (NH4)2SiF6 и температуре 80°C; наночастицы увеличиваются до средних размеров 61 нм и 89 нм при концентрациях 20 и 33 мас.% гексафторсиликата аммония соответственно для аналогичной температуры. При концентрации 3 мас.% (NH4)2SiF6 понижение температуры синтеза до 20°C способствует увеличение среднего размера наночастиц до 33 нм. Изменение концентрации и температуры в указанных интервалах позволяет увеличивать удельную поверхность нанодисперсных порошков аморфного кремнезема от 92 до 508 м2/г, при этом удельный объем пор увеличивается от 0,096 до 0,255 см3/г.
В разбавленных растворах при концентрации 3 мас.% гексафторсиликата аммония и температуре 80°C достигается максимальное извлечение аморфного кремнезёма, равное 92,36 мас.%, которое уменьшается до 71,47 мас.% при концентрации 33 мас.% (NH 4 ) 2 SiF 6 для аналогичной температуры. При концентрации 3 мас.% (NH 4 ) 2 SiF 6 и температуре 20°С степень извлечения аморфного кремнезёма составляет 82,35 мас.%, и она уменьшается до 68,53 мас.% с повышением концентрации (NH 4 ) 2 SiF 6 до 20 мас.% для аналогичной температуры.
Спектральный анализ нанодисперсных порошков аморфного кремнезема подтверждает наличие в них минимального количества вредных примесей (менее 10-2 мас.%); на дифрактограммах наблюдается рентгеноаморфное гало с отсутствием кристаллических фаз. По данным химического анализа в аморфном кремнеземе содержится 99,99 мас.% SiO 2 и обнаружены следы фтора [6]. В водном растворе (0,5-3 мас.% (NH 4 ) 3 AlF 6 ) гексафтора-люминат аммония взаимодействует с аммиачной водой (25 мас.% NH 3 ) при температурах 20-80°С по реакции 8 до образования осадка гидроксида алюминия (Al(OH) 3 ) при pH = 8-9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония, который поступает на стадию регенерации (реакция 7). В результате прохождения процесса (реакция 8) происходит образование микрочастиц гидроксида алюминия с размерами фракций от 1 до 10 мкм 2-10%, от 10 до 50 мкм 10-60%, микрочастицы крупнее 50 мкм – более 30% по массе. Спектральный анализ микрочастиц гидроксида алюминия показал наличие в них минимального количества микропримесей (менее 10-1 мас.%), на дифрактограммах фиксируется кристаллическая фаза гиббсит. По данным химического анализа в гидроксиде алюминия содержится 64,98 мас.% Al 2 O 3 , суммарное содержание щелочей (Na 2 O + K 2 O) не превышает 0,1 мас.%. В разбавленных растворах при концентрации 0,5 мас.%
(NH 4 ) 3 AlF 6 и температуре 80°C достигается максимальное извлечение гидроксида алюминия, равное 97,10 мас.%, которое уменьшается до 88,91 мас.% при концентрации 3 мас.% (NH 4 ) 3 AlF 6 для аналогичной температуры. При концентрации 0,5 мас.% (NH 4 ) 3 AlF 6 и температуре 20°C степень извлечения гидроксида алюминия составляет 91,88 мас.%, и она уменьшается до 77,62 мас.% с повышением концентрации (NH 4 ) 3 AlF 6 до 2 мас.% для аналогичной температуры.
Математическая обработка результатов экспериментов проводилась в предположении о том, что массовая степень извлечения аморфного кремнезема или гидроксида алюминия зависит от температуры по уравнению Аррениуса [7]: а = а 0 ехр (- Е а / RT ), а энергия активации вычислялась по формуле: E а = R∆ln а / ∆ (1/ Т ). Средняя величина E а составляет 1,6 кДж/моль для реакции 6 и 1,75 кДж/моль для реакции 8, что свидетельствует о протекании этих реакций в диффузионной области. Далее гидроксид алюминия подвергается кальцинации по реакции
2Al(OH) 3 = Al 2 O 3 + 3H 2 O (13)
при температурах 1100-1200°C в течение 20-40 мин с получением кондиционного металлургического глинозема, состоящего по данным рентгенофазового анализа из смеси фаз: 60-80% γ-Al 2 O 3 и 20-40% α-Al 2 O 3 . По данным химического, электронномикроскопического и спектрального анализов, полученный глинозем содержит 99,8 мас.% Al 2 O 3 и следующие примеси (мас.%): SiO 2 – 0,02; Fe 2 O 3 – 0,03; TiO 2 – следы; CaO, MgO, Na 2 O и K 2 O не обнаружены, и соответствует маркам ГО и Г1 [8], и из него путем электролитического восстановления извлекается первичный технический алюминий марок А5–А85.
По известной методике [9] шламовый осадок подвергается термической обработке перегретым водяным паром при 350-650°С в течение 1,5-2,5 час с образованием оксида железа по реакции 9, а фториды кальция и магния не подвергаются пирогидролизу. Далее полученный осадок выщелачивают разбавленным раствором соляной кислоты при температуре 50-60°С и выдержке 2-3 ч с образованием раствора хлорида железа (FeCl 3 ) по реакции 10, который путем фильтрования отделяется от нерастворимого в соляной кислоте остатка, состоящего по данным рентгенофазового анализа из фторидов кальция и магния. Полученный концентрат поступает на дальнейшую переработку.
Хлорид железа подвергается гидролизу в водных растворах под действием аммиачной воды (25 мас.% NH3) при температурах 20–80°C и pH =7-8 по реакции 11 с образованием красного железооксидного пигмента (Fe2O3), который выпадает в осадок, выдерживается при заданной температуре не менее 1 ч и отделяется путем фильтрования от хлорида аммония (NH4Cl). Из NH4Cl регенерируются при температурах выше 338°С соляная кислота и аммиак по реакции 12, которые поступают на стадии технологического процесса.
На рис. 1 изображена технологическая схема выщелачивания высококремнистых техногенных отходов под действием растворов гидродифторида аммония. На схеме в скобках обозначены химические реакции комплексной переработки электромагнитной фракции (ЭМ) угольной золы, вероятности прохождения которых подтверждены термодинамическими расчетами. Применяемые дополнительные компоненты легко восстанавливаются с отсутствием твердых, жидких и газообразных отходов, что позволяет многократно использовать их в технологическом процессе (реакции 7, 12). При комплексной переработке 100 кг высококремнистых техногенных отходов теоретически можно извлечь 54,27 кг аморфного кремнезема, 21,01 кг глинозема, 8,09 кг красного железооксидного пигмента и другие полезные компоненты. В лабораторных условиях при фторидной гидрохимической переработке электромагнитной фракции угольной золы степень извлечения аморфного кремнезема составляет 96,1%, глинозема – 96,8%, красного железооксидного пигмента – 95,2%, регенерация гидродифторида аммония, аммиачной воды и соляной кислоты превышает 95%. Среднемировая стоимость ($/кг) золы составляет 0,06, гидродифторида аммония – 2,0, аммиачной воды – 0,1, соляной кислоты – 0,2, а конечных продуктов аморфного кремнезема – 5,0, глинозема – 0,45, гексафторсиликата аммония – 4,0, красного железооксидного пигмента – 3,0. Замкнутый технологический процесс с высокой степенью восстановления применяемых реагентов и высокая стоимость конечных продуктов обеспечивают экономическую рентабельность гидрохимического метода и экологическую безопасность промышленного производства и окружающей среды.
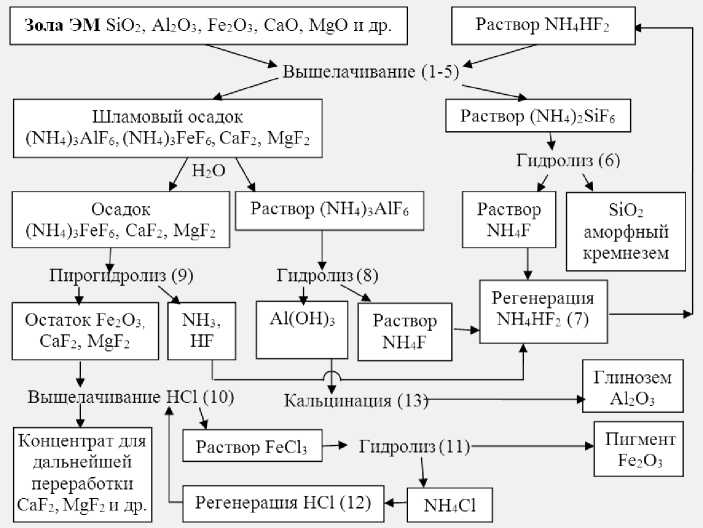
Рис. 1. Технологическая схема гидрохимической переработки высококремнистых техногенных отходов
Аморфный кремнезем широко используется в резинотехнической, строительной, медицинской и косметических отраслях промышленности, для производства полупроводникового кремния, основы оптоволоконного кабеля и других целей. Глинозем широко применяется для производства технического алюминия электролитическим способом, специальных видов керамики и электрокерамики, изготовления конструкционных и диэлектрических материалов для машиностроительной, энергетической и электронной отраслей промышленности. Обладающий сильными огнестойкими и биоцидными свойствами гексафторсиликат аммония находит применение в деревообрабатывающей, пищевой, химической и других отраслях промышленности. Красный железооксидный пигмент предназначается для получения высокачественных красок, бумаги, резины, пластмасс и других продуктов.
Выводы: теоретическими и экспериментальными исследованиями выявлены оптимальные физико-химические условия переработки высококремнистых техногенных отходов в водных растворах гидродифторида и фторида аммония, аммиачно воды и соляной кислоты. В результате разработан гидрохимический метод извлечения нанодисперсного аморфного кремнезема, гидроксида алюминия, глинозема, красного железооксидного пигмента и других полезных компонентов из угольной золы. Внедрение разработанного метода позволит перерабатывать большие объемы высококремнистых техногенных отходов тепловых электростанций в более экологически чистых и технологически безопасных промышленных условиях и значительно уменьшить материальные и энергетические затраты получения конечной продукции по сравнению с существующими способами.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 14-05-00239а).
Список литературы Перспективы комплексной переработки высококремнистых техногенных отходов тепловых электростанций
- Черепанов, А.А. Комплексная переработка золошлаковых отходов ТЭЦ/А.А. Черепанов, В.Т. Кардаш//Геология и полезные ископаемые мирового океана. 2009. № 2. С. 98-115.
- Делицын, Л.М. Необходимость новых подходов к использованию золы ТЭС/Л.М. Делицын, А.С. Власов//Теплоэнергетика. 2010. № 4. С. 49-55.
- Фомина, Е.Ю. Исследование возможности переработки золошлаковых отходов ТЭС металлургическими методами/Е.Ю. Фомина, О.С. Артемова//Горный информационно-аналитический бюллетень. 2011. № 8. С. 273-277.
- Лидин, Р.А. Справочник по неорганической химии/Р.А. Лидин, Л.П. Андреева, В.А. Молочко. -М.: Химия, 1987. 320 с.
- Равдель, А.А. Краткий справочник физико-химических величин/А.А. Равдель, А.М. Пономарева. -Ленинград: Химия, 1983. 244 с.
- Римкевич, В.С. Синтез и свойства наночастиц аморфного SiO2/В.С. Римкевич, А.А. Пушкин, И.В. Гиренко//Неорганические материалы. 2012. Т. 48, № 4. С. 423-428.
- Стромберг, А.Г. Физическая химия/А.Г. Стромберг, Д.П. Семченко. -М.: Химия, 1999. 528 с.
- Лайнер, А.И. Производство глинозема/А.И. Лайнер, Н.И. Еремин, Ю.А. Лайнер, И.З. Певзнер. -М.: Металлургия, 1978. 344 с.
- Дьяченко, А.Н. Разделение кремний-железо-медно-никелевого концентрата фтороаммониевым методом на индивидуальные оксиды/А.Н. Дьяченко, Р.И. Крайденко//Известия Томского политехнического университета. 2007. Т. 311, № 3. С. 38-41.


