Перспективы получения проростков семян луковых культур, обогащенных селеном
Автор: Голубкина Н.А., Середин Т.М., Баранова Е.В., Старцева Л.В., Агафонов А.Ф., Ушакова О.В., Ковальский Ю.Г.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 6 (44), 2018 года.
Бесплатный доступ
Проростки семян сельскохозяйственных культур являются функциональными продуктами питания с высоким содержанием природных антиоксидантов. Хотя семена растений рода Allium используют в ряде стран в качестве приправы, однако возможности использования соответствующих проростков в пищу ранее не исследовались. Оценка эффективности обогащения семян мно-голетнихлуков и лука репчатого селеном выявила высокую пищевую ценность получаемого продукта, отличающегося не только высоким содержанием селена, причем преимущественно в виде селенометил селеноцистеина, мощного природного антиканцерогена, но также повышенным уровнем антиоксид антной активности и высоким содержанием полифенолов. Установлено, что среди 7 исследованных представителей рода Allium наиболее перспективными являются проростки семян лука репчатого Красное кружево и многолетнего лука батуна, содержащих наиболее высокие уровни селена (10500-11000 мкг/кг С. м), полифенолов (9,3-10,8 мг-экв ГК/1 г С. м.) и имеющих наибольший уровень антиоксидантной активности (14,7-17,1 мг-экв ГК/1 г С. м.). Использование 1 г порошка высушенных проростков лука, обогащенных селеном, обеспечивает поступление в организм человека до 15,7% суточной потребности человека в селене, причем в виде селенометил селеноцистеина, обладающего высокой антиканцерогенной активностью.
Проростки семян, селен, антиоксиданты
Короткий адрес: https://sciup.org/140238397
IDR: 140238397 | УДК: 635.25: | DOI: 10.18619/2072-9146-2018-6-50-54
Текст научной статьи Перспективы получения проростков семян луковых культур, обогащенных селеном
Введение
Впоследние годы все большее внимание уделяется пищевой ценности и применению проростков сельскохозяйственных растений как функциональных продук- тов с высоким содержанием природных антиоксидантов (Penas et al., 2008; Sangronis and Machado, 2007). Это в значительной степени связано с интенсивно развивающим- ся экологическим кризисом в мире, загрязнением окружающей среды, возрастанием оксидантного стресса, низким уровнем потребления овощей и фруктов в значительном количестве стран мира, включая Россию (Голубкина и др., 2012).
Среди различных сельскохозяйственных культур семена лука в настоящее время мало востребованы населением, несмотря на то, что они используются в ряде стран в качестве приправы к пище благодаря высокому содержанию полиненасыщенных жирных кислот, белков, витаминов, макро- и микроэлементов (Dini et al., 2008; Yalcin and Kavuncuoglu, 2014). Высокое содержание цистеина и других серосодержащих соединений определяет семена луковых культур как функциональные продукты питания, эффективные в борьбе с ожирением и предупреждении онкологических заболеваний (Yalcin and Kavuncuoglu, 2014). Установлено, что проращивание семян луковых культур в присутствии солей селена способствует интенсивному образованию метилированной формы селеноцистеина Se-Me-Se-Cys (Scientific opinion, 2007) (>96% от общего содержания селена), являющегося мощным природным антиканцерогенном (Sugihara et al., 2004). Именно Se-Me-Se-Cys среди различных производных селена обладает наиболее выраженным противораковым действием, причем это соединение характерно только для растений рода Allium и Brassica. Лабораторные исследования выявили несколько механизмов биологического действия Se-Me-Se-Cys. Это соединение восстанавливает регуляторные белки, связанные с циркадными биоритмами, обеспечивая нормализацию уровня мелатонина и эстрогеновых рецепторов, определяющих интенсивность процесса развития рака молочной железы (Zhang X., Zarbl, 2008; Fang et al., 2010). Установлено также, что селенометил селеноцистеин ингибирует ангиогенез (Bhattacharya et al., 2011, 2009; Li et al., 2009), замедляя рост злокачественых опухолей и усиливая эффективность использования противораковых препаратов (Bhattacharya et al., 2008). Так, в эксперименте на животных показано, что Se-Me-Se-Cys усиливает способность тамоксифена (эффективного препарата против рака молочной железы) ингибировать рост раковых клеток молочной железы, привитых на мышей (Li et al., 2009). Выявлен эффект синергизма Se-Me-Se-Cys c другими препаратами, используемыми при лечении рака молочной железы и предстательной железы (Bhattacharya et al., 2008; Bhattacharya, 2011; Cao et al., 2004). Многоплановость биологического действия Se-Me-Se-Cys проявляется также в способности этого соединения снижать экспрессию Bcl-2 белка, препятствующего протеканию апоптоза раковых клеток (Lee et al., 2009), приводя к быстрому разрушению последних (Pan et al., 2011). Доказано, что Se-Me-Se-Cys также предотвращает возникновение и развитие рака прямой кишки, предстательной железы, головы и шеи (Bhattacharya et al., 2011; Bhattacharya, 2011; Johnson et al., 2008; Lindshield et al., 2010; Wang L et al., 2009). С позиций практики использование природных источников селенометил селеноцистеина является предпочтительным по сравнению с разработкой химического синтеза и получением соответствующих БАДов, поскольку только в природных биологических системах максимально проявляется синергизм действия различных антиоксидантов, включая селен, и сводится к минимуму возможность токсикозов (Голубкина и др., 2012). Следует также отметить, что растения рода Allium относятся к группе вторичных аккумуляторов селена, что определяет их высокую устойчивость к высоким концентрациям микроэлемента, в отличие от большинства сельскохозяйственных культур, для которых повышенные концентрации селена часто оказываются токсичными (Pilon-Smits, 2010). Кроме того, установлено, что содержание селена в семенах растений рода Allium пропорционально уровню накопления в семенах масла (Golubkina and Caruso, 2017).
Целью настоящего исследования было установление меж- и внутривидовых особенностей биохимического состава проростков лука репчатого и многолетних луков без и на фоне обогащения проростков селеном.
Материалы и методы
В апреле 2018 года семена 4-х видов многолетних луков (косой, батун, алтайский, слизун) и 3-х сортов лука репчатого (Красное кружево, Примо и Черный принц) урожая 2017 года проращивали в чашках Петри в камере для роста растений GC-300TLH (Корея) при средней влажности воздуха 50% и температуре 20°С, используя: а) дистиллированную воду (контроль) или б) раствор селената натрия (10 мг селената натрия в 1 л воды). Повторность 4-х кратная. Получаемые проростки промывали дистиллированной водой и высушивали до постоянной массы при 70°С. Полученный продукт гомогенизировали и определяли показатели антиоксидантной активности: содержание полифенолов, селена и общую антиоксидантную активность.
Для определения уровня накопления полифенолов использовали колориметрический метод Фолина-Чиокалтеу (Golubkina et al., 2017) на спектрофотометре Unico 2804 UV (США). Содержание полифенолов рассчитывали по калибровочной кривой, построенной по пяти концентрациям галловой кислоты (0-90 мкг/мл) в мг-эквива-лентах галловой кислоты на 1 г сухой массы (мг-экв ГК/г с.м.).
Уровень антиоксидантной активности устанавливали по методу Максимова и др. (2001) титрованием 0,01 N раствора KMn04 этанольным экстрактом образцов проростков. Восстановление KMnO4 до бесцветного Mn+2 в этой реакции отражает количество антиоксидантов, растворенных в 70% этаноле. Результаты выражали в мг-эквивалентах галловой кислоты/г с.м. Этот метод успешно использовался ранее для определения антиоксидантного потенциала Ocimum basilicum (Srivastava et al., 2015) и антиоксидантной активности сыворотки крови (Zhan et al., 2014).
Содержание селена устанавливали микрофлуорометрически по методу, описанному ранее для биологических тканей и жидкостей (Alfthan, 1984). Метод включает мокрое сжигание гомогенизированных образцов смесью хлорной и азотной кислот, последующее восстановление Se+6 до Se+4 действием 6 N HCl, и образование комплекса между Se+4 и 2,3-диаминонафталином. Расчет содержания селена осуществляли по величине флуоресценции пиазоселенола в гексане при λ эмиссии 519 нм и λ возбуждения 376 нм. В работе использовали трехкратную повторность каждого определения. Достоверность результатов устанавливали, используя референс-стандарт – образец лиофилизованной капусты белокочанной с регламентированным содержанием селена 150 мкг, кг с.м. (Институт питания, Россия).
Статистическую обработку результатов осуществляли с использование критерия Стьюдента.
Результаты и обсуждения
Более высокая пищевая ценность проростков семян сельскохозяйственных растений по сравнению с нативными семенами определяется процессами гидролиза запасных белков, интенсивным биосинтезом антиоксидантов и образованием наиболее биологически активных водорастворимых форм селена (Zakarova et аl., 2010; Голубкина, Папазян, 2006). В этом отношении проростки семян следует рассматривать как функциональные продукты питания с повышенной антиканцерогенной активностью (Zakarova et аl., 2010).
Сравнение показателей антиоксидантной активности проростков лука репчатого и многолетних луков (табл.1) с аналогичными данными для взрослых растений (Golubkina and Caruso, 2018) показывает, что содержание полифенолов и уровень антиоксидантной активности (АОА) в среднем в 3-5 раз выше у проростков. Так, содержание полифенолов в луке репчатом составляет около 2 мг-экв ГКг/г сухой массы (Golubkina and Caruso, 2018), а АОА – около 4 мг-экв ГК/г с.м., в то время как у проростков эти показате-
Таблица. Содержание антиоксидантов в проростках семян растений рода Allium, обогащенных и не обогащенных селеном Table. Content of antioxidants in Allium seeds sprouts fortified and non fortified with selenium
|
Species, variety |
Полифенолы, мг- экв. ГК/г с.м. Polyphenols mg-eq GA/g.d.w. |
АОА,мг-экв. ГК/г с.м. AOA, mg-eq GA/g.d.w. |
Селен Selenium |
|||
|
Контроль Control |
Селенат Selenate |
Контроль Control |
Селенат Selenate |
Общий, мкг/кг с.м. Total,μg/kg d.w. |
Водораст-вори-мые формы, % Water soluble, % |
|
|
Многолетние луки Perennial |
||||||
|
Алтайский A. altaicum |
5.38±0.50adА |
5.36±0.32aА |
8.50±0.26aA |
8.80±0.24aA |
2841±267a |
66.0 |
|
Косой A. obliquum |
6.29±0.50dА |
7.79±0.58bB |
8.07±0.23aA |
11.59±0.33bB |
4288±160b |
64.9 |
|
Слизун A. nutans |
9.24±0.62bA |
9.32±0.64cA |
11.41±0.32bA |
15.73±0.34cB |
8681±914c |
64.6 |
|
Батун A. fistulosum |
7.99±0.60cA |
10.79±0.80cB |
12.30±0.30cA |
15.60±0.34cA |
11033±309d |
65.3 |
|
Лук репчатый A.cepa |
||||||
|
Примо Primo |
4.78±0.31aA |
4.91±0.30aA |
8.02±0.25aA |
8.81±0.23aB |
4382±177b |
65.3 |
|
Черный принц Cherniy prints |
9.50±0.63bA |
9.77±0.67cA |
11.91±0.31bcA |
16.11±0.35cB |
8672±16c |
66.8 |
|
Красное кружево Krasnoe krugevo |
7.21±0.57cA |
9.52±0.62cB |
11.70±0.32bcA |
14.73±0.30dB |
10501±830d |
65.4 |
|
M±SD |
7.20±1.47 |
8.21±1.88 |
10.27±1.78 |
13.05±2.85 |
7200±2882 |
65.5±0.5 |
|
CV, % |
20.4 |
22.9 |
17.3 |
21.8 |
40.0 |
0.8 |
|
Интервал концентрации Concentration range |
4.78-9.50 |
4.91-10.79 |
8.02-11.91 |
8.80-16.11 |
4288-11033 |
64.6-66.8 |
Значения в столбцах с одинаковыми индексами, выделенными курсивом и в рядах с одинаковыми прописными индексами для каждого показателя статистически не различаются (P>0.05)
Values in columns with similar italics indexes and in lines with similar capital letters for each parameter do not differ statistically according to Duncan test (P>0.05)
ли находятся в интервале 4,8-9,2 мг-экв ГК/г с.м и 8,0-12,3 мг-экв ГК/г с.м. соответственно. При обогащении проростков селеном содержание полифенолов возрастает до 4,9-10,8 мг-экв ГК/г с.м, а АОА – до 8,8-16,1 мг-экв ГК/г с.м (табл.1).
Данные таблицы показывают, что проростки многолетних луков и лука репчатого мало различаются по содержанию полифенолов и антиоксидантной активности. Общей закономерностью как для обогащенных, так и не обогащенных селеном проростков является прямая корреляция между общим уровнем антиоксидантной защиты и содержанием полифенолов (рис.1).
Обращает внимание тот факт, что при сравнительно небольших уровнях антиоксидантной активности и содержания полифенолов в не обогащенных проростках (семена лука репчатого Примо, семена многолетнего лука Алтайский) биофортификация селеном достоверно не меняет эти показатели, в то время как для образцов с исходной высокой концентрацией антиоксидантов (семена лука репчатого Красное кружево и многолетнего лука сли-
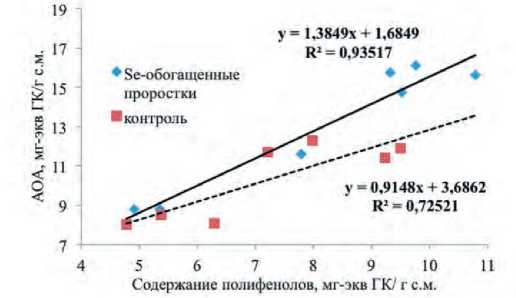
Рис.1. Взаимосвязь между антиоксидантной активностью и содержанием полифенолов в проростках растений рода Allium, обогащенных (r=+0.97; P<0.001)
и не обогащенных селеном (r=+0.85; P<0.004)
Polephenol content, mg-eq GA/g d.w,
-
Fig.1. Relationship between AOA and polyphenol content in Allium seeds sprouts fortified (r=+0.97; P<0.001) and non fortified (r=+0.85; P<0.004) with selenium
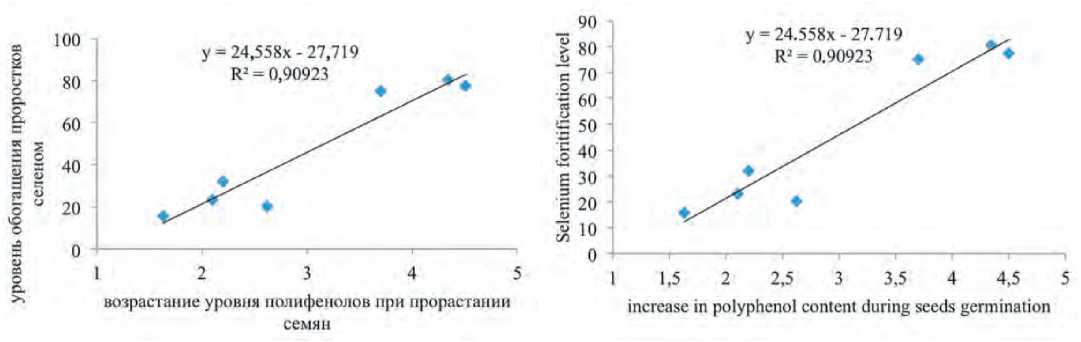
Рис.2. Взаимосвязь уровня обогащения селеном проростков и возрастание уровня полифенолов при прорастании семян (r=+0.95; P<0.001).
-
Fig.2. Relationship between selenium fortification level and increase in polyphenol content during seeds germination (r=+0.95; P<0.001).
зун) степень возрастания этих показателей при обогащении селеном оказывается значительной и составляет 3235% для полифенолов и 26-27% – для уровня общей антиоксидантной активности. Более того, содержание полифенолов в обогащенных селеном проростках оказывается пропорционально степени обогащения семян селеном (рис.2). Это явление, по крайне мере частично, может быть связано с известным фактом существования серосодержащих флавоноидов в растениях рода Allium (Fernandes et al., 2018), что предполагает возможность существования также соответствующих селеновых аналогов, поскольку селен активно замещает серу в биологических системах селена, полифенолов и уровень антиоксидантной активности в проростках семян которых достигает 10500-11000 мкг/кг, 9,5-10,8 мг-экв ГК/г и 14,7-15,6 мг-экв ГК/г соответственно. С другой стороны, обращает внимание, что доля водорастворимых форм селена в проростках луковых культур при обогащении есть величина постоянная и не зависит от концентрации селена и степени обогащения микроэлементом и составляет около 65,5% (табл.1). Столь высокий уровень водорастворимых форм селена в проростках луковых культур свидетельствует о значительной биологической активности получаемого продукта.
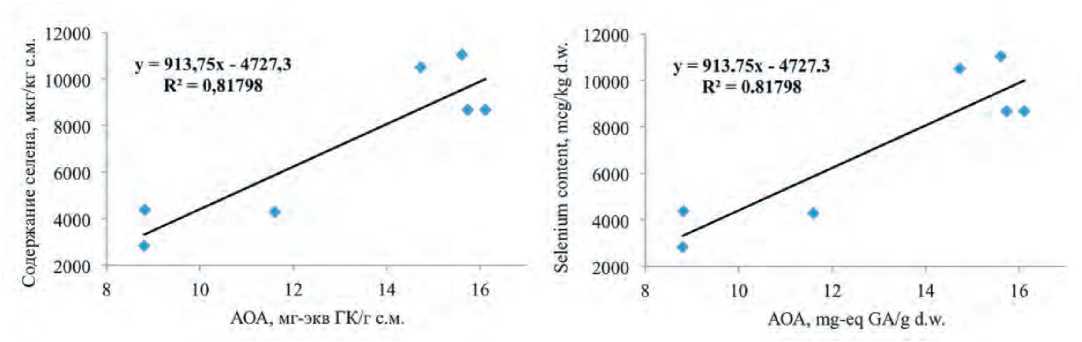
Рис.3. Взаимосвязь между содержанием селена и антиоксидантной активностью проростков растений рода Allium (r=+0.90; P<0.001)
Fig.3. Relationship between selenium content and AOA of Allium seeds sprouts (r=+0.90; P<0.001).
(Pilon-Smits, 2010).
Известно, что семена обладают способностью активно поглощать биологически активные соединения, обеспечивая процесс биофортификации. Так, при проращивании семян японского редиса в растворе витамина В12 (200 мкг/мл) содержание последнего в проростках возрастало до 1,5 мкг/г (Sato et al.,2004). Показано, что проростки семян сои можно обогатить витамином С (Kim, 1988). Работами японских исследователей показана эффективность повышения содержания селена в проростках при прорастании семян в условиях гидропоники (Sugihara et al., 2004; Yoshida et al., 2007a; 2007b; Hama et al., 2008). Семена луковых культур легко обогащаются селеном благодаря тому, что растения рода Allium относятся к группе природных аккумуляторов микроэлемента.
Выявленная прямая взаимосвязь между содержанием селена и АОА проростков (рис.3) позволяет выделить наиболее перспективные сорта для получения функциональных продуктов: Красное кружево и батун, содержание
Заключение
В целом обогащенные селеном проростки семян луковых культур (за исключением лука косого, алтайского и лука репчатого сорт Примо) отличаются высокими антиоксидантной активностью (от 14,7-17,1 мг-экв ГК/100 г с.м.), содержанием полифенолов (9,3-10,8 мг-экв ГК/100 г с.м.) и микроэлемента селена (8670-11000 мкг/кг с.м). Такие проростки не только являются источниками наиболее мощного антиканцерогенного производного селена (селенометил селеноцистеина) и антиоксидантов, но и обеспечивают от 12,4 до 15,7% суточной потребности в микроэлементе при потреблении 1 г высушенного порошка проростков. Следует отметить, что обогащение селеном проростков луковых культур обеспечивает увеличение антиканцерогенной активности продукта также за счет высокого содержания полифенолов, проявляющих мощную противораковую защиту в целом (Niedzwiecki et al., 2016) и в отношении рака молочной железу, в частности (Dayem et al., 2016).
Список литературы Перспективы получения проростков семян луковых культур, обогащенных селеном
- Голубкина Н.А., Надежкин С. М., Пивоваров В.Ф., Лосева Т.А., Соколова А.Н. Глобальный экологический кризис. Проблемы и решения. М., ВНИИССОК, 2012.
- Голубкина Н.А., Папазян Т.Т. Селен в питании. Растения, животные, человек. М., Печатный город. 2006.
- Максимова Т.В., Никулина И.Н., Пахомов В.П., Шкарина Е.И., Чумакова З.В., Арзамасцев А.П. Способ определения антиокислительной активности. Пат РФ 2170930 С1 М. 2001.
- Alfthan, G. A micromethod for the determination of selenium in tissues and bio-logical fluids by single-test-tubefluorimetry//Anal.Chim.Acta. 1984. Vol. 65. P. 187-194.
- Bhattacharya A. Methylselenocysteine: a promising antiangiogenic agent for overcoming drug delivery barriers in solid malignancies for therapeutic synergy with anticancer drugs//Expert Opin Drug Deliv. 2011. Vol.8(6). P. 749-63.
- Bhattacharya A., Turowski S.G., San Martin I.D. Magnetic resonance and fluorescence-protein imaging of the anti-angiogenic and anti-tumor efficacy of selenium in an orthotopic model of human colon cancer//Anticancer Res. 2011. Vol.31(2). P.387-393.
- Bhattacharya A., Toth K., Sen A., Inhibition of colon cancer growth by methylselenocysteine-induced angiogenic chemomodulation is influenced by histologic characteristics of the tumor//Clin Colorectal Cancer. 2009. Vol. 8(3). P. 155-162.
- Bhattacharya A., Seshadri M., Oven S.D., Toth K., Vaughan M.M., Rustum Y.M. Tumor vascular maturation and improved drug delivery induced by methylselenocysteine leads to therapeutic synergy with anticancer drugs//Clin Cancer Res. 2008. Vol.14(12). P. 3926-3932.
- Bhattacharya A. Methylselenocysteine: a promising antiangiogenic agent for overcoming drug delivery barriers in solid malignancies for therapeutic synergy with anticancer drugs//Expert Opin Drug Deliv. 2011. Vol.8(6). P. 749-763.
- Cao S., Durrani F.A., Rustum Y.M. Selective modulation of the therapeutic efficacy of anticancer drugs by selenium containing compounds against human tumor xenografts//Clin Cancer Res. 2004. Vol.10(7). P. 2561-2569.
- Dayem A.A., H.Y. Choi, G.-M. Yang, K. Kim, S.K. Saha, Cho S.-G. The Anti-Cancer Effect of Polyphenols against Breast Cancer and Cancer Stem Cells: Molecular Mechanisms//Nutrients. 2016. Vol. 8. P.581; DOI: 10.3390/nu8090581
- Dini I., Tenore G.C., Dini A. Chemical composition, nutritional value and antioxidant properties of Allium cepa L. var. tropeae (red onion) seeds//Food Chem. 2008. Vol. 107(2). P. 613-621.
- Fang M.Z., Zhang X., Zarbl H. Methylselenocysteine resets the rhythmic expression of circadian and growth-regulatory genes disrupted by nitrosomethylurea in vivo//Cancer Prev Res (Phila). 2010. Vol. 3(5). P.640-652.
- Fernandes D.A., Souza MS.R., Teles YCF., Oliveira LHG., Lima J.B., Conceiçâo A.S., Nunes F.C., Silva TMS., de Souza MFV. New sulphated flavonoids and larvicidal activity of Helicteres velutina K. Schum (Sterculiaceae//Molecules. 2018. Vol. 22 in press
- Hama H., Jamanoshita O., Chiba M., Takeda I., Nakajima T. Selenium-enriched japanese radish sprouts influence glutathione peroxidase and glutathione S-transferase in an organ-specific manner in rats//J Occupational Health. 2008. Vol. 50. P. 147-154.
- Golubkina N.A., Caruso G. Nutritional Composition, Health Benefits and Antioxidant Properties of Onion//In-Nutritional Composition and Antioxidant Properties of Fruits and Vegetables 1st Edition Paperback ISBN: 9780128127803 Academic Press 1st September 2018.
- Golubkina N.A., Nadezhkin S.M., Agafonov A.F., Kosheleva O.V., Molchanova A.V., Russo G., Cuciniello A., Caruso G. Seed oil content, fatty acids composition and antioxidant properties as affected by genotype in Allium cepa L. and perennial onion species//Advances in Horticultural Science. 2016. Vol. 29(4). P. 199-206.
- Golubkina N.A., Kosheleva O.V., Krivenkov L.V., Dobrutskaya H.G., Nadezhkin S., Caruso G. Intersexual differences in plant growth, yield, mineral composition and antioxidants of spinach (Spinacia oleracea L.) as affected by selenium form//Sci Hort. 2017. Vol. 225. P. 350-358.
- Johnson W.D., Morrissey R.L., Kapetanovic I., Crowell J.A., McCormick D.L. Subchronic oral toxicity studies of Se-methylselenocysteine, an organoselenium compound for breast cancer prevention//Food Chem Toxicol. 2008. Vol. 46(3). P. 1068-1078.
- Kim E.H., Kim S.H., Chung J.I., Chi H.Y., Kim J.A., Chung I.M., Analysis of phenolic compounds and isoflavones in soybean seeds (Glycine max (L.) Merill) and sprouts grown under different conditions//Eur. Food Res. Technol. 2006. Vol. 222. P. 201-208.
- Lee J.T., Lee T.J., Park J.W., Kwon T.K. Se-methylselenocysteine sensitized TRAIL-mediated apoptosis via down-regulation of Bcl-2 expression//Int J Oncol. 2009. Vol. 34(5). P. 1455-1460.
- Li Z., Carrier L., Belame A. Combination of methylselenocysteine with tamoxifen inhibits MCF-7 breast cancer xenografts in nude mice through elevated apoptosis and reduced angiogenesis//Breast Cancer Res Treat. 2009. Vol. 118(1). P. 33-43.
- Lindshield B.L., Ford N.A., Canene-Adams K., Diamond A.M., Wallig M.A., Erdman J.W. Selenium, but not lycopene or vitamin E, decreases growth of transplantable dunning R3327-H rat prostate tumors//PLoS One. 2010. Vol. 5(4). e10423.
- Niedzwiecki A., Roomi M.W., Kalinovsky T., Rath M. Anticancer Efficacy of Polyphenols and Their Combinations//Nutrients. 2016. Vol. 8. 552; DOI: 10.3390/nu8090552
- Pan M.H., Hong H.M., Lin C.L. Se-methylselenocysteine inhibits lipopolysaccharide-induced NF-kappaB activation and iNOS induction in RAW 264.7 murine macrophages//Mol Nutr Food Res. 2011. Vol. 55(5). P. 723-732.
- Penas E., Gomez R., Frias J., Vidal-Valverde C., Application of high-pressure on alfalfa (Medigo sativa) and mung bean (Vigna radiata) seeds to enhance the microbiological safety of their sprouts//Food Control. 2008. Vol. 19. P. 698-705.
- Pilon-Smits E.A.H., Quinn C.F. Selenium Metabolism in Plants. In: Hell R., Mendel RR. (eds) Cell Biology of Metals and Nutrients. Plant Cell Monographs. 2010. Vol. 17. Springer, Berlin, Heidelberg.
- Sangronis E., Machado C.J., Ifluence of germination on the nutritional quality of Phaseolus vulgaris and Cajanus cajan//LWT. 2007. Vol. 40. P. 116-120.
- Sato K., Kudo Y., Muramatsu K. Incorporation of a high level of vitamin B12 into a vegetable, kaiwaredaikon (Japanese radish sprout), by the absorption from its seeds//Biochim Biophys Acta. 2004. Vol. 1672. P. 135-137.
- Scientific opinion of the panel on food additives and nutrient sources added to food on Se-Methyl-L-Selenocysteine as a source of selenium added for nutritional purposes to food supplements following a request from the European Commission//The EFSA J. 2009. Vol. 1067. P. 1-23.
- Srivastava S., Adholeya A., Conlan X.A. and Cahill D.M. Acidic potassium permanganate chemiluminesence for the determination of antioxidant potential in three cultivars of Ocimum basilicum//Plant Foods Hum. Nutr. 2015. Vol. 70(4). DOI 10.1007/s11130-016-0527-8.
- Sugihara S., Kondo M., Chihara I., Yuji M., Hattori H., Yoshida M. Preparation of selenium enriched sprouts and identification of their selenium species by high-performance liquid chromatography -Inductively coupled plasma Mass spectrometry//Biosci. Biotechnol. Biochem. 2004. Vol. 68(1). P. 193-199 DOI: https://doi.org//10.1271/bbb.68.193
- Wang L., Bonorden M.J., Li G.X. Methyl-selenium compounds inhibit prostate carcinogenesis in the transgenic adenocarcinoma of mouse prostate model with survival benefit//Cancer Prev Res (Phila). 2009. Vol. 2(5). P. 484-495.
- Yalcin H., Kavuncuoglu H. Physical, chemical and bioactive properties of onion seef and seeds oil//J.Appl.Botany and Food Quality. 2014 Vol. 87. P. 87-92 DOI: 10.5073/JABFQ.2014.087.013
- Yoshida M., Okada T., Namikawa Y., Matsuzaki Y., Nishiyama T., Fukunaga K. Evaluation of nutritional availability and anti-tumor activity of selenium contained in selenium-enriched kaiware radish sprouts//Biosci. Biotechnol. Biochem. 2007. Vol. 71. P. 2198-2205.
- Zakarova A., Seo J.Y., Kim H.Y., Kim J.H., Shin J-H., Cho K.M., Lee C.H, Kim J.-S. Garlic Sprouting Is Associated with Increased Antioxidant Activity and Concomitant Changes in the Metabolite Profile//J. Agric. Food Chem. 2014. dx.doi.o DOI: rg/10.1021/jf500603v
- Zhan M.G., Liu N., Liu H. Determination of the total mass of antioxidant substances and antioxidant capacity per unit mass in serum using redox titration//Bioinorg. Chem. Appl. 2014 -Article ID 928595, DOI: 10.1155/2014/928595
- Zhang X., Zarbl H. Chemopreventive doses of methylselenocysteine alter circadian rhythm in rat mammary tissue//Cancer Prev Res (Phila). 2008. Vol. 1(2). P. 119-127.


