Перспективы применения ТГЧ-терапии при дентальной имплантации в условиях хронической табачной интоксикации (экспериментальное исследование)
Автор: Булкина Н.В., Макарова Н.И., Иванов П.В., Никишин Д.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Стоматология
Статья в выпуске: 1 т.16, 2020 года.
Бесплатный доступ
Цель: выявить особенности заживления периимплантатных тканей в условиях табачной интоксикации и возможность коррекции изменений с помощью электромагнитного излучения терагерцового диапазона (ЭМИ ТГЧ) на частоте 129,0 ГГц Материал и методы. 36 кроликов разделены на 4 группы: группу контроля и три опытные. В опытных группах смоделирована табачная интоксикация в течение шести недель, затем проводилась имплантация и поддержание табачной интоксикации до выведения животных из эксперимента. В 1-й опытной группе физиотерапевтического воздействия не производилось; во 2-й и 3-й опытных группах использовались различные схемы воздействия ЭМИ ТГЧ. Результаты оценивали с помощью гистологических методов. Результаты. В контрольной группе отмечены наиболее активные процессы регенерации в зоне оперативного вмешательства. Среди опытных групп лучшие показатели достигнуты в группах, где применялось ТГЧ-облучение. Толщина соединительнотканной прослойки через 1 месяц статистически значимо ниже во 2-й и 3-й опытных группах, составив 48,0±3,9 и 42,7±3,4 мкм соответственно, чем в 1-й группе: 76,4±3,5 мкм (р
Дентальная имплантация, курение, регенерация, терагерцовое облучение
Короткий адрес: https://sciup.org/149135539
IDR: 149135539 | УДК: 616.314-089.843
Текст научной статьи Перспективы применения ТГЧ-терапии при дентальной имплантации в условиях хронической табачной интоксикации (экспериментальное исследование)
1 Введение. Табакокурение является важной проблемой для здравоохранения Российской Федерации и большинства стран мира. Несмотря на меры, предпринимаемые в последние десятилетия для борьбы с курением, распространенность этой пагубной привычки все еще чрезвычайно велика. По опубликованным Всемирной организацией здравоохранения в 2019 г. данным, в мире насчитывается около 1,1 млрд курильщиков. Ежегодно от заболеваний, ассоциированных с курением, умирают более 8 млн человек, из них около 1,2 млн гибнут вследствие пассивного курения [1].
По различным оценкам, в России смертность от проблем, связанных с курением, варьируясь по годам, составляет от 300 тыс. до 500 тыс. человек ежегодно [2].
Курение табака является фактором риска развития и прогрессирования заболеваний сердечно-сосудистой, дыхательной, пищеварительной систем, повышает вероятность развития онкопатологии, проблем репродуктивной сферы и опорно-двигательного аппарата [3]. Известно, что хроническое воздействие табачного дыма приводит к снижению минеральной плотности костной ткани, повышению риска возникновения переломов и замедлению сроков их заживления [4].
Стоматологический статус курильщиков также находится под ударом. Помимо прямого повреждающего воздействия высокой температуры и местнораздражающего действия токсичных компонентов табачного дыма (формальдегида, аммиака, синильной кислоты и др.), известно его негативное влияние на состояние сосудов микроциркуляторного русла. Вазоспазм, снижение макрофагальной активности, провоцируемые никотином, ослабляют защитные механизмы пародонта и слизистой оболочки ротовой полости, обусловливая более тяжелое течение воспалительных процессов, их большую резистентность к терапии и развитие осложнений, в том числе потерю зубов [3, 5].
Потребление табака затрудняет стоматологическую реабилитацию пациентов с дефектами зубного ряда. Курение на протяжении десятилетий рассматривается как один из самых часто упоминаемых факторов риска при дентальной имплантации. У курильщиков отмечается более выраженная утрата маргинальной костной ткани, худшее качество костной ткани и более высокий риск развития периим-плантита. Вероятность неудачи имплантологического лечения в первые три года у пациентов с табачной зависимостью, по данным различных исследователей, может в 1,5–1,7 раза превышать таковую у некурящих [6–8].
Цель: выявить особенности заживления тканей вокруг дентального имплантата в условиях табачной интоксикации и возможность коррекции изменений, вызванных воздействием табачного дыма, с помощью электромагнитного излучения терагерцового диапазона на частоте молекулярного спектра излучения и поглощения атмосферного кислорода 129,0 ГГц.
Материал и методы. Исследование проводилось на 36 кроликах-самцах новозеландской породы массой 3000–3500 г, разделенных на 4 группы по 9 животных. В трех опытных группах смоделирована хроническая табачная интоксикация в течение 6 не-
дель до имплантации и после нее, до выведения животных из эксперимента. С целью создания условий хронической табачной интоксикации использовали известную модель [9]: ежедневно кроликов помещали в камеру с приточно-вытяжной вентиляцией, куда нагнетался табачный дым, на 7 минут через каждые полчаса в течение 6 часов в день. Все животные во время проведения эксперимента находились в одинаковых условиях: при температуре 20±2 С° и 12-часовом освещении, со свободным доступом к пище и воде, в условиях вивария ООО «Центр доклинических исследований» (г. Пенза).
Все эксперименты выполнены в соответствии с приказом Минздрава СССР от 12 августа 1977 г. №755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» (по состоянию на 20 марта 2016 г.), Федеральным законом от 1 декабря 1999 г. «О защите животных от жестокого обращения», Женевской конвенцией «Internetional Guiding Principals for Biomedical Involving Animals» (Geneva, 1990), Хельсинкской декларацией о гуманном отношении к животным, а также рекомендациями комитета по этике ФГБОУ ВО «Саратовский государственный медицинский университет им. В. И. Разумовского» Минздрава России (протокол № 2 от 01.10.2019 г.).
После шести недель моделирования хронической табачной интоксикации животным трех опытных и контрольной групп под общей анестезией (золетил 100: 0,1 мл/кг массы животного внутримышечно; кси-лазин 2%: 0,4 мл/кг массы животного внутримышечно; пропофол для поддержания сна в дозе 0,5 мл/кг массы животного в час) и местной анестезией (р-р убистезин 4%) проводилось удаление резца нижней челюсти на произвольно выбранной стороне, препарирование лунки с помощью набора фрез Dio (Dio Corporation, Южная Корея) с водным охлаждением стерильным физиологическим раствором и выполнялась одномоментная установка дентального имплантата Dio (Dio Corporation, Южная Корея). После этого на слизистую краев раны накладывали швы материалом капроаг 4/0 (ООО «Репромед», Россия).
В контрольной и 1-й опытной группах животные не получали физиотерапевтического воздействия. Во 2-й опытной группе производилось воздействие на слизистую в зоне предполагаемого оперативного вмешательства электромагнитного излучения тера-герцового диапазона на частотах (ЭМИ ТГЧ) молекулярного спектра излучения и поглощения (МСИП) атмосферного кислорода 129,0 ГГц при выходной мощности 250 мкВт в течение 15 минут, 1 раз в сутки, курсом 10 процедур, 5 дней до дентальной имплантации и 5 дней в послеоперационном периоде. В 3-й опытной группе производилось комплексное воздействие ЭМИ ТГЧ на частоте МСИП атмосферного кислорода 129,0 ГГц путем облучения слизистой в зоне предполагаемой дентальной имплантации и кожи в проекции мечевидного отростка грудины, в режиме по 15 минут в каждой локализации, 1 раз в сутки, курсом 10 процедур, 5 дней до дентальной имплантации и 5 дней в послеоперационном периоде. Для проведения ТГЧ-облучения применяли аппарат КВЧ-терапии «Орбита» (ОАО «Центральный научноисследовательский институт измерительной аппаратуры», г. Саратов).
Выведение животных из эксперимента производилось по 3 особи из каждой группы на 14-е, 30-е и 90-е сутки после оперативного вмешательства путем передозировки эфирного наркоза. Осуществлялся забор фрагмента нижней челюсти животного, содержащего установленный дентальный имплантат. Полученный материал фиксировали в 10%-м растворе нейтрального формалина, декальцинировали в растворе 6,5%-й азотной кислоты, затем проводили по спиртам возрастающей концентрации. После декальцинации из фрагмента челюсти удаляли дентальный имплантат механическим путем, осуществляли заливку в парафин и получали срезы толщиной 7 мкм, с последующей окраской гематоксилином и эозином, а также по методу Ван Гизона. Производилось изучение микропрепаратов, выполнялась микроморфометрия в зоне контакта дентального имплантата с костной тканью с помощью микроскопа МИКМЕД v. 6.6.
Полученные данные подвергались статистической обработке с использованием статистических пакетов Statistica v. 7. Для проверки нормальности распределения использован критерий Шапиро — Уилка. Все описанные в данной работе параметры имели распределение близкое к нормальному. Для каждого параметра рассчитывали минимальное (Min) и максимальное (Max) значения, среднюю арифметическую (M), ошибку средней арифметической (m), коэффициент вариации (Cv).
Значимость различий между группами определяли с помощью параметрического критерия Фишера и непараметрического критерия Колмогорова — Смирнова. Различия считали значимыми при 95%-м пороге вероятности (p<0,05). Полученные морфометрические данные исследованы также с помощью парного непараметрического корреляционного анализа (по Спирмену).
Результаты. При морфологическом исследовании материалов, полученных у животных на 14-е сутки после оперативного вмешательства, во всех группах наблюдаются признаки дистрофии в области края имплантата.
В препаратах животных контрольной группы отмечается слабо выраженная лимфогистиоцитарная инфильтрация. Соединительная ткань составляет всего 29,2±2,7%. В непосредственной близости от имплантата начинает формироваться новообразованная костная ткань (остеоид), причем степень зрелости костной ткани увеличивается по мере удаления от дефекта. Объемная доля остеоида в образцах составляет 9,9±0,6%, а зрелой костной ткани 40,4±2,3%. Средняя толщина соединительнотканной прослойки между имплантатом и окружающей костной тканью достигает 43,8±4,1 мкм. Сосудистый компонент составляет до 3,4±0,6%.
У животных 1-й опытной группы отмечается выраженная лимфогистиоцитарная инфильтрация. Грубоволокнистая соединительная ткань формируется в небольшом объеме. В более глубоких отделах начинает формироваться новообразованная грубоволокнистая соединительная ткань, причем зрелость ее увеличивается по мере удаления от дефекта. Объемная доля соединительной ткани достигает 34,6±2,3%, остеоида 8,3±0,4%, зрелой костной ткани всего 33,0±1,5%. Средняя толщина соединительнотканной прослойки 51,8±3,4 мкм. Объемная доля кровеносных сосудов составляет до 2,0±0,2%, что является минимальным значением среди всех групп.
Во 2-й и 3-й опытных группах определяется умеренная лимфогистиоцитарная инфильтрация. Грубоволокнистая соединительная ткань формируется в обеих группах в большем объеме. В более глубоких отделах начинает формироваться новообразованная костная ткань, с увеличением ее зрелости по мере удаления от дефекта.
При морфометрии препаратов, полученных во 2-й группе, объемная доля соединительной ткани составляет 38,4±2,5%, остеоида 9,2±0,4%, зрелой костной ткани 36,7±1,7%. В 3-й группе объемная доля соединительной ткани составляет 34,2±2,2%, остеоида 10,3±0,5%, зрелой костной ткани 41,1±1,9%. Средняя толщина соединительной ткани во 2-й группе 57,6±3,7 мкм, в 3-й группе 51,3±3,3 мкм. Объемная доля кровеносных сосудов достигает 2,5±0,27% во 2-й группе, а в 3-й группе 2,9±0,3%. У животных 3-й группы в образовавшейся грануляционной ткани отмечается выраженный неоангиогенез.
На сроке 14 дней хрящевая ткань не наблюдалась в материалах ни одной группы (рис. 1).
Через 1 месяц после операции у животных контрольной группы в области края титанового имплантата начинает формироваться первичная костная мозоль, состоящая из грубоволокнистой
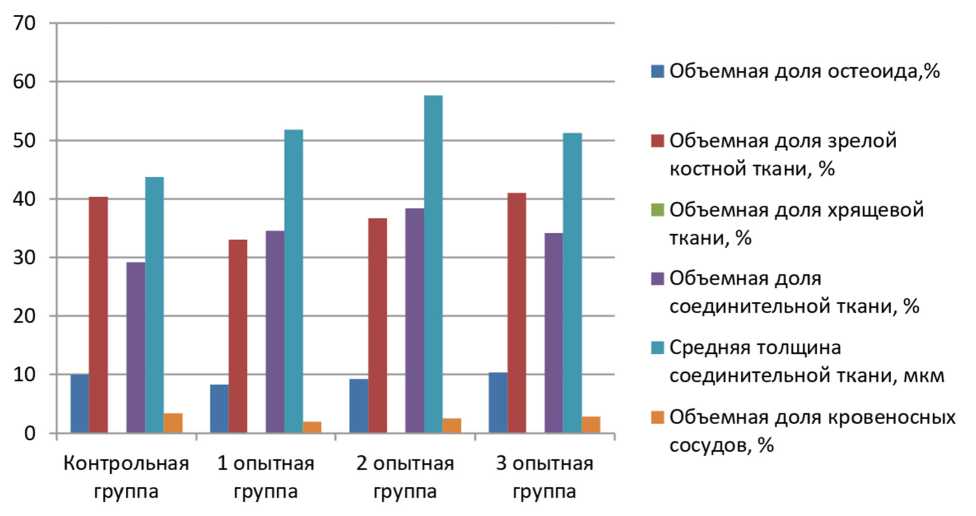
Рис. 1. Соотношение компонентов периимплантатных тканей в группах на сроке 14 суток после имплантации
соединительной ткани и остеоида. Объемная доля остеоида статистически значимо (p<0,05) возрастает до 17,1±0,9%, а доли соединительной ткани и зрелой костной ткани уменьшаются до 22,4±2,4% (p>0,05) и 39,8±2,0% (p>0,05) соответственно. Фокусы хрящевой ткани и отдельные хондроциты не выявляются. Толщина соединительнотканной прослойки снижается, составляя 33,6±3,6 мкм (p<0,05). Объемная доля кровеносных сосудов увеличивается до 6,8±0,7% (p<0,05).
На 30-е сутки в 1-й опытной группе в области края титанового имплантата грубоволокнистая соединительная ткань имеет тенденцию к увеличению, хрящевая ткань и остеоид встречаются на значительном удалении от края имплантата. Отмечается увеличение остеоида до 13,0±0,8% (p<0,05) и соединительной ткани до 48,8±2,4% (p<0,05), в то время как зрелая костная ткань демонстрирует тенденцию к снижению до 30,4±1,9% (p>0,05). В препаратах выявляется хрящевая ткань, занимающая до 7,6±1,9% от общей площади контакта костной ткани с имплантатом. Средняя толщина соединительной ткани возрастает до 76,4±3,45 мкм (p<0,05). В толще соединительнотканной капсулы обнаруживаются групповые новообразованные кровеносные сосуды, отмечается увеличение объемной доли кровеносных сосудов.
В препаратах 2-й опытной группы через 1 месяц после операции в области края титанового имплантата начинает формироваться первичная костная мозоль, состоящая из грубоволокнистой соединительной ткани, хрящевой ткани и остеоида. При этом объемная доля остеоида возрастает до 14,5±0,9% (p<0,05), доли соединительной и зрелой костной тканей снижаются до 32,0±2,6% (p<0,05) и 33,8±2,08% (p>0,05). В толще соединительнотканной мозоли можно обнаружить множественные хрящевые клетки — хондроциты, начинающие образовывать изогенные группы, и формируется хрящевой матрикс. Хрящевая ткань составляет до 8,4±2,1%. Средняя толщина соединительнотканной прослойки уменьшается, составляя 48,0±3,9 мкм (p<0,05). Объемная доля сосудов возрастает до 3,7±0,5% (p<0,05).
На 30-е сутки у животных 3-й группы в области края титанового имплантата также начинает формироваться первичная костная мозоль, состоящая из грубоволокнистой соединительной ткани, хрящевой ткани и остеоида. Отмечается более значительное увеличение доли остеоида, до 16,4±1,0% (p<0,05) при снижении объема соединительной и зрелой костной тканей до 28,5±2,3% (p<0,05) и 38,4±2,3% (p>0,05) соответственно. В толще соединительнотканной мозоли можно обнаружить единичные хондроциты, начинающие образовывать изогенные группы. При этом объемная доля хрящевой ткани составляет лишь 0,7±0,3%. Отмечается увеличение доли кровеносных сосудов до 4,3±0,5% (p<0,05) (рис. 2).
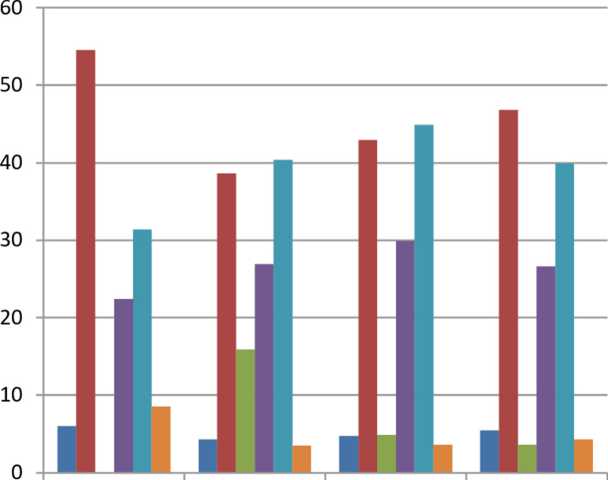
На 90-е сутки после операции имплантации в группе контроля наблюдается дальнейшее созревание и формирование костной ткани вокруг титанового имплантата. Соединительнотканный компонент в большей степени замещается костным комплексом, состоящим из остеоида и зрелой костной ткани, начинаются выраженные процессы ремоделирования остеоида. При этом объемная доля остеоида уменьшается до 6,1±0,3% (p<0,05), соединительная ткань остается практически на прежнем уровне: 22,4±2,1%, а зрелая костная ткань, наоборот, возрастает до 54,5±2,6% (p<0,05). Хрящевых фокусов и хондроцитов в исследуемом материале не выявляется. Толщина соединительнотканной прослойки продолжает уменьшаться, составляя 31,4±2,9 мкм (p>0,05). Объемная доля кровеносных сосудов возрастает до 8,5±1,4% (p<0,05).
В новообразованных костных балках определяется значительное количество остеобластов и остеокластов, что свидетельствует об активных процессах ремоделирования и формировании зрелой костной ткани.
В 1-й опытной группе через 3 месяца после оперативного вмешательства наблюдается дальнейшее созревание и формирование грубоволокнистой соединительной ткани вокруг титанового имплантата. Соединительнотканный компонент в меньшей степени представлен костно-хрящевым комплексом, на-
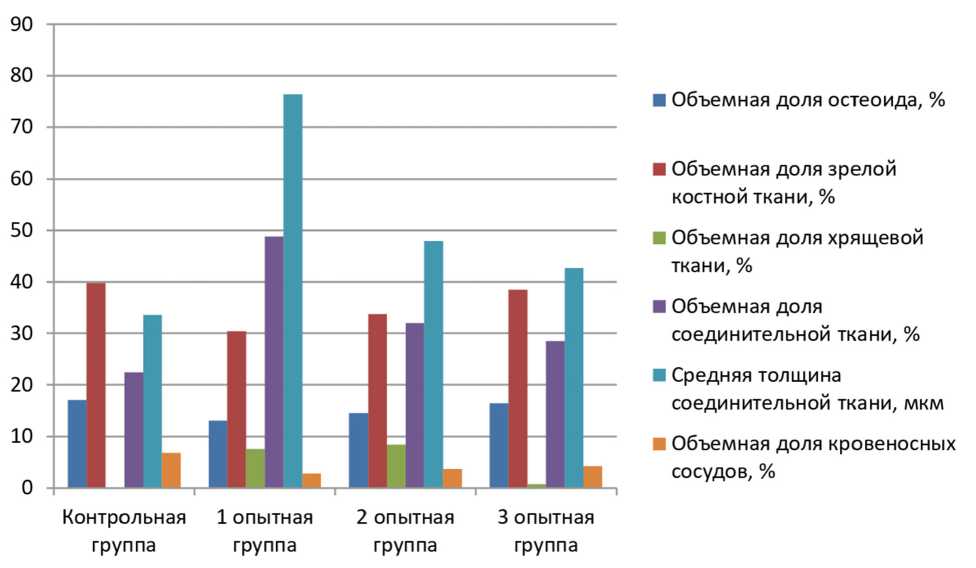
Рис. 2. Соотношение компонентов периимплантатных тканей в группах на сроке 30 суток после имплантации
чинаются слабые процессы ремоделирования остеоида. Объемные доли остеоида и соединительной ткани статистически значимо (p<0,05) уменьшаются до 4,3±0,3 и 26,9±1,9% соответственно, отмечается увеличение зрелой костной ткани до 38,7±2,5% (p<0,05). Однако в отдельных участках мозоли фиксируются небольшие области гиалинового хряща. Хрящевая ткань при морфометрии составляет до 15,9±1,3% (p<0,05), достигая максимума среди всех групп. Средняя толщина соединительной ткани снижается до 40,4 ±2,9 мкм (p<0,05). Объемная доля кровеносных сосудов составляет 3,5±0,6%.
В новообразованных костных балках регистрируется незначительное количество остеобластов и остеокластов, что свидетельствует о слабых процессах ремоделирования костной ткани и формировании зрелой костной ткани.
Во 2-й опытной группе на сроке 3 месяца наблюдается дальнейшее созревание и формирование костной ткани вокруг титанового имплантата. Соединительнотканный компонент в большей степени замещается костно-хрящевым комплексом, начинаются средневыраженные процессы ремоделирования остеоида. Доли остеоида и соединительной ткани уменьшаются до 4,8±0,3% (p<0,05 значимо) и 29,9±2,2% (p>0,05) соответственно, в то время как зрелая костная ткань возрастает до 43,0±2,8% (p<0,05 значимо). Однако в отдельных участках мозоли отмечаются небольшие области гиалинового хряща. Хрящевая ткань составляет до 4,9±0,9% (p<0,05). Средняя толщина соединительнотканной прослойки сокращается до 44,9±3,3 мкм (p>0,05). Также наблюдается некоторое уменьшение объемной доли кровеносных сосудов: до 3,6±0,5% (p>0,05).
В новообразованных костных балках фиксируется значительное количество остеобластов и остеокластов, что свидетельствует о процессах ремоделирования костной ткани и формировании зрелой костной ткани.
На 90-е сутки после оперативного вмешательства в материалах 3-й опытной группы наблюдается дальнейшее созревание и формирование костной ткани вокруг титанового имплантата. Соединительнотканный компонент в большей степени замещается костно-хрящевым комплексом, начинаются средневыраженные процессы ремоделирования остеоида. Объемные доли остеоида и соединительной ткани статистически незначимо (p>0,05) снижаются до 5,5±0,4 и 26,6±1,9% соответственно, а доля зрелой костной ткани возрастает до 46,8±3,1% (p<0,05). Однако в отдельных участках мозоли отмечаются единичные островки хряща, хрящевая ткань составляет до 3,6±0,03%. Средняя толщина соединительной ткани продолжает снижаться, составив 39,9±2,9 мкм (p<0,05). Объемная доля кровеносных сосудов показывает некоторое повышение до 4,3±0,6% (p<0,05).
В новообразованных костных балках обнаруживается значительное количество остеобластов и остеокластов, что свидетельствует о процессах ремоделирования костной ткани и формировании зрелой костной ткани (рис. 3).
Обсуждение. На 14-е сутки во всех исследуемых материалах выявлены признаки дистрофии и воспалительные изменения, что является физиологической реакцией на операционную травму. Однако выраженность лимфогистиоцитарной инфильтрации варьировалась в разных группах: в контрольной группе оценивалась как слабая; в 1-й опытной группе, где животные подвергались хронической табачной интоксикации без ТГЧ-терапии, была наиболее выражена; во 2-й и 3-й группах, где применялись различные режимы ТГЧ-облучения, оказалась умеренной, что показывает противовоспалительный эффект данного метода [10, 11].
Анализ данных морфометрии показывает, что в период с 14 до 30 суток после операции во всех группах происходило увеличение количества остеоида и снижение объема зрелой костной ткани. Данные изменения объясняются резорбцией зрелой костной ткани вследствие операционной травмы и давления имплантата на кость, а также началом формирования новообразованной костной ткани. При этом признаки резорбции наиболее выражены в 1-й опытной группе, а в группе контроля
Контрольная 1 опытная 2 опытная 3 опытная группа группа группа группа
-
■ Объемная доля остеоида, %
-
■ Объемная доля зрелой костной ткани, %
-
■ Объемная доля хрящевой ткани, %
-
■ Объемная доля соединительной ткани,%
-
■ Средняя толщина соединительной ткани, мкм
-
■ Объемная доля кровеносных сосудов, %
Рис. 3. Соотношение компонентов периимплантатных тканей в группах на сроке 90 суток после имплантации
определялись умеренно выраженные признаки резорбции зрелой костной ткани. Наиболее близкие к контролю значения продемонстрированы в 3-й опытной группе, где применялся комплексный режим ТГЧ-воздействия.
Средняя толщина соединительнотканной прослойки между имплантатом и окружающей костной тканью достигала максимума на 14-е сутки с последующим снижением в контрольной, 2-й и 3-й опытных группах. В 1-й опытной группе не только достигнуты наивысшие значения данного показателя, но и отмечалась волнообразная динамика с пиком на 30-е сутки.
Среди опытных групп наиболее активные процессы регенерации и оссификации в области оперативного вмешательства наблюдались в группах, где применялась ТГЧ-терапия. При этом остеогенез происходил с меньшим образованием хрящевой ткани, что свидетельствует о более благоприятных условиях для заживления костной ткани [10, 12].
Объемная доля кровеносных сосудов имела тенденцию к увеличению во всех группах с 2 недель до 3 месяцев. Максимальные значения сосудистого компонента наблюдались в контрольной группе, где животные не подвергались воздействию табачного дыма, а минимальные — в 1-й опытной группе, что, видимо, объясняется вазоспазмом сосудов в результате хронической табачной интоксикации [9]. Воздействие терагерцового облучения на частоте атмосферного кислорода 129,0 ГГц позволило несколько скорректировать данный показатель, причем лучшие результаты достигнуты в 3-й опытной группе.
Заключение. Полученные экспериментальные данные показывают, что хроническое воздействие табачного дыма приводит к снижению активности процессов регенерации и образования новой костной ткани, а также провоцирует вазоспазм, ухудшая трофику тканей в зоне имплантации. Применение протоколов ТГЧ-облучения на частоте атмосферного кислорода 129,0 ГГц позволяет частично компенсировать негативное влияние хронической табачной интоксикации и стимулировать остеогенез и созревание костной ткани вокруг дентального имплантата. Наиболее перспективно применение комплексного режима ТГЧ-терапии, включающего локальное и системное воздействие на гемодинамику, что обеспечивает более быстрое течение регенераторных процессов, улучшая интеграцию дентального имплантата в костной ткани.
Список литературы Перспективы применения ТГЧ-терапии при дентальной имплантации в условиях хронической табачной интоксикации (экспериментальное исследование)
- WHO: Report on the Global Tobacco Epidemic, 2019. Geneva: World Health Organization, 2019.
- Safyanova NV, Chukhlovin AB, Shaporova NL, et al. The possibility of creating an experimental model to study the effects of smoking on the P1-, p2-adrenergic receptors, M-cholinergic receptors of blood vessels and bronchi. Regional blood circulation and microcirculation 2013; 12 (2): 64-73. Russian (Сафьянова Н. В., Чухловин А. Б., Шапорова Н. Л. и др. Возможности создания экспериментальной модели для изучения влияния табакокурения на в-адренорецепторы и М-холинорецепторы сосудов и бронхов. Регионарное кровообращение и микроциркуляция 2013; 12 (2): 64-73).
- Soldatova YuO, Bulgakova AI, Gantseva HH, Khismatullina FR. Investigation of the effect of smoking on oral health indicators and the relationship amount of carbon monoxide from smoking experience. Periodontology 2016; 21 (1): 26-9. Russian (Солдатова Ю. О., Булгакова А. И., Ганцева Х. Х., Хисматуллина Ф. Р. Исследование влияния табакокурения на показатели стоматологического здоровья и взаимосвязи количества выделяемого угарного газа со стажем курения. Пародонтология 2016; 21 (1): 26-9).
- AL-Bashaireh AM, Haddad LG, Weaver M, et al. The effect of tobacco smoking on musculoskeletal health: a systematic review. Journal of Environmental and Public Health 2018; 018: 4184190.
- Silin AV, Nekhoroshev AS, Danilova NB, et al. Modern view on dental status in smokers according to preventive medicine. Preventive and clinical medicine 2018; 1 (66): 5-10. Russian (Силин А. В., Нехорошев А. С., Данилова Н. Б. и др. Современный взгляд на стоматологический статус курильщиков с точки зрения профилактической медицины. Профилактическая и клиническая медицина 2018; 1 (66): 5-10).
- Takamiya AS, Goiato MC, Gennari FH. Effect of smoking on the survival of dental implants. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2014; 158 (4): 650-3.
- Mumcu E, Beklen A. The effect of smoking on the marginal bone loss around implant-supported prostheses. Tobacco Induced Diseases 2019; 17: 43.
- Ivanov PV, Makarova NI, Bulkina NV, Zyulkina LA. Modern views on the osseointegration of dental implants (literature review). University proceedings: Volga region: Medical sciences 2018; 4 (48): 191-202. Russian (Иванов П. В., Макарова Н. И., Булкина Н. В., Зюлькина Л. А. Современные представления об остеоинтеграции дентальных импланта-тов (обзор литературы). Известия высших учебных заведений: Поволжский регион: Медицинские науки 2018; 4 (48): 191-202).
- Yen CY, Tu YK, Ma CH, et al. Measurement of tibial endothelial cell function after cigarette smoking, cessation of smoking and hyperbaric oxygen therapy. Injury 2008; Suppl 4: 40-6.
- Bulkina NV, Zyulkina LA, Ivanov PV, Vedyaeva AP. Experimental validation of application of new xenogenic biomaterials for reconstructive dental procedures in conditions of chronic inflammation. Periodontology 2017; 3 (84): 69-72. Russian (Булкина Н. В., Зюлькина Л. А., Иванов П. В., Ведяе-ва А. П. Экспериментальное обоснование применения новых ксеногенных биоматериалов при реконструктивных стоматологических вмешательствах в условиях хронического воспаления. Пародонтология 2017; 3 (84): 69-72).
- Zelenova AV, Bulkina NV, Olenko ES, Tokmakova EV. The effectiveness of electromagnetic terahertz radiation use in the treatment of patients with rapidly progressive periodontitis. Saratov Journal of Medical Scientific Research 2015; 11 (4): 556-561. Russian (Зеленова А. В., Булкина Н. В., Оленко Е. С., Токмакова Е. В. Эффективность использования электромагнитного облучения терагерцевого диапазона в комплексной терапии больных быстропрогрессирующим пародонтитом. Саратовский научно-медицинский журнал 2015; 11 (4): 556-61).
- Zyulkina LA. Strategy of planning reconstructive dental interventions in various functional states of the oral microcirculation system: DSc diss. Saratov, 2018; 282 p. Russian (Зюлькина Л. А. Стратегия планирования реконструктивных стоматологических вмешательств при различных функциональных состояниях системы микроциркуляции полости рта: дис. ... д-ра мед. наук. Саратов, 2018; 282 с.).


