Первая успешная высокодозная химиотерапия с аутологичной трансплантацией кроветворных стволовых клеток при лимфоме Ходжкина у больного с вич-инфекцией
Автор: Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.19, 2024 года.
Бесплатный доступ
Риск развития лимфомы Ходжкина (ЛХ) у ВИЧ-инфицированных пациентов в 5-26 раз выше по сравнению с общей популяции. У пациентов с ВИЧ ЛХ может развиваться даже при умеренном снижении иммунитета, несмотря на прием антиретровирусной терапии. В статье рассматривается современная тактика лечения ЛХ у ВИЧ-инфицированных пациентов, а также описывается первый успешный опыт проведения высокодозной химиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток (ВДХТ+аутоТГСК) у ВИЧ-инфицированного пациента в клинике гематологии ФГБУ «НМХЦ им Н. И. Пирогова». Наше клиническое наблюдение подтверждает эффективность и безопасность ВДХТ+аутоТГСК при лечении рецидивов и рефрактерных форму ЛХ у пациентов с ВИЧ-инфекцией.
Вич-инфекция, лимфома ходжкина, аутологичная трансплантация гемопоэтических стволовых клеток
Короткий адрес: https://sciup.org/140308710
IDR: 140308710 | DOI: 10.25881/20728255_2024_19_4_159
Текст научной статьи Первая успешная высокодозная химиотерапия с аутологичной трансплантацией кроветворных стволовых клеток при лимфоме Ходжкина у больного с вич-инфекцией
ВИЧ-инфекция – медленно прогрессирующее антропонозное заболевание с контактным механизмом передачи, характеризующееся специфическим поражением иммунной системы с развитием синдрома приобретенного иммунодефицита (СПИД).
Онкологические заболевания развиваются у 9–30% пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ) [1]. ВОЗ классифицирует злокачественные новообразования у ВИЧ-инфицированных на две группы: связанные со СПИД (СПИД-ассоциированные опухоли) и не связанные с развитием СПИД (СПИД-неассоциированные опухоли) [2]. Согласно классификации СDC (1993) (Centers for Disease Control and Prevention – Центры по контролю и профилактике заболеваний) к СПИД-ассоциированным опухолям относится саркома Капоши, неходжкинские лимфомы (лимфома Беркитта, плазмобластная лимфома, первичная лимфома центральной нервной системы) и рак шейки матки [3].
Лимфома Ходжкина (ЛХ) – злокачественное лимфопролиферативное заболевание как результат моноклональной пролиферации зрелых В-лимфоцитов в зародышевом центре фолликула лимфа- тического узла. ЛХ не считается СПИД-ассоциированной опухолью [4]. Однако у ВИЧ-инфицированных пациентов вероятность развития ЛХ повышается в 5–26 раз по сравнению с общей популяцией, и по данным международных исследований заболеваемость возрастает до 50 случаев на 100000 человек в год [5; 6].
У ВИЧ-инфицированных пациентов ЛХ обычно не связана с тяжелым иммунодефицитом и может возникать даже при умеренном нарушении иммунного статуса на фоне приема антиретровирусной терапии (АРТ) [4].
Развитие ЛХ у ВИЧ-инфицированных пациентов тесно связано с инфекцией вирусом Эпштейна-Барр (ВЭБ). Исследования показывают, что у 80–100% ВИЧ-положительных пациентов с ЛХ выявляется инфекция ВЭБ, в то время как у ВИЧ-отрицательных пациентов ВЭБ диагностируется всего в 30–40% случаев [7]. При ВЭБ инфекции в клетке и на ее поверхности экспрессируются вирусные белки, которые через активацию сигнальных путей увеличивают пролиферацию В-лимфоцитов и препятствует их апоптозу, тем самым повышая вероятность онкогенного события [8; 9]. Кроме того, ВЭБ индуцирует сверхэкспрессию PD-L1
на поверхности клеток Рид – Штернберга, являющихся опухолевым субстратом ЛХ. Это приводит к ускользанию опухолевых клеток от иммунного надзора [10]. При этом ВИЧ и кодируемые им белки также способствуют пролиферации и активации В-клеток путем хронической антигенной стимуляции [4]. Таким образом, совместное онкогенное действие ВЭБ и ВИЧ приводит к более высокому риску развития ЛХ у ВИЧ-инфицированных пациентов.
Согласно классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ (2022), выделяют два основных типа ЛХ: классическую ЛХ и нодулярную с лимфоидным преобладанием ЛХ [11]. Нодулярная с лимфоидным преобладанием ЛХ является самостоятельной редкой лимфомой с иным, чем у классической ЛХ, патогенезом и иммунофенотипом и не встречается у пациентов с ВИЧ [11].
У ВИЧ-инфицированных пациентов наиболее часто диагностируется смешанно-клеточный вариант классической ЛХ. В общей популяции же преобладает вариант с нодулярным склерозом, составляющий до 70% всех случаев [12–15]. Несмотря на различия в частоте встречаемости гистологических вариантов, морфологическая картина ЛХ у ВИЧ-положительных и

Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
ПЕРВАЯ УСПЕШНАЯ ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ЛИМФОМЕ ХОДЖКИНА У БОЛЬНОГО С ВИЧ-ИНФЕКЦИЕЙ
ВИЧ-отрицательных пациентов схожа [4].
У ВИЧ-инфицированных пациентов с ЛХ чаще наблюдаются симптомы опухолевой интоксикации: лихорадка выше 38 °С не менее трех суток подряд без признаков воспаления, ночные профузные поты, потеря веса на 10% от массы тела за последние 6 месяцев [16; 17]. Также у этой группы пациентов чаще диагностируется распространенная стадия заболевания и экстранодальные поражения [4; 15].
Первая линия терапии ЛХ у ВИЧ-инфицированных пациентов
Лечение ЛХ у ВИЧ-инфицированных пациентов должно проводиться на фоне постоянного приема АРТ. Исследование группой GESIDA, продемонстрировало, что применение АРТ у пациентов с первичной ЛХ приводит к значительному улучшению результатов лечения. В группе пациентов, получавших АРТ, наблюдался более высокий показатель полных ремиссий (91% против 70% в группе без АРТ) и более длительная медиана общей выживаемости (ОВ) (медиана не достигнута против 39 месяцев) [18].
В эпоху широкого применения АРТ результаты лечения ЛХ у ВИЧ-инфицированных пациентов стали сопоставимы с результатами лечения ВИЧ-отрица-тельных пациентов [19–21]. Преобладание смешанно-клеточного варианта заболевания, а также наблюдающиеся у
ВИЧ-инфицированных характеристики агрессивного течения ЛХ (B-симптомы, распространенная стадия, наличие экс-транодальных поражений) статистически значимо не влияют на исходы лечения, поэтому рекомендации по лечению ЛХ у пациентов с ВИЧ-инфекцией не отличаются от рекомендаций для общей популяции. Стандартные схемы полихимиотерапии (ПХТ) первой линии ABVD (доксорубицин, блеомицин, винбластин и дакарбазин) и BEACOPP-подобные режимы (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин, преднизон) демонстрируют аналогичную высокую эффективность у ВИЧ-инфицированных пациентов (табл. 1).
Табл. 1. Эффективность режимов химиотерапии первой линии лечения ЛХ у ВИЧ-инфицированных пациентов в эпоху АРТ
|
Автор |
Тип исследования |
Режим химиотерапии |
Кол-во пациентов |
Медиана возраста больных, лет (интервал) |
Стадия |
Медиана количества CD4+ клеток/ мкл (интервал) |
Частота полных ремиссий (%) |
Выживаемость (%) |
Общая выживаемость (%) |
|
Hartmann и соавт., 2003 [25] |
Проспективное |
BEACOPP |
12 |
33 (22–49) |
III–IV |
205 (110–1020) |
100 |
70 (5-летняя DFS) |
70 (5-летня) |
|
Xicoy и соавт., 2007 [24] |
Проспективное |
ABVD |
51 |
37 (24–61) |
II–IV |
129 (5–1209) |
87 |
95 (5-летняя EFS) |
76 (5-летняя) |
|
Montoto и соавт., 2012 [19] |
Ретроспективное |
ABVD |
93 |
41 (26–73) |
I–IV |
Нет данных |
74 |
59 (5-летняя EFS) |
81 (5-летняя) |
|
Hentrich и соавт., 2012 [26] |
Проспективное |
Стадия-адаптированное лечение: BEACOPP-21 или ABVD |
108 |
44 (27–70) 3 |
III–IV |
240 (7–967) 3 |
86 1 |
87.5 (2-летняя PFS) |
87 (2-летняя) |
|
Castillo и соавт., 2015 [6] |
Ретроспективное |
ABVD |
229 |
Нет данных |
III–IV |
Нет данных |
83 |
69 (5-летняя PFS) |
78 (5-летняя) |
|
Besson и соавт., 2015 [20] |
Проспективное |
ABVD (96%) |
68 |
44 (38–48) |
I–IV |
387 (151–540) |
Нет данных |
89 (2-летняя PFS |
94 (2-летня) |
|
Sorigu e и соавт., 2017 [21] |
Ретроспективное |
ABVD |
21 |
40 (18–56) |
III–IV |
Нет данных |
89 |
70 (10-летняя DFS) |
73 (10-летня) |
|
Rubinstein и соавт., 2023 [27] |
Проспективное |
BV+AVD |
41 |
Нет данных |
II–IV |
Нет данных |
90 |
87 (2-летняя PFS |
92 (2-летня |
|
Mponda и соавт., 2024 [28] |
Проспективное |
ABVD |
11 |
39 (32–42) |
I–IV |
179 (102–298) |
100 |
79 (2-летняя PFS |
80 (2-летня) |
|
Hentrich и соавт., 2024 [15] |
Проспективное |
Ранние стадии благоприятный прогноз: 2–4 цикла ABVD +30 ГР СОД |
23 |
43,9 (27–70) |
I–IV |
240 (7–967) |
Нет данных |
87 (10-летняя PFS) |
95,7 (10-летняя) |
|
Ранние стадии неблагоприятный прогноз: 4 цикла BEACOPP-21 или 4 цикла ABVD +30 ГР СОД |
14 |
Нет данных |
85,1 (10-летняя PFS) |
84,6 (10-летняя) |
|||||
|
Распространенные стадии: 6–8 циклов BEACOPP-21 |
71 |
Нет данных |
66,9 (10-летняя PFS) |
76,1 (10-летняя) |
|||||
|
Souza и соавт., 2024 [16] |
Метаанализ |
38882 |
Нет данных |
I–IV |
Нет данных |
Нет данных |
79 (5-летняя) |
92 (2-летняя) 79 (5-летняя) |
Примечание : DFS: disease-free survival – безрецидивная выживаемость (рассчитывается для пациентов с полной ремиссией (ПР) от даты установления полной ремиссии до даты регистрации рецидива заболевания), EFS: event-free survival – бессобытийная выживаемость (промежуток времени от на-чала/окончания лечения до наступления неудачи лечения: отсутствие достижения ПР, рецидив после ПР или смерть от любой причины), PFS: progression-free survival – выживаемость без прогрессирования (промежуток времени от начала лечения до прогрессирования заболевания.

Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
ПЕРВАЯ УСПЕШНАЯ ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ЛИМФОМЕ ХОДЖКИНА У БОЛЬНОГО С ВИЧ-ИНФЕКЦИЕЙ
Табл. 2. Зарегистрированные показания к применению PD-1-ингибиторов (ниволумаб и пембролизумаб) и таргетной терапии брентуксимаб ведотином при р/р кЛХ в РФ
|
Иммунотерапия: PD-1-ингибиторы |
|
|
Пембролизумаб |
монотерапия после выполнения аутоТГСК или после одной и более предшествующей линий терапии при наличии противопоказаний к выполнению аутоТГСК |
|
Ниволумаб |
монотерапия после предшествующей аутоТГСК и терапии с использованием брентуксимаба ведотина или после 3-х и более линий системной терапии, включающей аутоТГСК |
|
Таргетная терапия |
|
|
Брентуксимаб ведотин |
|
Также у ВИЧ-инфицированных пациентов эффективна ПЭТ-адаптиро-ванная стратегия лечения, при которой результаты промежуточной позитронноэмиссионной томографии, совмещенной с КТ (ПЭТ-КТ), могут быть использованы для возможной коррекции объема терапии [22; 23].
Вторая и последующие линии терапии ЛХ у ВИЧ-инфицированных пациентов
При лечении рефрактерности (отсутствие полной ремиссии после завершения химиотерапии первой линии или прогрессирование заболевания во время ее проведения) или рецидива ЛХ должны использоваться те же терапевтические стратегии, что и у ВИЧ-негативных пациентов [4].
Традиционным подходом к терапии второй линии является проведение 2 циклов ПХТ по схемам ICE, DHAP, IGEV, GDP, ESHAP, GemOx и др.
При рецидивах и рефрактерном течении ЛХ (р/р ЛХ) в качестве альтернативы классической ПХТ второй линии или при недостаточном ответе на нее могут применяться ингибиторы иммунных контрольных точек (PD-1-ингибиторы), такие как ниволумаб и пембролизумаб, а также таргетная терапия брентукси-маб ведотином [29–32]. Брентуксимаб ведотин представляет собой конъюгат моноклонального антитела CD30 и цитостатика монометил ауристина Е.
Зарегистрированные в Российской Федерации показания к применению PD-1-ингибиторов и брентуксимаб ведотина при р/р классической ЛХ представлены в таблице 2. У ВИЧ-инфицированных пациентов с р/р классической ЛХ продемонстрирована аналогичная высокая эффективность этих опций [33].
При достижении как минимум частичного ответа на противорецидивное лечение проводится консолидация с помощью высокодозной химиотерапии с трансплантацией аутологичных гемопоэтических стволовых клеток (ВДХТ + аутоТГСК) [34].
Сроки приживления трансплантата, профиль токсичности и частота побочных эффектов ВДХТ+аутоТГСК у ВИЧ-инфицированных пациентов, получающих непрерывную АРТ, схожи с теми, которые наблюдаются у ВИЧ-негативных пациентов [33; 35; 36]. В исследованиях также было показано, что факторы, связанные с ВИЧ (стадия ВИЧ, вирусная нагрузка или количество CD4+ клеток перед трансплантацией), не оказывали значимого влияния на показатели ОВ и выживаемости без прогрессирования (ВБП) [33].
Таким образом, в эпоху АРТ лечение как впервые выявленной ЛХ, так и ее рецидивов у пациентов с ВИЧ не отличается от стандартов лечения ЛХ у пациентов без ВИЧ-инфекции.
Пациент Н., 25 лет, с ноября 2020 г. наблюдался в инфекционной больнице по месту жительства по поводу ВИЧ-инфекции, непрерывно получал комбинированную АРТ эмтрицитабином, тено-фовиром, рилпивирином в адекватных дозах с соблюдением режима приема. С марта 2021 г. на фоне приема АРТ вирусная нагрузка не определяется.
В мае 2021 г. впервые отметил увеличение аксиллярных лимфатических узлов слева. Была выполнена эксцизионная биопсия аксиллярного лимфоузла слева, при гистологическом исследовании – ВИЧ-ассоциированный лимфаденит.
В ноябре 2021 г. вновь отметил увеличение аксиллярных лимфоузлов слева, появление профузной ночной потливости и похудение на 15 кг (более 10% от исходной массы тела за 3 месяца). Выполнена повторная эксцизионная биопсия аксиллярного лимфоузла слева. На основании гистологического и иммуногистохимического (ИГХ) исследований диагностирована классическая ЛХ ЕВV-позитивная, смешанно-клеточный вариант. В феврале 2022 г. по результатам ПЭТ-КТ выявлены метаболически активные увеличенные лимфатические узлы в аксиллярных, субпекторальных областях слева, а также во множествен- ных мезентериальных лимфатических узлах. Установлен диагноз: классическая лимфома Ходжкина ЕВV-позитивная, смешанно-клеточный вариант, IIIB стадия с поражением аксиллярных и суб-пекторальных лимфоузлов слева, множественных мезентериальных лимфатических узлов.
С февраля 2022 г. по месту жительства на фоне непрерывной АРТ (эмтри-цитабин, тенофовир, рилпивирин) проведено 2 цикла ПХТ по схеме ABVD без нарушения сроков введения химиопрепаратов, но с редукцией дозы винбластина в связи с развитием нейропатии.
На промежуточной ПЭТ-КТ, после 2 циклов ABVD, констатирован частичный метаболический ответ.
Проведены 3 и 4 циклы ABVD в том же режиме. На контрольной ПЭТ-КТ после 4 цикла констатировано прогрессирование заболевания: увеличение размеров ранее исходно пораженного лимфатического узла в аксиллярной области слева с 15 x 10 мм до 23 x 21 мм, с повышением уровня накопления радиофармпрепарата (РФП) до SUVmax 11,56 (ранее SUVmax 7,56).
В июле 2022 г. на основании данных ПЭТ-КТ принято решение об эскалации терапии: проведен первый цикл ПХТ по схеме BEACOPP-эскалированный (BEACOPPesc). По данным промежуточной ПЭТ-КТ констатирован полный метаболический ответ (3 балла по шкале Deauville). Проведено 2 консолидирующих цикла по схеме BEACOPPesc. После завершения всей программы лечения (4 цикла ABVD + 3 цикла BEACOPPesc) в октябре 2022 г. при контрольной ПЭТ-КТ подтверждена полная ремиссия. Продолжена АРТ.
На плановой ПЭТ-КТ через 3 месяца (в январе 2023 г.) выявлен рецидив кЛХ: увеличение размеров аксиллярных лимфатических узлов слева до 17 x 19 мм с инфильтрацией окружающей клетчатки и гиперметаболической активностью РФП до SUVmax = 10,56 (ранее до

Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
ПЕРВАЯ УСПЕШНАЯ ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ЛИМФОМЕ ХОДЖКИНА У БОЛЬНОГО С ВИЧ-ИНФЕКЦИЕЙ
8 x 14 мм, SUVmax = 1,9) - 5 баллов по шкале Deauville. Выполнена эксцизионная биопсия пораженного аксиллярного лимфоузла, подтверждён первый ранний редицив.
В апреле 2023 г. больной госпитализирован в клинику гематологии ФГБУ «НМХЦ им. Н.И. Пирогова» для лечения первого раннего рецидива кЛХ.
При дополнительном обследовании получены КТ-данные о наличии увеличенных подмышечных и подключичных лимфатических узлов слева. Проведено 2 цикла противорецидивной ПХТ по схеме GDP (гемцитабин, дексаметазон, карбоплатин), профилактика фебрильной нейтропении выполнялась эмпэгфил-грастимом 7,5 мг п/к однократно через 24 часа после окончания введения химиопрепаратов. В связи с тем, что высокие дозы дексаметазона приводят к снижению концентрации рилпивирина в плазме крови, доза дексаметазона была редуцирована до 16 мг/сут. Лечение проводилось на фоне продолжающейся АРТ.
По данным контрольной ПЭТ-КТ сохранялась метаболическая активность на уровне 5 баллов по шкале Deauville только в увеличенном до 29 x 19 мм ак-силлярном лимфатическом узле слева с инфильтрацией окружающей клетчатки; метаболическая активность ниже, чем до начала лечения – констатирована стабилизация кЛХ.
Ввиду недостаточного ответа на терапию 2 линии (не достигнут полный или частичный ответ) на данном этапе, пациент не рассматривался в качестве кандидата для проведения ВДХТ+аутоТГСК. Однако высокая вероятность достижения полного ответа при проведении иммунотерапии ингибиторами PD-1, две линии предшествующей интенсивной химиотерапии (3 цикла BEACOPPesc и 2 цикла GDP) и отсутствие специфического поражения костного мозга послужили основанием для сбора периферических кроветворных стволовых клеток (ПКСК). Мобилизация ПКСК проведена цитарабином с последующей стимуляцией гемопоэза филграстимом, получено 6,8 млн. CD34+ клеток на кг массы тела.
С июля 2023 по февраль 2024 г. выполнено 11 введений пембролизумаба 200 мг в/в каждые 3 недели. По данным ПЭТ-КТ отмечено уменьшение размеров единственного метаболически активного лимфатического узла в аксиллярной области слева до 15 x 10 мм, со снижением уровня накопления РФП (4 балла по шкале Deauville) – констатирован частичный ответ (Рис. 1).
С целью консолидации достигнутой ремиссии принято решение о проведении ВДХТ с поддержкой ПСКК на фоне продолжения АРТ. Проведено кондиционирование по протоколу BEAM (ломустин 200 мг/м2 перорально в Д-7, цитарабин 200 мг/м2 каждые 12 часов Д-6 – Д-3, этопозид 200 мг/м2 Д-6 – Д-3, мелфалан 140 мг/м2 Д-2) с последующей реинфузией аутологичных периферических стволовых клеток (введено 6,8 x 10 6 CD 34+/кг).
Ранний посттрансплантационный период осложнился лейкопенией IV ст. с Д+3 по Д+8 (с максимальным снижением лейкоцитов до 0,044х109/л (Д+4)), тромбоцитопенией IV ст. с Д+5 по Д+10 (с максимальным снижением тромбоци- тов до 5х109/л (Д+6)), мукозитом ротовой полости II степени и фебрильной нейтропенией (купирована антибактериальной терапией: пиперицилином 4000 мг + та-зобактамом 500 мг 4 раза в сутки с Д+3 по Д+10, даптомицином 500 мг 1 раз в стуки с Д+7 по Д+10). Отмечалось развитие синдрома приживления трансплантата, купированный НПВС. На Д+12 больной выписан в удовлетворительном состоянии. Прием АРТ продолжен амбулаторно.
При плановом ПЭТ-КТ через 3 месяца (07.2024) констатировано дальнейшее уменьшение аксиллярного слева лимфатического узла с полным метаболическим ответом (2 балла по шкале Deauville), констатирована ремиссия заболевания.
Графическое отображение последовательности лечебных этапов представлено на рисунке 2.
Обсуждение
В эпоху АРТ результаты лечения ЛХ у ВИЧ-инфицированных пациентов сопоставимы с результатами лечения ВИЧ-отрицательных пациентов, что подтверждается результатами многочисленных исследований [19–21; 33; 35; 36]. При лечении рецидивов аутоТГСК является эффективным и безопасным методом консолидации достигнутого ответа у ВИЧ-инфицированных пациентов. Ключевым фактором эффективности лечения, помимо соблюдения химиотерапевтического протокола и интервала введения противоопухолевых препаратов, является непрерывный прием АРТ. Именно АРТ способна улучшить исходный соматический статус пациента
На фоне терапии пембролизумабом
После АутоТГСК
Сентябрь 2023 Аксиллярные л/у слева до 12х24 мм, SUVmax 6,93
Декабрь 2023 Аксиллярные л/у слева до 15х10 мм, SUVmax 5,25
Апрель 2024 Аксиллярные л/у слева до 15х10 мм, SUVmax 3,55
Июль 2024
Аксиллярные л/у слева до 13х6 мм, SUVmax 1,37
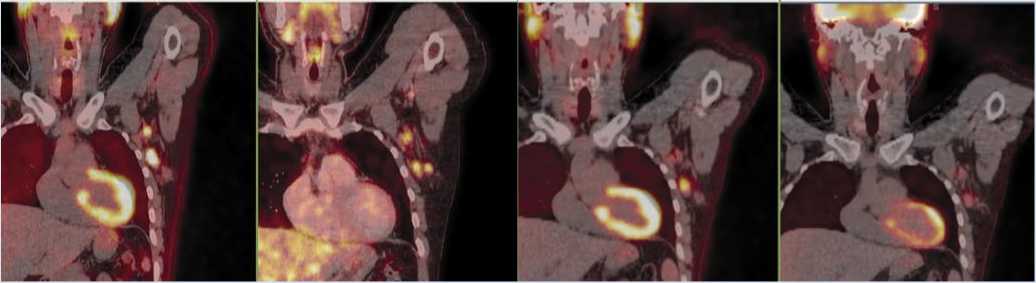
Рис. 1. Динамика метаболической активности опухоли на ПЭТ-КТ на фоне терапии пембролизумабом и после аутоТГСК. Л/у – лимфатический узел. АутоТГСК – трансплантация аутологичных гемопоэтических стволовых клеток.
Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
ПЕРВАЯ УСПЕШНАЯ ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ЛИМФОМЕ ХОДЖКИНА У БОЛЬНОГО С ВИЧ-ИНФЕКЦИЕЙ
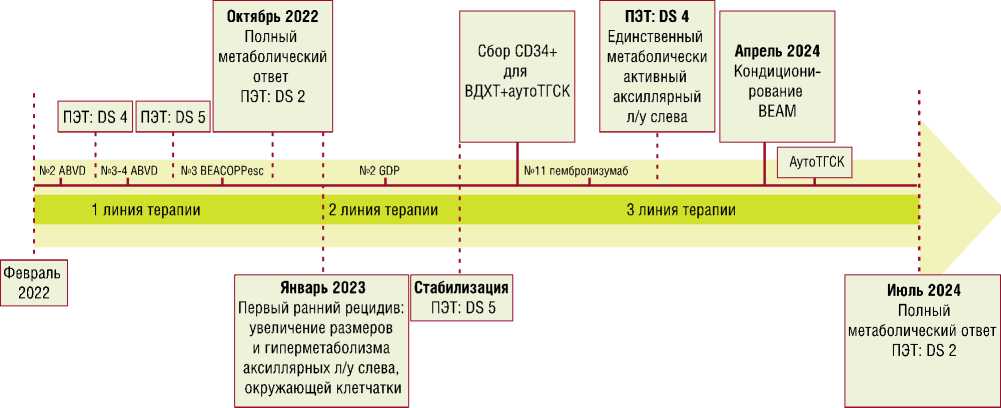
Рис. 2. Последовательности лечебных этапов. ПЭТ – позитронно-эмиссионной томографии. DS – количество баллов по шкале визуальной оценки ПЭТ-данных Deauville point scale. Л/у – лимфатический узел. АутоТГСК – трансплантация аутологичных гемопоэтических стволовых клеток.
Табл. 3. Рекомендации NCCN по профилактике инфекций у ВИЧ-инфицированных пациентов, проходящих противоопухолевое лечение [37]
Лечение ЛХ у ВИЧ-инфицированных пациентов часто сопровождается полипрагмазией (регулярный прием 5 или более лекарственных препаратов одновременно), что обуславливает необходимость тщательной оценки лекарственных взаимодействий между противоопухолевыми препаратами и АРТ. Для получения исчерпывающей информации о взаимодействиях между лекарственными препаратами рекомендуется использовать специализированные ресурсы, например, сайт «HIV Drug Interactions» Ливерпульского университета , где представлен удобный онлайн-сервис для про- верки лекарственных взаимодействий, сокращенно называемый «драг-чекером» (drug checker). Наш пациент получал АРТ в виде комбинации эмтрицитабина, те-нофовира и рилпивирина. Перед назначением противоопухолевой терапии мы воспользовались «драг-чекером», чтобы оценить потенциальные риски токсического взаимодействия между противоопухолевыми препаратами и АРТ и убедиться в безопасности терапии.
Безусловно, при лечении ЛХ у ВИЧ-инфицированных пациентов необходимо учитывать высокий риск развития инфекционных осложнений. Рутинная антимикробная профилактика не рекомендуется из-за отсутствия доказанной эффективности и риска возникновения бактериальной устойчивости. При низком количестве CD4+ Т-лимфоцитов (<200 клеток/мкл) и/или нейтропении в анамнезе, на фоне лечения режи- мами химиотерапии со средним и высоким риском развития фебрильной нейтропении (ФН) рекомендуется использовать гранулоцитарные колониестимулирующие факторы в качестве первичной профилактики ФН. Рекомендации Национальной комплексной онкологической сети (National Comprehensive Cancer Network (NCCN)) по профилактике инфекций у ВИЧ-инфицированных пациентов, проходящих противоопухолевое лечение, изложены в таблице 3 [37].
Использование иммунотерапии PD-1-ингибиторами может быть связано с реактивацией туберкулеза (ТБ) [38]. Поэтому перед началом иммунотерапии рекомендуется проведение скрининга на латентную ТБ-инфекцию.
Заключение
Представленное клиническое наблюдение подтверждает возможность
Мочкин Н.Е., Мельниченко В.Я., Демина Е.А., Протопопова Ю.В.
ПЕРВАЯ УСПЕШНАЯ ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ЛИМФОМЕ ХОДЖКИНА У БОЛЬНОГО С ВИЧ-ИНФЕКЦИЕЙ успешного и безопасного применения ВДХТ + аутоТГСК в лечении р/р ЛХ у ВИЧ-инфицированных пациентов при условии непрерывного приема АРТ, осуществления тщательной оценки лекарственных взаимодействий и комплексной оптимизации терапии.
Список литературы Первая успешная высокодозная химиотерапия с аутологичной трансплантацией кроветворных стволовых клеток при лимфоме Ходжкина у больного с вич-инфекцией
- Gopal S, Achenbach CJ, Yanik EL, Dittmer DP, Eron JJ, Engels EA. Moving Forward in HIV-Associated Cancer. JCO. 2014; 32(9): 876-880. doi: 10.1200/JCO.2013.53.1376.
- Berhan A, Bayleyegn B, Getaneh Z. HIV/AIDS Associated Lymphoma: Review. BLCTT. 2022; 12: 31-45. doi: 10.2147/BLCTT.S361320.
- Castro KG, Ward JW, Slutsker L, et al. 1993 Revised Classification System for HIV Infection and Expanded Surveillance Case Definition for AIDS Among Adolescents and Adults. Published online 1993.
- Navarro JT, Moltó J, Tapia G, Ribera JM. Hodgkin Lymphoma in People Living with HIV. Cancers. 2021; 13(17): 4366. doi: 10.3390/cancers13174366.
- Bachanova V, Connors JM. Hodgkin lymphoma in the elderly, pregnant, and HIV-infected. Seminars in Hematology. 2016; 53(3): 203-208. doi: 10.1053/j.seminhematol.2016.05.002.
- Castillo JJ, Bower M, Brühlmann J, et al. Prognostic factors for advanced-stage human immunodeficiency virus-associated classical Hodgkin lymphoma treated with doxorubicin, bleomycin, vinblastine, and dacarbazine plus combined antiretroviral therapy: A multi-institutional retrospective study. Cancer. 2015; 121(3): 423-431. doi: 10.1002/cncr.29066.
- Carbone A, Gloghini A, Caruso A, De Paoli P, Dolcetti R. The impact of EBV and HIV infection on the microenvironmental niche underlying Hodgkin lymphoma pathogenesis. International Journal of Cancer. 2017; 140(6): 1233-1245. doi: 10.1002/ijc.30473.
- Miller CL, Burkhardt AL, Lee JH, et al. Integral membrane protein 2 of Epstein—barr virus regulates reactivation from latency through dominant negative effects on protein-tyrosine kinases. Immunity. 1995; 2(2): 155-166. doi: 10.1016/S1074-7613(95)80040-9.
- Caldwell RG, Wilson JB, Anderson SJ, Longnecker R. Epstein-Barr Virus LMP2A Drives B Cell Development and Survival in the Absence of Normal B Cell Receptor Signals. Immunity. 1998; 9(3): 405-411. doi: 10.1016/S1074-7613(00)80623-8.
- Keir ME, Butte MJ, Freeman GJ, Sharpe AH. PD-1 and Its Ligands in Tolerance and Immunity. Annu Rev Immunol. 2008; 26(1): 677-704. doi: 10.1146/annurev.immunol.26.021607.090331.
- Alaggio R, Amador C, Anagnostopoulos I, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022; 36(7): 1720-1748. doi: 10.1038/s41375-022-01620-2.
- Jacobson CA, Abramson JS. HIV-Associated Hodgkin’s Lymphoma: Prognosis and Therapy in the Era of cART. Advances in Hematology. 2012; 2012: 1-8. doi: 10.1155/2012/507257.
- Ruiz M, Parsons C, Cole J. Characterization of HIV-Associated Hodgkin’s Lymphoma in HIV-Infected Patients: A Single-Center Experience. Journal of the International Association of Physicians in AIDS Care. 2012; 11(4): 234-238. doi: 10.1177/1545109711431492.
- Olszewski AJ, Castillo JJ. Outcomes of HIV-associated Hodgkin lymphoma in the era of antiretroviral therapy. AIDS. 2016; 30(5): 787-796. doi: 10.1097/QAD.0000000000000986.
- Hentrich M, Müller M, Wyen C, et al. Stage-adapted treatment of HIV-associated Hodgkin lymphoma: Long-term results of a prospective, multicenter study. HemaSphere. 2024; 8(7): e68. doi: 10.1002/hem3.68.
- Souza AT de, Andrade FR de, Sarmento AC, Villarim CC, Araújo-Filho I, Medeiros KS de. Clinical features in Hodgkin lymphoma patients living with human immunodeficiency virus: A meta-analysis in the antiretroviral therapy era. Int J STD AIDS. Published online June 21, 2024: 09564624241259512. doi: 10.1177/09564624241259512.
- Chekalov A, Popova M, Tsygankov I, et al. P1077: HODGKIN LYMPHOMA IN PATIENTS WITH HIV: NATIONAL RETROSPECTIVE MULTICENTER STUDY. HemaSphere. 2022; 6: 67-968. doi: 10.1097/01.HS9.0000847176.96022.91.
- Berenguer J, Miralles P, Ribera JM, et al. Characteristics and Outcome of AIDS-Related Hodgkin Lymphoma Before and After the Introduction of Highly Active Antiretroviral Therapy. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2008; 47(4). [URL].
- Montoto S, Shaw K, Okosun J, et al. HIV Status Does Not Influence Outcome in Patients With Classical Hodgkin Lymphoma Treated With Chemotherapy Using Doxorubicin, Bleomycin, Vinblastine, and Dacarbazine in the Highly Active Antiretroviral Therapy Era. JCO. 2012; 30(33): 4111-4116. doi: 10.1200/JCO.2011.41.4193.
- Besson C, Lancar R, Prevot S, et al. High Risk Features Contrast With Favorable Outcomes in HIV-associated Hodgkin Lymphoma in the Modern cART Era, ANRS CO16 LYMPHOVIR Cohort. Clinical Infectious Diseases. 2015; 61(9): 1469-1475. doi: 10.1093/cid/civ627.
- Sorigué M, García O, Tapia G, et al. HIV-infection has no prognostic impact on advanced-stage Hodgkin lymphoma. AIDS. 2017; 31(10): 1445-1449. doi: 10.1097/QAD.0000000000001487.
- Lawal IO, Ankrah AO, Popoola GO, et al. 18F-FDG-PET metabolic metrics and International Prognostic Score for risk assessment in HIV-infected patients with Hodgkin lymphoma. Nuclear Medicine Communications. 2018; 39(11): 1005-1012. doi: 10.1097/MNM.0000000000000905.
- Danilov AV, Li H, Press OW, et al. Feasibility of interim positron emission tomography (PET)-adapted therapy in HIV-positive patients with advanced Hodgkin lymphoma (HL): a sub-analysis of SWOG S0816 Phase 2 trial. Leukemia & Lymphoma. 2017; 58(2): 461-465. doi: 10.1080/10428194.2016.1201573.
- Blanca X, Josep-María R, Pilar M, et al. Results of treatment with doxorubicin, bleomycin, vinblastine and dacarbazine and highly active antiretroviral therapy in advanced stage, human immunodeficiency virus-related Hodgkin’s lymphoma. haematol. 2007; 92(2): 191-198. doi: 10.3324/haematol.10479.
- Hartmann P, Rehwald U, Salzberger B, et al. BEACOPP therapeutic regimen for patients with Hodgkin’s disease and HIV infection. Annals of Oncology. 2003;14(10):1562-1569. doi:10.1093/annonc/mdg408.
- Hentrich M, Berger M, Wyen C, et al. Stage-Adapted Treatment of HIV-Associated Hodgkin Lymphoma: Results of a Prospective Multicenter Study. JCO. 2012; 30(33): 4117-4123. doi: 10.1200/JCO.2012.41.8137.
- Rubinstein PG, Moore PC, Bimali M, et al. Brentuximab vedotin with AVD for stage II–IV HIV-related Hodgkin lymphoma (AMC 085): phase 2 results from an open-label, single arm, multicentre phase 1/2 trial. The Lancet Haematology. 2023; 10(8): e624-e632. doi: 10.1016/S2352-3026(23)00157-6.
- Mponda M, Kudowa E, Craven DM, et al. Safety, efficacy, and affordability of ABVD for Hodgkin lymphoma in Malawi: a prospective cohort study. eClinicalMedicine. 2024; 69: 102480. doi: 10.1016/j.eclinm.2024.102480.
- Ansell SM, Bröckelmann PJ, von Keudell G, et al. Nivolumab for relapsed/refractory classical Hodgkin lymphoma: 5-year survival from pivotal phase 2 CheckMate 205 study. Blood Advances. Published online August 2, 2023:bloodadvances.2023010334. doi: 10.1182/bloodadvances.2023010334.
- Armand P, Zinzani PL, Lee HJ, et al. Five-year follow-up of KEYNOTE-087: pembrolizumab monotherapy for relapsed/refractory classical Hodgkin lymphoma. Blood. 2023; 142(10): 878-886. doi: 10.1182/blood.2022019386.
- Mei MG, Lee HJ, Palmer JM, et al. Response-adapted anti-PD-1–based salvage therapy for Hodgkin lymphoma with nivolumab alone or in combination with ICE. Blood. 2022; 139(25): 3605-3616. doi: 10.1182/blood.2022015423.
- Pier LZ, Simonetta V, Antonella A, et al. Brentuximab vedotin in relapsed/refractory Hodgkin’s lymphoma: the Italian experience and results of its use in daily clinical practice outside clinical trials. haematol. 2013; 98(8): 1232-1236. doi: 10.3324/haematol.2012.083048.
- Lurain K, Zarif TE, Ramaswami R, et al. Real-World Multicenter Study of PD-1 Blockade in HIV-Associated Classical Hodgkin Lymphoma Across the United States. Clinical Lymphoma, Myeloma and Leukemia. 2024; 24(8): 523-530. doi: 10.1016/j.clml.2024.03.011.
- Moskowitz AJ, Yahalom J, Kewalramani T, et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood. 2010; 116(23): 4934-4937. doi: 10.1182/blood-2010-05-282756.
- Krishnan A, Molina A, Zaia J, et al. Durable remissions with autologous stem cell transplantation for high-risk HIV-associated lymphomas. Blood. 2005; 105(2): 874-878. doi: 10.1182/blood-2004-04-1532.
- Re A, Michieli M, Casari S, et al. High-dose therapy and autologous peripheral blood stem cell transplantation as salvage treatment for AIDS-related lymphoma: long-term results of the Italian Cooperative Group on AIDS and Tumors (GICAT) study with analysis of prognostic factors. Blood. 2009; 114(7): 1306-1313. doi: 10.1182/blood-2009-02-202762.
- National Comprehensive Cancer Network. Cancer in People with HIV (Version: 2.2024). April 4, 2024. [URL].
- Bae S, Kim YJ, Kim M ju, et al. Risk of tuberculosis in patients with cancer treated with immune checkpoint inhibitors: a nationwide observational study. J Immunother Cancer. 2021;.9(9):.e002960. doi:.10.1136/jitc-2021-002960.


