Первичная оценка радиобиологического ответа на облучение ускоренными ионами углерода in silico и in vivo
Автор: Кизилова Я.В., Корякин С.Н., Хозяшева Т.С., Колесникова Т.В., Трошина М.В., Пикалов В.А., Лычагин А.А., Минаева Н.Г., Соловьев А.Н.
Рубрика: Научные статьи
Статья в выпуске: 3 т.34, 2025 года.
Бесплатный доступ
В представленной работе исследуются вопросы радиобиологической эффективности облучения ионами углерода, получаемыми на ускорительном комплексе У70. Особое внимание уделено комплексному подходу, сочетающему расчётные (in silico) методы на базе ранее разработанного программного обеспечения и экспериментальные исследования (in vivo) на лабораторных животных с перевиваемыми опухолями. Такой подход позволяет уточнить пространственноэнергетические характеристики пучка ускоренных ионов, установить оптимальные условия формирования пика Брэгга, а также оценить влияние вторичных частиц на итоговый радиобиологический эффект. Целью исследования являлось проведение комплексной оценки относительной биологической эффективности ионного пучка. Оценка выполнялась на основании экспериментально измеренных поглощённых доз и прямого наблюдения динамики роста опухоли после облучения, с использованием специально разработанных математических и программных средств для валидации и прогнозирования спектра излучения и характеристик линейной передачи энергии. Оценку поглощённых доз в экспериментальных исследованиях проводили с помощью ионизационных камер, размещаемых в оснастке для позиционирования объектов. После облучения, проводимого на 12 сутки после имплантации опухоли саркомы М1, осуществляли серии наблюдений за динамикой роста опухолей у крыс на протяжении 25 сут. Результаты продемонстрировали высокий уровень радиобиологического ответа при облучении ионами углерода, что, в первую очередь, обусловлено повышенной линейной плотностью ионизации и интенсивным формированием кластерных повреждений ДНК. В экспериментах также была подтверждена важность строгого дозиметрического контроля и корректного учёта индивидуальных особенностей организмов при анализе терапевтического эффекта. Таким образом, интеграция моделирования и экспериментов in vivo в рамках комплексного подхода обеспечивает более глубокое понимание механизмов взаимодействия тяжёлых ионов с биологическими объектами, повышает точность прогнозирования эффективности лечения и формирует основу для дальнейшей оптимизации протоколов ионной терапии в онкологии.
Радиация, углеродная терапия, крысы, саркома М-1, радиобиологический ответ, лучевая терапия, математическое моделирование, биологическая доза, дозиметрия, поглощённая доза, У-70, обработка изображений, программное обеспечение
Короткий адрес: https://sciup.org/170210842
IDR: 170210842 | УДК: 616.006-3.04:085.849.1:577.391-092.9-036.8 | DOI: 10.21870/0131-3878-2025-34-3-131-145
Текст научной статьи Первичная оценка радиобиологического ответа на облучение ускоренными ионами углерода in silico и in vivo
Современное развитие лучевой терапии онкологических заболеваний всё более активно опирается на применение лёгких заряженных частиц, среди которых особое место занимают ионы углерода. Их отличает выгодное соотношение физических и радиобиологических свойств. Так, высокие энергии, обеспечивающие формирование пика Брэгга на большой глубине залегания, обеспечивают прецизионность распределения дозы по всему размеру опухоли, в то же время высокая линейная плотность ионизации приводит к формированию более тяжёлых
повреждений ДНК опухолевых клеток (преимущественно, двунитевых и кластерных разрывов). Это способствует увеличению вероятности радикального подавления роста новообразований при одновременном снижении радиотоксического воздействия на здоровые ткани. Однако столь высокая эффективность предполагает необходимость строгой дозиметрической и радиобиологической верификации, поскольку любая неточность при планировании лечения может значительно увеличить риск лучевых осложнений.
Неотъемлемой частью развития данного направления являются исследовательские работы с использованием биологических моделей in vitro и in vivo , а также моделирование in silico . Отдельные исследования на клеточных культурах in vitro зачастую не позволяют в полной мере учесть сложные системные реакции организма, включая иммунный ответ и особенности микроокружения опухоли. Между тем, работа с животными моделями in vivo даёт возможность получать более полные сведения о клинически релевантных эффектах и достоверно оценивать как противоопухолевое действие, так и потенциальные повреждения нормальных тканей. Проведение подобных экспериментов требует дополнительной верификации и сопоставления с результатами, полученными вычислительными методами. Это необходимо, прежде всего, для повышения достоверности оценок подводимых доз и обеспечения качества терапевтического воздействия. В дальнейшем такие подходы могут использоваться и для прогнозирования взаимодействия частиц при сложном транспорте ионов в тканях. Путём анализа особенностей подведения пучка (спектральные характеристики излучения в тканях, энергии и глубина модифицированного пика, эффекты мощности подводимых доз) в современном мире становится возможным определять уникальные характеристики, определяющие терапевтический отклик на действие излучения. Именно такой комплексный подход повышает достоверность итоговых данных и способствует более точному планированию будущих клинических исследований.
В рамках общей стратегии развития ионной терапии неизбежно возрастает роль верификационных исследований, направленных на сопоставление результатов, полученных с помощью расчётных методов, с наблюдениями in vivo . Такое сочетание может дать достаточно полную картину взаимодействия ионов углерода с опухолью и здоровыми тканями. Накопленный экспериментальный опыт, подкреплённый данными вычислительного моделирования, формирует теоретическую базу для последующего внедрения ионной терапии в стандарты оказания медицинской помощи населению. При этом важной задачей является обеспечение воспроизводимости и точности измерений, что позволяет проводить корректное сопоставление результатов ионной терапии между различными центрами. Для достижения этой цели необходимо проводить комплексную дозиметрическую калибровку используемого оборудования в соответствии с международными стандартами.
Таким образом, цель настоящей работы заключается в проведении всесторонней оценки относительной биологической эффективности (ОБЭ) облучения пучками ионов углерода, формируемыми на экспериментальном комплексе У-70. Для этого были выполнены измерения поглощённых доз, проведены прямые наблюдения за динамикой опухолевого роста у лабораторных животных после облучения, а также реализована программно-математическая валидация спектра излучения с целью определения ключевых характеристик линейной передачи энергии.
Материалы и методы
Облучательный стенд ВРБС в 2014-2017 гг.
Ускорительный комплекс У-70 относится к уникальным научно-техническим сооружениям Советского Союза. Созданный и запущенный в эксплуатацию в 1967 г. для изучения физики вы-сокоэнергетичных пучков протонов с энергией до 70 ГэВ, он по-прежнему служит базой для проведения фундаментальных и прикладных исследований всей России. Комплекс, состоящий из каскада ускорителей, прошёл несколько этапов модернизации, включая ввод в эксплуатацию комплекса с ускоренными ионами углерода в середине 2000-х. Начиная с 2011 г. НИЦ «Курчатовский институт» – ИФВЭ и МРНЦ им. А.Ф. Цыба приступили к предварительным исследованиям прикладного назначения с целью формирования требований по модернизации вывода пучка ионов углерода для последующего медицинского применения в лучевой терапии пациентов с онкологическими заболеваниями.
Экспериментальные исследования, описанные в настоящей статье, были проведены на Временном радиобиологическом стенде (ВРБС) в период 2014-2016 гг. К этому времени силами НИЦ «Курчатовский институт» – ИФВЭ была отлажена схема медленного вывода пучка ионов углерода [1], ускоренных до энергии 450 МэВ/нуклон, в канал № 25. Выводной канал № 25 на установку ВРБС состоял из 4 дипольных магнитов и 7 квадрупольных линз.
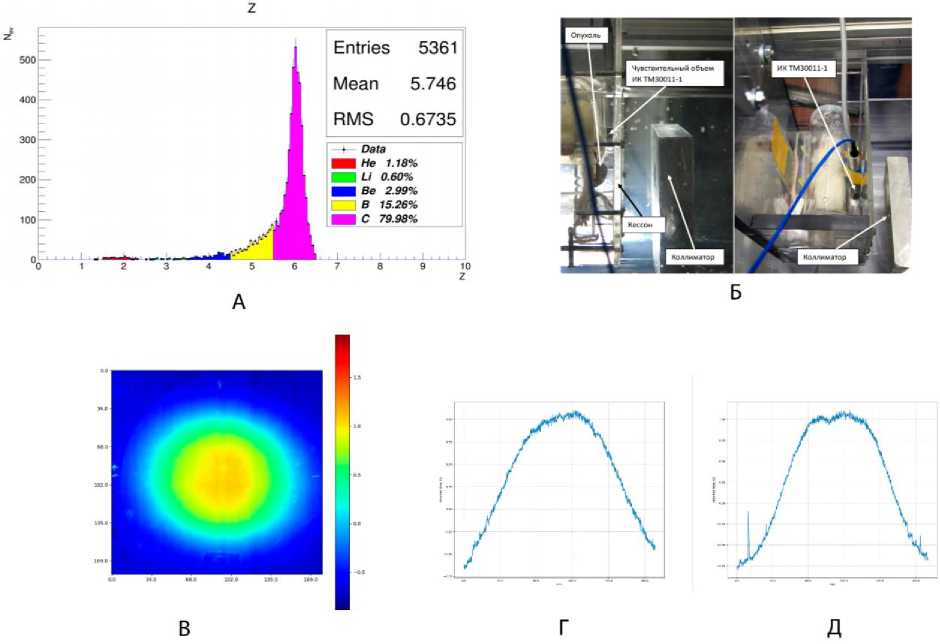
Рис. 1. Основные характеристики пучка и схема облучения: А – состав пучка за первые 30 мс сброса в центре поле при включённых вобблер-магнитах, сеанс апрель 2015 г.;
Б – фотографии животного в средстве позиционирования вида «кессон» за коллиматором в воде; В – двумерный профиль пучка по данным радиохромной плёночной дозиметрии на входе в фантом, поглощённая доза за 8 сбросов, сеанс декабрь 2015 г.; Г – горизонтальный профиль поглощённой дозы по рисунку В в центральной оси; Д – вертикальный профиль поглощённой дозы по рисунку В в центральной оси.
Общие характеристики выводного канала и методов формирования поля подробно описаны в статье [2]. Стоит отметить, что к моменту преобразования ВРБС в Центре коллективного пользования ускорительного комплекса У-70 (ЦКП «РБС на У-70») [3] в 2017 г. был значительно улучшен вывод пучка. Во время проведения первичных оценок задача экспериментальной дозиметрии значительно осложнялась, в частности, из-за того, что краевые области гауссовского профиля пучка частично перекрывались элементами магнитных квадрупольных линз в процессе транспортировки. Таким образом, пучок был представлен не чистым углеродом, а углеродом с существенной долей примесей (рис. 1А). В рабочем пучке, получаемом позднее на ЦКП «РБС на У-70», доля ядер углерода была доведена до 96,9%, что является необходимым и достаточным условием для обоснования последующей медико-терапевтической эксплуатации.
Работы на пучке ионов углерода на ВРБС проводились на протяжении одной-двух недель один (2014 г.) или два раза (2015, 2016 гг.) в год по две недели, включая сопутствующие исследования по верификации in vitro [4, 5], дополнительные дозиметрические работы [6] и исследования, проводимые другими пользователями [7].
Верификация кривых Брэгга
Физико-дозиметрическое сопровождение сеансов проводили сотрудники НИЦ «Курчатовский институт» – ИФВЭ и МРНЦ им. А.Ф. Цыба. Для измерения глубинного дозового распределения в водном фантоме было использовано дозиметрическое оборудование, включающее радиометры Unidos Webline (сеансы 2014-2016 гг.) и IBA Dose 1 (сеансы 2016 г.), набор ионизационных камер PTW TM30010-1 (сеансы 2014 г.), PTW TM30013 (сеансы 2015-2016 гг.), IBA PPC40 (сеансы 2016 г.), а также контрольную плоскопараллельную ионизационную камеру и монитор потока нейтронов [8] (разработаны в НИЦ «Курчатовский институт» – ИФВЭ).
Перемещение ионизационных камер (PTW) внутри водного фантома осуществлялось посредством высокоточной системы перемещения (оцененная абсолютная погрешность позиционирования объекта – не хуже ±25 мкм). Контрольная плоскопараллельная камера находилась перед фантомом на пути прохождения пучка ионов углерода, монитор нейтронного потока был установлен сбоку от водного фантома (положение данного монитора в течение сеанса не изменялось). Используемые для определения величины поглощённой дозы радиометры Unidos Webline, IBA Dose 1 и набор ионизационных камер поверялись в сертифицированной лаборатории, контрольная плоскопараллельная ионизационная камера, используемая в качестве средства мониторирования пучка, откалибрована по распаду 11С в детекторе совпадений. Запись показаний всех детекторов осуществляли в ручном режиме по команде СТАРТ/СТОП ответственного лица. Значения измеренных доз нормировали на показания мониторных дозиметров и в дальнейшем подведение требуемой дозы осуществлялось по показаниям именно этих дозиметров-мониторов.
Подбор коллиматоров, выбор первичного гребенчатого фильтра
Поскольку облучение подавляющего большинства биологических объектов в интересах своих и смежных исследований преимущественно проводили широким пучком ионов углерода, а размеры опухоли не превышали 20 мм в поперечном направлении, было изготовлено средство для коллимации пучка. По причине того, что облучение изначально планировалось проводить в пике Брэгга, контейнер с экспериментальным животным размещался во внутренней воздушной полости «кессона», который затем позиционировался в воде. Установка металлического коллиматора ближе к выходу ионного пучка могла бы привести к дополнительному образованию вторичных тяжёлых заряженных частиц. В связи с этим было предложено использовать алюминиевый коллиматор небольшой толщины (5 см), устанавливаемый на подставке непосредственно перед кессоном в рабочем положении для облучения. Таким образом, поглощённая доза от большей части широкого рассеянного пучка выделяется до коллиматора просто ввиду геометрических размеров пучка, приходящегося на воду до расположения средства коллимации, а толщина коллиматора, в свою очередь, была рассчитана как минимально достаточная для защиты тела животного вне целевой зоны опухоли как поглотитель остаточных пробегов вторичных образованных ионов и первичного пучка уже в самом коллиматоре. Окно коллиматора имело форму круга диаметром 30 мм.
Формирование расширенного (модулированного) пика Брэгга проводилось с помощью гребенчатого фильтра. Процедура проектирования гребенчатого фильтра, включая его изначальное целевое назначения для иных экспериментов in vitro , особенности их изготовления, а также фотографии готовых изделий описаны ранее [9]. Из ранее неопубликованных данных стоит отметить, что методы получения кривых Брэгга могут отличаться. Так, при проектировании описанного фильтра была использована параметризация в терминах ожидаемого остаточного пробега ионов, совместно с моделью моноэнергетического (455 МэВ/н) малодисперсного (0,5%) плоскопараллельного пучка ионов углерода на бесконечном отдалении от водного фантома. В последующих работах, выполнявшихся в рамках проекта ЦКП «РБС на У-70», применялись альтернативные подходы к параметризации пучка и характеристик отклика. Так, например, в исследовании [10], посвящённом т.н. биологической дозе, рассматривалась зона модифицированной кривой Брэгга, в которой произведение ожидаемой поглощённой физической дозы (в Гр) и ожидаемой ОБЭ должно обеспечивать равномерность биологического эффекта. В других работах [11, 12], фокусировавшихся на физической дозе, изучалась зона глубинного распределения вдоль модифицированной кривой Брэгга эквивалентной дозы в Гр, определяемой по данным дозиметрии с учётом её неопределённостей. В этих исследованиях использовалась модель, основанная на оценке потерь энергии в тонком слое фильтрационного материала, с последующей алгоритмической оптимизацией среднеквадратичного отклонения поглощённой дозы в области мишени.
Доставка дозы к объекту
Так как измерение кривой Брэгга происходило за малое число сбросов (3-5), а доза за каждый сброс составляла сотни мГр в немодифицированном пике и менее 100 мГр в модифицированном, в то время как планируемые для отпуска дозы составляли 10-12 Гр, базовое мониторное число (отношение числа мониторных единиц для заданной дозы к измеренной фактической дозе) измерялось на ожидаемой дозе 4 Гр. После этого требуемое для дозы 12 Гр значение мониторного числа записывалось как задание, фактическое подведение дозы осуществляли до достижения данного значения. При этом при проведении эксперимента в те годы для радиометра использовалась только стандартная поправка на текущую температуру и давление, никакие иные коэффициенты, включая коэффициент качества излучения, не учитывались. Таким образом, данные тех лет без подкрепления на базе in silico моделирования не могут быть использованы для верификации отклика биологических объектов самостоятельно в пределах точности, требуемой для медицинского применения (±3% согласно Постановлению Правительства от 16 ноября 2020 г.
№ 1847 «Об утверждении перечная измерений, относящихся к сфере государственного регулирования обеспечения единства измерений»). Оцененные суммарные погрешности с учётом только экспериментальных данных тех лет по отпущенной дозе могли превышать 10-12%. Ожидаемые в эксперименте дозы составляли:
-
- 12 Гр в немодифицированном пике (2014 г.), а также в немодифицированном и модифицированном по физической дозе пике (сеансы 2015 г.), включая модифицированный пик Брэгга. Немодифицированный пик характеризуется по дозе, измеренной дозиметрически в точке максимума пика, с учётом неопределённости положения ±50 мкм. Это измерение носит качественный характер и в дальнейшем в работе не анализируется. Модифицированный пик определялся как усреднённое значение дозы в интервале по глубине в пределах кривой Брэгга – от уровня 95% на проксимальном подъёме до 95% на дистальном спаде, где 100% соответствует максимуму дозы в пределах измеренного интервала, без привязки к конкретной глубине этого максимума;
-
- 25 Гр в начале пробега пучка – зона «прострела» (сеанс апрель 2016 г.); доза характеризуется как прямые измерения дозиметром в Гр цилиндрической камерой в тканеэквивалентном колпачке, расположенном в воздухе;
-
- 10 и 12 Гр в модифицированном по биологической дозе пике Брэгга (сеанс декабрь 2016 г.); дозы модифицированного по биологической дозе пика Брэгга даны аналогично дозам в физическом пике как точка максимума кривой Брэгга.
В зависимости от линейного размера опухоли осуществлялось перемещение кессона с животным с целью подведения максимума дозы на задний край опухоли (3 мм от физического края лапы животного). При этом в немодифицированном и модифицированном по физической дозе распределённом пике Брэгга данная точка устанавливалась в непосредственной близости к дистальному спаду дозной кривой, а в случае применения биологического фильтра референсная точка опухоли располагалась непосредственно в центре модифицированной кривой (таким образом, ближняя половина опухоли облучалась проксимальным подъёмом кривой, а дальняя половина – начальным спадом физической дозы). Общая характеристика облучения может быть представлена согласно определению понятия референсной точки для пучков ионов углерода, определённом согласно TRS-398 rev. 1 (2024 г.), с учётом того, что положение референсной точки для облучения выбирается относительно внешних (наблюдаемых) геометрических размеров опухолевого узла.
Референсные данные гамма-излучения получены на базе установки Луч-1 (60Co), расположенной в МРНЦ им. А.Ф. Цыба. При этом использовались стандартные методики дозиметрии, а подвод дозы осуществлялся в соответствии с показаниями встроенного таймера пульта управления с последующим расчётом её величины на основании текущей мощности дозы источника. В качестве необлучённого контроля для расчёта индекса ТРО использовались результаты предыдущих экспериментов, поскольку проведение контрольных замеров на необлучённых животных не было предусмотрено протоколом исследования.
Общий вид облучательных технологических средств позиционирования представлен на рис. 1Б. Профили поглощённых доз, используемые для позиционирования объекта в широком поле, и его характеристики приведены на рис. 1В-Д.
Пересчёт поглощённых доз в экспериментах
Работы по in silico оценкам поглощённых доз выполнены позднее в 2024-2025 гг. на базе специально разработанного программно-вычислительного комплекса моделирования воздействий ионизирующего излучения [13]. Для создания источника ионов с целью проведения моделирования воздействия на животное-опухоленоситель был использован следующий подход. Оценка базовой энергии пучка, обеспечивающей измеренный пробег в водном фантоме в абсолютных координатах кессона с привязкой к относительным координатам фантома в помещении, была численно заимствована из ранее проведённых работ [2, 3, 10]. Спектральное распределение флюенса фрагментов, возникающих после канала транспорта и воздушного промежутка, составляющего около 15 м в те годы, задано в соответствии с экспериментальными характеристиками, полученными сотрудниками НИЦ «Курчатовский институт» – ИФВЭ (рис. 1А). На первом этапе была разработана полновесная (англ. full scale) модель облучения, включающая в себя взаиморасположение нейтронного монитора, измерительного водного фантома со всеми стенками (поликарбонат, передняя – 30,4 мм (окно – 20,0 мм), боковые 14,9 мм, задняя – 30,3 мм, нижняя – 15,0 мм) и перемещающегося кессона (передняя стенка полиметилметакрилат 5,0 мм, остальные стенки – поликарбонат 15 мм), позволяющая оценить зависимость между измеренной поглощённой дозой и числом отпущенных мониторных единиц. При этом восстановленные данные показаний инструментальной дозиметрии в последующем позволяют восстановить ожидаемое эквивалентное число историй источника в описанной Монте-Карло модели с поправкой на линейный коэффициент масштабирования.
Обработка снимков рукописных протоколов
В годы выполнения работ, описанных в настоящей статье, все наблюдения проводились в ручном режиме. Объёмы опухолей вычислялись на основе линейных размеров наблюдаемого опухолевого узла, которые вручную измерялись линейкой и штангенциркулем каждые 2-3 дня после облучения и заносились в рукописную таблицу. В отделе радиационной биофизики накоплен огромный массив рукописных данных, относящихся не только к данному эксперименту, но и к более ранним (начиная с 2000-х годов) и более поздним исследованиям. В этой связи отдельной научно-технической задачей стало создание автоматизированного средства обработки рукописных данных. В рамках разработанных решений было предложено использовать библиотеки машинного зрения. Все рукописные таблицы были отсканированы на поточном сканере и сохранены в формате pdf, после чего специально написанные на языке Python программные средства, построенные на базе библиотек opencv, pytorch и Apple Vision, осуществляли автоматическое преобразование рукописных данных в машинное представление. Точность распознавания символов, в целом, составляет от 75 до 92%, при использовании готового набора рукописных данных MNIST, ведутся работы по улучшению качества распознавания.
Автоматизация построения таблиц и графиков
Распознанные символы каждого листа наблюдений объёмов опухоли далее переводились в формат Microsoft Office Excel для удобства использования вне разработанных систем автоматизированной обработки данных. Таблицы Excel, помимо собственно данных о наблюдаемых значениях линейных размеров опухоли, содержат также данные о дате проведения облучения, типе воздействия и датах проведения контрольных замеров.
В рамках работ по автоматизации экспериментальной деятельности выполнены также разработки специализированного программного обеспечения по оценке терапевтического эффекта и безопасности. В интерактивном режиме на базе таблиц Excel, полученных на предыдущем этапе, осуществлялось автоматизированное построение графиков наблюдения за динамикой роста опухоли, величиной индекса торможения роста опухоли (ТРО), отслеживалась частота и тяжесть кожных реакций, а также ряд иных показателей, не использованных в настоящей работе. В целом, разработанные программные средства позволяют эффективно оптимизировать рутинную ручную работу с данными экспериментальных наблюдений и существенно ускорить выполнение наукоёмких исследований.
Экспериментальные животные
Исследование выполнено на беспородных самцах крыс. Для экспериментальных исследований отбираются половозрелые самцы, массы тела которых должны находиться в диапазоне 150±10 г. Опухолевая линия саркомы М-1 получена из банка опухолевых штаммов МНИОИ им. П.А. Герцена. Опухоль прививается на бедро здорового животного путём имплантации подкожно с помощью троакара на правую лапку подготовленного опухолевого материала. Подготовка материала осуществляется после забития крысы-донора, сначала после переноса всей отрезанной опухоли в чашку Петри, содержащую один объём традиционной питательной среды, дополняемый антибиотиками в таком же объёме (стрептомицин, 25000 ед., пенициллин 25000 ед.), затем выделением и отбором кусков в новую чашку Петри. Осуществляется обрезка некротических зон, и последующее послойное нарезание опухолевого материала на кусочки для непосредственной трансплантации в зависимости от необходимого числа животных в экспериментах. Вес переносимой ткани для одиночного животного не превышает 100 мг, оцененное число клеток опухоли на момент имплантации – менее 105. К моменту облучения (12-е сут после имплантации) объём опухолевого узла по результатам наблюдений составлял примерно 1 см³. В зависимости от факторов внешней среды, включая условия содержания животных, в длительных сериях экспериментов такой объём может формироваться в период от 12 до 16 сут после перевивки.
Результаты
На рис. 2А представлены примеры экспериментальных данных. Радиохромная плёночная дозиметрия, при которой плёнки располагались вдоль направления пучка, использовалась для предварительной визуальной оценки положения кривой Брэгга в водном фантоме. По результатам измерения положения края зоны высокой дозы на внешнем перемещающем устройстве наносилась метка маркером. Дополнительно на базе плёночных дозиметров контролировалось попадание центра пучка в геоцентр помещения расположения фантома. При позиционировании животного первичный визуальный контроль осуществлялся с использованием данной метки. В рамках повышения качества проводимых работ с 2015 г. были реализованы средства автоматизированной записи и построения результатов измерений (рис. 2Б), построенные на базе языка высокого уровня Python и библиотек wxPython для создания графического интерфейса и matplotlib непосредственно для построения оцененных данных инструментальной дозиметрии. Хранение данных осуществлялось в формате JSON, что позволяет обеспечить переносимость информации между разнородными средствами обработки и хранения данных. На рис. 2В представлена трёхмерная реконструкция поглощённых доз в воде, построенная на базе обработан- ных сканов радиохромных плёнок (Ashland Gafchromic EBT3, сканирование 200 точек на дюйм на Epson Perfection V100 в режиме трансмиссии, обработка специализированным ПО), помещаемых в специальный держать в месте расположения облучаемого объекта в кессоне, заполненном водой. На графике (рис. 2Г) представлены модельные оценки спектральных характеристик линейной передачи энергии (ЛПЭ) в тонком слое толщиной 100 мкм, расположенном в центре расширенной кривой Брэгга. В данном случае в качестве оценки величины ЛПЭ взято прямое отношение величины поглощённой дозы в Монте-Карло модели к длине шага, при этом оба параметра измерялись внутри события попадания (Hit) в чувствительном детекторе, соответствующем заданному объёму (SensitiveDetector). Подобное сопоставление измеренных и расчётных данных позволяет оперативно оценивать качество экспериментальных работ и обеспечивает воспроизводимость между сеансами облучения.
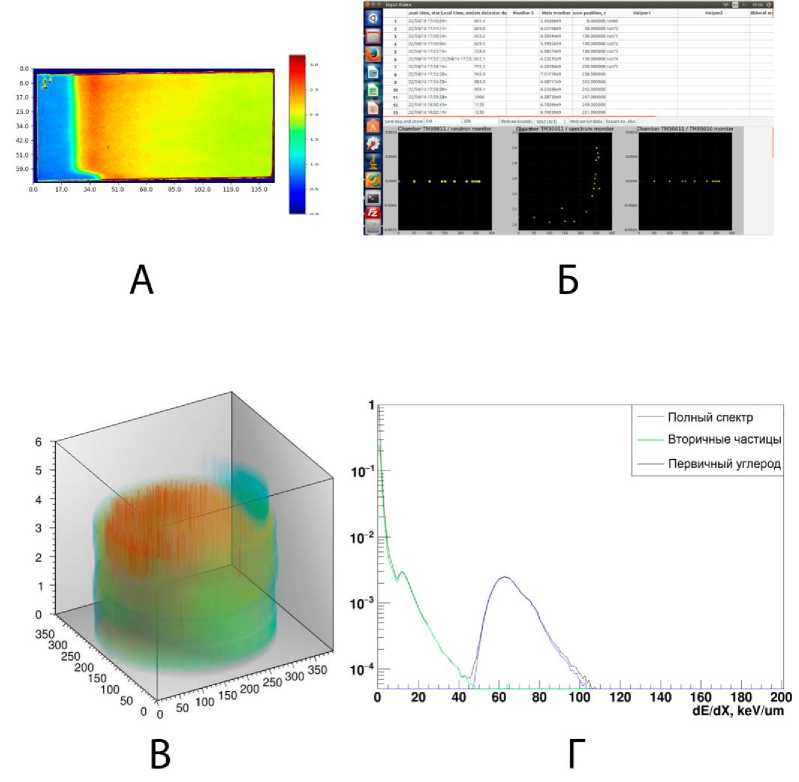
Рис. 2. Результаты физико-дозиметрической верификации и математического моделирования: А – двумерный профиль модифицированной кривой Брэгга по данным радиохромной плёночной дозиметрии, сеанс декабрь 2015 г.; Б – пример разработанного автоматизированного средства записи результатов измерений для экспериментов на ВРБС, сеанс апрель 2016 г.;
В – пример трёхмерной реконструкции поглощённых доз на основе пакета соосно расположенных плёночных дозиметров, визуализация ROOT; Г – спектральные характеристики ЛПЭ в тонком слое в центре расширенного пика Брэгга, расчёт Geant4.
На рис. 3 приведены показатели сравнения исследуемых групп по критериям размеров опухолевых узлов (рис. 3А), а также торможения роста опухоли относительно контроля (рис. 3Б). Из рисунков видно, что исследуемые схемы облучения в модифицированных пиках сопоставимы между собой и оказывают существенное влияние на характеристики опухолевого роста. В динамике после однократного облучения отмечалось небольшое увеличение объёма опухоли в течение первых трёх суток, последующая стабилизация к 6-7 сут, уменьшение объёма к 12 сут и возобновление роста в период наблюдения до 24 сут. Такая последовательность полностью согласуется с известными классическими представлениями о радиобиологии опухолевых новообразований при опытах на перевиваемых клеточных культурах. Соответствие наблюдаемых радиобиологических эффектов в разных сеансах после облучения в модифицированном по физической дозе пике Брэгга (сеансы декабрь 2015 г., апрель 2016 г.) говорит о достаточно высоком качестве выводимого пучка и сохранении его характеристик между сеансами. В свою очередь, режим облучения «на прострел» в двукратно превышающей физической дозе говорит и о верной предварительной (запланированной априори до постановки эксперимента) оценке величины ОБЭ излучения.
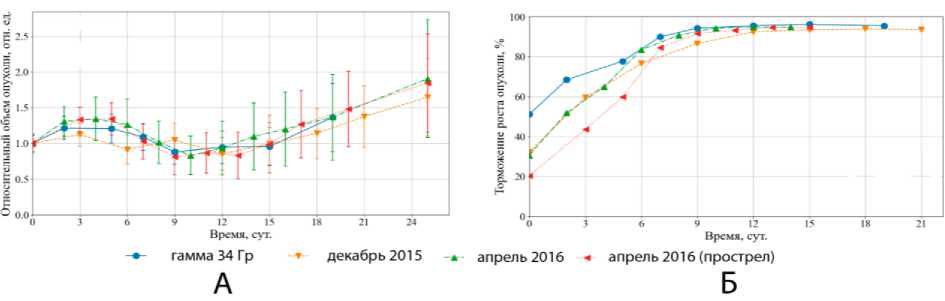
Рис. 3. Результаты наблюдений роста опухоли облучённых животных: А – график относительного роста размеров опухолевого узла в зависимости от дня наблюдения после облучения, среднее по группам; Б – торможение роста опухоли (индекс ТРО) относительно необлучённого контроля.
Оценка зависимости ОБЭ от ЛПЭ приведена на рис. 4 как основной итог работ, полученных на текущем этапе выполнения исследования. В свою очередь, непосредственная оценка коэффициента ОБЭ выполнена на основании комплексного анализа пересчитанных величин поглощённых доз в проведённых экспериментах, с учётом референсных кривых по гамма-излучению в объёме 28, 30, 32, 34 и 36 Гр по критерию относительного размера опухоли, усреднённого по всей наблюдаемой группе, на 14-й день после облучения. При этом в качестве знаменателя при определении ОБЭ для каждой из рассмотренных групп бралась модельная оценка поглощённой дозы ионных пучков в выражении усредненной физической подведённой дозы, а в качестве числителя – ближайшее эквивалентное по эффекту значение из перечисленных референсных групп гамма-излучения. В качестве оценки величин ЛПЭ также взят расчёт, выполненный в среде моделирования, с оценками усреднённого (взвешенного) по дозе ЛПЭ как для режима «прострел», так и для обоих вариантов модификации кривой Брэгга, путём операции математической свёртки графика ЛПЭ, представленного на рис. 2Г и дополнительной операции свёртки с учётом реальных протяжённостей опухоли вдоль продольного распространения пучка. Все неопределённости, включая погрешности выбора референса, фактическое расхождение размера узла на 14-й день у индивидуальных животных, погрешность расположения, негомогенность дозы и различия в ЛПЭ по причине разницы в размерах наблюдаемой опухоли, включены в график в качестве планок погрешностей.
Из графика видно, что в целом зависимость ОБЭ-ЛПЭ в исследованном диапазоне подчиняется монотонно возрастающей зависимости с трендом на линейное возрастание, однако существенные погрешности измеренных данных не позволяют судить о сколь-либо значимом общем характере зависимости. Облучение в точке прострела происходило однократно (сеанс апрель 2016 г.), облучение в физическом пике происходило в двух сеансах с двукратно превышающем числом наблюдений за экспериментальными животными (сеансы декабрь 2015 г., апрель 2016 г.), облучение в биологической модифицированной кривой проводилось в одном временном отрезке (сеанс декабрь 2016 г.) в двух различных дозах, как это было описано выше. Тем не менее, наблюдаемые значения в однократном эксперименте не позволяют существенно сузить величину абсолютной погрешности в этой точке. Неопределённость величины ЛПЭ на рис. 4, в первую очередь, связана с геометрической протяжённостью объекта вдоль направления облучения, статистическая неопределённость проведённых расчётов по оценке значения ЛПЭ (систематическая ошибка) не превышает 4%.
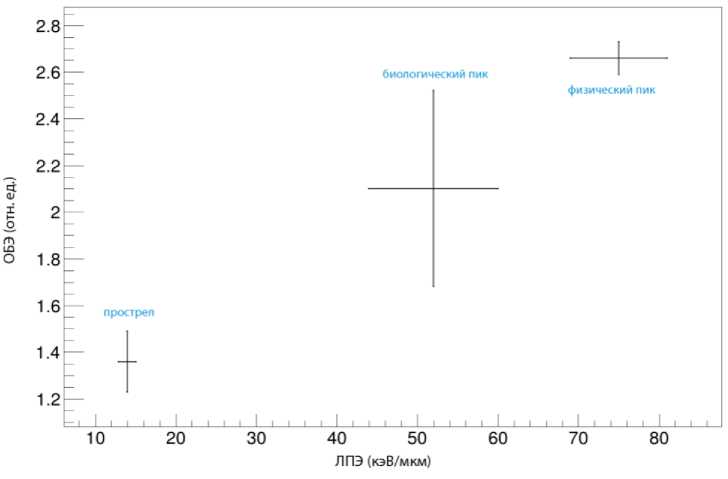
Рис. 4. Расчётно-экспериментальная оценка зависимости ОБЭ от ЛПЭ по обработанным данным, планками погрешности по обоим осям показаны суммированные статистические и систематические ошибки по интегральной оценке наблюдаемых показателей. Под пиками понимаются соответствующие модифицированные кривые Брэгга.
Обсуждение ограничений модели
Ограничения применяемой методики моделирования и полученных результатов во многом связаны с неизбежными упрощениями, которые вносятся на этапе построения виртуальной модели процесса облучения, а также при переносе экспериментальных результатов, полученных на животных, на будущие клинические приложения.
Во-первых, даже при использовании современных методов транспорта частиц невозможно учесть весь спектр их взаимодействий и структурных особенностей реальной биологической ткани, что приводит к определённым погрешностям в расчётных кривых распределения дозы.
Во-вторых, весьма сложная конфигурация исследуемого объекта (в частности, водный фантом с расположенным внутри него контейнером для животного), наряду с широкой вариабельностью анатомических особенностей самих лабораторных крыс, ограничивает воспроизводимость экспериментальных условий и усложняет сопоставление данных между различными сеансами облучения.
Дополнительным фактором, снижающим точность и универсальность полученных результатов, являются различия между моделью опухолевого процесса у лабораторных животных и клиническими случаями у человека. Биологические характеристики имплантированных модельных опухолей могут отличаться от таковых у спонтанных человеческих новообразований, что может вызывать расхождения в оценке терапевтического эффекта.
Кроме того, методика расчёта дозы, основанная на упрощённых предположениях о физикохимических параметрах тканей, не отражает всего многообразия их состояния и структуры на момент облучения, что может привести к искажению реальных дозовых нагрузок.
Заключение
В результате проведённых работ продемонстрирована принципиальная возможность получения данных о радиобиологическом ответе опухолевых клеток на облучение ионами углерода путём тесной интеграции расчётных ( in silico ) и экспериментальных ( in vivo ) подходов. Моделирование в среде GEANT4 позволило уточнить на базе скорректированных спектральных характеристик пучка как глубинное распределение дозы, так и оценку ЛПЭ, что в сочетании с непосредственными наблюдениями динамики роста опухоли у лабораторных животных предоставляет всестороннюю информацию о формировании терапевтического эффекта и потенциальных повреждениях нормальных тканей.
Полученные результаты подтверждают перспективность ионной терапии в качестве эффективного инструмента радиологического воздействия на глубоко залегающие и радиорези-стентные новообразования. При этом выявленные особенности формирования дозы и её биологического действия подчёркивают важность корректного расчёта физических параметров, а также необходимость строгой дозиметрической и радиобиологической верификации. Эксперименты на биологических моделях, несмотря на присущие им ограничения в части воспроизведения клинических условий, остаются решающим этапом, позволяющим оценивать системные эффекты, а также валидировать гипотезы, выдвигаемые на основе расчётных методик. Сформированная методическая платформа может быть использована для дальнейшего совершенствования алгоритмов планирования и оптимизации дозы, а также для определения оптимальных схем и режимов облучения.
Исследование с лабораторными животными одобрено Комиссией по биоэтическому контролю за содержанием и использованием лабораторных животных в научных целях ФГБУ «НМИЦ радиологии» Минздрава России, протокол № 1-H-00065.


