Первично-множественные синхронные злокачественные опухоли сигмовидной кишки и молочной железы в сочетании с менингиомой спинного мозга
Автор: Агапов М.А., Донченко К.А., Кубышкин В.А., Какоткин В.В., Кащеев А.А., Полторако Е.Н., Сигалева Т.В., Бондарь С.В., Бритикова М.В.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 2 (46), 2021 года.
Бесплатный доступ
Общая частота первично-множественных онкологических заболеваний колеблется от 2,4% до 17%. Основные причины возникновения первичномножественных заболеваний включают факторы, связанные с образом жизни пациента, экологические и генетические факторы, а также факторы, связанные с проведенным комплексным лечением ранее выявленных злокачественных заболеваний.Мы демонстрируем клинический случай лечения пациентки с синхронным первично-множественным раком сигмовидной кишки и молочной железы в сочетании с менингиомой спинного мозга. Интересен факт возможной связи между менингиомой и раком молочной железы. Так, риск возникновения менингиом у женщин, перенесших рак молочной железы, и риск рака молочной железы у женщин с менингиомой в анамнезе, умеренно повышен (RR = 1,40-1,64 и 1,54 соответственно). Данная двусторонняя зависимость может быть следствием общих факторов риска и частичного совпадения генно-средовых взаимодействий, определяющих туморогенез.Необходимы дальнейшие исследования, чтобы лучше определить проблемы профилактики, скрининга, диагностики, лечения и безрецидивной выживаемости. Важно, чтобы пациенты с диагнозом «рак» имели информацию о возможных поздних и долгосрочных последствиях лечения и их симптомах, а также о возможных признаках рецидива и появления вторичных опухолей. Важно, чтобы пролеченные по поводу злокачественных новообразований пациенты следовали рекомендациям по профилактике рака и раннему выявлению среди населения в целом, включая отказ от курения, физическую активность, питание и диету, здоровый вес и все стандартные скрининговые обследования на рак.
Рак, онкология, первично-множественный рак, наблюдение, рак молочной железы, менингиома, колоректальный рак
Короткий адрес: https://sciup.org/142230060
IDR: 142230060 | УДК: 616-006.6-031.81 | DOI: 10.38181/2223-2427-2021-2-48-60
Текст научной статьи Первично-множественные синхронные злокачественные опухоли сигмовидной кишки и молочной железы в сочетании с менингиомой спинного мозга
С каждым годом число новых случаев выявления онкологических заболеваний растет. Учитывая достижения современной медицины в отношении ранней диагностики и успешного комплексного лечения злокачественных новообразований,рост и старение населения в сочетании с улучшением показателей безреци-дивной выживаемости привели к увеличению числа пациентов, находящихся в ремиссии после лечения онкологического заболевания. Большинство таких пациентов социально адаптированы,с отсутствием функцио-нальных,когнитивных и психологических нарушений [1]. Данные принципы сохранены и в отношении пациентки нижеизложенного клинического случая.Паци-енты, находящиеся в длительной ремиссии и показывающие хорошие долгосрочные результаты безреци-дивной выживаемости,вызывают особый клинический интерес в плане возникновения первично-множественных злокачественных новообразований различной локализации.
Для формирования правильного диагноза и определения тактики лечения необходимо владеть терминоло-гией,а именно определять разницу между первичномножественным синхронным и метахронным злокачественным новообразованием. Наличие у пациента с онкологическим заболеванием двух или более самостоятельных злокачественных образований, диагностированных одновременно или последовательно, определяется термином «первично-множественные опухоли» [2]. Согласно классификации, первично-множественные злокачественные опухоли принято подразделять по времени их возникновения на синхронные и метахронные [3]. Критерием метахронности при этом считается интервал между диагностируемыми опухолями не менее 1 года и не менее 6 месяцев для рака in situ [2, 3]. Интервал возникновения между первой и второй опухолью в пределах до 6-12 месяцев относят к категории синхронных опухолей.
Общая частота первично-множественных онкологических заболеваний колеблется от 2,4% до 17% [4]. Основные причины возникновения первично-множественных заболеваний включают факторы,связанные с образом жизни пациента, экологические и генетические факторы, а также факторы, связанные с ранее проводимым комплексным лечением первичных злокачественных заболеваний.
Существуют различные критерии, которые позволяют различать онкологические заболевания,которые являются впервые возникшими, и те, которые являются продолжением существующего и ранее выявленного процесса.Двумя наиболее часто используемыми разделениями являются программы Surveillance, Epidem i-ology, and End Results (SEER) Program и International Association of Cancer Registries and International Agency for Research on Cancer (IACR/IARC). База данных SEER учитывает гистогенез опухоли, локализацию и время с момента первоначального диагноза для выявления первично-множественных злокачественных заболеваний и рассматривает отдельные опухоли разных частей одного и того же органа как самостоятельные очаги.Пра-вила IACR/IARC немного отличаются: независимо от времени выявления,поражение одного органа класси-фицируется,как одна опухоль,если нет гистологических различий. База данных SEER рекомендует использовать 2-месячный период для дифференцирования синхронных и метахронных первично-множественных раков, в то время как IARC предлагает 6-месячный период. [5,6,7] Правила программы SEER используются в основном североамериканскими регистрами рака,в то время как правила IACR и IARC используются на международном уровне.
Факторы,связанные с повышенным риском развития более чем одного первичного рака, могут включать генетическую восприимчивость и семейные онкологические синдромы, воздействие окружающей среды и образа жизни (например, табак, употребление алкоголя), гормональные факторы, иммунные нарушения и инфекцию, канцерогенные эффекты предшествующего лечения рака и, наконец, взаимодействия между всеми этими факторами [4, 8, 9]. Около 1–2% всех видов рака связаны с наследственными онкологическими синдромами. Наиболее значимые синдромы предрасположенности к раку в рутинной онкологической практике включают наследственный синдром рака молочной железы и яичников,синдром Линча/наследственный неполипозный рак толстой кишки,множественную эндокринную неоплазию типа 1 и типа 2, болезнь фон Гиппеля-Линдау и синдром Ли-Фраумени [10]. Что касается вышеупомянутых факторов риска, употребление табака, например, является одной из наиболее хорошо известных причин множественных первичных онкологических заболеваний,с преимущественной ассоциацией между раком легких и верхних дыхательных путей (полости рта, глотки, гортани и пищевода) [11, 12, 13]. Па-циенты,находящиеся в ремиссии после лечения рака легких, также демонстрируют повышенный риск разви- тия злокачественных новообразований кожи головы, шеи, мочевого пузыря и контрлатерального легкого [14]. Употребление алкоголя связано с повышенным риском развития рака полости рта и глотки, пищевода, печени, толстой кишки, гортани и молочных желез. Гормональные факторы играют важную роль в развитии рака молочной железы у женщин и некоторых видов рака женской репродуктивной системы. Пациенты могут подвергаться повышенному риску развития множественных первичных злокачественных заболеваний из-за гормональных факторов. Исследования множественных первичных онкологических заболеваний показали увеличение относительного риска развития рака молочной железы,яичников и тела матки,что может быть связано с общими гормональными факторами риска, связанными с менструальным анамнезом и беременностью, а также использованием гормональных препаратов.
Все больше появляется данных, подтверждающих причинно-следственную связь иммунодефицита и инфекций в повышении риска развития первичного и вторичного рака. Синдромы иммунодефицита, приобретенные или унаследованные,связаны с повышенным риском неходжкинской лимфомы,саркомы Капоши и плоскоклеточного рака на открытых солнцу участках кожи. Инфекции, вызванные вирусом папилломы человека (ВПЧ), являются основной причиной рака шейки матки, и были вовлечены в развитие других видов рака аногенитального тракта (вульвы, влагалища, промежности, ануса, полового члена).
Канцерогенный потенциал химиотерапии и лучевой терапии хорошо известен. Связь между некоторыми алкилирующими химиотерапевтическими агентами и риском развития острого лейкоза,который может возникнуть в первые 10 лет после лечения, давно установ-лена.Другие классы лекарств,связанные с повышенным риском острого миелоидного лейкоза,включают ингибиторы топоизомеразы II, антрациклины и препараты на основе платины. Другие виды бластом, связанные с лучевой терапией, включают острый лейкоз, хронический миелолейкоз,а также рак молочной железы, легких, щитовидной железы и немеланомный рак кожи. Поражение костей и соединительных (мягких) тканей с возможной малигнизацией возникает в пределах или рядом с облученной областью у пациентов, получавших высокодозную лучевую терапию (ЛТ). Доза и тип ЛТ, внутренняя восприимчивость облученных тканей и характеристики пациента влияют на риск разви- тия рака, связанного с ЛТ.Риск, как правило, выше, когда ткани организма подвергаются воздействию в более молодом возрасте [15].
Число пациентов с первично-множественными видами рака растет на основании данных программы Национального института рака SEER [16]. С достижениями в области раннего выявления,поддерживающей помощи и эффективного лечения рака,а также с более длительным последующим наблюдением число первично-множественных злокачественных опухолей будет продолжать увеличиваться. У все большего числа пациентов,находящихся в ремиссии,во время планового онкологического обследования обнаруживают новые подозрительные изменения в щитовидной железе, толстой кишке, молочной железе, пищеводе, желчных протоках, голове и шее, которые в противном случае могли бы быть пропущены [17,18].
Определение оптимальной тактики лечения больных с первичным множественным раком является залогом безрецидивной выживаемости пациента.Задача состоит в том,чтобы определить стратегию противоопухолевой терапии, которая охватывает оба типа рака без повышенной токсичности или соответствующих фармакологических взаимодействий, либо определить нужную последовательность лечения обоих новообразований, если речь идет о хирургическом лечении.В этой ситуации нет устоявшихся, основанных на фактических данных руководств и принципов. Решение о том, как следует лечить этих пациентов, должно основываться на междисциплинарных обсуждениях и быть индивидуальными.
Обзор клинического случая
Пациентка 81 года обратилась с жалобами на слабость, периодические запоры, чередующиеся диареей. На момент обращения считала себя больной около 4-х месяцев, когда начали появляться и нарастать вышеуказанные жалобы. Ранее системно не обследовалась, в том числе диспансеризацию не проходила. В ходе обследования были получены следующие результаты:
-
1. При проведении колоноскопии на расстоянии 15–16 см от ануса определяется экзофитное эпителиальное образование ректосигмоидного изгиба толстой кишки протяженностью около 4 см, опухоль I типа по Парижской классификации, субкомпенсированный бластоматозный стеноз ректосигмоидного отдела толстой кишки.
-
2. По данным мультиспиральной компьютерной томографии органов грудной клетки выявлено образование в просвете позвоночного канала по задней по-
- верхности тела Th9 позвонка, размерами 15х10х12мм с сужением канала до 4-5 мм. В верхненаружном квадранте правой молочной железы визуализировано васкуляризированное образование размерами 14х13х15 мм с неровными тяжистыми контурами. Кожа правой молочной железы диффузно утолщена до 7 мм.
-
3. По данным мультиспиральной компьютерной томографии органов брюшной полости с внутривенным контрастированием определяется неравномерное циркулярное утолщение стенки сигмовидной кишки на протяжении около 5,5 см. Регионарная лимфаденопатия. Удвоение ЧЛС левой почки, неполное удвоение левого мочеточника.
-
4. По данным гистологического исследования биопсийного материала выявлена аденокарцинома толстой кишки (8140/3 по классификации ВОЗ).
-
5. МРТ малого таза с контрастом: экзофитное образование средней трети сигмовидной кишки, похожее на малигнизированный ворсинчатый полип T2N0.
-
6. МРТ грудного отдела позвоночника: МР картина менингиомы на уровне тела Th10 позвонка
-
7. Биопсия образования молочной железы: ГИ+ИГХ биопсийоного материала молочной железы:инфильт-ративная карцинома молочной железы неспецифического типа (протоковая) G1, люминальный тип А.
Клинический случай рассмотрен на онкологическом консилиуме. Был уставлен диагноз: Первично-множественный синхронный рак:
-
1) Сигмовидной кишки сТ2 сN0 сM0, стадия I, клиническая группа II.
-
2) Правой молочной железы сТ1b сN0 сM0, стадия Ia, клиническая группа II.
-
3) Менингиома на уровне тела Th10 позвонка.
Проведен онкоконсилиум в составе химиотерапевта, хирурга-онколога-колопроктолога, онколога-маммолога, лучевого терапевта, нейрохирурга. Приняты следующие решения:
-
1. Решение о необходимости выполнения оперативного вмешательства в объеме лапароскопической резекции сигмовидной кишки с D3-лимфодиссекцией в первую очередь.
-
2. Решение о необходимости проведения гормонотерапии в течение 3-х месяцев (ингибиторы ароматазы) по поводу рака правой молочной железы с последующим хирургическим лечением.
-
3. Учитывая отсутствие клинических проявлений в отношении менингиомы Th10, целесообразно динамическое наблюдение.
Первая госпитализация заняла 8 койко-дней. Была выполнена лапароскопическая резекция сигмовидной кишки с наложением десцендо-ректального анастомоза конец-в-конец, D3 лимфодиссекция. Послеоперационный период проходил без особенностей,ранние и отдаленные хирургические осложнения не наблюдались
Гистологическое исследование удаленного участка сигмовидной кишки: высокодифференцированная аденокарцинома толстой кишки рТ4а pN0(0/13) cM0, G1, R0.
В соответствии с решением онкоконсилиума, после проведения гормонотерапии в течение 3-х месяцев (ингибиторы ароматазы) по поводу рака правой молочной железы,пациентке предложено хирургическое лечение в объеме радикальной резекции правой молочной же-лезы,однако пациентка настояла на выполнении радикальной мастэктомии справа с лимфодиссекцией.
Таким образом ко второй госпитализации пациентка подходила уже с уточненным диагнозом:
Первично множественный синхронный рак:
-
1) Рак сигмовидной кишки рТ4а pN0 cM0, стадия IIB. ГИ: высокодифференцированная анденокарцинома G1. состояние после лапароскопической резекции сигмовидной кишки с D3 лимфодиссекцией.
-
2) Рак правой молочной железы сТ1bN0M0, стадия Ia, состояние после 3 месяцев гормонотерапии (ана-стразол 1 мг). ГИ+ИГХ: инфильтративная карцинома молочной железы неспецифического типа (протоковая) G1, люминальный тип А.
В ходе госпитализации была выполнена радикальная мастэктомия справа с пластикой подмышечно-подключично-подлопаточной области мышечным трансплантатом. Послеоперационный период прошел без осложнений. После получения результатов гистологического исследования послеоперационный диагноз приобрел следующий вид:
Первично множественный синхронный рак:
-
1. Рак сигмовидной кишки рТ4а pN0 cM0, стадия IIB. ГИ: высокодифференцированная анденокарцинома G1. состояние после лапароскопической резекции ректосигмоидного отдела ободочной кишки с наложением десцендо-ректального анастомоза конец-в-конец, d3 лимфодиссекцией.
-
2. Рак правой молочной железы ypT1byN0cM0, стадия Ia, состояние после комбинированного лечения: 3 месяца неоадьювантной гормонотерапии (анастразол 1мг) и хирургического лечения в объеме радикальной мастэктомии справа с пластикой подмышечно-подклю-
- чично-подлопаточной области композитным мышечным трансплантатом. ГИ+ИГХ: инфильтративная карцинома молочной железы неспецифического типа (протоковая) G1, люминальный тип А.
При рассмотрении клинического случая на онкоконсилиуме в прежнем составе принято решение о необходимости продолжения гормонотерапии (ингибиторы ароматазы) в течение 5-ти лет, рекомендовано выполнение контрольных обследований в соответствии с программой послеоперационного онкомониторинга, наблюдение у нейрохирурга
Пациентка, через 3года после проведенного лечения, госпитализирована в нейрохирургическое отделение Медицинского Научно-Образовательного Центра МГУ имени М.В. Ломоносова с жалобами на выраженное затруднение ходьбы, снижение чувствительности в ногах,особенно в правой,эпизодические нарушения мочеиспускания, жжение в ногах. Из анамнеза известно, что жалобы начали беспокоить около 6 месяцев назад и быстро прогрессировали;в последние недели перед госпитализацией отмечала невозможность выйти за пределы квартиры,резкое снижение самообслужи- вания,необходимость использования опоры при вставании и ходьбе.
Следует отметить: при детальном обследовании данных в пользу рецидива рака толстой кишки,молочной железы, не выявлено.
В неврологическом статусе отмечен нижний спастический парапарез до 3-4 баллов в правой ноге и до 2-3 баллов в левой ноге, снижение поверхностной и глубокой чувствительности с уровня Th9 (элементы синдрома Броун-Секара), нейропатическая боль в левой ноге до 4-5 баллов по ВАШ. При проведении МРТ у пациентки выявлено интрадуральное экстрамедуллярное объемное образование на уровне Th10, больше слева, с грубой компрессией спинного мозга на данном уровне, наличием очага миелопатии (рис. 1).
Выполнено оперативное вмешательство в объеме ламинэктомии Th10-Th11, микрохирургического удаления опухоли на уровне Th10. В ходе операции особую сложность представляла вентральная локализация опухоли, ограничивавшая тракцию спинного мозга для доступа к солидной части,а также наличие в объемном образовании гиперостоза (оссификации твердой моз-
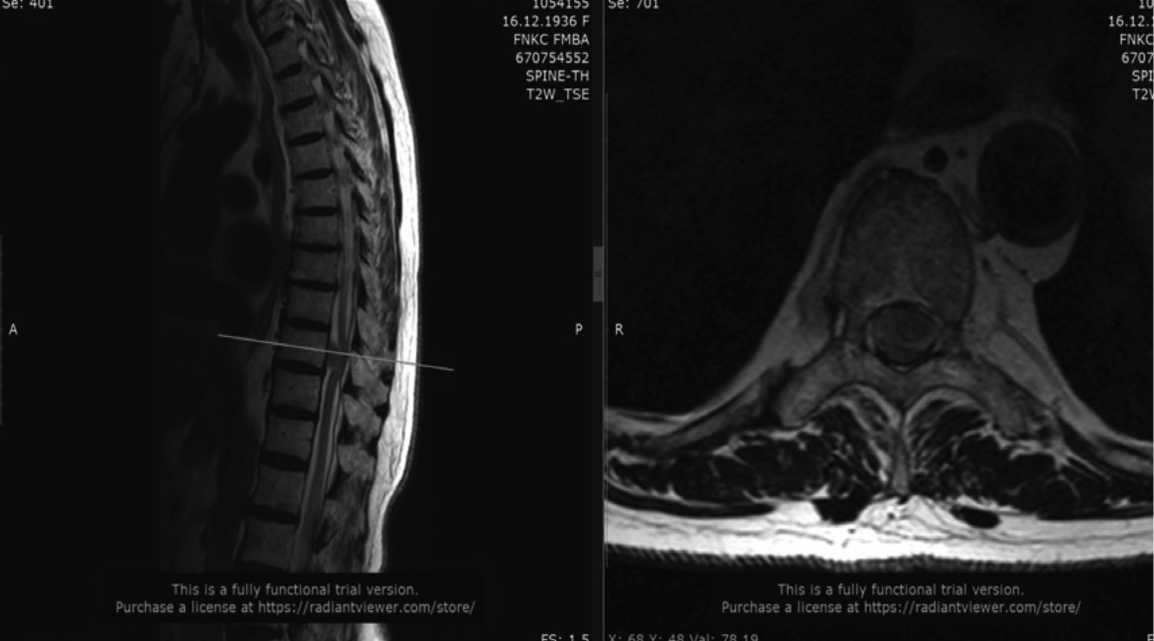
Рис. 1. МРТ грудного отдела позвоночника. Белой стрелкой отмечено новообразование.
Fig. 1. MRI of the thoracic spine. The neoplasm is marked with a white arrow.
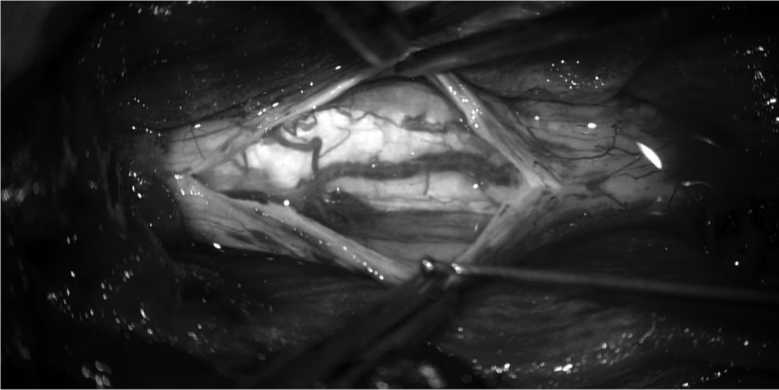
Рис. 2. Вскрытие твердой мозговой оболочки.
Fig. 2. Dissection of the dura mater.
Рис. 3. Фиксация твердой мозговой оболочки.
Fig. 3. Fixation of dura mater.

Рис. 4. Выделение полюсов опухоли.
Fig. 4. Isolation of the tumor poles.
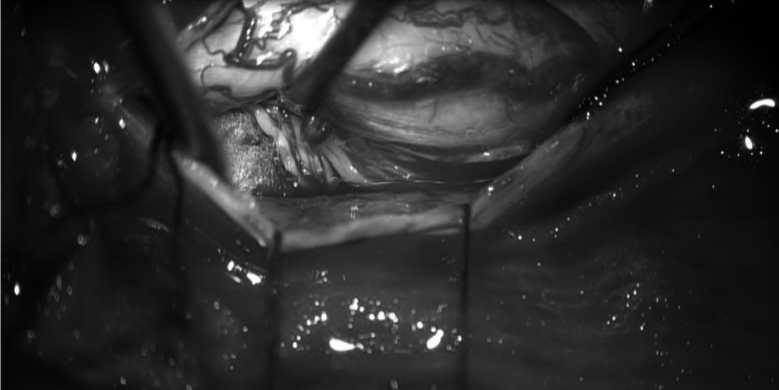
Рис. 5. Дебалкинг центральной части опухоли.
Fig. 5. Debulking of the central part of the tumor.

Рис. 6. Выявлен гиперостоз вентральной части ТМО - источник роста опухоли.
Fig. 6. Hyperostosis of the ventral part of the DM - the source of tumor growth-was revealed.
Рис. 7. Большая часть опухоли удалена мелкими фрагментами электроотсосом.
Fig. 7. Most of the tumor was removed in small fragments using electric pumps.
говой оболочки (ТМО) в зоне роста). Опухоль удалось выделить от полюсов и удалить тотально с минимальной тракцией мозга (рис. 2-9).
В раннем послеоперационном периоде отмечен регресс гипестезии с уровня Th9 и спастического нижнего парапареза в сочетании с нарушениями глубокой чувствительности в левой стопе.Больная активизирована на следующий день с ходунками (рис. 10). На фоне комплексного реабилитационного лечения в течение 1,5 месяцев послеоперационные нарушения в стопе полностью регрессировали, больная способна ходить на существенные расстояния без опоры,полностью обслуживает себя.
С учетом наличия неврологического дефицита, важно начинать раннюю реабилитацию пациента. У пациентки в первые сутки после операции начат курс корпоральной иглорефлексотерапии и ЛФК. Первые двое суток ЛФК проводилось в пределах кровати. На 3сутки пациентка активизирована с ходунками в пределах палаты. Проведена БОС терапия. На этапе ранней послеоперационной реабилитации с первых суток после операции проведено 6 сеансов рефлексотерапии и 6 индивидуалных занятий ЛФК.Достигнут положительный результат: пациентка активизирована может самостоятельно передвигаться при помощи ходунков.
Рис. 8. Спинной мозг избавлен от сдавления.
Fig. 8. The spinal cord is no longer compressed.

Рис. 9. Конечный вид.
Fig. 9. The final view.
Через 5недель от момента операции пациентка госпитализирована с целью дальнейшей реабилитации. Проведен курс иглорефлексотерапии, расширенный курс индивидуальных занятий ЛФК уже с минимальной нагрузкой на кардиотренажере, стабилоплатформе (рис. 11).
Благодаря своевременно проведенной операции и ранней реабилитации достигнут высокий клинический результат.
Риски удаления опухолей вентральной локализации с гиперостозом у пожилых пациентов с сопутствующей патологией резко увеличиваются,что связано со сни- жением компенсаторных возможностей спинного мозга противостоять ишемии при тракции. Тем не менее, мы считаем,что даже в данной возрастной категории необходима радикальная хирургическая тактика, исход которой может быть существенно улучшен благодаря реабилитационному и восстановительному лечению.
Менингеомы представляют собой новообразования, происходящие из мозговых оболочек. За исключением метастазов в головной мозг, они являются наиболее частыми первичными опухолями ЦНС (частота встречаемости около 8 случаев на 100 000 человек в год) [19]. Они чаще встречаются у женщин и у пожилых людей

Рис. 10. Активизация и реабилитация пациентки через 3 дня после операции.
Fig. 10. Activation and rehabilitation of the patient 3 days after the operation.
(старше 65 лет), при этом большинство (~90%) имеют внутричерепную локализацию и только около 10% развиваются из спинномозговых оболочек [20,21]
Компрессия головного и / или спинного мозга менингиомой может привести к таким симптомам, как болевой синдром, двигательные и чувствительные нарушения, судороги, нарушения зрения и психические изменения. Основой метод лечения менингиом – хирургическое удаление,иногда в сочетании с лучевой терапией.
Некоторые наследственные синдромы характеризуются повышенным риском появления менингиом. Наиболее изученным из них является нейрофиброматоз 2 типа, который вызывается мутацией в гене NF2. Рас- пространенность менингиом при данном заболевании составляет около 50%. Дальнейшее изучение данного заболевания привело к открытию того факта, что потеря функции NF2 происходит примерно в 60% спорадических менингиом [22]. Недавние полноэкзомные и полногеномные секвенирования позволили выявить в менингиомах без мутации NF2 дополнительные мутации в генах TRAF7, KLF4, AKT1, PI3K и SMO [23]. Другие наследственные заболевания с повышенным риском возникновения менингиом включают синдром базально-клеточного невуса, множественную эндокринную неоплазию 1 типа (MEN1), синдром Каудена, синдром Вернера, синдром предрасположенности к опухоли BAP1, синдром Рубинштейна – Тайби и семейный

Рис. 11. Пациентка через пять недель после операции.
Fig. 11. The patient's condition is five weeks after the operation.
множественный менингиоматоз, вызванный герминативными мутациями в генах SMARCB1 и SMARCE1 [24].
Также существуют литературные данные о возможной связи между менингиомой и раком молочной же-лезы.Так,риск возникновения менингиом у женщин, перенесших рак груди,и риск рака груди у женщин с менингиомой в анамнезе, умеренно повышен (RR = 1,40-1,64 и 1,54 соответственно). Данная двусторонняя зависимость может быть следствием общих факторов риска и частичного совпадения генно-средовых взаимодействий, определяющих туморогенез [25].
Обсуждение
В целом, заболеваемость первично-множественными видами рака растет в связи с увеличением числа случаев выявления рака на ранних стадиях и достижениями в лечении рака. Различные механизмы, такие как семейный анамнез, генетические дефекты, гормональные факторы,алкоголь,табак и влияние окружающей среды, были вовлечены в развитие множественных первичных раковых заболеваний.Диагностика и лечение множественных раковых заболеваний остается сложной задачей из-за различных определений множественных первичных методов, отсутствия конкретных рекомендаций по скринингу и отсутствия хорошо зарекомендовавших себя рекомендаций по лечению.Веде-ние этих пациентов должно быть индивидуализировано на основе междисциплинарного подхода. Необходимы дальнейшие исследования, чтобы лучше понять и определить проблемы профилактики, скрининга, диагностики, лечения и выживания в этой области. важно, чтобы пациенты с диагнозом рак имели информацию о возможных поздних и долгосрочных последствиях лечения и их симптомах, а также о возможных признаках рецидива и вторичных опухолей. План последующего наблюдения под руководством врача должен включать информацию о рекомендуемом скрининге рака, наблюдении за рецидивами и графике проведения анализов и обследований.В дополнение к рекоменда-циям,специфичным для их первичного рака,возраста на момент первоначальной диагностики и потенциальных рисков, связанных с лечением, важно, чтобы пролеченные по поводу рака пациенты следовали рекомендациям по профилактике рака и раннему выявлению среди населения в целом, включая отказ от курения или прекращение курения, физическую активность, питание и диету, здоровый вес и все стандартные скрининговые обследования на рак.
Список литературы Первично-множественные синхронные злокачественные опухоли сигмовидной кишки и молочной железы в сочетании с менингиомой спинного мозга
- Copur M. S., Manapuram S. Multiple Primary Tumors Over a Lifetime. Oncology (Williston Park, NY). - 2019; 33.7.
- Каприн А.Д., Старинский В.В. Состояние онкологической помощи населению России в 2016 году / МНИОМ им. П.А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава России, Москва, 2017 год. 236 с.
- April Fritz Constance Percy Andrew Jack Kanagaratnam Shanmugaratnam Leslie Sobin D Max Parkin Sharon Whelan. International classification of diseases for oncology (ICD-O) - 3rd edition, 1st revision. WHO, 2013. 252 p.
- Miller KD, Nogueira L, Mariotto AB, Rowland JH, Yabroff KR, Alfano CM, Jemal A, Kramer JL, Siegel RL. Cancer treatment and survivorship statistics, 2019. CA Cancer J Clin. 2019 June 11. https://doi.org/10.3322/caac.21565
- Wood ME, Vogel V, Ng A, Foxhall L, Goodwin P, Travis LB. Second malignant neoplasms: assessment and strategies for risk reduction. J Clin Oncol. 2012 Oct 20;30(30):3734-45. https://doi.org/ 10.1200/JCO.2012.41.8681
- Vogt A, Schmid S, Heinimann K, Frick H, Herrmann C, Cerny T, Omlin A. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. https://doi.org/ 10.1136/esmoopen-2017-000172
- Coyte A, Morrison DS, McLoone P. Second primary cancer risk--the impact of applying different definitions of multiple primaries: results from a retrospective population-based cancer registry study. BMC Cancer. 2014;14:272. https://doi.org/10.1186/1471-2407-14-272
- Amer MH. Multiple neoplasms, single primaries, and patient survival. Cancer Manag Res. 2014;6:119-34. https://doi.org/10.2147/CMAR.S57378
- Scott LC, Kuo TM, Il'yasova D, Mobley LR. Geospatial analysis of multiple cancers in individuals in the US, 2004-2014. Ann Cancer Epidemiol. 2021 Mar;5:2. https://doi.org/10.21037/ace-19-40
- Zheng G, Sundquist K, Sundquist J, Chen T, Försti A, Hemminki A, Hemminki K. Second Primary Cancers After Gastric Cancer, and Gastric Cancer as Second Primary Cancer. Clin Epidemiol. 2021 Jul 2;13:515-525. https://doi.org/10.2147/CLEP.S304332
- Fraumeni JF, Curtis RE, Edwards BK, Tucker MA. Introduction. In: Curtis RE, Freedman DM, Ron E. New malignancies among cancer survivors: SEER Cancer Registries, 1973-2000. NIH Publ. 05-5302. Bethesda, MD: National Cancer Institute; 2006.
- Waespe N, Belle FN, Redmond S, Schindera C, Spycher BD, Rössler J, Ansari M, Kuehni CE; Swiss Paediatric Oncology Group (SPOG). Cancer predisposition syndromes as a risk factor for early second primary neoplasms after childhood cancer - A national cohort study. Eur J Cancer. 2021 Mar;145:71-80. https://doi.org/ 10.1016/j.ejca.2020.11.042
- Begg CB, Zhang ZF, Sun M, Herr HW, Schantz SP. Methodology for evaluating the incidence of second primary cancers with application to smoking-related cancers from the Surveillance, Epidemiology, and End Results (SEER) program. Am J Epidemiol. 1995;142:653-65. https://doi.org/10.1093/oxfordjournals.aje.a117689
- Sung H, Hyun N, Leach CR, Yabroff KR, Jemal A. Association of First Primary Cancer With Risk of Subsequent Primary Cancer Among Survivors of AdultOnset Cancers in the United States. JAMA. 2020 Dec 22;324(24):2521-2535. https://doi.org/ 10.1001/jama.2020.23130
- Forjaz de Lacerda G, Howlader N, Mariotto AB. Differences in Cancer Survival with Relative versus Cause-Specific Approaches: An Update Using More Accurate Life Tables. Cancer Epidemiol Biomarkers Prev. 2019 Sep;28(9):1544-1551. https://doi.org/ 10.1158/1055-9965.EPI-19-0125
- Montiel Ishino FA, Odame EA, Villalobos K, Liu X, Salmeron B, Mamudu H, Williams F. A National Study of Colorectal Cancer Survivorship Disparities: A Latent Class Analysis Using SEER (Surveillance, Epidemiology, and End Results) Registries. Front Public Health. 2021 Feb 25;9:628022. https://doi.org/10.3389/fpubh.2021.628022
- Ishimori T, Patel PV, Wahl RL. Detection of unexpected additional primary malignancies with PET/CT. J Nucl Med. 2005 May;46(5):752-7.
- Miyazaki T, Sohda M, Higuchi T, et al. Effectiveness of FDG-PET in screening of synchronous cancer of other organs in patients with esophageal cancer. Anticancer Res. 2014;34
- McNeill KA. Epidemiology of Brain Tumors. Neurol Clin. 2016 Nov;34(4):981-998. https://doi.org/10.1016/j.ncl.2016.06.014
- Baldi I, Engelhardt J, Bonnet C, Bauchet L, Berteaud E, Grüber A, Loiseau H. Epidemiology of meningiomas. Neurochirurgie. 2018 Mar;64(1):5-14. https:// https://doi.org/doi.org/10.1016/j.neuchi.2014.05.006
- Ketter R, Rahnenführer J, Henn W, Kim YJ, Feiden W, Steudel WI, Zang KD, Urbschat S. Correspondence of tumor localization with tumor recurrence and cytogenetic progression in meningiomas. Neurosurgery. 2008 Jan; 62(1):61-9; discussion 69-70. https://doi.org/10.1227/01.NEU.0000311062.72626.D6
- Choy W, Kim W, Nagasawa D, Stramotas S, Yew A, Gopen Q, Parsa AT, Yang I. The molecular genetics and tumor pathogenesis of meningiomas and the future directions of meningioma treatments. Neurosurg Focus. 2011 May;30(5):E6. https://doi.org/10.3171/2011.2.FOCUS1116
- Clark VE, Erson-Omay EZ, Serin A, Yin J, Cotney J, Ozduman K, Avşar T, Li J, Murray PB, Henegariu O, Yilmaz S, Günel JM, Carrión-Grant G, Yilmaz B, Grady C, Tanrikulu B, Bakircioğlu M, Kaymakçalan H, Caglayan AO, Sencar L, Ceyhun E, Atik AF, Bayri Y, Bai H, Kolb LE, Hebert RM, Omay SB, Mishra-Gorur K, Choi M, Overton JD, Holland EC, Mane S, State MW, Bilgüvar K, Baehring JM, Gutin PH, Piepmeier JM, Vortmeyer A, Brennan CW, Pamir MN, Kiliç T, Lifton RP, Noonan JP, Yasuno K, Günel M. Genomic analysis of non-NF2 meningiomas reveals mutations in TRAF7, KLF4, AKT1, and SMO. Science. 2013 Mar 1;339(6123):1077-80. https://doi.org/ 10.1126/science.1233009
- Kerr K, Qualmann K, Esquenazi Y, Hagan J, Kim DH. Familial Syndromes Involving Meningiomas Provide Mechanistic Insight Into Sporadic Disease. Neurosurgery. 2018 Dec 1;83(6):1107-1118. https://doi.org/ 10.1093/neuros/nyy121
- Custer BS, Koepsell TD, Mueller BA. The association between breast carcinoma and meningioma in women. Cancer. 2002 Mar 15;94(6):1626-35. https://doi.org/ 10.1002/cncr.10410


