Первично-рефрактерная саркома Юинга грудной стенки у взрослого больного (клинический случай). Возможности и роль лучевой терапии
Автор: Поляков А.А., Лушникова П.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 т.15, 2025 года.
Бесплатный доступ
Cаркома Юинга является второй по частоте опухолью костей, уступая только остеосаркоме, а среди группы детей до 15 лет это наиболее частая опухоль костной ткани. Достаточно редко эти опухоли встречаются у пациентов старше 30 лет и моложе 5 лет. Саркома Юинга грудной стенки является редким злокачественным новообразованием, о котором в научной литературе сообщается достаточно редко. В лечении данной нозологии зачастую применяется комплексный подход с применением химиотерапии, хирургии и лучевой терапии. Однако стандарта лечения данной опухоли при прогрессировании на фоне первой линии не существует. Хотя современные комбинированные подходы в лечении, включающие химиотерапию, хирургию и лучевую терапию позволяют добиться контроля заболевания у части больных, отсутствие стандартизированных протоколов для терапии рефрактерных и рецидивирующих форм создает значительные сложности в определении оптимальных терапевтических опций. В реальной клинической практике врачи имеют ограниченный личный опыт ведения таких больных, что приводит к вариабельности в выборе тактики лечения рефрактерных форм и необходимости принятия решений на основе ограниченных данных. В статье рассмотрены основные подходы к лечению, а также возможности и роль лучевой терапии в терапии данного заболевания и представлен клинический случай неоперабельной саркомы Юинга грудной стенки у пациента 50 лет с местным прогрессированием на фоне первой линии химиотерапии.
Саркома Юинга, рефрактерная саркома, грудная стенка, лучевая терапия, клинический случай
Короткий адрес: https://sciup.org/140310767
IDR: 140310767 | DOI: 10.18027/2224-5057-2025-045
Текст научной статьи Первично-рефрактерная саркома Юинга грудной стенки у взрослого больного (клинический случай). Возможности и роль лучевой терапии
В 1921 году Джеймс Юинг сообщил в Трудах Нью-Йоркского патологического общества о случае не известного ранее злокачественного новообразования лучевой кости у девочки 14 лет. Он назвал данную опухоль диффузной эндотелиомой кости, так как полагал, что она происходит из эндотелия кровеносных сосудов ткани костного мозга [1]. В ходе дальнейших исследований были получены доказательства нейроэктодермального происхождения данной опухоли [2].
Среди детей и молодых взрослых саркома Юинга является второй по частоте опухолью костей, уступая только остеосаркоме, а среди группы детей до 15 лет является наиболее частой опухолью костной ткани. Достаточно редко такие опухоли встречаются у пациентов старше 30 лет и моложе 5 лет [3]. Отмечено преобладание пациентов мужского пола, особенно в первые 2–3 десятилетия жизни. Соотношение лиц мужского и женского пола составляет 1,6:1. По разным данным, опухоль в 10 раз чаще диагностируется у детей европеоидной расы, чем у коренных жителей и выходцев из стран Африки и Азии [4].
Появление химиотерапии в 1970-х годах и ее развитие в сочетании с хирургическими и лучевыми методами лечения способствовали улучшению общей и безрецидивной выживаемости, однако в случаях метастатического заболевания прогноз все равно остается неблагоприятным. У детей в возрасте до 15 лет 5-летняя выживаемость за последние 40 лет увеличилась с 59% до 75–80%, а у молодых людей в возрасте от 15 до 19 лет с 20% до 65%. Однако, у пациентов с изолированными метастазами в легких 5-летняя выживаемость составляет не более 30%, а при поражении костей и костного мозга — около 20% [5].
В 1990-х годах в мировой литературе принят термин «опухоли семейства саркомы Юинга»(ОССЮ), объединивший группу опухолей с единым гистологическим происхождением и общими молекулярно-генетическими маркерами:
-
• костную саркому Юинга (КСЮ);
-
• внескелетную саркому Юинга (ВСЮ);
-
• периферическую примитивную нейроэктодермальную опухоль кости (ПНЭО);
-
• злокачественную мелкоклеточную опухоль торако-пульмональной зоны (опухоль Аскина) [2,4].
Для клеток опухолей семейства саркомы Юинга типичным вариантом генетической аномалии является транслокация между геном EWSR1 на хромосоме 22 и геном FLI1 хромосомы 11 [t (11;22) (q24; q12)], приводящая к появлению химерного белка EWS/FLI1, который опосредует аберрантные онкогенные транскрипционные программы и препятствуют основным сигнальным путям, участвующим в клеточном росте, дифференцировке и пролиферации [6].
Практически 100% клеток саркомы Юинга и PNET экспрессируют на своих мембранах поверхностный гликопротеин р30/32MIC2 (СD99), являющийся продуктом онкогена MIC-2. Определение его экспрессии является убедительным подтверждением клинико-рентгенологического диагноза саркомы Юинга. Кроме того, для клеток саркомы Юинга и ПНЭО характерна экспрессия виментина [7].
В 1969 году Melvin Tefft и коллеги впервые описали клинические случаи внесклетной саркомы Юинга [8]. На долю ВСЮ приходится 20–30% всех случаев саркомы Юинга с частотой 0,4 на 1 миллион, что в 10 раз реже, чем при КСЮ [9]. Крайне редки случаи заболевания ВСЮ у пациентов в возрасте 50 лет и старше [10]. Среди мягкотканых сарком ВСЮ составляет от 1% до 2,3% [11]. Чаще ВСЮ локализуется в мягких тканях паравертебральной области [12,13], мягких тканях нижних конечностей [14] и грудной стенки [15]. Реже опухоль возникает в области таза и бедра, забрюшинного пространства и верхних конечностей [10]. Крайне редки первичные поражения легких [16], желудочно-кишечного тракта [17], почек [18], матки [19] и других органов [20]. Прогноз ВСЮ более благоприятен по сравнению с скелетным подтипом. По данным SEER (1973–2007 гг.), пятилетняя выживаемость при локализованной ВСЮ — 69,7% против 62,6% при КСЮ (р = 0,02) [13]. Из-за редкости ВСЮ крупные исследования по лечению и исходам ограничены.
За последние четыре десятилетия было проведено множество международных исследований, целью которых был поиск, изучение прогностических факторов саркомы Юинга и определение групп риска, нуждающихся в персонифицированном лечении. В большом систематическом обзоре S.E. Bosma с соавторами сделали заключение, что наиболее значимыми прогностическими факторами, влияющими на выживаемость больных с саркомой Юинга, являются наличие отдаленных метастазов при постановке диагноза, размер и объем опухоли, степень патоморфоза в ответ на специализированное лечение и расположение первичной опухоли. Взаимосвязь между такими факторами риска, как возраст, раса/этническая принадлежность, уровень ЛДГ, расположение метастазов, метод местного вида лечения (лучевая терапия или хирургия) и выживаемостью неубедительна [21].
Несмотря на достижения современной онкологии, по крайней мере, у четверти пациентов с первоначальной локальной стадией болезни происходит рецидив заболевания после завершения всей запланированной терапии, и шанс на долгосрочную выживаемость у данной группы больных крайне низок. Кроме того, не существует стандартизированных протоколов для терапии рефрактерных и рецидивирующих форм, что вызывает множество вопросов о том, как лучше действовать в случае неудач первой линии терапии [22].
Современная тактика лечения больных саркомой Юинга подразумевает на первом этапе проведение курсов системной полихимиотерапии (ПХТ) с обязательным включением в схемы винкристина, доксорубицина, ифосф-амида и этопозида. Продолжительность первой линии химиотерапии составляет от 6 месяцев до 1 года [23,24].
Общепринятого лечения второй линии противоопухолевого лекарственного лечения для пациентов с рецидивирующей или рефрактерной саркомой Юинга не существует. Большинство пациентов с впервые выявленным рецидивом лечатся стандартной системной химиотерапией. Другие методы лечения, которые были изучены в отношении рецидивирующей саркомы Юинга, включают терапию моноклональными антителами, иммунотерапию, таргетеную терапию мультикиназными ингибиторами [25].
После индукционной химиотерапии обычно решается вопрос о проведении местной терапии с использованием лучевой терапии, хирургического вмешательства или комбинации того и другого.
Хирургическое вмешательство является предпочтительным методом местного лечения в связи с лучшей частотой локального контроля и меньшим риском развития отдаленных осложнений по сравнению с лучевой терапией [26].
В ретроспективном исследовании Children’s Oncology Group было оценено влияние метода локального контроля на клинические конечные точки (безрецидивная выживаемость, общая выживаемость, местное прогрессирование, системное прогрессирование) у 465 пациентов с локализованной костной саркомой Юинга. При многофакторном анализе по сравнению с хирургическим вмешательством лучевая терапия имела более высокий риск локальной неудачи (ОР 2,41; 95% ДИ 1,24–4,68), хотя не было существенных различий в показателях БСВ (ОР 1,42; 95% ДИ 0,94–2,14), общей выживаемости (ОР 1,37; 95% ДИ 0,83–2,26) или отдаленных рецидивов (ОР 1,13; 95% ДИ 0,70–1,84) между группами [27].
Стоит отметить, что ни в одном рандомизированном исследовании не сравнивали хирургию и ЛТ. Объективная оценка преимуществ хирургии над лучевым лечением затруднена, потому что пациенты, получившие ЛТ как метод локального контроля, как правило, имеют более позднюю стадию заболевания и неблагоприятный прогноз [28].
Учитывая высокую радиочувствительность саркомы Юинга, которая была подтверждена с момента первого ее описания Джеймсом Юингом [1], роль лучевой терапии (ЛТ) в лечении этой опухоли неоспорима. Она назначается как метод локального контроля в сочетании с хирургическими методами лечения, в самостоятельном варианте при невозможности оперативного лечения и в паллиативных целях.
Показаниями для проведения предоперационной ЛТ являются прогрессирование опухолевого процесса на фоне химиотерапии, невозможность оперативного лечения в объеме R0, наличие патологических состояний требующих срочной коррекции, таких как компрессия спинного мозга [29,30]. В ретроспективном анализе небольшой группы больных (n = 49) с саркомой Юинга малого таза изучалось влияние селективной и неселективной лучевой терапии на локальный контроль и выживаемость. Неселективная предоперационная ЛТ определялась как использование предоперационной (или неоадъювантной) ЛТ для всех пациентов с опухолями малого таза. Селективная послеоперационная ЛТ проводилась только группе больных с неблагоприятными факторами прогноза (положительный край резекции или недостаточный ответ на химиотерапию). Неселективная предоперационная ЛТ при опухолях области малого таза увеличила выживаемость без местного рецидива (88% против 66,5%), увеличила частоту радикальных резекций (81,5% против 59,1%) и ответ на ПХТ (96,3% против 63,6%) по сравнению с селективной послеоперационной ЛТ. Различий в выживаемости без отдаленных метастазов, 60,0% и 54,5% (p = 0,728) и общей выживаемости (ОВ), 57,7% и 63,6% (p = 0,893) не было [31].
Послеоперационная селективная лучевая терапия показана в случае плохого гистологического ответа на неоадьювантную химиотерапию (10% или более жизнеспособных опухолевых клеток), при наличии позитивных краев резекции после операции (R1 или R2 резекция), в случае оперативного лечения на этапе диагностики, если в последующем не была выполнена “second look» операция, и при расположении опухоли в паравертебральной области или области таза [29,30]. Группа Euro-E.W. I. N. G провела исследование для оценки влияния послеоперационной лучевой терапии (ПОРТ) на локальный контроль у пациентов с локализованной саркомой Юинга и хорошим гистологическим ответом на химиотерапию. В исследование были включены пациенты, участвовавшие в рандомизированном исследовании EE99-Р1, перенесшие операцию после индукционной химиотерапии; 142 из 599 пациентов получили ПОРТ в средней доза 45 Гр. У пациентов, которым была рекомендована адъювантная лучевая терапия, но они ее не получали, 8-летняя частота местных рецидивов составила 30%, в отличие от 11 % рецидивов среди тех, кто получил курс ПОРТ согласно рекомендациям по лечению. Польза ПОРТ была особенно заметна при опухолях объемом ≥ 200 мл и 100% некрозе [32].
Радикальная или самостоятельная лучевая терапия проводится в качестве местного метода лечения в случаях нерезектабельности опухоли, функциональной неопера-бельности пациента, отказа больного от оперативного лечения, а также при опухолях, расположенных в критических областях (голова, таз, позвоночник), где радикальное хирургическое вмешательство привело бы к неприемлемому уровню травматизации тканей и развитию тяжелых осложнений [29,30].
В ретроспективном исследовании с включением 75 пациентов с локализованными опухолями Юинга конечностей и области таза изучались факторы, влияющие на локальный контроль и функциональные результаты после лечения с помощью лучевой терапии (ЛТ). ЛТ проводилась один или два раза в день, средняя доза составила 55,2 Гр. Медиана продолжительности наблюдения составила 4,7 года. Десятилетняя общая выживаемость, выживаемость без рецидивов и локальный контроль составили 48%, 42% и 71 % соответственно. Более низкая выживаемость без рецидивов была связана с более крупными опухолями (81 % для опухолей размером менее 8 см против 39% для опухолей размером более 8 см, p < 0,05) [33].
В другом анализе, проведенном в Мемориальном онкологическом центре имени Слоуна-Кеттеринга, проводилась оценка результатов лечения 60 пациентов с саркомой Юинга. Все пациенты получали химиотерапию, включая винкристин, доксорубицин и циклофосфамид, и лучевую терапию с модулированной интенсивностью в средней дозе 51 Гр. Трехлетний местный контроль составил 77%. У пациентов без метастазов 3-летняя выживаемость без признаков заболевания и общая выживаемость составили 70% и 86% соответственно, в то время как у пациентов с метастазами они составили 21% [34].
Паллиативная лучевая терапия применяется, как правило, в случае метастатического заболевания, с целью облегчения или предотвращения симптомов заболевания при минимизации влияния лечения на качество жизни. В ретроспективном анализе результатов лечения, больных получивших паллиативную лучевую терапию в средней дозе 30 Гр (диапазон 4,5–68,5 Гр) с целью купирования болевого синдрома у 55% наблюдался полный клинический ответ, у 29% наблюдался частичный ответ. Медианная продолжительность ответа составила 4,0 месяца (диапазон от 10 дней до 4,8 года) [35].
Дозы, режим фракционирования, методика лучевой терапии и объемы облучения во многом зависят от клинической ситуации, возраста больного, расположения критических органов. Согласно международным протоколам выделяют следующее объемы облучения:
Объем макроскопической опухоли до лечения (GTV1), который включает максимальное распространение первичной опухоли до начала лечения или прогресса на фоне лечения. Так же в этот объем должны включаться любые клинически вовлеченные лимфатические узлы;
Первоначальный клинический объем мишени (СTV1) охватывает GTV1 c отступом 1–2 см с включением всей зоны пораженных лимфоузлов;
-
• Объем макроскопической опухоли после лечения (GTV2) включает объем остаточной опухоли после курсов ПХТ. Для нерезецированных опухолей GTV2 включает изменения до лечения в костях и остаточную опухоль в мягких тканях после индукционной химиотерапии. В случае резекции в этот объем включается послеоперационное ложе опухоли.
-
• Клинический объем мишени (CTV2) включает GTV2 с отступом 1–2 см с учетом анатомических барьеров распространения опухоли.
-
• CTV3 выделяется при опухолях грудной стенки или при вовлечении плевральных листков, и включает весь объём лёгкого и плевральных полостей.
-
• Планируемый объем мишени (PTV) включает CTV с дополнительным отступом от 3 до10 мм [30,36,37]. Рекомендуемые дозы лучевой терапии при саркоме
Юинга, согласно протоколу AEWS1031, отражены в таблице 1 [36].
Таблица 1. Рекомендуемые дозы лучевой терапии при саркоме Юинга
Table 1. Recommended doses of radiation therapy for Ewing sarcoma
Первичная Последовательный
Вид лучевой терапии СОД (PTV1) буст СОД (PTV2)
Радикальная ЛТ 45 Гр 10,8 Гр
Радикальная ЛТ (позвоночник) 45 Гр 5,4 Гр
Радикальная ЛТ при внекост- 50,4 Гр – ной локализации при полном ответе на ПХТ
Предоперационная ЛТ 36,0 Гр –
Послеоперационная лучевая – 14,4 Гр терапия после предоперационной лучевой терапии при наличии R1-резекции и полном патоморфозе после
НАПХТ (< 10% опухолевых клеток)
Послеоперационная лучевая 14,4 Гр – терапия после предоперационной лучевой терапии при наличии R1-резекции и неполном патоморфозе после НАПХТ (> 10% опухоле вых клеток)
Послеоперационная лучевая 19,8 Гр – терапия после предоперационной лучевой терапии при наличии R2-резекции
Послеоперационная – 50,4 Гр лучевая терапия при наличии
R1-резекции и полном пато- морфозе после НАПХТ (< 10% опухолевых клеток)
Послеоперационная 50,4 Гр – лучевая терапия при наличии
R1-резекции и неполном пато-морфозе после НАПХТ (> 10% опухолевых клеток)
Послеоперационная 45 Гр 10,8 Гр лучевая терапия при наличии
R2-резекции
В рандомизированном контролируемом клиническом исследовании III фазы с участием пациентов с неоперабельной саркомой Юинга было изучено влияние эскалации дозы лучевой терапии на локальный контроль, общую и безрецидивную выживаемости. В группе эскалации дозы (70,2 Гр за 39 фракций) 5-летний локальный контроль был значительно лучше (76,4% против 49,4%; P = 0,02) по сравнению с группой стандартной дозы лучевой терапии (55,8 Гр за 31 фракцию), но различия в общей и безрецидив-ной выживаемости через 5 лет не достигли статистической значимости [38].
Стереотаксическая лучевая терапия (СЛТ) является одним из потенциальных вариантов лечения пациентов с метастатической или рецидивирующей саркомой Юинга. В 2014 году опубликованы результаты ретроспективного анализа группы больных получивших СЛТ по поводу рецидивирующей или метастатической саркомы Юинга и остеосаркомы. Средняя доза при проведении СЛТ с целью локального контроля заболевания составила 40 Гр за 5 фракций (диапазон, 30–60 Гр за 3–10 фракций), средняя доза паллиативной (обезболивающая, гомеостатическая) СЛТ составила 40 Гр за 5 фракций (диапазон 16–50 Гр за 1–10 фракций). Из 14 пациентов, получивших лечебный курс СЛТ, у одного пациента с остеосаркомой наблюдалось прогрессирование в 2 очагах после подведения СОД 30 Гр за 3 фракции. Среди группы больных из 13 пациентов, получивших СЛТ с паллиативной целью, три очага прогрессировали после СЛТ. У двух больных после курса СЛТ отмечены явления поздней токсичности 2 степени (мионекроз, асептический некроз с патологическим переломом), у 1 больного — 3 степени (крестцовая плексопатия). Токсичность наблюдалась и у пациентов, получивших СЛТ c одновременной химиотерапией и при повторном облучении [39].
Облучение всей половины грудной клетки (Hemithorax Irradiation) показано при опухолях грудной стенки с обширным поражением плевры. Рекомендуемые дозы составляют 15–20 Гр (1,5 Гр за фракцию) на все ипсилатеральное легкое и плевру с эскалацией дозы до 45–54 Гр на область первичной опухоли. При наличии метастазов в легких следует рассмотреть возможность облучения всего объема легкого после всех курсов ПХТ до СОД 15–18 Гр [30,36,37].
Достижение достаточного локального контроля и минимизация побочных постлучевых эффектов являются основными целями ЛТ. Оптимальный выбор различных методик и видов ионизирующего излучения может позволить снизить токсичность, не снижая локальный контроль. Лучевая терапия с модуляцией интенсивности (IMRT), протонная лучевая терапия (ПЛТ), брахитерапия являются основными современными инструментами для обеспечения оптимального покрытия опухоли и сохранения критических структур [40]. В сравнительном исследовании 2013 г. были оценены преимущества лучевой терапии с модулированной интенсивностью (IMRT) по сравнению с трехмерной конформной лучевой терапией (3D–CRT) при саркоме Юинга таза. Оба метода показали сопоставимые результаты в отношении локального контроля опухоли, но IMRT была связана с меньшей частотой острых и поздних токсических эффектов, особенно со стороны желудочнокишечного тракта и мочеполовой системы. Однако исследование не выявило различий в показателях выживаемости между двумя группами [41].
Применение ПЛТ является предпочтительным методом лучевой терапии, особенно среди педиатрических боль- ных. ПЛТ позволяет добиться наилучших дозиметрических результатов при минимальном воздействии на здоровые ткани, таким образом, снизив риск развития вторичных злокачественных новообразований и других поздних осложнений у детей [42]. В ретроспективном анализе медицинских карт 30 детей с саркомой Юинга в период с апреля 2003 по апрель 2009 года изучалось влияние протонной терапии на клинические конечные точки. Средняя доза составила 54 Гр. Трехлетние показатели БРВ, локального контроля и ОВ составили 60%, 86% и 89% соответственно. Кумулятивная частота повторных злокачественных новообразований составила 7% через 2 года и 15% через 3 года после начала облучения [43].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент Ш. 50 лет, мужчина европеоидной расы, в октябре 2023 года отметил появление умеренно болезненного объемного образования в области грудной клетки слева. Спустя неделю присоединились жалобы на общую слабость, потливость в ночное время, повышение температуры тела до 38° С, снижение аппетита. Обратился в поликлинику по месту жительства, по данным рентгенографии органов грудной клетки выявлен экссудативный плеврит слева, направлен в дежурный терапевтический стационар.
27.11.2023 выполнена спиральная компьютерная томография грудной клетки (СКТ ОГК), по данным которой визуализирован ателектаз S8–10 слева, субателектазы S4–6 слева, с наличием сливных очагов консолидации по периферии. Определялись мелкие фиброзные тяжи в проекции апикальной плевры обоих легких, на уровне нижней доли левого легкого неравномерное скопление жидкости до 49,5 мм. На этом фоне отмечалось неравномерное утолщение плевры: на уроне 7–10 ребер по лопаточной линии,
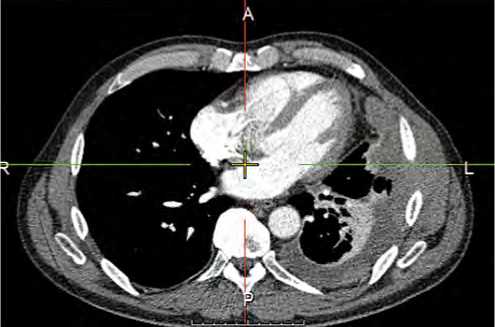
Рисунок 1. Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки 27.11.2023. Утолщение плевры в виде мягкотканого конгломерата размерами 52,0 × 113,5 мм
Figure 1. Multispiral computed tomography of the chest 11 / 27 / 2023. Thickening of the pleura in the form of a soft tissue conglomerate measuring 52.0 × 113.5 mm с распространением до передней подмышечной линии на уровне 5–7 ребер, толщиной до 20,0 мм, с неровными контурами и инвазией 5–7 межреберных промежутков по подмышечной и передней подмышечной линии в виде мягкотканного конгломерата размерами 52,0 × 113,5 мм (рис. 1).
По данным УЗИ мягких тканей от 27.11.2023 описано протяженное гипоэхогенное образование неоднородной структуры на глубине 15 мм внутримышечно, вероятно, исходящее из полости грудной клетки, размером не менее 55 × 17 мм, с четким, неровным контуром. По данным бронхоскопии патологии рельефа слизистой оболочки трахеобронхиального дерева не выявлено.
В общеклинических анализах грубых изменений не выявлено, отмечено только увеличение С-реактивного белка до 134,0 мг/л, гипопротеинемия.
Выставлен диагноз неуточненного плеврального поражения, рекомендовано обратиться к онкологу по месту жительства для дальнейшего обследования.
Онкологом была выполнена трансторакальная биопсия опухоли левой половины грудной клетки. При гистологическом исследовании в материале выявлены фрагменты опухоли, построенной из мелких клеток с гиперхром-ными ядрами и неразличимой цитоплазмой. Опухолевые клетки формировали солидные поля и тяжи, разделенные на отдельных участках фиброзными прослойками и тонкостенными сосудами синусоидного типа. В некоторых фрагментах биоптата определялись поперечнополосатые мышечные клетки, инфильтрированные опухолью.
При иммуногистохимическом анализе биопсийного материала в опухолевых клетках отсутствовала экспрессия маркеров эпителиальных (Multi-Cytokeratin), лимфоцитарных (CD45, PAX5, CD56,) и нейроэндокринных опухолей (Chromogranin A, Synaptophysin, INSM), при этом отмечалась яркая диффузная мембранная экспрессия CD99 и ERG с уровнем пролиферативной активности Кі 67–40%.
Материал направлен на FISH-исследование. Ткань опухоли обработана ДНК-зондами EWSR1 (22q12) и ДНК-зондами SS18 (18q11). Обнаружена транслокация гена EWSR1 (22q12).
Пациенту выставлен диагноз: саркома Юинга грудной стенки слева cT4bN0M0 (AJCC, 8th ed 2017).
С 12.01.2024 начата альтернирующая полихимиотерапия согласно рекомендациям RUSSCO по схеме VAC/IE Курсы ПХТ переносил удовлетворительно, с явлениями астении и анемии 1 степени
После трех курсов ПХТ (2 VAC/1IE) 18.03.24г пациенту выполнена ПЭТ-КТ c 18F-ФДГ. Получено заключение о наличии местнораспространенного метаболически активного объемного образования мягких тканей грудной стенки слева с метаболически активными уплотнениями и узловыми образованиями по костальной плевре и в рёберно-диафрагмальном синусе слева — более вероятно, вторичного генеза. Динамика опухолевого процесса не оценена (рис. 2).
После 6 курсов химиотерапии (3VAC / 3IE) в мае 2024 в ходе контрольного обследования по данным СКТ
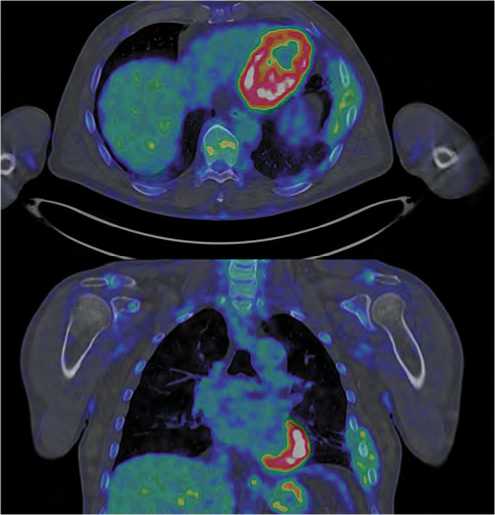
Рисунок 2. ПЭТ-КТ с 18F-ФДГ от 18.03.24 г.: метаболически активное объемное образование мягких тканей грудной стенки слева с метаболически активными уплотнениями и узловыми образованиями по костальной плевре и в рёберно-диафрагмальном синусе слева.
Figure 2. PET-CT with 18F-FDG from 03 / 18 / 24: metabolically active volumetric soft tissues mass of the left half of the chest wall with metabolically active compactions and nodular formations along the costal pleura and in the costophrenic sinus on the left
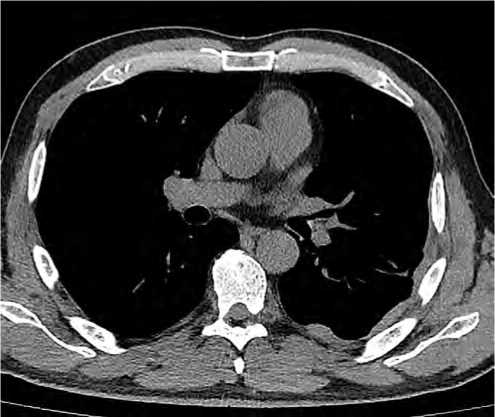
Рисунок 3. СКТ ОГК от 16.05.2024: уменьшение опухолевого образования грудной стенки слева до 88 × 35 мм (ранее на аналогичных срезах около 118 × 46 мм) и уменьшение образования вдоль костальной плевры до 33 × 12 мм (ранее 45 × 15 мм)
Figure 3. CT scan of the chest from 05 / 16 / 2024: reduction of the tumor formation of the chest wall on the left to 88 × 35 mm (previously on similar sections about 118 × 46 mm), and reduction of the formation along the costal pleura to 33 × 12 mm (previously 45 × 15 mm)
ОГК от 16.05.2024 отмечена положительная динамика в виде уменьшения опухолевого образования грудной стенки слева до 88 × 35 мм (ранее на аналогичных срезах около 118 × 46 мм) и уменьшения образования вдоль костальной плевры до 33 × 12 мм (ранее 45 × 15 мм) (рис. 3).
В июле 2024 года пациенту проведен 8 курс ПХТ (4VAC/4IE). В межкурсовом интервале пациент отметил рост объемного образования в левой половине грудной клетки, появление одышки лежа, субфебрилитет в вечернее время. Самостоятельно 27.08.2024 выполнил ПЭТ-КТ с 18F-ФДГ. Заключение: в сравнении с ПЭТ исследованием от 18.03.2024 отмечается прогрессирование в виде значительного увеличения многоузлового объемного образования грудной стенки слева со слиянием ранее отдельных узлов в единый конгломерат с выраженным повышением его метаболической активности (более чем два раза), увеличение отдельного мелкого узлового образования плевры слева (рис. 4).
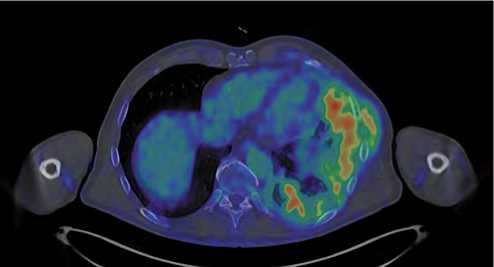
Рисунок 4. ПЭТ КТ от 08.2024: увеличение объемного образования грудной стенки слева со слиянием ранее отдельных узлов в единый конгломерат с выраженным повышением его метаболической активности более чем в два раза
Figure 4. PET CT from 08.2024: an increase of the chest wall mass on the left with the fusion of previously separate nodes into a single conglomerate with a pronounced increase in its metabolic activity by more than two times
Пациент осмотрен на междисциплинарном консилиуме онкологического диспансера. Учитывая прогрессирование на фоне первой линии ПХТ, отказ больного от дальнейших курсов ПХТ принято решение о проведении паллиативной дистанционной лучевой терапии.
11.09.2024 пациент поступил в отделение радиотерапии. При первичном осмотре предъявлял жалобы на наличие умеренно-болезненного объемного образования в левой половине грудной клетки, одышку в положении лежа, субфебрилитет в вечернее время, выраженную слабость. Объективно: грудная клетка слева деформирована подкожными опухолевыми узлами, болезненными, несмещаемыми. При перкуссии звук справа во всех отделах легких легочный, одинаковый. Дыхание везикулярное, хрипы не выслушивались. При перкуссии слева притупление перкуторного звука в нижних отделах (до 4 ребра)
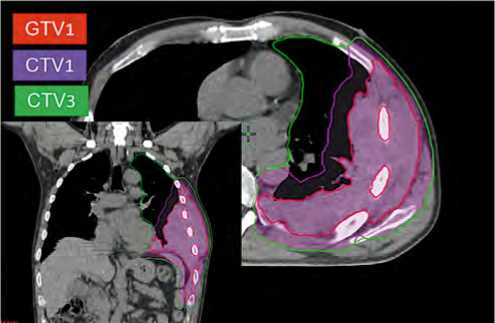
Рисунок 5. Объемы облучения: GTV1-опухолевые очаги, выявленные на КТ и ПЭТ-КТ, CTV1 = GTV + 1,5 см радиально. CTV3-весь объем левого легкого и плевральных полостей
Figure 5. Irradiation volumes: GTV1-tumor foci identified on
CT and PET-CT, CTV1 = GTV + 1.5 cm radially. CTV3-the entire volume of the left lung and pleural cavities
Дыхание выслушивается только над верхушкой левого легкого. ЧДД 21 в мин.
Учитывая распространенность и расположение опухолевого процесса, а также наличие плеврального поражения по данным ПЭТ-КТ от 27.08.2024, пациенту был запланирован курс ДЛТ в два этапа: дистанционная лучевой терапия на область левой половины грудной клетки в РОД 1,5 Гр до суммарной дозы 18 Гр, вторым этапом — буст на опухолевые очаги в левой половине грудной клетки в режиме стандартного фракционирования до суммарной дозы 54 Гр (с учетом соблюдения толерантных уровней доз на критически органы).
Перед началом лучевого лечения выполнена предлуче-вая подготовка: КТ-топометрия грудной клетки на аппарате Aquilion LB (Toshiba), толщина среза 2 мм с использованием индивидуальных внешних фиксирующих устройств (WingBoard with T-Grip, фиксатор коленей и ступней).
На станции оконтуривания MONACO (версия 5.51.10) выполнялось оконтуривание органов риска и мишеней с совмещением диагностических снимков КТ до начала спецлечения, ПЭТ-КТ при прогрессировании процесса и топометрических изображений (image fusion), согласно КР МЗ РФ и рекомендациям и ASTRO.
Опухолевый объем, выявленный на ПЭТ-КТ при прогрессировании заболевания, значительно превосходил объем поражения, выявленный при КТ до начала курсов ПХТ, в связи с чем GTV1 (gross tumor volume) для первого этапа лечения включал ПЭТ-позитивный объем распространения опухоли в мягких тканях. Клинические объемы облучения включали в себя весь объем левого легкого и плевральных листков (CTV3) и GTV с отступом 1,5 см радиально (CTV1). Отступ для Planning Tumor Volume (PTV) составил 10 мм радиально (рис. 5).
Дозиметрическое планирование осуществлялось в среде Monaco (версия 5.51.10) с использованием модели пучка
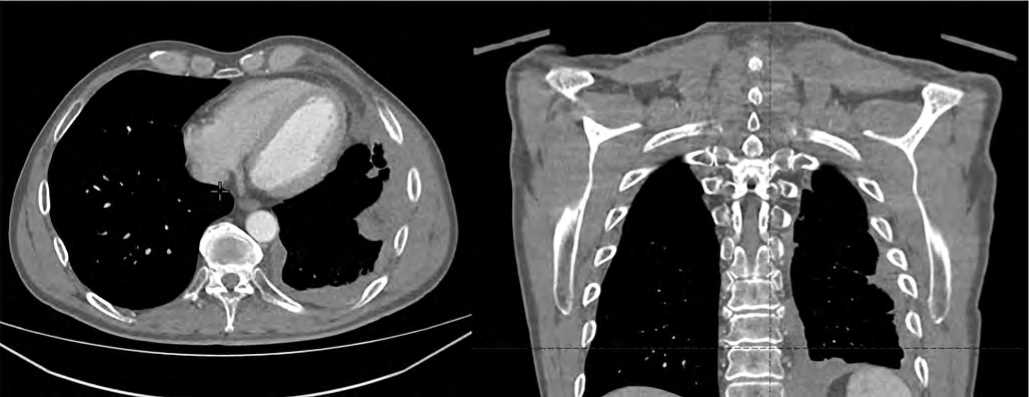
Рисунок 6. СКТ от 02.11.2024: СКТ картина мягкотканного образования грудной клетки слева с признаками местного распространения с уменьшением размеров в динамике до 90 × 40 мм (ранее на аналогичных срезах около 124 × 52 мм), с уменьшением мягкотканого образования на уровне ребер и узлов по плевре
Figure 6. CT scan from 02.11.2024: CT scan of a soft tissue mass in the chest on the left with signs of local spread with a decrease in size over time to 90 × 40 mm (previously — about 124 × 52 mm), with a decrease in the soft tissue mass at the level of the ribs and nodes along the pleura
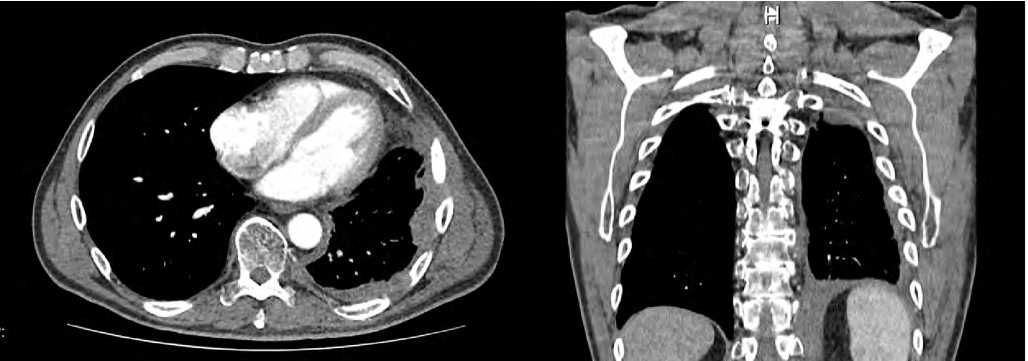
Рисунок 7. СКТ от 03.02.2025: СКТ картина мягкотканного образования грудной клетки слева с признаками местного распространения. В динамике от 02.11.2024 отмечается уменьшение размеров образования до 76 × 36 мм (ранее на аналогичных срезах около 90 × 40 мм)
Figure 7. CT scan from 02 / 03 / 2025: CT scan of a soft tissue mass in the chest on the left with signs of local spread.
In dynamics from 11 / 02 / 2024, a decrease in the size to 76 × 36 mm is noted (previously about 90 × 40 mm).
фотонов с энергией 10 МэВ для линейного ускорителя Elekta Synergy. Для данного случая была выбрана технология подведения поглощенной дозы к опухоли — ротационная лучевая терапия с модуляцией интенсивности фотонного пучка VMAT (Volumetric Modulated Arc Therapy).
Каждый план состоял из двух взаимообратных арок (дуг), включающих по две суб-арки под углом 180 градусов. Начальный угол для каждой арки составлял 0 градусов с поворотом по часовой стрелке при инкременте не более 30. Угол коллиматора подбирался исходя из анатомических особенностей пациента для лучшего прикрытия критических структур и составлял 15 градусов для первой и 345 градусов для второй арок. Максимальное число контрольных точек на каждую арку — 150, с шириной beamlet 0,3 см. Ширина расчетной сетки 0,3 см, минимальная ширина сегмента 0,9 см.
Геометрия дозиметрического плана для второго этапа терапии совпадала с геометрией первого этапа, за исключением выбора точки изоцентра, который разместили на КТ-срезе, совпадающим со срезом, на котором располагался центр мишени. В процессе планирования приоритет отдавался покрытию мишени.
Оценка дозиметрических планов проводилась согласно протоколу ICRU 83 по критериям конформности, гомоген- ности и по распределению поглощенной дозы в объеме мишени и критических структурах на основе гистограммы доза-объем.
Курс лучевой терапии проводился с ежедневным контролем положения пациента и мишеней на лечебном столе с использованием трехмерных рентгеновских изображений (XVI).
После подведения суммарной дозы 18,0 Гр на первом этапе лечения отмечено значительное уменьшение опухолевого объема в левой половине грудной клетки. При объективном осмотре ранее пальпируемое объемное образования в левой половине грудной клетки не определялось. Клинически у пациента исчезла одышка и полностью купирован болевой синдром.
Курс лучевой терапии пациент перенес удовлетворительно с явлениями гематологический токсичности 2 степени по шкале EORTC/RTOG, не требующей медикаментозной коррекции и перерыва в лечении.
02.11.2024, через 2 недели после завершения курса ДЛТ, выполнено контрольное обследование, включающее СКТ органов грудной клетки, брюшной полости и забрюшинного пространства, по данным которого отмечена положительная динамика в виде значительного уменьшения опухолевой массы левой половины грудной клетки (рис. 6).
На мультидисциплинарном консилиуме вновь был рассмотрен клинический случай больного. Коллегиально рекомендована ПХТ 2 линии, однако пациент от предложенного лечения отказался. С ноября 2024 года пациенту начата терапия мультитирозинкиназным ингибитором пазопанибом. В феврале 2025 года в ходе контрольного обследования отмечена стабилизация процесса (рис. 7), явлений ранней лучевой токсичности не наблюдалось. Терапию пазопанибом переносил без выраженных побочных явлений.
ОБСУЖДЕНИЕ
Внескелетная саркома Юинга — редкая опухоль, поражающая в основном молодых людей, с плохим прогнозом и очень высокими показателями смертности, особенно при метастатических формах.
ВСЮ часто имеет скрытое начало, не имеет специфических клинических проявлений, тем самым затрудняя раннюю диагностику. Наиболее часто первым проявляющимся симптомом является быстро растущее болезненное мягкотканое образование. При первичной постановке диагноза часто опухоли имеют значительное распространение, что значительно ухудшает прогноз и коррелирует с более высокой смертностью.
Стандартных подходов в лечении при прогрессировании заболевания после первой линии терапии у данной нозологии не существует. Учитывая отрицательную динамику опухолевого процесса на фоне первой линии ПХТ и невозможность оперативного лечения, единственной возможной терапевтической опцией в описанном клиническом случае была лучевая терапия.
Приведенное клиническое наблюдение является интересным в связи с локализацией и распространённостью опухолевого процесса, нетипичным для данной нозологии возрастом больного и первично-рефрактерным течением заболевания с хорошим ответом на проведенный курс лучевой терапии.
Нестандартным аспектом является отказ от курсов ПХТ в пользу таргетной терапии. Несмотря на изменение подхода, достигнутый эффект в виде стабилизации заболевания подтверждает потенциал комбинированной стратегии — лучевой терапии с последующей таргетной терапией. Однако для оценки долгосрочной эффективности и безопасности подобной тактики необходимо целенаправленно формировать когорты пациентов с тщательным наблюдением их исходов. Сбор и анализ таких данных позволит оценить роль нестандартных подходов в клинической практике и оптимизировать алгоритмы лечения пациентов с резистентными опухолями.
Лучевая терапия — важный компонент комбинированного лечения пациентов с опухолями семейства Юинга и является разумной альтернативой для неоперабельных больных, а использование современных методик лучевой терапии (IMRT/VMAT) позволяют добиться клинической эффективности с приемлемым уровнем токсичности. Поэтому необходимо продолжать исследования по применению лучевой терапии у данной категории больных и собирать информацию о столь редкой опухоли.


