Первичные опухоли центральной нервной системы
Автор: Улитин А.Ю., Желудкова О.Г., Иванов П.И., Кобяков Г.Л., Мацко М.В., Насхлеташвили Д.Р., Проценко С.А., Рыжова М.Ф.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.13, 2023 года.
Бесплатный доступ
Опухоли центральной нервной системы, глиобластома, астроцитома, эпендимома, первичная лимфома, герминома, медуллобластома, олигодендроглиома, пинеобластома, метилирование, химиотерапия, лучевая терапия, ген мgmt, ко-делеция 1p/19q, ген idh1, ген idh2
Короткий адрес: https://sciup.org/140302373
IDR: 140302373 | DOI: 10.18027/2224-5057-2023-13-3s2-1-120-147
Текст статьи Первичные опухоли центральной нервной системы
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация TNM в нейроонкологии не используется.
2. ДИАГНОСТИКА 2.1. Обследование
Обследование пациента с первичной опухолью ЦНС включает в себя:
-
• сбор данных анамнеза;
-
• неврологический осмотр с оценкой общемозговых и /или очаговых неврологических симптомов, наличия судорожного синдрома, нарушения движений, чувствительности, речи, праксиса, симптомов поражения черепных нервов, психических нарушений, менингеальных симптомов;
-
• осмотр нейроофтальмолога (оценивается острота зрения, поля зрения, состояние дисков зрительных нервов, глазодвигательные нарушения);
-
• осмотр отоневролога;
-
• нейровизуализационные исследования:
– МРТ в трех проекциях в стандартных режимах (Т1, Т2, Т1 с контрастированием, FLAIR, DWI); при локализации опухоли в области речевых и двигательных зон выполняется функциональная МРТ (фМРТ) и МР-трактография. При подозрении на диссеминацию опухоли по оболочкам спинного мозга выполняется МРТ с контрастированием всего спинного мозга. При необходимости выполняется МР-ангиография, МР-перфузия, МР-спектроскопия;
– при невозможности выполнения МРТ (наличие кардиостимулятора или ферромагнитных имплантов, другие причины) проводится КТ с контрастированием (КТ-перфузия, КТ-ангиография);
– при необходимости (дифференциальная диагностика с инфекционными, демиелинизирующими, сосудистыми и прочими заболеваниями) выполняется ПЭТ (ПЭТ-КТ) с метионином, тирозином, метил-допа;
– при невозможности выполнить гистологическое исследование опухолевой ткани клинический диагноз может быть установлен на основании нейровизуа-лизационных методик (МРТ, ПЭТ с аминокислотами);
– пациентам с глиомами в течение первых 24–72 часов послеоперационного периода выполняется МРТ/КТ с контрастированием;
-
• инструментальные исследования;
-
– ЭЭГ — при наличии судорожного синдрома;
-
– рентгенография и/или КТ органов грудной клетки;
-
– ЭКГ, ЭхоКГ — по показаниям: при наличии кардиоваскулярных заболеваний, в возрасте старше 60 лет, в случае предполагаемой операции в положении «сидя», при планировании лучевой и/или химиотерапии;
-
– УЗИ вен нижних конечностей (для исключения тромбоза), УЗИ внутренних органов;
-
• лабораторная диагностика: развернутый клинический и биохимический анализы крови, коагулограмма, D-димер, общий анализ мочи, опухолевые маркеры (РЭА, АФП и другие) по показаниям.
-
2.2. Морфологический и молекулярно-генетический диагноз
Формулировка морфологического диагноза должна включать в себя 5-значный код опухоли в соответствии с классификацией ВОЗ опухолей ЦНС (2021 г.), 4-значный код локализации опухоли (в соответствии с МКБ-10), а также степень злокачественности (grade). Ключевым фактором в определении тактики лечения и прогноза заболевания является гистологический диагноз и grade, которая имеет 4 степени: grade 1 - нет критериев злокачественности; grade 2 - один критерий злокачественности (атипия ядер), grade 3 - два критерия злокачественности (атипия ядер, митозы), grade 4 - три или четыре критерия злокачественности (атипия ядер, митозы, пролиферация эндотелия, некрозы). Критерии степеней злокачественности астроцитом с мутацией в генах IDH представлены в табл. 1.
Таблица 1. Критерии степени злокачественности астроцитом с мутацией в генах IDH1 / IDH2 .
|
Grade |
Признаки |
|
Grade 2 |
|
|
Grade |
Признаки |
|
Grade 3 |
|
|
Grade 4 |
• Диффузно-инфильтративная астроцитарная глиома с мутацией в генах IDH1 или IDH2 , проявляющаяся микрососудистой пролиферацией (пролиферация эндотелия) или некрозом, или гомозиготной делецией CDKN2A и/или CDKN2B , или любой комбинацией этих признаков |
Молекулярно-генетическое тестирование необходимо выполнить для постановки корректного патоморфологического диагноза в соответствии с классификацией ВОЗ опухолей ЦНС (2021 г.). Согласно классификации, рубрика «Диффузные глиомы у взрослых» упрощена до трех основных типов: 1) астроцитома с мутацией в генах IDH (grade 2–4); 2) олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q (grade 2–3); 3) глиобластома без мутаций в генах IDH . Исключена такая нозологии как «Глиобластома с мутацией в генах IDH ». Теперь эти новообразования обозначаются как «Астроцитома с мутацией в генах IDH grade 4». Присутствие в опухоли мутаций в генах IDH является ключевым диагностическим признаком для диффузных глиом grade 2, grade 3, grade 4 у взрослых и вторичных глиобластом, что помогает дифференцировать первичную глиобластому от глиом grade 2, grade 3, grade 4. Глиомы grade 1 не несут в опухоли мутаций в генах IDH . Мутации в генах IDH коррелируют с метилированием промотора гена MGMT , пациенты с этими новообразованиями имеют лучший прогноз и ответ на ЛТ и ХТ алкилирующими препаратами. Диагноз «Олигодендроглиома» может быть установлен только в том случае, если опухоль имеет и мутацию в гене IDH1 или IDH2 , и ко-делецию 1p19q. Последняя подтверждает благоприятный прогноз и является предиктором хорошего ответа на терапию алкилирующими препаратами. Наличие гомозиготной делеции CDKN2A и/или CDKN2B изменяет степень злокачественности в диффузных астроцитомах на «grade 4» (табл. 1). Тестирование на мутацию в гене TERT не является обязательным, однако данная мутация является характерной для олигодендроглиом (у взрослых) и первичной глиобластомы. Ее наличие при отсутствии мутации в генах IDH связано с неблагоприятным прогнозом. Опухоли с мутациями в гене BRAF могут отвечать на лечение ингибиторами BRAF . Схематически диагностический алгоритм представлен на рис. 1, а основные молекулярно-генетические аберрации — в табл. 2.
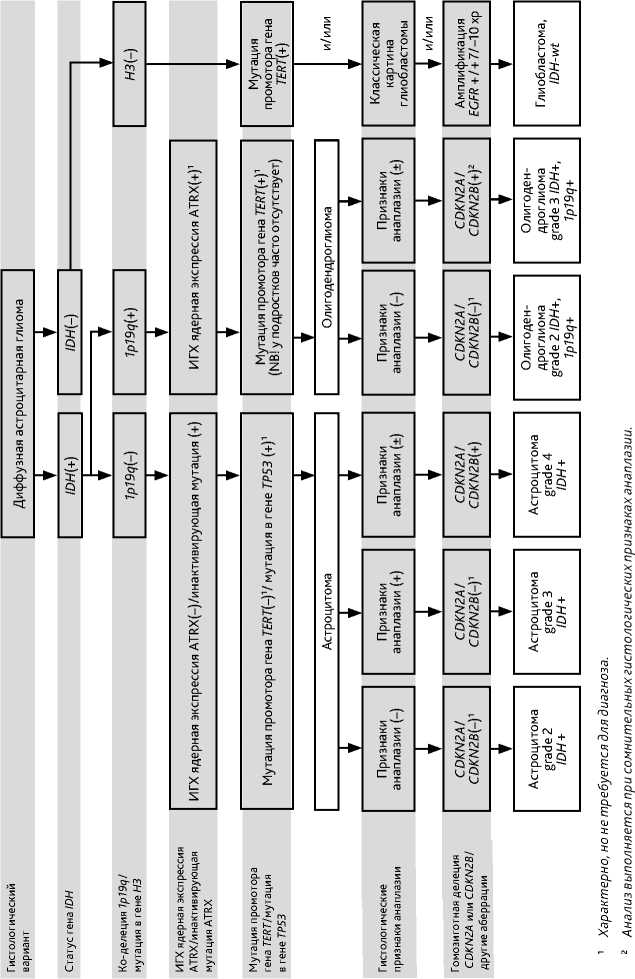
Рисунок 1. Алгоритм диагностики диффузных глиом.
Таблица 2. Диагностически значимые молекулярно-генетические аберрации (ВОЗ, 2021 г.).
|
Тип опухоли |
Характерные повреждения генов/молекулярный профиль |
|
Диффузные глиомы у взрослых |
|
|
Астроцитома с мутацией в генах IDH |
IDH1 , IDH2 |
|
Олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q |
IDH1 , IDH2 , 1p/19q |
|
Глиобластома без мутаций в генах IDH |
IDH-wt , хромосомы 7 и 10, TERT , EGFR , другие |
|
Диффузные глиомы низкой степени злокачественности у детей |
|
|
Диффузная астроцитома с альтерацией в генах MYB или MYBL1 |
MYB , MYBL1 |
|
Ангиоцентрическая глиома |
MYB |
|
Полиморфная нейроэпителиальная опухоль низкой степени злокачественности у молодых |
BRAF , FGFR |
|
Диффузная глиома низкой степени злокачественности с альтерацией MAPK-пути |
Гены MAPK-пути |
|
Диффузные глиомы высокой степени злокачественности у детей |
|
|
Диффузная срединная глиома с альтерацией H3 K27 |
Н3 p. К28 (К27) , EGFR , EZHIP |
|
Диффузная полушарная глиома с мутацией H3 G3 4 |
H3 р. G34 (G34) |
|
Диффузная детская глиома высокой степени злокачественности без мутаций в генах H3 и IDH |
IDH-wt , H3-wt , метиляционное профилирование |
|
Инфантильная полушарная глиома |
RTK гены |
|
Отграниченные астроцитарные глиомы |
|
|
Пилоцитарная астроцитома |
KIAA1549::BRAF , BRAF |
|
Астроцитома высокой степени злокачественности с пилоидными признаками |
Метиляционное профилирование |
|
Плеоморфная ксантоастроцитома |
BRAF , CDKN2A |
|
Субэпендимальная гигантоклеточная астроцитома |
TSC1 , TSC2 |
|
Хордоидная глиома |
PRKCA |
|
Астробластома c альтерацией в гене MN1 |
MN1 , BEND2 |
|
Глионейрональные и нейрональные опухоли |
|
|
Ганглионарноклеточные опухоли |
BRAF |
|
Дизэмбриопластическая нейроэпителиальная опухоль |
FGFR1 |
|
Диффузная глионейрональная опухоль с олигодендроглиомоподобными признаками и кластерами ядер |
Метиляционное профилирование |
|
Папиллярная глионейрональная опухоль |
PRKCA |
|
Розеткообразующая глионейрональная опухоль |
FGFR1 , PIK3CA , NF1 |
|
Миксоидная глионейрональная опухоль |
PDGFRA |
|
Тип опухоли |
Характерные повреждения генов/молекулярный профиль |
|
Диффузная лептоменингеальная глионейрональная опухоль |
KIAA1549::BRAF , 1p, метиляцион-ное профилирование |
|
Многоузловая и вакуолизирующая нейрональная опухоль |
Гены MAPK-пути |
|
Диспластическая ганглиоцитома мозжечка (болезнь Лермитта-Дюкло) |
PTEN |
|
Экстравентрикулярная нейроцитома |
FGFR гены (FGFR1::TACC1) , IDH-wt |
|
Эпендимарные опухоли |
|
|
Супратенториальная эпендимома |
ZFTA (C11orf95) , YAP1 |
|
Эпендимома задней черепной ямки |
PFA молекулярный профиль, PFB молекулярный профиль |
|
Спинальная эпендимома |
NF2 , MYCN |
|
Эмбриональные опухоли |
|
|
Медуллобластома с активацией сигнального каскада WNT |
Активация генов сигнального каскада WNT |
|
Медуллобластома с активацией сигнального каскада SHH |
Активация генов сигнального каскада SHH |
|
Медуллобластома без активации сигнальных каскадов WNT/SHH |
Метиляционное профилирование |
|
Атипичная тератоидная/рабдоидная опухоль |
SMARCB1 , SMARCA4 |
|
Эмбриональная опухоль с многослойными розетками |
C19MC , DICER1 |
|
Нейробластома ЦНС с активацией гена FOXR2 |
FOXR2 |
|
Опухоль ЦНС с внутренней тандемной дупликацией гена BCOR |
BCOR |
|
Десмопластическая миксоидная опухоль пинеальной области с мутацией в гене SMARCB1 |
SMARCB1 |
|
Менингиома |
NF2 , AKT1 , TRAF7 , SMO , PIK3CA , и в подтипах KLF4 , SMARCE1 , BAP1 |
|
Солитарная фиброзная опухоль |
NAB2::STAT6 |
|
Менингеальные меланоцитарные новообразования |
NRAS , GNAQ , GNA11 , PLCB4 , CYSLTR2 |
|
Опухоли области турецкого седла |
|
|
Адамантиноматозная краниофарингиома |
CTNNB1 |
|
Папиллярная краниофарингиома |
BRAF |
3. ЛЕЧЕНИЕ 3.1. Хирургическое лечение
Основным методом лечения является хирургическое в объеме резекции опухоли (частичной, субтотальной, тотальной) или биопсии (открытой или СТБ). Целью хирургического лечения является получение ткани опухоли и максимальная резекция опухоли с сохранением неврологических и когнитивных функций пациента. Особенности удаления внутримозговых опухолей головного мозга:
Лучевое лечение используется как самостоятельный метод терапии либо после хирургического удаления/биопсии опухоли, либо при возникновении рецидива/про-долженного роста опухоли. ЛТ может проводиться как на область опухоли (на остаточную опухоль или на ложе опухоли), так и на пути возможного метастазирования (например, КСО), а также в качестве буст-терапии (дополнительное облучение опухоли/ложа удаленной опухоли). КСО применятся у пациентов с опухолями, склонными к метастазированию по оболочкам головного и спинного мозга. При лечении злокачественных опухолей (grade 3–4) ЛТ следует начинать в сроки от 2 до 6 нед. после операции, в ряде случаев — в комбинации с ХТ. Оптимальными методиками облучения в настоящее время являются конформная ЛТ, IMRT и VMAT. Планирование дозового распределения должно осуществляться с учетом толерантности тканей головного мозга, критических и функционально-значимых структур. Направления пучков и арок следует задавать исходя из пространственной модели опухоли и окружающих ее тканей таким образом, чтобы минимизировать лучевое воздействие на них. Предлучевая топометрическая подготовка включает изготовление индивидуального фиксирующего устройства (термопластической маски) и выполнение тонкосрезовой КТ. Рекомендуется выполнять МРТ в режимах T1, T2, T1 с контрастным усилением и FLAIR. МРТ изображения должны иметь высокое разрешение и тканевую контрастность, оптимальная толщина среза не должна превышать 2 мм.
В ряде случаев при определении мишени целесообразно использовать доопераци-онные снимки. Возможно уменьшение отступов и дозы облучения для снижения лучевых реакций. Возможна эскалация дозы на участки гиперметаболизма или компонента опухоли, накапливающего контраст на T1-взвешенных постконтрастных МР-изображениях, а также в случае рецидивов и агрессивного поведения опухоли. При лечении рецидивов после проведенной ранее ЛТ облучение фокусируется только на области активной опухоли, без отступа на ее возможное распространение.
Режим гипофракционирования (РОД ≥ 2,5 Гр, СОД ≥ 15 Гр) используется у пациентов с опухолями, имеющими чёткие границы, либо с минимальной зоной возможной инфильтрации тканей (до 3–5 мм), а также у пациентов с образованиями более 3 см и/или с опухолями, располагающимися вблизи критических структур мозга. Гипофракционирование проводится и при лечении рецидивов глиальных и эмбриональных опухолей после проведенной ранее ЛТ.
Радиохирургическое лечение может использоваться у пациентов с небольшими опухолями grade 1–2 (до 3 см в максимальном измерении), имеющими чёткие границы, и с небольшими рецидивами опухолей grade 3–4 после проведенной ранее ЛТ. После ЛТ возможны осложнения в виде отдаленных постлучевых реакций, в том числе, лучевой некроз.
Для дифференциальной диагностики постлучевых повреждений и продолженного роста опухоли выполняется МРТ с контрастированием, ПЭТ (ПЭТ-КТ) с метионином/тиро-зином/холином, МР-спектроскопия, КТ/МР-перфузия. В лечении постлучевых осложнений возможно применение ГКС и/или введение бевацизумаба (5–10 мг/кг в/в в 1-й день каждые 21 день).
Используется в сочетании с ЛТ и как самостоятельный метод лечения после хирургического и/или лучевого лечения в виде моно- или полихимиотерапии.
После завершения лечения рекомендуется регулярное выполнение МРТ головного мозга в стандартных проекциях с контрастированием в режимах Т1, Т2, FLAIR, DWI. При опухолях, склонных к лептоменингеальной диссеминации, необходимо выполнять МРТ всех отделов спинного мозга. К таким новообразованиям относятся диффузная глиома средней линии с альтерацией в гене H3 K27 ; диффузная полушарная глиома с мутацией в гене H3 G34 ; миксопапиллярная эпендимома; спинальная эпендимома с амплификацией гена MYCN ; супратенториальная эпендимома; глиобластома с примитивным нейрональным компонентом (особенно с амплификацией гена MYCN ); эмбриональные опухоли; опухоли шишковидной железы (особенно с гиперэкспрессией гена FOXR2 , амплификацией гена MYCN и альтерацией гена RB1 -преимущественно у детей); пинеальная паренхиматозная опухоль промежуточной дифференцировки grade 3; папиллярная опухоль пинеальной области grade 3 (редко); пинеобластома; пилоцитарная астроцитома (редко); пиломиксоидная астроцитома. Оценка МРТ-данных проводится в соответствии с критериями эффективности лечения RANO с обязательным наличием всех признаков для каждого критерия (табл. 3). Для определения функционального статуса нейроонкологических больных используется шкала Карновского (табл. 4).
Таблица 3. Критерии эффективности по шкале RANO.
|
Полный ответ |
Частичный ответ |
Прогрессирование |
|
|
чем на 25% суммы перпендикулярных диаметров всех определяемых очагов
|
Все остальные ситуации расцениваются как стабилизация состояния.
Таблица 4. Шкала оценки функционального статуса (по Карновскому).
|
% |
Характеристика состояния |
|
100 |
Состояние нормальное, жалоб нет |
|
90 |
Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
|
80 |
Нормальная активность с усилием, незначительные симптомы или признаки заболевания |
|
70 |
Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
|
60 |
Нуждается порой в посторонней помощи, но способен сам удовлетворять бóльшую часть своих потребностей |
|
50 |
Нуждается в значительной посторонней помощи и медицинском обслуживании |
|
40 |
Инвалид, нуждается в специальной помощи, в т. ч. медицинской |
|
30 |
Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
|
20 |
Тяжелое состояние, необходимы госпитализация и лечение |
|
10 |
Умирающий |
|
0 |
Смерть |
4. АЛГОРИТМЫ ЛЕЧЕНИЯ РАЗЛИЧНЫХ ГРУПП ПЕРВИЧНЫХ ОПУХОЛЕЙ ЦНС 4.1. Отграниченные астроцитомы и глионейрональныеопухоли (grade 1): пилоцитарная астроцитома, субэпендимальная гигантоклеточная астроцитома, ганглиоглиома
После радикального удаления опухоли обычно не требуется проведения адъювантной терапии, проводится динамическое наблюдение: МРТ один раз в 3–6 месяцев или при нарастании неврологических симптомов.
При озлокачествлении опухоли лечение осуществляется по принципам лечения злокачественных глиом. При диффузной субэпендимарной гигантоклеточной астроцитоме (одно из проявлений туберозного склероза) показано лечение ингибитором mTOR эверолимусом. При неполном удалении/биопсии или наличии хотя бы одного фактора риска развития раннего рецидива (возраст > 40 лет, размер опухоли более 60 мм, неврологический дефицит, поражение двух долей или мозолистого тела) выполняется ЛТ. Пациентам с пилоцитарной астроцитомой с диаметром опухоли до 3 см может выполняться радиохирургия (10–14 Гр), более 3 см — в режиме гипофракционирования (3–5 фракций до СОД 18–25 Гр). ХТ этой категории больных проводится только в случае рецидива/прогрессирования заболевания. Таргетная терапия применяется при глиомах низкой степени злокачественности с мутацией в гене BRAF . Вопрос о лечении пациентов старше 70 лет решается индивидуально. Алгоритм лечения взрослых больных с диффузными глиальными опухолями grade 1 представлен в табл. 5.
Таблица 5. Алгоритм лечения взрослых больных с диффузными глиальными опухолями grade 1 (пилоцитарная астроцитома, субэпендимальная гигантоклеточная астроцитома, ганглиоглиома).
|
Рекомендованные режимы |
Возможные режимы |
|
|
Адьювантная терапия |
После радикального хирургического удаления — наблюдение |
BRAF/ МЕК ингибиторы (ПА, ГГ):
|
|
Рецидив/прогрессия заболевания |
|
NTRK-перестройки в опухоли:
BRAF (V600E) активирующие мутации — BRAF/МЕК ингибиторы:
или BRAF (V600E) активирующими мутациями или НФ1) Платиносодержащие схемы (ПА):
|
Сокращения: PCV — прокарбазин + ломустин + винкристин; CV — ломустин + винкристин; АХТ — адью-вантная ХТ; СЭГА — субэпендимарная гигантоклеточная астроцитома; НФ1-нейрофиброматоз 1 типа; ПА — пилоцитарная астроцитома; ГГ — ганглиоглиома.
-
4.2. Диффузные глиомы и отграниченные астроцитарные глиомы (grade 2): астроцитома с мутацией в генах IDH ; олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q; плеоморфная ксан-тоастроцитома
-
4.3. Диффузные глиомы grade 3–4 и глионейрональные опухоли grade 3: астроцитома с мутацией в генах IDH grade 3; астроцитома с мутацией в генах IDH grade 4; олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q; плеоморфная ксанто-астроцитома; глиобластома без мутаций в генах IDH ; диффузная глиома средней линии с альтерацией в гене H3 K27 grade 4; диффузная полушарная глиома с мутацией H3 G34 grade 4; ганглиоглиома grade 3
-
4.3.1. Диагностика осуществляется с помощью МРТ, ПЭТ/ПЭТ-КТ. Молекулярно-генетическое исследование: мутации в генах IDH1 / IDH2 , ко-делеция 1p/19q, метилирование промотора гена MGMT , мутации в гене BRAF , мутации в гене TERT , гомозиготная делеция CDKN2A и/или CDKN2B .
-
4.3.2. Определение степени злокачественности диффузных глиом основывается на наличии в опухоли указанных выше критериев злокачественности, индекса пролиферации Ki-67 (табл. 1) и нового критерия — гомозиготной делеции CDKN2A и/или CDKN2B . Обнаружение гомозиготной делеции CDKN2A и/или CDKN2B приводит к изменению степени злокачественности для диффузных астроцитом (рис. 1). Если она обнаруживается в опухоли, даже в случае гистологической картины «Доброкачественной глиомы» (при отсутствии микрососудистой пролиферации и некрозов), степень анаплазии будет соответствовать grade 4. При отсутствии мутации в генах IDH целесообразно исследовать мутационный статус гена H3F3A , мутации которого у детей и взрослых могут возникать в двух вариантах: в срединных опухолях — К27 (неблагоприятный прогноз) и в полушарных опухолях — G34 (прогноз относительно благоприятный, часто сочетаются с метилированием промотора гена MGMT ). Опухоли, гистологически соответствующие диффузной астроцитоме, но без мутаций в генах IDH1 или IDH2 , целесообразно дополнительно исследовать для оценки мутации в гене TERT , амплификации гена EGFR . Диффузные астроцитомы без мутаций в генах IDH1 / IDH2 следует считать глиобластомами, в этих опухолях выявляются мутация TERT и/или амплификация EGFR .
-
4.3.3. Лечение
-
4.3.3.1. После хирургической резекции опухоли пациентам с верифицированным диагнозом проводится ЛТ (30 фракций по 2 Гр на фракцию до СОД 60 Гр) с одновременным ежедневным приемом темозоломида (75 мг/м 2 ) в течение всего курса ЛТ с последующей адьювантной ХТ (рис. 3). В GTV рекомендуется включать остаточную опухоль и/или ложе опухоли. На дозе 46 Гр при РОД 2 Гр и 50,4 Гр при РОД 1,8 Гр возможно сокращение объема облучения (буст). Пациентам старше 70 лет, а также больным в общем состоянии по шкале Карновского < 60% рекомендован режим гипофракционирования с РОД 3 Гр и СОД 45 Гр.
-
-
Для диффузных астроцитом характерен инвазивный рост с постепенной трансформацией в астроцитомы более высокой степени злокачественности. Объем резекции является важным прогностическим фактором, однако не у всех больных опухоль можно удалить тотально. При локализации опухоли в глубоких областях мозга или в функционально-значимых зонах часто выполняется СТБ.
Вопрос о целесообразности назначения ЛТ и ХТ решается индивидуально с определением групп низкого или высокого риска прогрессирования опухоли (рис. 2). К факторам высокого риска относят: возраст > 40 лет, наличие резидуальной опухоли после хирургического удаления (субтотальная или частичная резекция, открытая или стереотаксическая биопсия), размер опухоли более 60 мм, неврологический дефицит, поражение двух долей или мозолистого тела (достаточно наличия одного фактора). К факторам риска развития раннего рецидива можно отнести фокальное накопление контраста на МРТ и индекс накопления РФП (метионина), соответствующий анаплазии, при проведении ПЭТ-КТ (достаточно наличия одного фактора). После оперативного вмешательства всем больным проводится ЛТ за исключением случаев с полной резекцией опухоли и без наличия факторов риска раннего прогрессирования. В этих случаях проводится наблюдение — МРТ 1 раз в 3–6 месяцев или при нарастании симптомов. При неполном удалении/биопсии опухоли и при наличии еще одного фактора высокого риска развития раннего рецидива показано назначение ЛТ с РОД 1,8–2,0 Гр до СОД 50,4–54 Гр и/или ХТ (табл. 6). Радиохирургия может рассматриваться при небольших отграниченных опухолях и при локальных небольших рецидивах после ЛТ.
Пациентам пожилого возраста (старше 70 лет) с обширными опухолями ЛТ может не проводиться, а назначается монотерапия темозоломидом (5/23) (табл. 6). Вопрос о назначении ЛТ и ХТ ослабленным пациентам (низкий индекс Карновского и/или признаки внутричерепной гипертензии), а также больным с распространённой опухолью решается индивидуально. После окончания курса ЛТ выполняется контрольная МРТ (через 2–4 недели после окончания ЛТ, а затем каждые 2–3 месяца в течение 2–3 лет) с решением вопроса о целесообразности проведения ХТ.
При рецидиве оценивается возможность повторного удаления с пересмотром гистологического диагноза. При невозможности проведения хирургического удаления степень анаплазии можно оценить по результатам ПЭТ-КТ с аминокислотами и накоплению контраста опухолью при МРТ. При планировании лечения учитывается, какие методы были использованы ранее, применялись ли лучевая и/или химиотерапия, был ли достигнут объективный ответ на лечение.
Таблица 6. Рекомендуемые режимы лекарственной терапии диффузных глиом (grade 2–4) и глионейрональных опухолей (grade 3).
|
Режим |
Схема проведения |
|
Темозоломид 1 |
Темозоломид (в составе ХЛТ) 75 мг/м 2 внутрь ежедневно, начиная с первого дня и на протяжении всего курса ЛТ |
|
Темозоломид 1 |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–12 циклов |
|
PCV 2 |
Ломустин 100 мг/м 2 внутрь в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни + прокарбазин 60–75 мг/м 2 внутрь в 8–21-й дни, цикл 6–8 недель |
|
CV |
Ломустин 90 мг/м 2 внутрь в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни, цикл 6–8 недель |
|
Ломустин |
Ломустин 90–110 мг/м 2 внутрь в 1-й день, цикл 6–8 недель |
|
Кармустин |
Кармустин 200 мг/м 2 в/в 1-часовая инфузия в 1-й день, цикл 6–8 недель |
|
Кармустин |
Кармустин 80 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 6–8 недель |
|
РС |
Прокарбазин 60 мг/м 2 внутрь в 1–10-й дни + ломустин 100 мг/м 2 внутрь в 1-й день, цикл 6–8 недель |
|
Темозоломид + цисплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, цикл 28 дней |
|
Темозоломид + карбоплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней |
|
Темозоломид + бевацизумаб |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни + бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
|
Бевацизумаб + этопозид |
Бевацизумаб 5 мг/кг в/в в 1-й и 15-й дни + этопозид 80 мг/м 2 в/в в 1–5-й дни, цикл 21 или 28 дней |
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней |
|
Дабрафениб + траметиниб 3 |
Дабрафениб 150 мг внутрь 2 раза в день ежедневно + траметиниб 2 мг внутрь 1 раз в день ежедневно, до прогрессирования или непереносимой токсичности |
|
Вемурафениб + кобиметиниб 3 |
Вемурафениб 960 мг внутрь 2 раза в день ежедневно + кобиметиниб 60 мг внутрь 1 раз в день в 1–21-й дни каждые 4 недели, до прогрессирования или непереносимой токсичности |
-
1 Стандартный режим для астроцитарных опухолей (grade 3–4).
-
2 Стандартный режим для астроцитарных опухолей (grade 2–3).
-
3 Для опухолей с мутацией в гене BRAF .
-
4.3.3.2. Пациентам с олигодендроглиомой grade 3 в послеоперационном периоде рекомендованы ЛТ и ХТ (PCV или монотерапия темозоломидом). Лечение можно начинать как с ЛТ, так и с ХТ. При полном ответе на ХТ проведение ЛТ может быть отложено в качестве резерва лечения при развитии рецидива (табл. 6).
-
4.3.3.3. Псевдопрогрессия. Через 2–3 месяца после комбинированной ХЛТ на контрольных МРТ можно наблюдать феномен псевдопрогрессии опухоли —увеличение ее контрасти-
- руемой части при отсутствии нарастания неврологических симптомов и при стабильных дозах ГКС. В данной ситуации рекомендуется ПЭТ с метионином/тирозином или МРТ с контрастированием через 2 месяца, или, при необходимости, — СТБ.
-
4.3.3.4. Наблюдение. МРТ с контрастированием в трёх проекциях в стандартных режимах — Т1, Т2, FLAIR, Т1 с толщиной среза, не превышающей 2 мм, выполняется каждые 3–4 месяца.
-
4.3.3.5. Неблагоприятные факторы прогноза. Гистологические характеристики опухоли, возраст старше 70 лет, функциональный статус по шкале Карновского ниже 60%, неполная резекция опухоли, высокая экспрессия гена MGMT (или отсутствие метилирования промотора гена MGMT ), отсутствие мутации в генах IDH1 / IDH2 .
-
4.3.3.6. Лечение рецидивов/прогрессирования. При возникновении рецидива/прогрес-сирования заболевания вопрос о повторном хирургическом вмешательстве, повторной ЛТ и лекарственной терапии решается индивидуально (рис. 4). Виды ЛТ рассматриваются в зависимости от характера рецидива — локальный в месте первичной опухоли, отдаленный, диссеминация по оболочкам головного и/или спинного мозга и т. д., времени от предыдущей ЛТ, размера нового очага. В качестве терапии рекомендованы режимы с включением бевацизумаба, схемы с препаратами платины, а также ХТ темозоломидом в случае объективного ответа на лечение в первой линии терапии или после ПХТ по схеме PCV/CV (табл. 7).
-
4.4. Опухоли ствола головного мозга
-
4.5. Эпендимома
Таблица 7. Рекомендуемые режимы лекарственной терапии рецидивов диффузных глиом (grade 3–4) и глионейрональных опухолей (grade 3).
|
Режим |
Схема проведения |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23) |
|
Темозоломид в метрономном режиме |
Темозоломид 75 мг/м 2 внутрь в 1–7-й дни, цикл 14 дней |
|
Бевацизумаб |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
|
Бевацизумаб + темозоломид |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней |
|
Бевацизумаб + ломустин |
Бевацизумаб 5–10 мг/кг в/в в 1-й, 15-й и 29-й дни + ломустин 90 мг/м 2 внутрь в 1-й день, цикл 6 недель |
|
Бевацизумаб 5–10 мг/кг в/в в 1-й, 15-й, 29-й и 43-й дни + лому-стин 40 мг внутрь в 1-й, 8-й, 15-й и 22-й дни, цикл 6 недель |
|
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней |
|
Бевацизумаб + карбоплатин |
Бевацизумаб 7,5 мг/кг в/в в 1-й день + карбоплатин AUC5 в/в в 1-й день, цикл 21 день |
|
Темозоломид + карбоплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней |
|
Регорафениб 1 |
Регорафениб 160 мг 1 раз в день, внутрь, ежедневно принимать 3 недели (затем 1 неделя – перерыв), до прогрессии или непереносимой токсичности, цикл 28 дней |
1 Для лечения рецидивов глиобластомы.
При узловых формах опухолей ствола мозга, экзофитном характере роста, т. е. при МР-признаках полной или частичной отграниченности от структур ствола (например, при пилоидной астроцитоме) показано удаление опухоли или открытая биопсия. Далее, в зависимости от гистологического диагноза, возраста и радикальности удаления назначаются ЛТ и/или ХТ. При диффузном характере роста и невозможности выполнить даже биопсию (из-за высокого риска жизнеугрожающих осложнений) рекомендовано выполнение ПЭТ-КТ с аминокислотами для оценки степени анаплазии опухоли. Назначение ЛТ и ХТ таким больным проводится в индивидуальном порядке. Рекомендуется применение стереотаксической техники облучения до СОД 54 Гр за 30 фракций, отступы на СTV и PTV минимизируются с учетом максимально точного определения границ опухоли на основании структурных и метаболических методов нейровизуализации. При ювенильных глиомах четверохолмной пластинки после разрешения гидроцефалии осуществляется регулярное клиническое и МРТ-наблюдение (в случае прогрессирования опухоли рассматривается вопрос об удалении опухоли с последующей ЛТ).
Выделяют три биологических подтипа с учетом локализации первичного очага и генетической аберрации:
-
• супратенториальная эпендимома с ZFTA fusion-positive; супратенториальная эпендимома с YAP1 fusion-positive;
-
• эпендимома задней черепной ямки группы А (PFA) ; эпендимома задней черепной ямки группы B (PFB) ;
-
• спинальная эпендимома с амплификацией гена MYCN .
Степень анаплазии опухоли установлена в каждой нозологии кроме «Спинальной эпендимомы с амплификацией гена MYCN », эта опухоль имеет неблагоприятный прогноз с высокой частотой возникновения отсевов, что необходимо учитывать при выборе тактики лечения.
Ведущую роль в прогнозе играет хирургическое удаление. При тотальном удалении эпендимомы grade 1 рекомендуется наблюдение. При установлении диагноза эпендимомы grade 2 или grade 3 в послеоперационном периоде выполняется МРТ головного и спинного мозга с контрастированием с целью выявления возможных субарахноидальных метастазов и исследование спинномозговой жидкости на опухолевые клетки (не ранее 2 недель после операции) (рис. 5).
При нерадикальном удалении эпендимомы grade 2 или эпендимоме grade 3 проводится ЛТ 1,8–2 Гр до СОД 54 Гр или гипофракционирование 3–5 фракций до СОД 18–25 Гр. При выявлении метастазирования (по данным МРТ или анализа ликвора) проводится КСО 36 Гр с РОД 1,8 Гр. При выявлении опухоли в спинном мозге выполняется буст-терапия до 45– 59,4 Гр. При эпендимоме с локализацией в спинном мозге и неполной резекции опухоли выполняется ЛТ СОД 45 Гр. Возможен буст до СОД 50,4–59,4 Гр. При небольшом объеме и локальной форме опухоли возможна стереотаксическая радиохирургия до 14–20 Гр. (рис. 5).
ХТ назначается пациентам с эпендимомой grade 3 и может рекомендоваться в случае рецидива эпендимомы grade 2 (рис. 5), даже при отсутствии злокачественной трансформации по данным повторного гистологического исследования (табл. 8).
Контрольные обследования (МРТ головного и всего спинного мозга с контрастированием и клиническое обследование) выполняется 1 раз в 3–4 месяца на протяжении первых 2 лет наблюдения, затем, при отсутствии данных за прогрессирование, — не реже 1 раза в 6 месяцев в течение следующих 2 лет, затем — 1 раз в год или при появлении неврологических симптомов. В случае прогрессирования в виде солитарного очага рассматривается вопрос о повторной операции или, при небольших размерах рецидива, — о радиохирургическом лечении.
Таблица 8. Рекомендуемые режимы лекарственной терапии эпендимом.
|
Режим |
Схема проведения |
|
Карбоплатин |
Карбоплатин 100 мг/м 2 в/в в 1–5-й дни, цикл 28–35 дней |
|
Цисплатин |
Цисплатин 80 мг/м 2 в/в в 1-й день, цикл 21 день |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней |
|
Этопозид |
Этопозид 50–100 мг/м 2 внутрь или в/в в 1–5-й дни, цикл 21–28 дней |
|
Цисплатин + этопозид |
Цисплатин 25 мг/м 2 в/в в 1–4-й дни + этопозид 80 мг/м 2 в/в в 1–4-й дни, цикл 21 день |
|
Цисплатин + этопозид + ифосфамид |
Цисплатин 20 мг/м 2 в/в в 1–5-й дни + этопозид 75 мг/м 2 в/в в 1–5-й дни + ифосфамид 750–1200 мг/м 2 (+ месна 1 ) в/в в 1-й, 3-й, 5-й дни, цикл 28 дней |
|
Карбоплатин + этопозид + винкристин |
Карбоплатин 300 мг/м 2 в/в 1 час в 1-й день + этопозид 140 мг/м 2 в/в 30 мин. в 1–3-й дни + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни, цикл 28 дней, 4–6 циклов в зависимости от переносимости |
|
Темозоломид + лапатиниб |
Темозоломид 150 мг/м 2 внутрь в 1–7-й и 15–21-й дни, цикл 28 дней + лапатиниб 2 1250 мг внутрь 1 раз в сутки ежедневно до прогрессирования или непереносимой токсичности |
|
Темозоломид + бевацизумаб |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни + бевацизу-маб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
-
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня (в процентном соотношении 20 %, 20 %, 60 %): непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
-
2 По решению консилиума при рецидиве (возможно вторичном рецидиве, когда все другие опции исчерпаны).
-
4.6. Первичная лимфома ЦНС
-
4.7. Первичные герминогенные (герминативно-клеточные) опухоли
-
4.7.1. Диагностика. МРТ головного и спинного мозга с контрастированием; β-ХГЧ, АФП, PLAP (плацентарная ЩФ) в крови и спинномозговой жидкости. При поражении хиазмальноселлярной области исследуются гормоны гипофиза.
-
4.7.2. Лечение. При повышении одного или обоих маркеров (β-ХГЧ — более 5 ВГН, АФП — более 2 ВГН) проводят ХТ без гистологической верификации опухоли с последующим облучением желудочковой системы (до уровня 2-го шейного позвонка) РОД 1,8–2Гр, СОД 24 Гр (при отсутствии метастазирования по оболочкам спинного мозга) с бустом на остаточную опухоль до СОД 30–45 Гр (табл. 10).
Морфологически более чем в 90% случаев представлена диффузной В-клеточ-ной лимфомой, однако встречаются все формы неходжкинских лимфом (Т-клеточная, внутрисосудистая крупноклеточная, MALT-лимфома твердой мозговой оболочки).
Методом установления диагноза лимфомы является СТБ. Открытая операция выполняется при состояниях, угрожающих жизни пациентов, и невозможности произвести СТБ. Использовать ГКС до операции не рекомендуется. Рекомендуется проводить ИГХ со следующими антителами: CD45, CD20, CD79a, MUM1, BCL-2, BCL-6. При общем состоянии по шкале Карновского > 50%, сохранной функции печени и почек, возрасте не старше 65 лет методом выбора является ХТ на основе высокодозного метотрексата. При достижении полного или частичного ответа после 4 циклов ПХТ (метотрексат + дексаметазон + темозоломид + ритуксимаб) пациенты получают дополнительный курс высоких доз метотрексата (1 введение) плюс 1 курс темозоломида. Далее, через 3–5 недель больным проводится терапия этопозидом с цитарабином (табл. 9), после чего выполняется МРТ головного мозга каждые 2 месяца в течение первого года, затем каждые 4 месяца в течение 2 и 3 лет. Начиная с 3,5 лет МРТ назначается каждые 6 месяцев. Пациентам старше 65 лет и/или при низком функциональном статусе (< 60% по шкале Карновского) рекомендовано применение в первой линии темозоломида в режиме 5/23.
Таблица 9. Рекомендуемые режимы лекарственной терапии первичной лимфомы.
|
Режим |
Схема проведения |
|
Метотрексат + дексаметазон + темозоломид + ритуксимаб |
Метотрексат 3000–8000 мг/м 2 в/в 24-часовая инфузия 1 раз в 14 дней, в 1-й день, 7 введений (+ кальция фолинат 0,5 мг/кг в/в каждые 6 часов, начиная через 24 часа после введения метотрексата и под контролем снижения его концентрации в крови, во 2-й день) + дексаметазон 8 мг/сут. в/в в 1–3-й дни + темозоломид 150 мг/м 2 внутрь в 7–11-й дни, цикл 28 дней, 4 цикла + ри-туксимаб 375 мг/м 2 в/в 1 раз в 7 дней, в 3-й день, 6 введений (при В-клеточной CD20 позитивной лимфоме). |
|
Этопозид + цитарабин |
Этопозид 5 мг/кг каждые 12 часов, 8 доз, непрерывная в/в инфузия в 1–4 дни (общая доза 40 мг/кг за 96 часов инфузии) + цитарабин 2000 мг/м 2 2-х часовая в/в инфузия, каждые 12 часов, 8 доз, в 1–4 дни (общая доза 16000 мг/м 2 ) |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23) |
|
Темозоломид + ритуксимаб |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + ритуксимаб 375 мг/м 2 в/в в 6-й день цикл 28 дней (при В-клеточной CD20 позитивной лимфоме) |
Вариантом проведения высокодозной ХТ метотрексатом является внутриартериальная ХТ с временным открытием гематоэнцефалического барьера. У молодых пациентов рассматривается метод высокодозной ХТ на основе метотрексата с пересадкой стволовых клеток крови. При полном ответе, сохраняющемся в течение года с момента верификации диагноза, пациент остается под наблюдением. При неполном ответе показана ЛТ всего головного мозга в дозе 36 Гр (20 фракций по 1,8 Гр) с последующим проведением МРТ с контрастированием и при необходимости с добавлением буста до СОД 45 Гр на сохраняющийся очаг контрастирования (рис. 6, 7). При лимфоме глаза выполняется интравит-реальное введение метотрексата и/или ЛТ глазного яблока (20 фракций по 1,8 Гр), а также назначение леналидомида. При тяжелом состоянии пациента и отказе в проведении ХТ может проводиться гипофракционированная ЛТ до СОД 15–20 Гр.
Встречаются преимущественно в детском и молодом возрасте и характеризуются высокой чувствительностью к ЛТ и ХТ. Выделяют «чистую» герминому и негерминоген-ные герминативно-клеточные опухоли (эмбриональная карцинома, опухоль желточного мешка, хориокарцинома, тератома (зрелая, незрелая, тератома со злокачественной трансформацией)), смешанные герминативно-клеточные опухоли.
В случае подозрения на остаточную опухоль (вероятнее всего — негермино-генную) до ЛТ решается вопрос о ее хирургическом удалении. При нормальных уровнях маркеров показана биопсия опухоли. При необходимости решается вопрос о ликворошунтирующей операции.
Таблица 10. Режим лекарственной терапии герминативно-клеточных опухолей.
|
Режим |
Схема проведения |
|
«Чистая» герминома |
|
|
ЕР |
Этопозид 100 мг/м 2 в/в 40-минутная инфузия в 1–5-й дни + цисплатин 20 мг/м 2 в/в 1-часовая инфузия в 1–5-й дни, цикл 21 день |
|
Этопозид 80 мг/м 2 в/в в 1–4-й дни + цисплатин 25 мг/м 2 в/в в 1–4-й дни, цикл 21 день |
|
|
Негерминогенные опухоли |
|
|
PEI |
Цисплатин 20 мг/м 2 в/в 1-часовая инфузия в 1–5-й дни + этопозид 75 мг/м 2 в/в 40-минутная инфузия в 1–5-й дни + ифосфамид 1200 мг/м 2 в/в 1-часовая инфузия (+ месна 1 ) в 1–5-й дни, цикл 21 день |
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня (в процентном соотношении 20%, 20%, 60%): непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
Уровень маркеров АФП, β-ХГЧ исследуется перед началом каждого цикла. После каждых 2 циклов выполняется МРТ головного и спинного мозга с контрастированием. До начала лечения у фертильных мужчин рекомендуется обсудить вопрос о криоконсервации спермы.
-
4.7.3. Наблюдение. МРТ головного и спинного мозга выполняется каждые 3 месяца в течение первого года, затем — каждые 6 месяцев в течение двух лет, затем — 1 раз в год или при появлении неврологических симптомов.
-
4.7.4. При рецидивах «чистых» гермином рекомендуется применение хирургического вмешательства, локального облучения или КСО, полихимиотерапии, высокодозной ХТ с аутологичной пересадкой гемопоэтических стволовых клеток.
-
4.8. Менингиома
-
4.9. Эмбриональные опухоли (grade 4): медуллобластома (4 биологических подтипа); атипичная тератоидная/рабдоидная опухоль; крибриформная нейроэпителиальная опухоль (grade не установлен); эмбриональная опухоль с многослойными розетками; нейробластома ЦНС с активацией гена FOXR2 ; опухоль ЦНС с внутренней тандемной дупликацией гена BCOR (grade не установлен)
-
4.9.1. Диагностика. МРТ головного и спинного мозга с контрастированием. Цитологическое исследование ликвора. Пациенты с эмбриональными опухолями ЦНС могут иметь наследственный онкологический синдром (cиндром Горлина или синдром Ли-Фраумени) и нуждаться в генетическом консультировании. Используется классификация ТМ (С. Chang) (табл. 12).
-
-
4.9.2. Лечение. Радикальная хирургическая резекция сопряжена с лучшим прогнозом. При необходимости в послеоперационном периоде выполняется вентрикулоперитонеальное шунтирование, однако следует помнить о возможности ликворного метастазирования в брюшную полость. МРТ спинного мозга, если она не выполнена до операции, рекомендовано выполнить не ранее чем через 2–3 недели после операции, чтобы избежать постхирургических артефактов.
Целью хирургического лечения менингиом является максимально радикальное удаление опухоли. При нерадикальном удалении менингиомы (grade 1) рекомендуется ЛТ с РОД 1,8–2,0 Гр до СОД 50–54 Гр; с РОД 7,5 Гр до СОД 22,5 Гр; с РОД 5,5 Гр до СОД 27,5 Гр или стеретаксической радиохирургии до СОД 14–16 Гр. У пациентов с менингиомой grade 2 рекомендуется ЛТ с РОД 1,8–2 Гр до СОД 54–60 Гр или гипофракционная ЛТ/сте-реотаксическая радиохирургия. При менингиоме grade 3 выполняется ЛТ с РОД 1,8 Гр до СОД 59,4–60 Гр, возможно радиохирургическое и гипофракционированное облучение. Во всех случаях GTV включает контрастируемую часть опухоли и гиперостатические изменения, вопрос об облучении «дурального хвоста» решается индивидуально. При менингиомах grade 2–3 в GTV включается ложе удаленной опухоли. В случаях менингиомы grade 3 возможно проведение ХТ (табл. 11).
Таблица 11. Рекомендуемые режимы лекарственной терапии при анапластической менингиоме и/или при агрессивном течении менингиомы grade 1–2.
|
Режим |
Схема проведения |
|
Бевацизумаб + сунитиниб |
Бевацизумаб 5 мг/кг в/в в 1-й и 15-й дни + сунитиниб 50 мг/сут. внутрь в 1–28-й дни, цикл 6 недель |
|
Бевацизумаб |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
|
Бевацизумаб + эверолимус |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней + эвероли-мус 5–10 мг внутрь 1 раз в сутки ежедневно до прогрессирования или непереносимой токсичности |
|
Сунитиниб |
Сунитиниб 50 мг внутрь 1 раз в сутки ежедневно в 1–28-й дни цикл, 6 недель |
Таблица 12. Классификация медуллобластом по С. Chang (1969 г.).
|
Категории Т, М |
Характеристика |
|
T1 |
Опухоль менее 3 см в диаметре, располагается в пределах червя мозжечка, крыши IV желудочка, полушарий мозжечка |
|
T2 |
Опухоль более 3 см в диаметре, прорастает в соседние структуры или частично заполняет IV желудочек головного мозга |
|
T3A |
Опухоль более 3 см в диаметре, прорастает в две соседние структуры или полностью заполняет четвертый желудочек с распространением на водопровод, отверстие Мажанди или отверстие Люшка, что приводит к выраженной внутренней гидроцефалии |
|
T3B |
Опухоль более 3 см в диаметре, возникающая из дна четвертого желудочка или ствола головного мозга и заполняющая четвертый желудочек |
|
T4 |
Опухоль более 3 см в диаметре, которая вызывает гидроцефалию за счет перекрытия путей оттока ликвора (либо водопровода мозга, либо отверстий Люшка и Мажанди) и прорастает в ствол мозга |
|
M0 |
Нет метастазирования |
|
M1 |
В ликворе при микроскопическом исследовании определяются опухолевые клетки |
|
M2 |
Метастазы в пределах субарахноидального пространства III и IV желудочков головного мозга |
|
M3 |
Метастазы в субарахноидальном пространстве спинного мозга |
|
M4 |
Метастазы за пределами центральной нервной системы |
После операции пациентам старше 18 лет проводится ЛТ (КСО с РОД 1,8–2 Гр и СОД до 35 Гр с дополнительным бустом на ложе опухоли до 55 Гр). После ЛТ проводится ХТ (табл. 13). Всем пациентам проводится ХТ. МРТ головного и спинного мозга с контрастированием выполняется каждые 2 цикла терапии. В случае остаточной опухоли после 1-й линии терапии выполняется ПЭТ-КТ с метионином/тирозином и при сохранении метаболической активности опухоли продолжается лечение с возможным изменением схем ХТ и/или использованием ЛТ в режимах радиохирургии или гипофракционирования.
Таблица 13. Рекомендуемые режимы лекарственной терапии медуллобластомы.
|
Режим |
Схема проведения |
|
Цисплатин + этопозид + циклофосфамид |
Цисплатин 25 мг/м 2 в/в в 1–4-й дни + этопозид 80 мг/м 2 в/в в 1–4-й дни + циклофосфамид 600 мг/м 2 в/в в 4-й день, цикл 4–6 недель, 6 циклов |
|
Цисплатин + этопозид + ифосфамид |
Цисплатин 20 мг/м 2 в/в 1–5-й дни + этопозид 80 мг/м 2 в/в в 1–5-й дни + ифосфамид 1500 мг/м 2 (+ месна 1 ) в/в в 1-й, 3-й, 5-й дни, цикл 21–28 дней (в зависимости от переносимости), 4–6 циклов |
|
Режим |
Схема проведения |
|
Цисплатин + лому-стин + винкристин |
Ццисплатин 70 мг/м 2 6-часовая в/в инфузия (карбоплатин 400 мг/м 2 в/в 1-часовая инфузия) в 1-й день + ломустин 75 мг/м 2 внутрь в 1-й день + винкристин 1,5 мг/м 2 (максимальная суммарная доза 2 мг) в/в в 1-й, 8-й и 15-й дни, цикл 41 день, 8 циклов |
|
Висмодегиб 2 |
Висмодегиб 150 мг 1 раз в день, внутрь, ежедневно до прогрессии или непереносимой токсичности, цикл 28 дней (до 26 циклов) |
-
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня (в процентном соотношении 20%, 20%, 60%): непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
-
2 При активации SHH пути.
Эмбриональные опухоли супратенториальной локализации, такие как нейробластома или ганглионейробластома, у пациентов старше 18 лет встречаются редко. В новой классификации (ВОЗ 2021 г.) в разделе «Другие эмбриональные опухоли» появились сразу три новые нозологии:
-
1. Крибриформная нейроэпителиальная опухоль (обозначена как «временная единица»). 2. Опухоль ЦНС с внутренней тандемной дупликацией гена BCOR.
-
3. Нейробластома ЦНС с активацией гена FOXR2 .
Исчезнувшие ганглионейробластомы ЦНС вошли в состав группы «Нейробластома ЦНС, с активацией гена FOXR2 ». Поскольку все эмбриональные опухоли имеют grade 4, кроме «Крибриформной нейроэпителиальной опухоли (временная единица)» и «Опухоли ЦНС с внутренней тандемной дупликацией гена BCOR », при которых степень анаплазии еще не определена, пациентам в обязательном порядке необходимо проводить ЛТ и ХТ (табл. 14, рис. 8).
Таблица 14. Рекомендуемые режимы лекарственной терапии нейробластомы/ганглионейробластомы.
|
Режим |
Схема проведения |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней |
|
Карбоплатин + этопозид |
Карбоплатин 200 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 150 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости |
|
Цисплатин + этопозид |
Цисплатин 40 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 120 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости |
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней |
|
Цисплатин + этопозид + ифосфамид |
Цисплатин 20 мг/м 2 в/в в 1–5-й дни + этопозид 75 мг/м 2 в/в 1–5-й дни + ифосфамид 750–1200 мг/м 2 (+ месна 1 ) в/в в 1-й, 3-й и 5-й дни, цикл 28 дней |
-
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня (в процентном соотношении 20%, 20%, 60%): непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
4.9.3. Наблюдение.
МРТ головного и спинного мозга с контрастированием выполняется каждые 3–4 месяца в течение первых 2 лет, затем — каждые 6 месяцев в течение 3-го и 4-го годов, затем — 1 раз в год или при появлении неврологических симптомов.
4.10. Опухоли шишковидной железы: пинеоцитома (grade 1); пинеальная паренхиматозная опухоль промежуточной дифференцировки (grade 2–3); папиллярная опухоль пинеальной области (grade 2–3); пинеобластома (grade 4); десмопластическая миксоидная опухоль пинеальной области с мутацией в гене
SMARCB1
(grade не установлен)
Тактика лечения опухолей шишковидной железы зависит от степени их анаплазии и биологического поведения.
Пинеоцитома grade 1 требует только хирургического лечения. У пациентов с пинеальной паренхиматозной опухолью промежуточной дифференцировки (grade 2) и папиллярной опухолью пинеальной области grade 2 при отсутствии диссеминации опухоли по субарахноидальным пространствам проводится ЛТ на ложе удаленной опухоли. Пациентам с пинеальной паренхиматозной опухолью промежуточной дифференцировки (grade 3) и папиллярной опухолью пинеальной области grade 3 выполняется ЛТ на ложе опухоли и весь спинной мозг, а затем — ХТ. Режимы ЛТ, ХТ и особенности наблюдения аналогичны таковым при эпендимоме и эмбриональных опухолях (табл. 8, 13, 14). У ослабленных пациентов со злокачественными опухолями пинеальной области лечение может быть начато с ХТ с последующим МРТ-контролем головного и спинного мозга после 2-х или 4-х циклов ХТ с планированием ЛТ.
АЛГОРИТМЫ ЛЕЧЕНИЯ БОЛЬНЫХ С ОПУХОЛЯМИ ЦНС
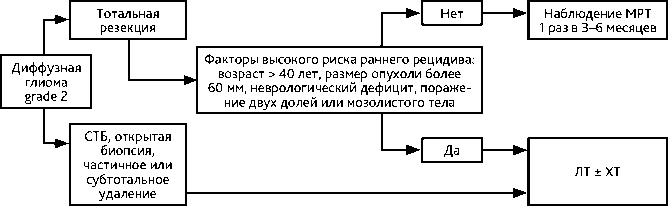
Рисунок 2. Алгоритм лечения больных диффузной глиомой grade 2.
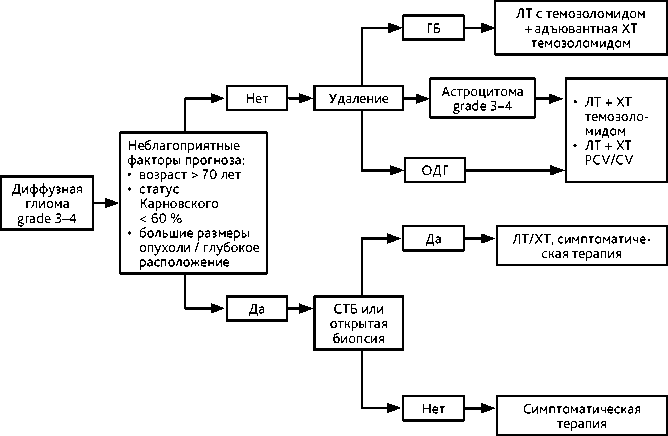
ГБ — глиобластома;
ОДГ — олигодендроглиома;
PCV — ломустин + прокарбазин + винкристин;
CV — ломустин + винкристин.
Рисунок 3. Алгоритм лечения больных диффузной глиомой grade 3–4.
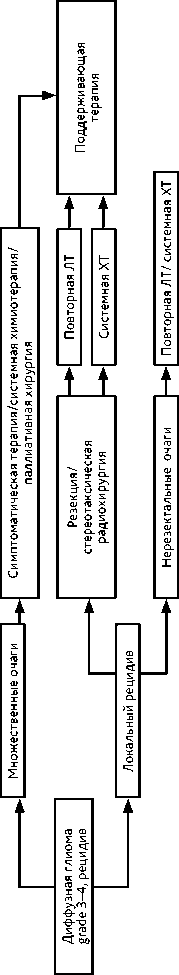
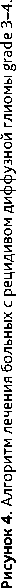
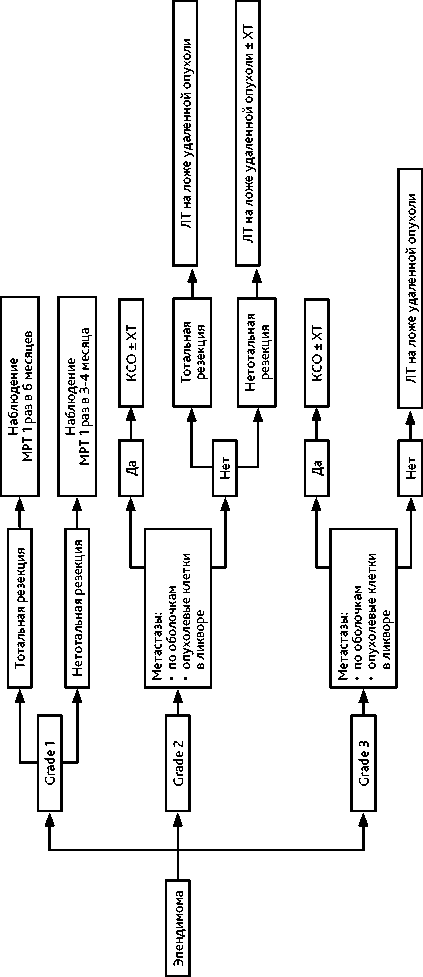
Рисунок 5. Алгоритм лечения больных эпендимомой grade1–3.
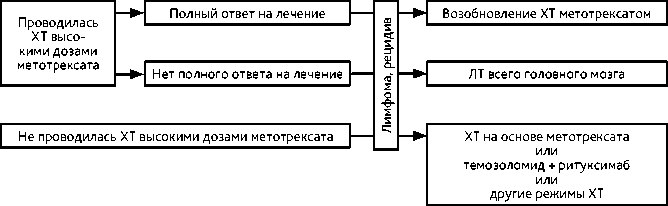
Рисунок 7. Алгоритм лечения больных с рецидивом лимфомы.
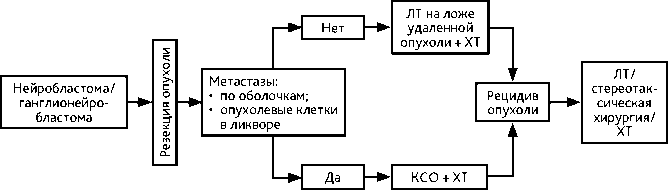
Рисунок 8. Алгоритм лечения больных нейробластомой ЦНС и ганглионейробластомой ЦНС.


