Первичные опухоли центральной нервной системы
Автор: Улитин А.Ю., Желудкова О.Г., Иванов П.И., Кобяков Г.Л., Мацко М.В., Насхлеташвили Д.Р., Рыжова М.В., Семенова А.И.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1.1 т.15, 2025 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (см. стр. 7). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Опухоли центральной нервной системы, глиобластома, астроцитома, эпендимома, первичная лимфома, герминома, нейробластома, медуллобластома, олигодендроглиома, пинеобластома, метилирование, химиотерапия, лучевая терапия, ген МGMT, ко-делеция 1p/19q, ген IDH1, ген IDH2
Короткий адрес: https://sciup.org/140312936
IDR: 140312936 | DOI: 10.18027/2224-5057-2025-15-3s2-1.1-10
Текст научной статьи Первичные опухоли центральной нервной системы
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация TNM в нейроонкологии не используется.
2. ДИАГНОСТИКА 2.1. Обследование
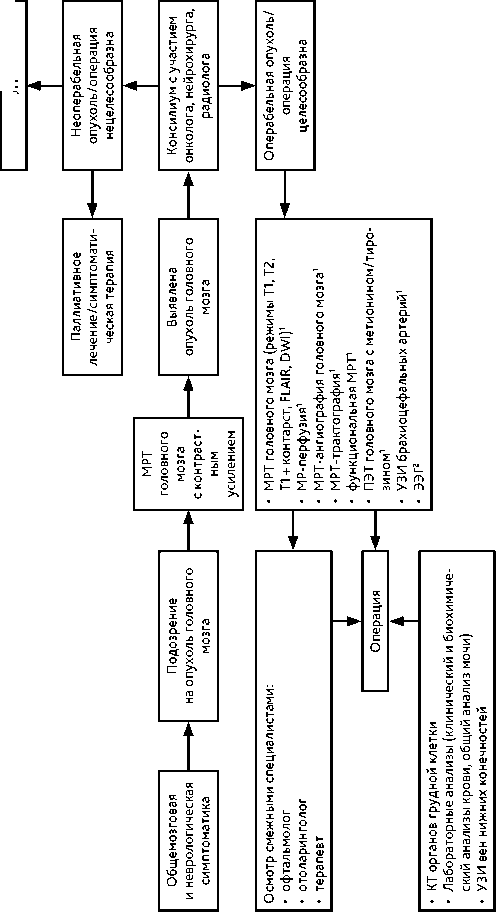
Обследование пациента с первичной опухолью ЦНС включает:
-
• сбор данных анамнеза;
-
• неврологический осмотр с оценкой общемозговых и /или очаговых неврологических симптомов, наличия судорожного синдрома, нарушения движений, чувствительности, речи, праксиса, симптомов поражения черепных нервов, психических нарушений, менингеальных симптомов;
-
• осмотр нейроофтальмолога (оцениваются острота зрения, поля зрения, состояние дисков зрительных нервов, глазодвигательные нарушения);
-
• осмотр отоневролога;
нейровизуализационные исследования:
– МРТ в трех проекциях в стандартных режимах (Т1, Т2, Т1 с контрастированием, FLAIR, DWI); при локализации опухоли в области речевых и двигательных зон выполняется функциональная МРТ (фМРТ) и МР-трактография. При опухолях с риском метастазирования, а также при подозрении на диссеминацию опухоли по оболочкам спинного мозга выполняется МРТ всего спинного мозга (шейного, грудного, пояснично-крестцового) с контрастированием;
– к опухолям с риском метастазирования в структуры головного и спинного мозга относятся диффузная глиома средней линии с альтерацией в гене H3 K27; диффузная полушарная глиома с мутацией в гене H3 G34; миксопапиллярная эпендимома; спинальная эпендимома с амплификацией гена MYCN; супратенториальная эпендимома; глиобластома с примитивным нейрональным компонентом (особенно с амплификацией гена MYCN); эмбриональные опухоли; опухоли шишковидной железы (особенно с гиперэкспрессией гена FOXR2, амплификацией гена MYCN и альтерацией гена RB1-преимущественно у детей); пинеальная паренхиматозная опухоль промежуточной дифференцировки grade 3; папиллярная опухоль пинеальной области grade 3 (редко); пинеобластома; пилоцитарная астроцитома (редко); пиломиксоидная астроцитома;
– при необходимости выполняется МР-ангиография, МР-перфузия, МР-спек-троскопия;
– в случае первичной опухоли спинного мозга — выполняется МРТ спинного мозга, в случае опухоли с риском метастазирования — выполняется МРТ головного мозга с контрастным усилением;
– при невозможности выполнения МРТ (наличие кардиостимулятора или ферромагнитных имплантов, другие причины) проводится КТ с контрастированием (КТ-перфузия, КТ-ангиография);
– при необходимости (дифференциальная диагностика с инфекционными, демиелинизирующими, сосудистыми и прочими заболеваниями) выполняется ПЭТ (ПЭТ-КТ) с метионином, тирозином, метилдопа;
– при невозможности выполнить гистологическое исследование опухолевой ткани клинический диагноз может быть установлен на основании нейро-визуализационных методик (МРТ, ПЭТ-КТ с аминокислотами);
– пациентам с глиомами в течение первых 24–72 часов послеоперационного периода выполняется МРТ / КТ с контрастированием;
инструментальные исследования:
-
– ЭЭГ — при наличии судорожного синдрома;
-
– рентгенография и /или КТ органов грудной клетки;
– ЭКГ, ЭхоКГ — по показаниям: при наличии кардиоваскулярных заболеваний, в возрасте старше 60 лет, в случае предполагаемой операции в положении «сидя» при планировании лучевой и/или химиотерапии;
-
– УЗИ вен нижних конечностей (для исключения тромбоза), УЗИ внутренних органов;
-
• лабораторная диагностика: развернутый клинический и биохимический анализы крови, коагулограмма, D-димер, общий анализ мочи, опухолевые маркеры (РЭА, АФП, ХГЧ и другие) по показаниям.
-
2.2. Морфологический и молекулярно-генетический диагноз
Формулировка морфологического диагноза должна включать в себя 5-значный код опухоли в соответствии с классификацией ВОЗ опухолей ЦНС (2021 г.), 4-значный код локализации опухоли (в соответствии с МКБ-10), а также степень злокачественности (grade). Ключевым фактором в определении тактики лечения и прогноза заболевания является гистологический диагноз и grade, которая имеет 4 степени: grade 1 — нет критериев злокачественности; grade 2 — один критерий злокачественности (атипия ядер), grade 3 — два критерия злокачественности (атипия ядер, митозы), grade 4 — три или четыре критерия злокачественности (атипия ядер, митозы, пролиферация эндотелия, некрозы). Критерии степеней злокачественности астроцитом с мутацией в генах IDH представлены в табл. 1.
Рекомендуемый алгоритм диагностики при опухолях ЦНС представлен на рис. 1.
Таблица 1. Критерии степени злокачественности астроцитом с мутацией в генах IDH1/IDH2
Grade Признаки
Grade 2 • Диффузно-инфильтративная астроцитарная глиома с мутацией в генах IDH1 или IDH2, хорошо дифференцирована и не имеет гистологических признаков анаплазии.
-
• Митотическая активность не выявляется или очень низкая.
-
• Микроваскулярная пролиферация (пролиферация эндотелия), некроз и гомозиготные делеции CDKN2A и/или CDKN2B отсутствуют.
Grade 3 • Диффузно-инфильтративная астроцитарная глиома с мутацией в генах IDH1 или IDH2, проявляющая очаговую или диффузную анаплазию и значительную митотическую активность.
-
• Микроваскулярная пролиферация (пролиферация эндотелия), некроз и гомозиготные делеции CDKN2A и/или CDKN2B отсутствуют.
Grade 4 • Диффузно-инфильтративная астроцитарная глиома с мутацией в генах IDH1 или
IDH2, проявляющаяся микрососудистой пролиферацией (пролиферация эндотелия) или некрозом, или гомозиготной делецией CDKN2A и/или CDKN2B, или любой комбинацией этих признаков.
Молекулярно-генетическое тестирование необходимо выполнить для постановки корректного патоморфологического диагноза в соответствии с классификацией ВОЗ опу- холей ЦНС (2021 г.). Согласно классификации, рубрика «диффузные глиомы у взрослых» включает три основных типа: 1) астроцитома с мутацией в генах IDH (grade 2–4); 2) олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q (grade 2–3); 3) глиобластома без мутаций в генах IDH. Исключена такая нозологии как «глиобластома с мутацией в генах IDH». Теперь эти новообразования обозначаются как «астроцитома с мутацией в генах IDH grade 4», которые могут развиваться как de novo, так и в результате анапластической трансформации астроцитомы grade 2–3. Присутствие в опухоли мутаций в генах IDH является ключевым диагностическим признаком для диффузных астроцитом grade 2-grade 4 и олигодендроглиом grade 2–3 у взрослых. Глиомы grade 1 не несут в опухоли мутаций в генах IDH. Мутации в генах IDH коррелируют с метилированием промотора гена MGMT, пациенты с этими новообразованиями имеют лучший прогноз и ответ на ЛТ и ХТ алкилирующими препаратами. Диагноз «олигодендроглиома» может быть установлен только в том случае, если опухоль имеет и мутацию в гене IDH1 или IDH2, и ко-делецию 1p19q (частичная делеция 1p или 19q не учитывается). Последняя подтверждает благоприятный прогноз и является предиктором хорошего ответа на терапию алкилирующими препаратами. Наличие гомозиготной делеции CDKN2A и/или CDKN2B изменяет степень злокачественности в диффузных астроцитомах на “grade 4”(табл. 1). Тестирование на мутацию в гене TERT является желательным, и она является характерной для олигодендроглиом (у взрослых) и первичной глиобластомы. Ее наличие при отсутствии мутации в генах IDH связано с неблагоприятным прогнозом. Опухоли с мутациями в гене BRAF могут отвечать на лечение ингибиторами BRAF. Схематически диагностический алгоритм представлен на рис. 2, а основные молекулярно-генетические аберрации — в таблице 2.
Таблица 2. Диагностически значимые молекулярно-генетические аберрации (ВОЗ, 2021 г.)
|
Тип опухоли |
Характерные повреждения генов/ молекулярный профиль |
|
Диффузные глиомы у взрослых |
|
|
Астроцитома с мутацией в генах IDH |
IDH1, IDH2 |
|
Олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q |
IDH1, IDH2, 1p/19q |
|
Глиобластома без мутаций в генах IDH |
IDH-wt, хромосомы 7 и 10, TERT, EGFR, другие аберрации |
|
Диффузные глиомы низкой степени злокачественности у детей |
|
|
Диффузная астроцитома с альтерацией в генах MYB или MYBL1 |
MYB, MYBL1 |
|
Ангиоцентрическая глиома |
MYB |
|
Полиморфная нейроэпителиальная опухоль низкой степени злокачественности у молодых |
BRAF, FGFR |
|
Диффузная глиома низкой степени злокачественности с альтерацией MAPK-пути |
Гены MAPK-пути |
|
Тип опухоли |
Характерные повреждения генов/ молекулярный профиль |
|
Диффузные глиомы высокой степени злокачественности у детей |
|
|
Диффузная срединная глиома с альтерацией H3 K27 |
Н3 p. К28 (К27), EGFR, EZHIP |
|
Диффузная полушарная глиома с мутацией H3 G34 |
H3 р. G34 (G34) |
|
Диффузная детская глиома высокой степени злокачественности без мутаций в генах H3 и IDH |
IDH-wt, H3-wt, метиляционное профилирование |
|
Инфантильная полушарная глиома |
RTK гены |
|
Отграниченные астроцитарные глиомы |
|
|
Пилоцитарная астроцитома |
KIAA1549::BRAF, BRAF |
|
Астроцитома высокой степени злокачественности с пилоидными признаками |
Метиляционное профилирование |
|
Плеоморфная ксантоастроцитома |
BRAF, CDKN2A |
|
Субэпендимальная гигантоклеточная астроцитома |
TSC1, TSC2 |
|
Хордоидная глиома |
PRKCA |
|
Астробластома c альтерацией в гене MN1 |
MN1, BEND2 |
|
Глионейрональные и нейрональные опухоли |
|
|
Ганглионарноклеточные опухоли |
BRAF |
|
Дизэмбриопластическая нейроэпителиальная опухоль |
FGFR1 |
|
Диффузная глионейрональная опухоль с олигодендроглиомоподобными признаками и кластерами ядер |
Метиляционное профилирование |
|
Папиллярная глионейрональная опухоль |
PRKCA |
|
Розеткообразующая глионейрональная опухоль |
FGFR1, PIK3CA, NF1 |
|
Миксоидная глионейрональная опухоль |
PDGFRA |
|
Диффузная лептоменингеальная глионейрональная опухоль |
KIAA1549::BRAF, 1p, метиляционное профилирование |
|
Многоузловая и вакуолизирующая нейрональная опухоль |
Гены MAPK-пути |
|
Диспластическая ганглиоцитома мозжечка (болезнь Лермитта–Дюкло) |
PTEN |
|
Экстравентрикулярная нейроцитома |
FGFR гены (FGFR1::TACC1), IDH-wt |
|
Эпендимарные опухоли |
|
|
Супратенториальная эпендимома |
ZFTA (C11orf95), YAP1 |
|
Эпендимома задней черепной ямки |
PFA молекулярный профиль, PFB молекулярный профиль |
|
Спинальная эпендимома |
NF2, MYCN |
|
Тип опухоли |
Характерные повреждения генов/ молекулярный профиль |
|
Эмбриональные опухоли |
|
|
Медуллобластома с активацией сигнального каскада WNT |
Активация генов сигнального каскада WNT, соматическая мутация в гене ТР53 |
|
Медуллобластома с активацией сигнального каскада SHH |
Активация генов сигнального каскада SHH (герминальные мутации ТР53, РТСН, SUFU, GLI2) |
|
Медуллобластома без активации сигнальных каскадов WNT/SHH |
Метиляционное профилирование |
|
Атипичная тератоидная/рабдоидная опухоль |
Герминальные мутации SMARCB1, SMARCA4 |
|
Эмбриональная опухоль с многослойными розетками |
C19MC, DICER1 |
|
Нейробластома ЦНС с активацией гена FOXR2 |
FOXR2 |
|
Опухоль ЦНС с внутренней тандемной дупликацией гена BCOR |
BCOR |
|
Десмопластическая миксоидная опухоль пинеальной области с мутацией в гене SMARCB1 |
SMARCB1 |
|
Менингиома |
NF2, AKT1, TRAF7, SMO, PIK3CA, и в подтипах KLF4, SMARCE1, BAP1 |
|
Солитарная фиброзная опухоль |
NAB2::STAT6 |
|
Менингеальные меланоцитарные новообразования |
NRAS, GNAQ, GNA11, PLCB4, CYSLTR2 |
|
Опухоли области турецкого седла |
|
|
Адамантиноматозная краниофарингиома |
CTNNB1 |
|
Папиллярная краниофарингиома |
BRAF |
3. ЛЕЧЕНИЕ 3.1. Хирургическое лечение
Основным методом лечения является хирургическое удаление опухоли (в объеме частичной, субтотальной, тотальной резекции) или биопсии (открытой или СТБ). Целью хирургического лечения является максимальная резекция опухоли с сохранением неврологических и когнитивных функций пациента. Особенности удаления внутримозговых опухолей головного мозга:
-
• использование метаболической навигации (5-АЛА);
-
• использование нейрофизиологического мониторинга (ЭКоГ, АСВП, ЗВП, моторное картирование) при локализации опухоли в двигательных зонах, в области черепных нервов и их ядер;
-
• применение хирургического лечения у пациента в сознании (при локализации опухоли в речевых зонах мозга);
-
• использование навигационных методик: интраоперационной электромагнитной навигации, МРТ-навигации, УЗ-навигации;
-
• применение интраоперационного микроскопа и эндоскопической ассистенции;
-
• использование методов непосредственного воздействия на опухолевую ткань (ФДТ, локальная ХТ, криодеструкция и др.)
-
• с учетом морфологической гетерогенности глиом на гистологическое исследование направляется достаточный объем опухолевой ткани из разных ее участков (оптимально — 3–5 фрагментов) с учетом предстоящего ИГХ-исследования и молекулярно-генетического анализа.
-
3.2. Лучевая терапия
-
3.3. Химиотерапия
-
3.4. Сопутствующая терапия3.4.1. Глюкокортикостероидная терапия
Лучевое лечение используется как самостоятельный метод терапии либо после хирургического удаления/биопсии опухоли, либо при возникновении рецидива/про-долженного роста опухоли. ЛТ может проводиться как на область новообразования (на остаточную опухоль или на ложе удаленной опухоли), так и на пути возможного метастазирования (например, КСО), а также в качестве буст-терапии (дополнительное облучение опухоли/ложа удаленной опухоли). КСО применятся у пациентов с опухолями, склонными к метастазированию по оболочкам головного и спинного мозга. При лечении злокачественных опухолей (grade 3–4) ЛТ следует начинать в сроки от 2 до 6 нед. после операции, в ряде случаев — лучевую терапию проводят в комбинации с ХТ. Оптимальными методиками облучения в настоящее время являются конформная ЛТ, IMRT и VMAT. Планирование дозового распределения должно осуществляться с учетом толерантности тканей головного мозга, критических и функционально-значимых структур. Направления пучков и арок следует задавать исходя из пространственной модели опухоли и окружающих ее тканей таким образом, чтобы минимизировать лучевое воздействие на них. Предлучевая топометрическая подготовка включает изготовление индивидуального фиксирующего устройства (термопластической маски) и выполнение тонкосрезовой КТ. Рекомендуется выполнять МРТ в режимах T1, T2, T1 с контрастным усилением и FLAIR. МРТ изображения должны иметь высокое разрешение и тканевую контрастность, оптимальная толщина среза не должна превышать 2 мм.
В ряде случаев при определении мишени целесообразно использовать доопераци-онные снимки. Возможно уменьшение отступов и дозы облучения для снижения лучевых реакций. Возможна эскалация дозы на участки гиперметаболизма или компонента опухоли, накапливающего контраст на T1-взвешенных постконтрастных МР-изображениях, а также в случае рецидивов и агрессивного поведения опухоли. При лечении рецидивов после предшествующей ЛТ облучение фокусируется только на области активной опухоли, без отступа на ее возможное распространение.
Режим гипофракционирования (РОД ≥ 2,5 Гр, СОД ≥ 15 Гр) используется у пациентов с опухолями, имеющими чёткие границы, либо с минимальной зоной возможной инфильтрации тканей (до 3–5 мм), а также у пациентов с образованиями более 3 см и/или с опухолями, располагающимися вблизи критических структур мозга. Гипофракционирование проводится и при лечении рецидивов глиальных и эмбриональных опухолей после проведенной ранее ЛТ.
Радиохирургическое лечение может использоваться у пациентов с небольшими опухолями grade 1–2 (до 3 см в максимальном измерении), имеющими чёткие границы, и с небольшими рецидивами опухолей grade 3–4 после проведенной ранее ЛТ. После ЛТ возможны осложнения в виде отдаленных постлучевых реакций, в том числе, лучевой некроз.
Для дифференциальной диагностики постлучевых повреждений и продолженного роста опухоли выполняется МРТ с контрастированием, ПЭТ (ПЭТ-КТ) с 11С-метиони-ном/18F-фторэтилтирозином, МР-спектроскопия, КТ/МР-перфузия. В лечении постлучевых осложнений возможно применение ГКС и/или введение бевацизумаба (5–10 мг/кг, в/в в 1-й день каждые 2 недели).
Используется в сочетании с ЛТ и как самостоятельный метод лечения после хирургического и/или лучевого лечения в виде моно- или полихимиотерапии.
-
3.4.2. Противосудорожная терапия
-
3.4.3. Антиэметическая терапия
-
3.5. Наблюдение
Антиконвульсанты назначаются при наличии судорожного синдрома (в т. ч. в анамнезе) или признаков эпилептиформной активности по данным ЭЭГ. При планировании и проведении ХТ желательно использование антиконвульсантов, не индуцирующих ферменты печени (ламотриджин, леветирацетам); нежелательно использование карбамазепина, фенитоина, фенобарбитала (повышение риска развития миелосупрессии), а также вальпроата натрия (при одновременном применении темозоломида с вальпроевой кислотой наблюдается слабовыраженное, но статистически значимое снижение клиренса темозоломида и, как следствие — снижение эффективности лечения). Профилактическое применение антиконвульсантов в отсутствие эпиприпадков в анамнезе не обязательно.
При проведении ХТ и ЛТ могут развиваться тошнота и рвота. При их появлении выполняется КТ головного мозга для исключения окклюзионной гидроцефалии, при ее обнаружении решается вопрос о вентрикулоперитонеальном шунтировании, а ХТ или ЛТ прекращают. С целью профилактики и лечения тошноты и рвоты рекомендуется применение ондансетрона 4 мг 2 раза в день ежедневно на фоне ЛТ. При проведении ХТ — 8 мг (или 16 мг) ондансетрона принимаются внутрь или вводятся в/в за 30 мин. до приема или в/в введения химиопрепарата, далее — по показаниям (через 6 часов ежедневно на фоне ХТ и два дня после ее завершения). При сохранении рвоты на фоне приема антиэметика рекомендовано в схему включить дексаметазон от 4 мг до 8 мг однократно.
После завершения лечения рекомендуется регулярное выполнение МРТ головного мозга в стандартных проекциях с контрастированием в режимах Т1, Т2, FLAIR, DWI. При опухолях, склонных к лептоменингеальной диссеминации, необходимо выполнять МРТ всех отделов спинного мозга. К таким новообразованиям относятся диффузная глиома средней линии с альтерацией в гене H3 K27; диффузная полушарная глиома с мутацией в гене H3 G34; миксопапиллярная эпендимома; спинальная эпендимома с амплификацией гена MYCN; супратенториальная эпендимома; глиобластома с примитивным нейрональным компонентом (особенно с амплификацией гена MYCN); эмбриональные опухоли; опухоли шишковидной железы (особенно с гиперэкспрессией гена FOXR2, амплификацией гена MYCN и альтерацией гена RB1-преимущественно у детей); пинеальная паренхиматозная опухоль промежуточной дифференцировки grade 3; папиллярная опухоль пинеальной области grade 3 (редко); пинеобластома; плеоморфная ксантоастроцитома; пилоцитарная астроцитома (редко); пиломиксоидная астроцитома. Оценка МРТ-данных проводится в соответствии с критериями эффективности лечения RANO с обязательным наличием всех признаков для каждого критерия (табл. 3). Для определения функционального статуса нейроонкологических больных используется шкала Карновского (табл. 4).
Таблица 3. Критерии эффективности по шкале RANO
|
Полный ответ |
Частичный ответ |
Прогрессирование |
уменьшающиеся некон-трастируемые в режиме Т2 FLAIR очаги
|
|
|
Все остальные ситуации расцениваются как стабилизация состояния.
Таблица 4. Шкала оценки функционального статуса (по Карновскому)
% Характеристика состояния
100 Состояние нормальное, жалоб нет
90 Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
-
60 Нуждается порой в посторонней помощи, но способен сам удовлетворять бóльшую часть своих потребностей
-
50 Нуждается в значительной посторонней помощи и медицинском обслуживании
-
40 Инвалид, нуждается в специальной помощи, в т. ч. медицинской
-
30 Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
-
20 Тяжелое состояние, необходимы госпитализация и лечение
-
10 Умирающий
0 Смерть
4. АЛГОРИТМЫ ЛЕЧЕНИЯ РАЗЛИЧНЫХ ГРУПП ПЕРВИЧНЫХ ОПУХОЛЕЙ ЦНС
4.1. Отграниченные астроцитомы и глионейрональные опухоли (grade 1):
-
• пилоцитарная астроцитома;
-
• субэпендимальная гигантоклеточная астроцитома;
-
• ганглиоглиома
После радикального удаления обычно не требуют проведения адъювантной терапии, проводится динамическое наблюдение: МРТ один раз в 3–6 месяцев или при нарастании неврологических симптомов.
При их озлокачествлении лечение осуществляется по принципам лечения злокачественных глиом. При диффузной субэпендимарной гигантоклеточной астроцитоме (одно из проявлений туберозного склероза) показано лечение ингибитором mTOR эверолимусом (МКЗ III-A). При неполном удалении/биопсии или наличии хотя бы одного фактора риска развития раннего рецидива (возраст > 40 лет, размер опухоли > 60 мм, неврологический дефицит, поражение двух долей или мозолистого тела) выполняется ЛТ. Пациентам с пило-цитарной астроцитомой с диаметром опухоли до 3 см может выполняться радиохирургия (10–14 Гр), более 3 см — ЛТ в режиме гипофракционирования (3–5 фракций до СОД 18–25 Гр). ХТ этой категории больных проводится только в случае рецидива/прогрессирования заболевания. Таргетная терапия применяется при глиомах низкой степени злокачественности с мутацией в гене BRAF. Возможна как монотерапия вемурафенибом и дабрафенибом (МКЗ II-A), так и комбинацией BRAF/МЕК ингибиторами (МКЗ III-A). Вопрос о лечении пациентов старше 70 лет решается индивидуально. Алгоритм лечения взрослых больных с диффузными глиальными опухолями grade 1 представлен в табл. 5.
Таблица 5. Алгоритм и схемы лечения взрослых больных с диффузными глиальными опухолями grade 1 (пилоцитарная астроцитома, субэпендимальная гигантоклеточная астроцитома, ганглиоглиома)
|
Рекомендованные режимы |
Возможные режимы |
|
|
Адьювантная терапия |
После радикального хирургического удаления — наблюдение |
BRAF/МЕК ингибиторы (ПА, ГГ):
|
Рекомендованные режимы
Возможные режимы
|
Рецидив/ |
• ЛТ + АХТ PCV |
|
прогрессия |
(ломустин 100 мг/м 2 внутрь в 1-й |
|
заболевания |
день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни + прокарбазин 60–75 мг/м 2 внутрь в 8–21-й дни, цикл 6–8 недель, до 6 циклов в зависимости от переносимости) или CV (ломустин 90 мг/м 2 внутрь в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни, цикл 6–8 недель, 6–8 циклов |
в зависимости от переносимости)
-
• ЛТ + АХТ темозоломид (темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–12 циклов, до 24 циклов
в зависимости от переносимости и эффективности
-
• ЛТ на фоне ежедневного приема темозоломида + АХТ темозоломидом
-
• PCV (ломустин 100 мг/м 2 внутрь в 1-й день + вин-кристин 1,4 мг/м 2 в/в в 1-й и 8-й дни + прокарбазин 60–75 мг/м 2 внутрь в 8–21-й дни, цикл 6–8 недель, до 6 циклов)
-
• Ломустин (ломустин 90–110 мг/м 2 внутрь в 1-й день, цикл 6–8 недель, 6–8 циклов)
-
• Кармустин (кармустин 200 мг/м 2 в/в 1-часовая инфузия в 1-й день, цикл 6–8 недель, 6–8 циклов; кармустин 80 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 6–8 недель, до 6 циклов)
-
• Темозоломид (темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–1 2 циклов (максимально 24 цикла)
NTRK-перестройки в опухоли:
-
• Ларотректиниб (ларотректиниб 100 мг внутрь
-
2 раза в день непрерывно до прогрессирования или непереносимой токсичности)
-
• Энтректиниб (энтректиниб 600 мг внутрь 1 раз в день ежедневно до прогрессирования, или непереносимой токсичности)
BRAF (V600E) активирующие мутации — BRAF/МЕК ингибиторы:
-
• Дабрафениб / траметиниб
-
• Вемурафениб / кобиметиниб
МЕК ингибитор:
-
• Селуметиниб (для ПА с BRAF-перестройками или BRAF (V600E) активирующими мутациями или НФ1) (селуметиниб 25 мг/м 2 внутрь 2 раза в день ежедневно, курс 28 дней, всего до 26 курсов)
Платиносодержащие схемы (ПА):
-
• Цисплатин + этопозид (цисплатин 40 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 120 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости)
-
• Карбоплатин + этопозид (карбоплатин 200 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 150 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости)
-
• Карбоплатин (карбоплатин 560 мг/м 2 в/в 1-й день, цикл 28 дней до прогрессирования заболевания, появления неприемлемой токсичности или в течение 12 дополнительных курсов после достижения максимального ответа)
PCV — прокарбазин + ломустин + винкристин;
CV — ломустин + винкристин;
НФ1 — нейрофиброматоз 1 типа;
ПА — пилоцитарная астроцитома;
ГГ — ганглиоглиома.
АХТ — адьювантная ХТ;
СЭГА — субэпендимарная гигантоклеточная астроцитома.
-
4.2. Диффузные глиомы и отграниченные астроцитарные глиомы (grade 2):
-
• астроцитома с мутацией в генах IDH;
-
• олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q;
-
• плеоморфная ксантоастроцитома
-
4.3. Диффузные глиомы grade 3–4 и глионейрональные опухоли grade 3:
Для диффузных астроцитом характерен инвазивный рост с постепенной трансформацией в астроцитомы более высокой степени злокачественности. Объем резекции является важным прогностическим фактором, однако не у всех больных опухоль можно удалить тотально. При локализации опухоли в глубоких областях мозга или в функционально-значимых зонах часто выполняется СТБ.
Вопрос о целесообразности назначения ЛТ и ХТ решается индивидуально с определением групп низкого или высокого риска прогрессирования опухоли (рис. 3). К фаторам высокого риска относят: возраст > 40 лет, наличие резидуальной опухоли после хирургического удаления (субтотальная или частичная резекция, открытая или стереотаксическая биопсия), размер опухоли > 60 мм, неврологический дефицит, поражение двух долей или мозолистого тела (достаточно наличия одного фактора). К факторам риска развития раннего рецидива можно отнести фокальное накопление контраста на МРТ и индекс накопления РФП (метионина), соответствующий анаплазии, при проведении ПЭТ-КТ (достаточно наличия одного фактора). После оперативного вмешательства всем больным проводится ЛТ за исключением случаев с полной резекцией опухоли и без наличия факторов риска раннего прогрессирования. В этих случаях проводится наблюдение — МРТ 1 раз в 3–6 месяцев или при нарастании симптомов. При неполном удалении/биопсии опухоли и при наличии еще одного фактора высокого риска развития раннего рецидива показано назначение ЛТ с РОД 1,8–2,0 Гр до СОД 50,4–54 Гр и/или ХТ (табл. 6) Радиохирургия может рассматриваться при небольших отграниченных опухолях и при локальных небольших рецидивах после ЛТ.
Пациентам пожилого возраста (старше 70 лет) с обширными опухолями ЛТ может не проводиться, а назначается монотерапия темозоломидом (5/23) (табл. 6). Вопрос о назначении ЛТ и ХТ ослабленным пациентам (низкий индекс Карновского и/или признаки внутричерепной гипертензии), а также больным с распространённой опухолью решается индивидуально. После окончания курса ЛТ выполняется контрольная МРТ (через 2–4 недели после окончания ЛТ, а затем — каждые 2–3 месяца в течение 2–3 лет) с решением вопроса о целесообразности проведения ХТ.
При рецидиве оценивается возможность повторного удаления с пересмотром гистологического диагноза. При невозможности проведения хирургического удаления степень анаплазии можно оценить по результатам ПЭТ-КТ с аминокислотами и накоплению контраста опухолью при МРТ. При планировании лечения учитывается, какие методы были использованы ранее, применялись ли лучевая и/или химиотерапия, был ли достигнут объективный ответ на лечение.
Рекомендуемый алгоритм лечения больных диффузной глиомой grade 2 представлен на рис. 3.
-
• астроцитома с мутацией в генах IDH grade 3;
-
• астроцитома с мутацией в генах IDH grade 4;
-
• олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q grade 3;
-
• плеоморфная ксантоастроцитома grade 3;
-
• глиобластома без мутаций в генах IDH grade 4;
-
• диффузная глиома средней линии с альтерацией в гене H3 K27 grade 4;
-
• диффузная полушарная глиома с мутацией H3 G34 grade 4;
-
• ганглиоглиома grade 3.
-
4.3.1. Диагностика
-
4.3.2. Определение степени злокачественности
-
4.3.3. Лечение
Осуществляется с помощью МРТ, ПЭТ-КТ. Молекулярно-генетическое исследование: мутации в генах IDH1/IDH2, ко-делеция 1p/19q, метилирование промотора гена MGMT, мутации в гене BRAF, мутации в гене TERT, гомозиготная делеция CDKN2A и/или CDKN2B.
В диффузных глиомах основывается на наличии в опухоли указанных выше критериев злокачественности, индекса пролиферации Ki-67 (табл. 1) и нового критерия — гомозиготной делеции CDKN2A и/или CDKN2B. Обнаружение гомозиготной делеции CDKN2A и/или CDKN2B приводит к изменению степени злокачественности для диффузных астроцитом (рис. 2). Если она обнаруживается в опухоли, даже в случае гистологической картины «доброкачественной глиомы»(при отсутствии микрососудистой пролиферации и некрозов), степень анаплазии будет соответствовать grade 4. При отсутствии мутации в генах IDH целесообразно исследовать мутационный статус гена H3F3A, мутации которого у детей и взрослых могут возникать в двух вариантах: в срединных опухолях — К27 (неблагоприятный прогноз) и в полушарных опухолях — G34 (прогноз относительно благоприятный, часто сочетаются с метилированием промотора гена MGMT). Опухоли, гистологически соответствующие диффузной астроцитоме, но без мутаций в генах IDH1 или IDH2, целесообразно дополнительно исследовать для оценки мутации в гене TERT, амплификации гена EGFR. Диффузные астроцитомы без мутаций в генах IDH1/IDH2 и H3F3A, присутствием мутации в гене TERT, амплификации EGFR, а также + 7/–10 хр, следует считать глиобластомами (рис. 2).
После хирургической резекции опухоли пациентам с верифицированным диагнозом проводится ЛТ (30 фракций по 2 Гр на фракцию до СОД 60 Гр) с одновременным ежедневным приемом темозоломида (75 мг/м2) в течение всего курса ЛТ с последующей адьювантной ХТ. В GTV рекомендуется включать остаточную опухоль и/или ложе опу- холи. На дозе 46 Гр при РОД 2 Гр и 50,4 Гр при РОД 1,8 Гр возможно сокращение объема облучения (буст). Пациентам старше 70 лет, а также больным в общем состоянии по шкале Карновского < 60% рекомендован режим гипофракционирования с РОД 3 Гр и СОД 45 Гр.
Таблица 6. Рекомендуемые режимы лекарственной терапии диффузных глиом (grade 2–4) и глионейрональных опухолей (grade 3)
|
Режим |
Схема проведения |
|
Темозоломид 1 |
Темозоломид (в составе ХЛТ) 75 мг/м 2 внутрь ежедневно, начиная с первого дня и на протяжении всего курса ЛТ |
|
Темозоломид 1 |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–12 циклов, до 24 циклов в зависимости от переносимости и эффективности |
|
PCV 2 |
Ломустин 100 мг/м 2 внутрь в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни + про-карбазин 60–75 мг/м 2 внутрь в 8–21-й дни, цикл 6–8 недель, до 6 циклов в зависимости от переносимости |
|
CV |
Ломустин 90 мг/м 2 внутрь в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й и 8-й дни, цикл 6–8 недель, 6–8 циклов в зависимости от переносимости |
|
Ломустин |
Ломустин 90–110 мг/м 2 внутрь в 1-й день, цикл 6–8 недель, 6–8 циклов в зависимости от переносимости |
|
Кармустин |
Кармустин 200 мг/м 2 в/в 1-часовая инфузия в 1-й день, цикл 6–8 недель, до 6 циклов |
|
Кармустин |
Кармустин 80 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 6–8 недель, до 6 циклов |
|
РС |
Прокарбазин 60 мг/м 2 внутрь в 1–10-й дни + ломустин 100 мг/м 2 внутрь в 1-й день, цикл 6–8 недель, до 6 циклов |
|
Темозоломид + цисплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, цикл 28 дней, до 6 циклов |
|
Темозоломид + карбоплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней, до 6 циклов |
|
Темозоломид + бевацизумаб |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни + бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб + этопозид |
Бевацизумаб 5 мг/кг в/в в 1-й и 15-й дни + этопозид 80 мг/м 2 в/в в 1–5-й дни, цикл 21 или 28 дней, до 6 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб + карбоплатин |
Бевацизумаб 7,5 мг/кг в/в в 1-й день + карбоплатин AUC5 в/в в 1-й день, цикл 21 день, до 6 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Дабрафениб + траметиниб3 |
Дабрафениб 150 мг внутрь 2 раза в день ежедневно + траметиниб 2 мг внутрь 1 раз в день ежедневно, до прогрессирования или непереносимой токсичности |
|
Вемурафениб + кобиметиниб3 |
Вемурафениб 960 мг внутрь 2 раза в день ежедневно + кобиметиниб 60 мг внутрь 1 раз в день в 1–21-й дни каждые 4 недели, до прогрессирования или непереносимой токсичности |
|
Темозоломид + ломустин |
Темозоломид 100 мг/м 2 внутрь в 2–6-й дни + Ломустин 80 мг/м 2 внутрь в 1-й день, цикл 6 недель, 8 циклов |
-
1 Стандартный режим для астроцитарных опухолей (grade 3–4).
-
2 Стандартный режим для астроцитарных опухолей (grade 2–3).
-
3 Для опухолей с мутацией в гене BRAF.
-
4.3.4. Псевдопрогрессия
-
4.3.5. Наблюдение
-
4.3.6. Неблагоприятные факторы прогноза
-
4.3.7. Лечение рецидивов/прогрессирования
Наилучшие результаты лечения глиом с мутацией в гене BRAF отмечены для плеоморфной ксантоастроцитомы (ПХА) при терапии вемурафенибом в монорежиме (МКЗ I-A). Накапливаются результаты применения двойной комбинации BRAF/МЕК ингибиторов у больных с ПХА с мутацией в гене BRAF (МКЗ II-A). BRAF ингибиторы для других нозологий с мутацией в гене BRAF также применяются (МКЗ II-A).
Пациентам с олигодендроглиомой grade 3 в послеоперационном периоде рекомендованы ЛТ и ХТ (PCV или монотерапия темозоломидом). Лечение можно начинать как с ЛТ, так и с ХТ. При полном ответе на ХТ проведение ЛТ может быть отложено в качестве резерва лечения при развитии рецидива (табл. 6).
Через 2–3 месяца после комбинированной ХЛТ на контрольных МРТ можно наблюдать феномен псевдопрогрессии опухоли — увеличение ее контрастируемой части при отсутствии нарастания неврологических симптомов и при стабильных дозах ГКС. В данной ситуации рекомендуется ПЭТ с метионином/тирозином или МРТ с контрастированием через 2 месяца, или, при необходимости, как крайняя мера — СТБ. Псевдопрогрессия может наблюдаться и в более поздние сроки после ЛТ с появлением контрастирования как в месте первичной опухоли, так и нового фокуса контрастирования на отдалении (часто паравентрикулярно, мозолистое тело).
МРТ с контрастированием в трёх проекциях в стандартных режимах — Т1, Т2, FLAIR, Т1 с толщиной среза, не превышающей 2 мм, выполняется каждые 3–4 месяца. Для спинного мозга опримальная толщина среза 1–1,5 мм.
Гистологические характеристики опухоли (grade 3–4), возраст старше 70 лет, функциональный статус по шкале Карновского ниже 60%, неполная резекция опухоли, высокая экспрессия гена MGMT (или отсутствие метилирования промотора гена MGMT).
Рекомендуемый алгоритм лечения больных диффузной глиомой grade 3–4 представлен на рисунке 4.
При возникновении рецидива/прогрессирования заболевания вопрос о повторном хирургическом вмешательстве, повторной ЛТ и лекарственной терапии решается индивидуально (рис. 5). Виды ЛТ рассматриваются в зависимости от характера рецидива — локальный в месте первичной опухоли, отдаленный, диссеминация по оболочкам головного и/или спинного мозга и т. д., времени от предыдущей ЛТ, размера нового очага. В качестве терапии рекомендованы режимы с включением бевацизумаба, схемы с препаратами платины, а также ХТ темозоломидом в случае объективного ответа на лечение в первой линии терапии или ПХТ по схеме PCV/CV. При наличии мутаций в гене IDH1 можно рассмотреть вопрос о назначении ивосидениба c прогнозируемым лучшим ответом на терапию у больных без накопления контраста в опухоли (МКЗ II-A) (табл. 7).
Таблица 7. Рекомендуемые режимы лекарственной терапии рецидивов диффузных глиом (grade 2–3–4) и глионейрональных опухолей (grade 3)
|
Режим |
Схема проведения |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), до 24 циклов в зависимости от переносимости и эффективности |
|
Темозоломид в метроном-ном режиме |
Темозоломид 75 мг/м 2 внутрь в 1–7-й дни, цикл 14 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
|
Бевацизумаб + темозоломид |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб + ломустин |
Бевацизумаб 5–10 мг/кг в/в в 1, 15 и 29-й дни + ломустин 90 мг/м 2 внутрь в 1-й день, цикл 6 недель, до 6 циклов |
|
Бевацизумаб 5–10 мг/кг в/в в 1, 15, 29 и 43-й дни + ломустин 40 мг внутрь в 1, 8, 15 и 22-й дни, цикл 6 недель, до 6 циклов |
|
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Бевацизумаб + карбоплатин |
Бевацизумаб 7,5 мг/кг в/в в 1-й день + карбоплатин AUC5 в/в в 1-й день, цикл 21 день, до 6 циклов в зависимости от переносимости и эффективности |
|
Темозоломид + карбоплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней, до 6 циклов в зависимости от переносимости и эффективности |
|
Ивосидениб1 |
Ивосидениб 500 мг внутрь 1 раз в день ежедневно, до прогрессирования или непереносимой токсичности |
1 Для опухолей с мутацией в гене IDH1.
-
4.4. Опухоли ствола головного мозга
-
4.5. Эпендимома
При узловых формах опухолей ствола мозга, экзофитном характере роста, т. е. при МР-признаках полной или частичной отграниченности от структур ствола (например, при пилоидной астроцитоме) показано удаление опухоли или открытая биопсия. Далее, в зависимости от гистологического диагноза, молекулярно-генетических характеристик, возраста и радикальности удаления назначаются ЛТ и/или ХТ/таргетная терапия. При диффузном характере роста и невозможности выполнить даже СТБ (из-за высокого риска жизнеугрожающих осложнений) рекомендовано выполнение ПЭТ-КТ с аминокислотами для оценки степени анаплазии опухоли. Назначение ЛТ и ХТ/таргетнной терапии таким больным проводится в индивидуальном порядке. Рекомендуется применение стереотаксической техники облучения до СОД 54 Гр за 30 фракций, отступы на СTV и PTV минимизируются с учетом максимально точного определения границ опухоли на основании структурных и метаболических методов нейровизуализации. При ювенильных глиомах четверохолмной пластинки после разрешения гидроцефалии осуществляется регулярное клиническое и МРТ-наблюдение (в случае прогрессирования опухоли рассматривается вопрос об удалении опухоли с последующей ЛТ).
Выделяют три биологических подтипа с учетом локализации первичного очага и генетической аберрации:
-
• супратенториальная эпендимома с ZFTA fusion-positive; супратенториальная эпендимома с YAP1 fusion-positive;
-
• эпендимома задней черепной ямки группы А (PFA); эпендимома задней черепной ямки группы B (PFB);
-
• спинальная эпендимома с амплификацией гена MYCN; субэпендимома; миксопапиллярная эпендимома.
Степень анаплазии опухоли в настоящее время не имеет значения в прогнозе. Прогностическое значение имеет молекулярная группа и объем резекции опухоли. Супратенториальная, инфратенториальная и спинальная эпендимома на первом этапе требуют хирургического удаления, которое имеет ведущую роль в прогнозе заболевания. При тотальном удалении эпендимомы прогноз очень хороший. При остаточной опухоли рекомендована повторная консультация нейрохирурга для решения вопроса о возможности тотального удаления образования.
В послеоперационном периоде выполняется МРТ головного и спинного мозга с контрастированием с целью выявления возможных субарахноидальных метастазов и исследование спинномозговой жидкости на опухолевые клетки (не ранее 2 недель после операции) (рис. 6).
После удаления супратенториальной, инфратенториальной и спинальной эпендимомы проводится локальная ЛТ при отсутствии лептоменингиальных метастазов и опухолевых клеток в ликворе — РОД 1,8–2 Гр до СОД 59,4 Гр. При выявлении метастазирования (по данным МРТ или анализа ликвора) проводится КСО 35,2 Гр с РОД 1,8 Гр, буст на очаги отсева 49,6 Гр. При эпендимоме с локализацией в спинном мозге выполняется ЛТ
СОД 54,6 Гр, в шейном отделе до СОД 50 Гр. Возможен буст до СОД 59,4 Гр в зависимости от локализации.
Субэпендимома и миксопапиллярная эпендимома при тотальном удалении опухоли и отсутствии метастазирования по ликворопроводящим путям переходят на динамическое наблюдение.
ХТ в первой линии в лечении эпендимомы при ее тотальном удалении не применяется.
В случае рецидива эпендимомы рекомендованы повторное хирургическое лечение и проведение повторной локальной ЛТ (при отсутствии метастазов и опухолевых клеток) в той же дозе.
При неоперабельном локальном рецидиве или при лептоменингиальном метастазировании рекомендована стереотаксическая радиохирургия в СОД 14–20 Гр.
ХТ назначается пациентам с эпендимомой в случае рецидива после повторной ЛТ при невозможности проведения повторного радикального хирургического удаления и повторной ЛТ (табл. 8). Хорошие результаты лечения с длительным контролем заболевания были получены при проведении терапии по схеме темозоломид + лапатиниб (МКЗ II-A) (табл. 8).
При динамическом наблюдении контрольные обследования (МРТ головного и всех отделов спинного мозга с контрастированием и клиническое обследование) выполняются 1 раз в 3–4 месяца на протяжении первых 2 лет наблюдения, затем, при отсутствии данных за прогрессирование — не реже 1 раза в 6 месяцев в течение следующих 3 лет, затем — 1 раз в год или при появлении неврологических симптомов. В случае прогрессирования в виде солитарного очага рассматривается вопрос о повторной операции и повторной локальной лучевой терапии. При неоперабельной опухоли или небольших размерах рецидива — о радиохирургическом лечении.
Таблица 8. Рекомендуемые режимы лекарственной терапии эпендимом в случае рецидива
|
Режим |
Схема проведения |
|
Темозоломид + лапатиниб |
Темозоломид 125 мг/м 2 (первые 2 цикла) — 150 мг/м 2 (при отсутствии гематологической токсичности 3–4 ст) внутрь в 1–7-й и 15–21-й дни, цикл 28 дней + лапатиниб1 1250 мг внутрь 1 раз в сутки ежедневно до прогрессирования или непереносимой токсичности (число циклов зависит от эффективности и переносимости терапии, но не более 24 циклов) |
|
Темозоломид |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–12 циклов, до 24 циклов в зависимости от переносимости и эффективности |
|
Этопозид |
Этопозид 50–100 мг/м 2 внутрь или в/в в 1–5-й дни, цикл 21–28 дней (минимум 6 циклов при отсутствии токсичности и продолженного роста) |
1 По решению консилиума при рецидиве (возможно вторичном рецидиве, когда все другие опции исчерпаны).
-
4.6. Первичная лимфома ЦНС
-
4.7. Первичные герминогенные (герминативно-клеточные) опухоли
Морфологически, более чем в 90% случаев представлена диффузной В-клеточной лимфомой, однако встречаются все формы неходжкинских лимфом (Т-клеточная, внутрисосудистая крупноклеточная, MALT-лимфома твердой мозговой оболочки).
Методом установления диагноза лимфомы является СТБ. Открытая операция выполняется при состояниях, угрожающих жизни пациентов, и невозможности произвести СТБ. Использовать ГКС до операции не рекомендуется. Для постановки морфологического диагноза рекомендуется проводить ИГХ со следующими антителами: CD45, CD20, CD79a, MUM1, BCL-2, BCL-6. При общем состоянии больного по шкале Карновского > 50%, сохранной функции печени и почек, возрасте не старше 65 лет методом выбора является ХТ на основе высокодозного (HD) метотрексата с обязательным определением концентрации метотрексата в крови после проведения цикла с HD метотрексатом. При достижении полного или частичного ответа после 4 циклов ПХТ (метотрексат + дексаметазон + темозоломид + ритуксимаб) пациенты получают дополнительный курс высоких доз метотрексата (1 введение) плюс 1 курс темозоломида. Далее, через 3–5 недель больным проводится терапия этопозидом с цитарабином (табл. 9), после чего выполняется МРТ головного мозга каждые 2 месяца в течение первого года, затем — каждые 4 месяца в течение 2-го и 3-го лет. Начиная с 3,5 лет МРТ назначается каждые 6 месяцев. Пациентам старше 65 лет и/или при низком функциональном статусе (< 60% по шкале Карновского) рекомендовано применение в первой линии темозоломида в режиме 5/23.
Таблица 9. Рекомендуемые режимы лекарственной терапии первичной лимфомы
|
Режим |
Схема проведения |
|
Метотрексат + дексаметазон + темозоломид + ритуксимаб |
Метотрексат 3000–8000 мг/м 2 в/в 24-часовая инфузия 1 раз в 14 дней, в 1-й день, 7 введений (+ кальция фолинат 0,5 мг/кг в/в каждые 6 часов, начиная через 24 часа после введения метотрексата и под контролем снижения его концентрации в крови, во 2-й день) + дексаметазон 8 мг/сут. в/в в 1–3-й дни + темозоломид 150 мг/м 2 внутрь в 7–11-й дни, цикл 28 дней, 4 цикла + ритуксимаб 375 мг/м 2 в/в 1 раз в 7 дней, в 3-й день, 6 введений (при В-клеточной CD20 позитивной лимфоме) |
|
Этопозид + цитарабин |
Этопозид 5 мг/кг каждые 12 часов, 8 доз, непрерывная в/в инфузия в 1–4-й дни (общая доза 40 мг/кг за 96 часов инфузии) + цитарабин 2000 мг/м 2 2-часовая в/в инфузия, каждые 12 часов, 8 доз, в 1–4-й дни (общая доза 16000 мг/м 2 ) |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), до 24 циклов в зависимости от переносимости и эффективности |
|
Темозоломид + ритуксимаб |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + ритуксимаб 375 мг/м 2 в/в в 6-й день цикл 28 дней (при В-клеточной CD20 позитивной лимфоме), 6 циклов, далее в зависимости от переносимости, эффективности по данным МРТ |
Вариантом высокодозной ХТ метотрексатом является внутриартериальная ХТ с временным открытием гематоэнцефалического барьера. У молодых пациентов рассматривается метод высокодозной ХТ на основе метотрексата с пересадкой стволовых клеток крови. При полном ответе, сохраняющемся в течение года с момента верификации диагноза, пациент остается под наблюдением. При неполном ответе показана ЛТ всего головного мозга в дозе 36 Гр (20 фракций по 1,8 Гр) с последующим проведением МРТ с контрастированием и при необходимости с добавлением буста до СОД 45 Гр на сохраняющийся очаг контрастирования (рис. 7, 8). При лимфоме глаза выполняется интравитреальное введение метотрексата и/или ЛТ глазного яблока (20 фракций по 1,8 Гр), а также назначение леналидомида. При тяжелом состоянии пациента и отказе от проведения ХТ может проводиться гипофракционированная ЛТ до СОД 15–20 Гр.
Встречаются преимущественно в детском и молодом возрасте (наиболее часто в возрасте от 8–10 до 30 лет) и характеризуются высокой чувствительностью к ЛТ и ХТ. Выделяют «чистую» герминому и негерминогенные герминативно-клеточные опухоли (эмбриональная карцинома (ЭК), опухоль желточного мешка, хориокарцинома, тератома (зрелая, незрелая, тератома со злокачественной трансформацией), смешанные герминативно-клеточные опухоли.
Локализация опухоли очень часто встречается в пинеальной и хиазмально-селлярной области, реже в базальных ганглиях, мозжечке. Герминома может одновременно располагаться в пинеальнной и хиазмально-селлярной области — бифокальная герминома (не относится к метастатической опухоли).
Не секретируют онкомаркеры «чистая» герминома, тератомы, иногда эмбриональная карцинома.
-
4.7.1. Диагностика
-
4.7.2. Лечение
МРТ головного и спинного мозга с контрастированием, исследование онкомаркеров β-ХГЧ, АФП в крови и спинномозговой жидкости, цитологическое исследование ликвора. При поражении хиазмально-селлярной области исследуются гормоны гипофиза.
Диагноз устанавливается на основании локализации опухоли и повышенном уровне онкомаркеров. При отсутствии повышения онкомаркеров («чистая» герминома, тератомы, иногда ЭК) рекомендована биопсия опухоли для установления морфологического диагноза.
При бифокальной герминоме и нормальных показателях онкомаркеров биопсия опухоли не показана.
Терапию герминогенных опухолей ЦНС рекомендовано проводить в специализированных центрах.
При выявлении повышения одного или обоих маркеров (β-ХГЧ — ≥ 5 × ВГН, АФП — ≥ 2 × ВГН) проводят ХТ без гистологической верификации опухоли с последующим облучением.
Лечение локализованной герминомы состоит из индукционной ХТ (комбинации «карбоплатин + этопозид»(СЕ) и «карбоплатин + ифосфамид»(СI) в альтернирующем режиме (всего 4 цикла) с последующей оценкой эффекта (табл. 10). При достижении полного регресса проводится облучение желудочковой системы (СОД 24 Гр), при достижении частичного регресса дополнительно проводится облучение остаточной опухоли (до СОД 40 Гр).
Метастатическая герминома подлежит только лучевой терапии в объеме краниоспинального облучения СОД 24 Гр с бустом на опухолевые очаги СОД 16 Гр.
При метастатической герминоме ХТ не показана!
Лечение негерминогенных опухолей ЦНС начинают с 3-х циклов ХТ по схеме PEI (комбинация «цисплатин + этопозид + ифосфамид») с последующей оценкой эффекта. При достижении полного регресса проводится 4-й цикл ХТ по схеме PEI, затем облучение ложа опухоли СОД 30 Гр и желудочковой системы СОД 24 Гр (при локальной форме) или облучение ложа опухоли СОД 24 Гр и краниоспинальное облучение СОД 30 Гр при метастатической форме. При достижении частичного регресса или стабилизации выполняется хирургическое удаление резидуальной опухоли с оценкой патоморфологического ответа, последующим проведением 4-го цикла ХТ по схеме PEI и аналогичным облучением.
При чистой несекретирующей герминоме проводят облучение желудочковой системы РОД 1,8–2 Гр, СОД 24 Гр (при отсутствии метастазирования) с бустом на остаточную опухоль до СОД 40 Гр. При отсутствии остаточной опухоли буст не проводится. При выявлении метастазирования инициально у пациентов с подтвержденной герминомой проводится только лучевая терапия в объеме КСО СОД 24 Гр, буст на область метастазов и опухоль до СОД 40 Гр.
При наличии остаточной опухоли (негерминогенные опухоли) до начала ЛТ решается вопрос о ее хирургическом удалении. Лучевая терапия при локальной опухоли составляет 54 Гр на область опухоли. При выявлении ининциально метастазов лучевая терапия проводится в объеме КСО СОД 30 Гр и буст на область опухоли до СОД 54 Гр.
При необходимости решается вопрос о ликворошунтирующей операции.
Таблица 10. Режимы лекарственной терапии герминативно-клеточных опухолей
Режим Схема проведения
«ЧИСТАЯ» ГЕРМИНОМА
2 блока, всего 4 альтернирующих цикла с интервалом в 21 день (начало 2 цикла на 22 день, 3-й цикл на 43 день и 4-й цикл на 64 день)
Этопозид + карбоплатин СЕ Этопозид 100 мг/м 2 в/в в 1–3-й дни + карбоплатин 600 мг/м 2 в/в 1 день;
Этопозид + ифосфамид EI Этопозид 100 мг/м 2 в/в в 1–3-й дни + ифосфамид 1800 мг/м 2 1–5дни (+ месна 1 )
Режимы второй — третьей линий
|
Паклитаксел |
Паклитаксел 120 мг/м 2 в/в в 1-й и 2-й дни + ифосфамид 1500 мг/м 2 в/в во |
|
+ ифосфамид |
2–5-й дни (+ месна 1 в/в во 2–5-й дни) + цисплатин 25 мг/м 2 в/в в 2–5-й дни |
|
+ цисплатин (TIP) |
(+ филграстим 5 мкг/кг п/к в 6–15-й дни или эмпэгфилграстим 7,5 мг п/к в 6-й день), цикл 21день, не более 4 циклов |
|
Режим |
Схема проведения |
|
Винбластин + ифосфамид + цисплатин (VeIP) |
Винбластин 0,11 мг/кг в/в в 1-й и 2-й дни + ифосфамид 1200 мг/м 2 в/в в 1–5-й дни (+ месна 1 в/в во 2–5-й дни) + цисплатин 20 мг/м 2 в/в в 1–5-й дни (+ филграстим 5 мкг/кг п/к в 6–15-й дни или эмпэгфилграстим 7,5 мг п/к в 6-й день), цикл 21 день, не более 4 циклов |
|
Гемцитабин + оксалиплатин (GEMOX) |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни + оксалиплатин 130 мг/м 2 в/в в 1-й день, цикл 21 день, 4–6 циклов |
|
Этопозид |
Этопозид 100 мг/сут внутрь в 1–10-й дни, перерыв 14 дней, до прогрессирова-ния 2 |
|
Негерминогенные опухоли 3 |
|
|
Цисплатин + этопозид + ифосфамид (PEI) |
Цисплатин 20 мг/м 2 в/в в 1–5-й дни + этопозид 100 мг/м 2 в/в в 1–3-й дни + ифосфамид 1500 мг/м 2 в/в в 1–5-й дни (+ месна 1 в/в в 1–5-й дни), цикл повторяется каждые 21 день, всего 4 цикла |
-
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
-
2 Может использоваться при невозможности или нецелесообразности проведения более интенсивных режимов лечения.
-
3 Режимы второй — третьей линий те же, что и при «чистой» герминоме.
-
4.7.3. Наблюдение
-
4.7.4. Рецидивы «чистых» гермином и НГКО
-
4.8. Менингиома
Уровень маркеров (АФП, β-ХГЧ) исследуется перед началом каждого цикла. После каждых 2 циклов ХТ выполняется МРТ головного и спинного мозга с контрастированием. До начала лечения у фертильных мужчин рекомендуется обсудить вопрос о криоконсервации спермы.
МРТ головного и спинного мозга и онкомаркеры (АФП, β-ХГЧ) выполняются каждые 3 месяца в течение первого года, затем — каждые 6 месяцев в течение двух лет, затем — 1 раз в год или при появлении неврологической симптоматики.
При метастазировании герминомы проводится облучение всей ЦНС с бустом на опухоль/метастазы. При локальном рецидиве — полихимиотерапия, с последующей локальной лучевой терапией (табл. 10).
При рецидиве НГКО рекомендуется применение хирургического вмешательства, с последующим применением ХТ и ЛТ локально или КСО в зависимости от наличия метастазов (табл. 10).
Целью хирургического лечения менингиом является максимально радикальное удаление опухоли. При нерадикальном удалении менингиомы (grade 1) рекомендуется ЛТ с РОД 1,8–2,0 Гр до СОД 50–54 Гр; с РОД 7,5 Гр до СОД 22,5 Гр; с РОД 5,5 Гр до СОД 27,5 Гр или стеретаксической радиохирургии до СОД 14–16 Гр. У пациентов с менингиомой grade 2 рекомендуется ЛТ с РОД 1,8–2 Гр до СОД 54–60 Гр или гипофракционная ЛТ/сте-реотаксическая радиохирургия. При менингиоме grade 3 выполняется ЛТ с РОД 1,8 Гр до СОД 59,4–60 Гр, возможно радиохирургическое и гипофракционированное облучение.
Во всех случаях GTV включает контрастируемую часть опухоли и гиперостатические изменения, вопрос об облучении «дурального хвоста» решается индивидуально. При менингиомах grade 2–3 в GTV включается ложе удаленной опухоли. В случаях менингиомы grade 3, а также неоднократных рецидивах менингиомы grade 1–2 возможно проведение лекарственной терапии (МКЗ II-A) (табл. 11).
Таблица 11. Рекомендуемые режимы лекарственной терапии при анапластической менингиоме и/или при агрессивном течении менингиомы grade 1–2
|
Режим |
Схема проведения |
|
Бевацизумаб |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней, до прогрессирования заболевания, непереносимой токсичности или объективного ответа на терапию |
|
Бевацизумаб |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней + эверолимус 5–10 мг внутрь |
|
+ эверолимус |
1 раз в сутки ежедневно (до прогрессирования или непереносимой токсичности) |
|
Сунитиниб |
Сунитиниб 50 мг внутрь 1 раз в сутки ежедневно в 1–28-й дни цикл, 6 недель, до прогрессирования заболевания, непереносимой токсичности или объективного ответа на терапию |
-
4.9. Эмбриональные опухоли (grade 4):
-
• медуллобластома (4 биологических подтипа);
-
• атипичная тератоидная/рабдоидная опухоль;
-
• крибриформная нейроэпителиальная опухоль (grade не установлен);
-
• эмбриональная опухоль с многослойными розетками;
-
• нейробластома ЦНС с активацией гена FOXR2;
-
• опухоль ЦНС с внутренней тандемной дупликацией гена BCOR
-
4.9.1. Диагностика
(grade не установлен)
Все эмбриональные опухоли относятся к высокой группе риска.
К эмбриональным опухолям относятся и пинеобластома grade4, но согласно дей-ствеющей классификации ВОЗ 2021г, она рассматривается в отдельной рубрике (4.10), посвященной «опухолям шишковидной железы».
МРТ головного и спинного мозга с контрастированием. Цитологическое исследование ликвора. Пациенты с эмбриональными опухолями ЦНС могут иметь наследственный онкологический синдром (cиндром Горлина, синдром семейного аденоматозного полипоза (АРС), синдром Ли–Фраумени) и нуждаются в генетическом консультировании. Нередко манифестация заболевания начинается именно с общемозговой симптоматики и выявления ОГМ. Наследственные синдромы встречаются при молекулярной группе SHH, в этом случае необходимо провести исследование крови на мутации ТР53, РТСН.
При молекулярной группе WNT рекомендовано исследование соматической мутации ТР53. При медуллобластоме необходимо провести исследование амплификации MYC и MYCN в опухоли.
Используется классификация медуллобластомы по Чангу (С. Chang) (табл. 12).
Таблица 12. Классификация медуллобластом по С. Chang (1969 г.)
|
Категории М |
Характеристика |
|
M0 |
Нет метастазирования |
|
M1 |
В ликворе при микроскопическом исследовании определяются опухолевые клетки |
|
M2 |
Метастазы в пределах головного мозга |
|
M3 |
Метастазы в субарахноидальном пространстве спинного мозга |
|
M4 |
Метастазы за пределами центральной нервной системы |
-
4.9.2. Лечение
Радикальная хирургическая резекция ассоциируется с лучшим прогнозом. При необходимости в послеоперационном периоде выполняется вентрикулоперитонеальное шунтирование, однако следует помнить о возможности ликворного метастазирования в брюшную полость.
Всем пациентам перед началом терапии рекомендовано выполнить МРТ головного и всех отделов спинного мозга с контрастированием. Лечение необходимо начать спустя 2–4 недели после операции. Отсрочка ЛТ более 6 недель ухудшает прогноз.
После операции пациентам старше 18 лет при М0 и М1 стадии проводится ЛТ (КСО с РОД 1,8–2 Гр и СОД до 35,2 Гр с дополнительным бустом на ЗЧЯ до СОД 55 Гр). Только локальное облучение ложа опухоли возможно при низком или стандартном риске, при отсутствии ликворной подушки в зоне операции (при наличии ликворной подушки ее следует включить в зону облучения).
При наличии метастазов облучение включает: КСО СОД 35,2 Гр, буст на метастазы в головном мозге до СОД 49,6 Гр, буст на метастазы в спинном мозге СОД 49,6 Гр. Буст дополнительно на остаточную опухоль в ЗЧЯ до СОД 60,4 Гр.
Предпочтительно проводить протонную лучевую терапию для уменьшения облучения прилежащих структур, уменьшения риска вторичных опухолей и снижения риска эндокринных нарушений.
После ЛТ всем пациентам проводится ХТ (табл. 13). МРТ головного и спинного мозга с контрастированием выполняется каждые 2 цикла терапии. При наличии остаточной опухоли после завершения ХТ проводится метрономная ХТ или ХТ с темозоломидом или висмодегибом при SHH молекулярной группе (МКЗ II-A).
Таблица 13. Рекомендуемые режимы лекарственной терапии медуллобластомы
|
Режим |
Схема проведения |
|
Цисплатин + этопозид + циклофосфамид |
Цисплатин 25 мг/м 2 в/в в 1–4-й дни + этопозид 80 мг/м 2 в/в в 1–4-й дни + циклофосфамид 600 мг/м 2 в/в в 4-й день, цикл 4–6 недель, 6 циклов |
|
Цисплатин + этопозид + ифосфамид |
Цисплатин 20 мг/м 2 в/в 1–5-й дни + этопозид 80 мг/м 2 в/в в 1–5-й дни + ифосф-амид 1500 мг/м 2 (+ месна1) в/в в 1-й, 3-й, 5-й дни, цикл 21–28 дней (в зависимости от переносимости), 4–6 циклов |
|
Цисплатин + ломустин + винкристин |
Цисплатин 70 мг/м 2 6-часовая в/в инфузия (карбоплатин 400 мг/м 2 в/в 1-часовая инфузия) в 1-й день + ломустин 75 мг/м 2 внутрь в 1-й день + винкристин 1,5 мг/м 2 (максимальная доза 2 мг) в/в в 1-й, 8-й и 15-й дни, цикл 41 день, 8 циклов |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней (5/23), до 24 циклов |
|
Этопозид |
Этопозид 50 мг/м 2 внутрь в 1–21-й дни, цикл 28–35 дней, до 24 циклов или прогрессирования заболевания, непереносимой токсичности |
|
Темозоломид + иринотекан + бевацизумаб |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + иринотекан 50 мг/м 2 в/в в 1–5-й дни + бевацизумаб 10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней, 6–10 циклов |
|
Висмодегиб2 |
Висмодегиб 150 мг 1 раз в день внутрь ежедневно до прогрессирования или непереносимой токсичности, цикл 28 дней (до 26 циклов) |
-
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
-
2 При активации SHH пути.
При выявлении метастазирования у пациентов с медуллобластомой для уменьшения опухоли и улучшения прогноза рекомендовано проведение 2 блоков ХТ, каждый состоит из 4 циклов (табл. 14). Таким образом, рекомендовано 8 циклов каждые 2 недели, после 4-го цикла перерыв составляет 3 недели.
Таблица 14. Рекомендуемый режим лекарственной терапии при медуллобластоме стадия М2–М3 перед лучевой терапией
Режим Схема проведения: каждые 2 недели, после 4-го цикла — 3 недели перерыв
Винкристин Винкристин 1,5 мг/м 2 в/в в 1-й день + циклофосфамид 800 мг/м 2 в/в 1-часовая
+ циклофосфамид инфузия в 1–3-й дни (+ месна)
|
Режим |
Схема проведения: каждые 2 недели, после 4-го цикла — 3 недели перерыв |
|
Винкристин + метотрексат, повторить цикл через 2 недели |
Винкристин 1,5 мг/м 2 в 1-й день + метотрексат 5 г/м² в 1-й день в/в 24 часовая инфузия с введением лейковорина 15 мг/м 2 в/в с 42 часа введения МТХ каждые 6 час до 72 часа и определением метотрексата в крови с 36 часа каждые 6 часов. |
|
Карбоплатин + этопозид |
Карбоплатин 200 мг/м² в/в в 1–3-й дни + этопозид 150 мг/м² в/в в 1–3-й дни |
Цикл № 2: винкристин + метотрексат проводится 2 раза.
При невозможности определять концентрацию метотрексата в крови после проведения цикла с HD метотрексатом, не рекомендуется проводить этот цикл.
ПЭТ-КТ при медуллобластоме не информативна, поэтому ее не рекомендовано применять.
Переливание компонентов крови рекомендуется, когда уровень гемоглобина падает ниже 70 г/л. Тромбоциты следует переливать при уровне ≤ 25 × 10⁹/л или по клиническим показаниям. Когда количество нейтрофилов ≤ 0,5 × 10⁹/л следует рассмотреть введение КСФ и вводить их предпочтительно в выходные дни. Любой перерыв в лечении должен компенсироваться.
Эмбриональные опухоли супратенториальной локализации, такие как нейробластома или ганглионейробластома, у пациентов старше 18 лет встречаются редко. В новой классификации (ВОЗ 2021 г.) в разделе «Другие эмбриональные опухоли» появились сразу три новые нозологии:
-
1) крибриформная нейроэпителиальная опухоль (обозначена как «временная единица»);
-
2) опухоль ЦНС с внутренней тандемной дупликацией гена BCOR;
-
3) нейробластома ЦНС с активацией гена FOXR2.
-
4.9.3. Наблюдение
«Исчезнувшие» ганглионейробластомы ЦНС вошли в состав группы «Нейробластома ЦНС, с активацией гена FOXR2». Поскольку все эмбриональные опухоли имеют grade 4, кроме «крибриформной нейроэпителиальной опухоли (временная единица)» и «опухоли ЦНС с внутренней тандемной дупликацией гена BCOR», при которых степень анаплазии еще не определена, пациентам в обязательном порядке необходимо проводить ЛТ и ХТ (табл. 15, рис. 9).
Таблица 15. Рекомендуемые режимы лекарственной терапии нейробластомы/ганглионейробластомы
|
Режим |
Схема проведения |
|
Карбоплатин + этопозид |
Карбоплатин 200 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 150 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости, до 12 циклов |
|
Цисплатин + этопозид |
Цисплатин 40 мг/м 2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 120 мг/м 2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости, до 6 циклов |
|
Режим |
Схема проведения |
|
Бевацизумаб + иринотекан |
Бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м 2 в/в в 1-й и 15-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Темозоломид + иринотекан + бевацизумаб |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + иринотекан 50 мг/м 2 в/в в 1–5-й дни + бевацизумаб 10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Цисплатин + этопозид + ифосфамид |
Цисплатин 20 мг/м 2 в/в в 1–5-й дни + этопозид 75 мг/м 2 в/в 1–5-й дни + ифосфамид 750–1200 мг/м 2 (+ месна 1 ) в/в в 1, 3 и 5-й дни, цикл 28 дней, 4–6 циклов в зависимости от переносимости |
|
Темозоломид |
Темозоломид 150–200 мг/м 2 внутрь в 1–5-й дни, цикл 28 дней, до 24 циклов в зависимости от переносимости и эффективности |
|
Этопозид |
Этопозид 50 мг/м 2 внутрь в 1–21-й дни, цикл 28–35 дней, до прогрессирования заболевания, непереносимой токсичности или объективного ответа на терапию |
|
Темозоломид + карбоплатин |
Темозоломид 150 мг/м 2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней, до 6 циклов |
1 Месна применяется в суточной дозе, равной 100 % от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
При М + стадии МРТ головного и спинного мозга с контрастированием выполняется каждые 3–4 месяца в течение первых 2-х лет, затем — каждые 6 месяцев до 5 лет наблюдения, затем — 1 раз в год или при появлении неврологических симптомов.
При отсутствии метастазирования — МРТ головного мозга выполнять каждые 3–4 мес, МРТ спинного мозга каждые 6 мес до 2-х лет наблюдения, далее МРТ головного мозга каждые 6 мес, спинной мозг каждые 12 мес до 5 лет наблюдения, далее только МРТ головного мозга 1 раз в 12 месяцев.
-
4.10. Опухоли шишковидной железы:
-
• пинеоцитома (grade 1);
-
• пинеальная паренхиматозная опухоль промежуточной дифференцировки (grade 2–3);
-
• папиллярная опухоль пинеальной области (grade 2–3);
-
• пинеобластома (grade 4);
-
• десмопластическая миксоидная опухоль пинеальной области с мутацией
в гене SMARCB1 (grade не установлен)
Тактика лечения опухолей шишковидной железы зависит от степени их анаплазии и биологического поведения.
Пинеоцитома grade 1 требует только хирургического лечения. У пациентов с пинеальной паренхиматозной опухолью промежуточной дифференцировки (grade 2) и папиллярной опухолью пинеальной области grade 2 при отсутствии диссеминации опухоли по субарахноидальным пространствам проводится ЛТ на ложе удаленной опухоли. Пациентам с пинеальной паренхиматозной опухолью промежуточной дифференцировки (grade 3) и папиллярной опухолью пинеальной области grade 3 выполняется ЛТ на ложе опухоли.
При пинеобластоме grade 4 режимы ЛТ, ХТ и особенности наблюдения аналогичны таковым при эмбриональных опухолях — лучевая терапия в объеме КСО СОД 35,2 Гр, бустерное облучение ложе опухоли до СОД 55 Гр. ХТ проводится в режиме поддерживающей ПХТ как при медуллобластоме (табл. 13, 15).
ЛТ
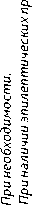
Схема 1. Алгоритм первичной диагностики
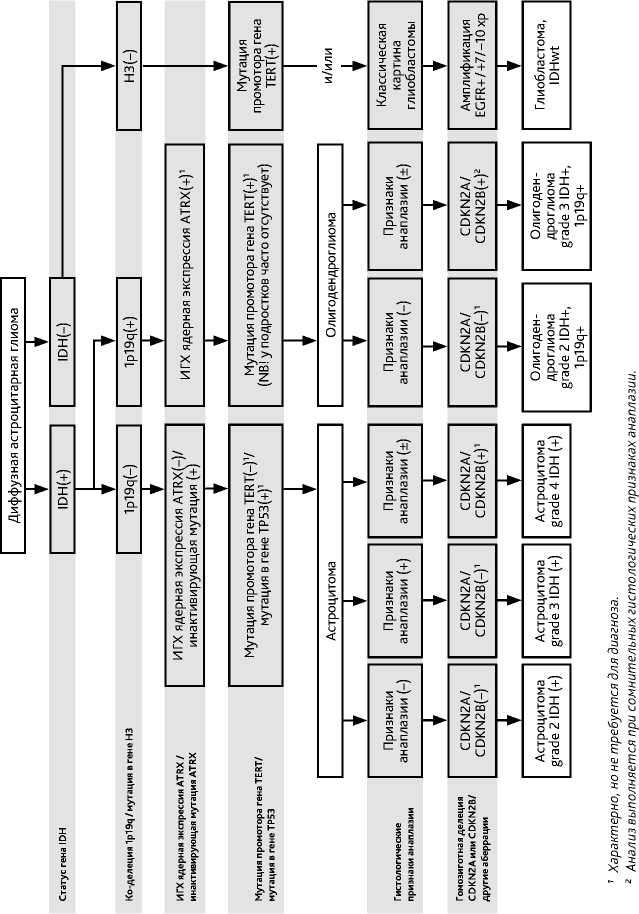
Схема 2. Алгоритм диагностики диффузных глиом (гистологический вариант)
Схема 3. Алгоритм лечения больных диффузной глиомой grade 2
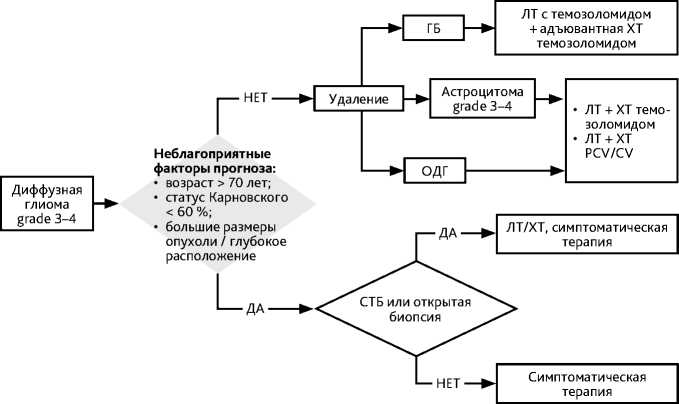
ГБ — глиобластома;
ОДГ — олигодендроглиома;
PCV — ломустин + прокарбазин + винкристин;
CV — ломустин + винкристин.
Схема 4. Алгоритм лечения больных диффузной глиомой grade 3–4
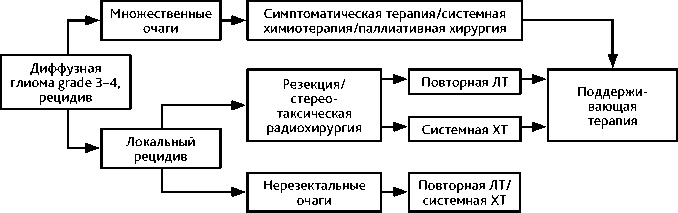
Схема 5. Алгоритм лечения больных с рецидивом диффузной глиомы grade 3–4
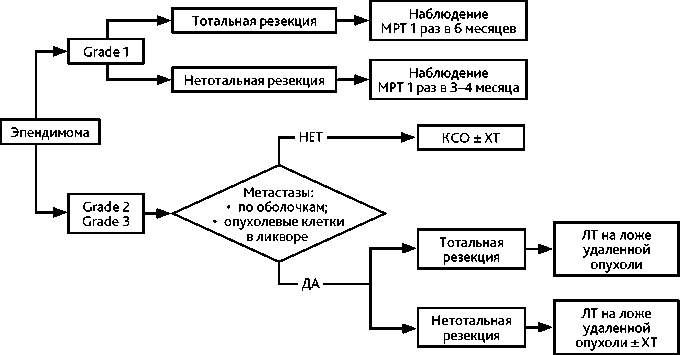
Схема 6. Алгоритм лечения больных эпендимомой grade 1–3
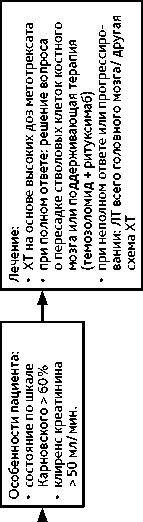

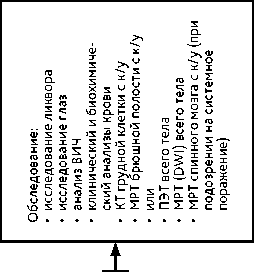
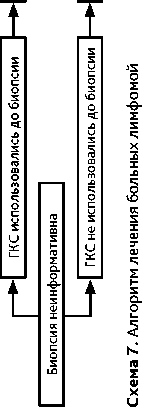
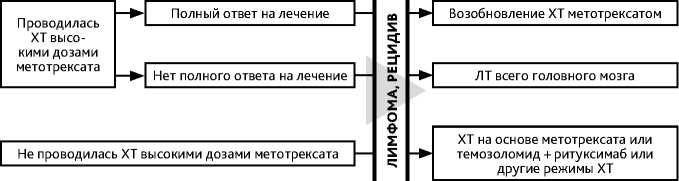
Схема 8. Алгоритм лечения больных с рецидивом лимфомы
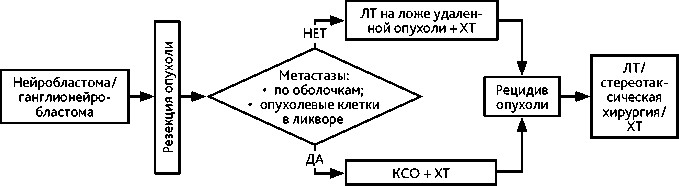
Схема 9. Алгоритм лечения больных нейробластомой ЦНС и ганглионейробластомой ЦНС
| том/vol. 15(3s2)2025
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


