Первичные злокачественные опухоли костей
Автор: Валиев А.К., Тарарыкова А.А., Тепляков В.В., Мусаев Э.Р., Рогожин Д.В., Сушенцов Е.А., Мачак Г.Н., Конев А.А., Федорова А.В., Федосеенко Д.И.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1.2 т.15, 2025 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (см. стр. 7). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Саркома кости, остеосаркома, саркома Юинга, хондросаркома, хордома, гигантоклеточная опухоль кости, комбинированное лечение, химиотерапия, таргетная терапия
Короткий адрес: https://sciup.org/140312968
IDR: 140312968 | DOI: 10.18027/2224-5057-2025-15-3s2-1.2-14
Текст научной статьи Первичные злокачественные опухоли костей
Первичные злокачественные опухоли костей скелета имеют мезенхимальное происхождение и представляют собой множество различных подтипов, которые составляют от 0,2% до 1% среди всех новообразований человека. В России ежегодно диагностируются не более 1500 новых случаев заболевания. Остеосаркома является наиболее распространенной первичной злокачественной опухолью кости. В возрасте от 15 до 29 лет на долю опухолей костей скелета приходится 3% всех опухолей, а на остеосаркому — примерно половина этих случаев. Хондросаркома, вторая по частоте встречаемости злокачественная опухоль костей, напротив, характерна для пациентов старшего возраста. Другие наиболее часто встречаемые гистологические типы костных сарком включают в себя саркому Юинга и хордому. Каждый из перечисленных гистологических типов имеет свои особенности течения заболевания, прогноза и тактики лечения, которые указаны в соответствующих разделах главы. Оставшиеся гистологические типы костных сарком (например, недифференцированная плеоморфная саркома кости, ангиосаркома или адамантинома кости) встречаются значительно реже и часто требуют индивидуального подхода в лечении. Гигантоклеточная опухоль кости (ГКО) по данным ВОЗ 2020 г. является опухолью неопределенного характера. Подтверждение диагноза и определение тактики лечения опухолей костей скелета должно быть принято в профильных онко-ортопедических/саркомных центрах на мультидисциплинарных консилиумах, которые обладают опытом диагностики и лечения данного заболевания.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
На выбор тактики лечения и онкологический прогноз влияет правильное стадирование в момент постановки диагноза и включает оценку локальной распространенности опухоли, степень дифференцировки и наличие отдаленных метастазов. Для стадирования используется TNM классификация, 8-е издание, 2017 г. (табл. 1). Классификация применяется ко всем первичным злокачественным опухолям костей, кроме злокачественной лимфомы, множественной миеломы, поверхностной/юкстакортикальной остеосаркомы и юкстакорти-кальной хондросаркомы. Стадия заболевания не выставляется при первичной локализации опухоли в позвоночнике или костях таза. Общепринятой градации степени злокачественности костных сарком, как при саркомах мягких тканей (FNCLCC), в настоящее время нет. Гистологический тип костной саркомы часто определяет клиническое течение и степень злокачественности соответственно. Например, саркома Юинга (СЮ), дедифференцирован-ная и мезенхимальная хондросаркомы по своему определению обладают только высокой степенью злокачественности (G3), в то время как паростальная остеосаркома — низкой степенью злокачественности (G1). Исключения: классическая хондросаркома (градируется как G1, G2 или G3); хордома не подлежит градации по степени злокачественности.
Таблица 1. Классификация категорий TNM при первичных злокачественных опухолях костей скелета
|
Категория Т |
Оценка локальной распространённости |
|
Для опухолей |
конечностей, туловища, черепа и лицевого скелета |
|
Tx |
Опухоль не может быть оценена |
|
T0 |
Нет признаков первичной опухоли |
|
T1 |
Опухоль менее 8 см в наибольшем измерении |
|
T2 |
Опухоль более 8 см в наибольшем измерении |
|
T3 |
Множественное поражение в первичном очаге |
|
Для опухолей |
позвоночника |
|
Tx |
Опухоль не может быть оценена |
|
T0 |
Нет признаков первичной опухоли |
|
T1 |
Опухоль поражает один позвонок или два смежных |
|
T2 |
Опухоль поражает три смежных позвонка |
|
T3 |
Опухоль поражает четыре и более смежных позвонков или имеется поражение несмежного сегмента позвоночника |
|
T4 |
Опухоль распространяется в спинномозговой канал или на магистральные сосуды |
|
T4a |
Распространение в спинномозговой канал |
|
T4b |
Опухоль прорастает в сосуды или вызывает тромбоз в магистральных сосудах |
|
Категория Т |
Оценка локальной распространённости |
|
Для опухолей |
костей таза |
|
Tx |
Опухоль не может быть оценена |
|
T0 |
Нет признаков первичной опухоли |
|
T1 |
Опухоль поражает один сегмент тазовой кости без мягкотканного компонента |
|
T1a |
Опухоль менее 8 см в наибольшем измерении |
|
T1b |
Опухоль более 8 см в наибольшем измерении |
|
T2 |
Опухоль поражает один сегмент тазовой кости с наличием мягкотканного компонента или два сегмента без внекостного компонента |
|
T2a |
Опухоль менее 8 см в наибольшем измерении |
|
T2b |
Опухоль более 8 см в наибольшем измерении |
|
T3 |
Опухоль вовлекает два сегмента костей таза с наличием внекостного компонента |
|
T3a |
Опухоль менее 8 см в наибольшем измерении |
|
T3b |
Опухоль более 8 см в наибольшем измерении |
|
T4 |
Опухоль вовлекает три сегмента тазовой кости или распространяется на крестцово-подвздошное сочленение |
|
T4a |
Опухоль вовлекает крестцово-подвздошное сочленение и распространяется медиальнее крестцовых отверстий |
|
T4b |
Опухоль распространяется на наружные подвздошные сосуды или вызывает тромбоз крупных сосудов таза |
|
Категория N |
Оценка распространенности по лимфатическим узлам |
|
Nx |
Региональные лимфоузлы не могут быть оценены |
|
N0 |
Метастазы в региональных лимфоузлах отсутствуют |
|
N1 |
Метастазы в региональных лимфоузлах |
|
Категория M |
Оценка отдаленных метастазов |
|
M0 |
Отдаленные метастазы отсутствуют |
|
M1 |
Наличие отдаленных метастазов |
|
M1a |
Отдаленные метастазы в легких |
|
M1b |
Отдаленные метастазы в костях или других органах |
|
Категория G |
Оценка дифференцировки опухоли |
|
Gx |
Степень дифференцировки опухоли не может быть оценена |
|
G1 |
Высокодифференцированная опухоль — низкая степень злокачественности (low-grade) |
|
G2 |
Умереннодифференцированная опухоль — высокая степень злокачественности (high-grade) |
|
G3 |
Низкодифференцированная опухоль — высокая степень злокачественности (high-grade) |
|
Группировка критериев TNM, G для определения стадии опухолей костей |
||||
|
T |
N |
M |
G |
Стадия |
|
Т1 |
N0 |
М0 |
G1, Х |
Стадия IA |
|
Т2, 3 |
N0 |
М0 |
G1, Х |
Стадия IB |
|
T |
N |
M |
G |
Стадия |
|
Т1 |
N0 |
М0 |
G2, 3 |
Стадия IIA |
|
Т2 |
N0 |
М0 |
G2, 3 |
Стадия IIB |
|
Т3 |
N0 |
М0 |
G2, 3 |
Стадия III |
|
Любая Т |
N0 |
М1а |
Любая G |
Стадия IVA |
|
Любая Т |
N1 |
Любая М |
Любая G |
Стадия IVB |
|
Любая Т |
Любая N |
М1b |
Любая G |
|
2. ДИАГНОСТИКА 2.1. Общие принципы
Дифференциальный диагноз саркомы кости проводится с остеомиелитом, другими доброкачественными опухолями, но в большей степени с метастатическим поражением, так как метастазы в кости составляет примерно 95% всех опухолевых поражений костей скелета. Дифференциальный диагноз может сильно зависеть от возраста пациента. У пациентов моложе 5 лет деструктивное поражение костей может быть интерпретировано преимущественно либо как метастатическая нейробластома, либо как гистиоцитоз из клеток Лангерганса. Для пациентов в возрасте старше 5 лет вероятность первичной костной саркомы выше. После 40 лет костные метастазы и миелома будут наиболее вероятными диагнозами. Рекомендованный алгоритм диагностики представлен на рис. 1.
-
2.2. Рентгенологическая оценка
Для оценки состояния костной системы используются анатомические и функциональные диагностические методы. К анатомическим методам относятся рентгенография, рентгеновская КТ, МРТ, дополненная в отдельных случаях в/в контрастированием, УЗИ, дополненное в отдельных случаях доплерографией; к функциональным метода относятся радионуклидное исследование (остеосцинтиграфия), ПЭТ. Кроме того, в настоящий момент широко используются такие гибридные методы диагностики, как ОФЭКТ/КТ, ПЭТ-КТ, в отдельных учреждениях начато внедрение ПЭТ /МРТ (ПЭТ, совмещенная с МРТ).
Классическая стандартная рентгенография может быть рекомендована как самый быстрый и простой метод визуализации при подозрении на первичную саркому кости.
КТ является дополнительным уточняющим методом исследования пациентов с опухолями костей, так же является оптимальным методом навигации при малоинвазивных диагностических процедурах (чрескожная биопсия кости).
МРТ является методом, который наиболее точно позволяет оценить состояние костей и мягких тканей in vivo . Метод не связан с рентгеновским облучением и позволяет с высокой точностью отличать солидный (опухолевый) компонент, кистозный компонент, фиброзную ткань, жировую ткань и т. д. Контрастирование при опухолях костей рутинно не показано ни при КТ, ни при МРТ, в отдельных случаях выполняется при клинической целесообразности по назначению врачей. Абсолютным показанием к контрастированию при МРТ костно-мышечной системы является подозрение на метастатическое поражение оболочек спинного мозга, которое очень часто не визуализируется при нативном исследовании.
При отсутствии противопоказаний МРТ рекомендуется проводить всем пациентам с первичными опухолями костей. При невозможности проведения МРТ, в том числе в связи с болевым синдромом, возможна замена на РКТ, при наличии внекостного компонента для оценки его распространенности желательно с в/в контрастированием.
Желательно проведение всех диагностических исследований до биопсии, т. к. изменения после биопсии могут затруднить анализ полученных изображений.
В табл. 2 представлен оптимальный алгоритм рентгенологического обследования пациентов с опухолями костей.
Таблица 2. Рекомендуемый алгоритм рентгенологической диагностики опухолей костей скелета
|
Опухоль |
Минимальный обязательный комплекс обследований |
Дополнительные методы |
|
Остеосаркома |
|
|
|
Хондросаркома |
|
• Остеосцинтиграфия при подозрении на вторичную хондросаркому (на фоне множественных доброкачественных хрящеобразующих опухолей) |
|
Саркома Юинга |
|
|
|
Опухоль |
Минимальный обязательный комплекс обследований Дополнительные методы |
|
Хордома |
и ортопедического решения)
|
|
Гигантоклеточная опухоль |
и ортопедического решения) очага
метастазов в легких |
|
Другие опухоли костей |
и ортопедического решения) (по показаниям) • МРТ головного мозга (по показаниям)
и др. |
1 ОБП — органы брюшной полости.
2 ОГК — органы грудной клетки.
2.3. Принципы выполнения биопсии
2.4. Морфологическое исследование опухолей костей
3. ЛЕЧЕНИЕ
3.1. Общие принципы лечения опухолей костей скелета3.1.1. Хирургическое лечение
Биопсия опухоли, необходимая для гистологического исследования, является ключевым моментом в диагностике саркомы кости. Предпочтительным методом получения материала является трепан-биопсия под различными видами навигационного контроля, которая позволяет наиболее быстрым способом получить морфологический материал для исследования. При неинформативном ответе (и стабильной клинической картине) трепан-биопсия выполняется повторно. В том случае, если трепан-биопсия не позволяет получить информативный материал дважды, показано выполнение открытой биопсии опухоли. При этом зона биопсии опухоли должна обязательно проходить в проекции хирургического доступа во время плановой операции, а биопсийный тракт должен включаться в препарат и удаляться вместе с опухолью. Доступ при выполнении биопсии должен проходить в стороне от магистральных сосудистых и нервных пучков. При выполнении открытой биопсии опухоли, имеющей внутрикостное распространение, необходимо выполнять небольшую остеотомию при помощи долота или пилы и оценивать угрозу возникновения патологического перелома. Выполнение открытой биопсии опухоли первым этапом показано в случае невозможности получения морфологического материала путем трепан-биопсии.
Морфологическая диагностика опухолей костей представляет собой большую сложность, что связано с большим разнообразием нозологических форм и подтипов опухоли. Достаточным может считаться объем материала, необходимый для достоверной верификации клинического диагноза и может варьировать от 3–5 мм диаметром до 1–1,5 см в наибольшем измерении. В табл. 3 представлены диагностические критерии для костных сарком.
Таблица 3. Диагностические критерии для костных сарком
|
Опухоль |
Обязательные диагностические критерии |
Дополнительные критерии |
|
Остеосаркома |
Признаки выраженной клеточной атипии и продукция патологического остеоида |
Амплификация MDM2 при паростальной и интрамедуллярной остеосаркоме низкой степени злокачественности |
|
Хондросаркома |
Повышенная клеточность, инвазивный характер роста, миксоидный матрикс, наличие фигур митозов |
Мутации IDH1 и IDH2 при классической хондросаркоме |
|
Саркома Юинга |
Мелкокруглоклеточная картина, CD99-мем-бранный локус экспрессии при ИГХ исследовании |
Цитогенетическое исследование (перестройка гена EWSR1/FUS с партнером семейства ETS) |
|
Хордома |
Локализация (аксиальный скелет), эпителиоидная морфология клеток с признаками нотохордальной дифференцировки, миксоидный матрикс |
ИГХ исследование на экспрессию brachyury и pan-cytokeratin. |
|
Гигантоклеточная опухоль |
Мононуклеарный неопластический компонент, гигантские многоядерные остеокластоподобные клетки |
ИГХ исследование на экспрессию G34W (H3F3A) |
Заключение формулируется с указанием локализации патологического процесса, конкретной нозологической единицы, с обязательным указанием кода по МКБ. Помимо этого, для опухолей костей необходимо указать ICD-O код. Например: конвенциональная остеосаркома дистального метадиафиза правой бедренной кости, хондробластический вариант. ICD-O code 9180/3. МКБ-10 C40.2. При наличии достаточной клинической информации производится стадирование по системе pTNM. Если при макроскопическом исследовании не представляется возможным судить о радикальности иссечения опухоли, применяют специальные окраски для маркировки краев резекции (отмечается в протоколе исследования).
В связи с редкостью патологии и сложностью лечения, общепринятым является лечение в референсных саркомных центрах, способных обеспечить доступ к полному спектру медицинской помощи и экспертным мнениям. В таких центрах терапия проводится либо в рамках проспективных, часто совместных клинических исследований, либо в рамках установленных протоколов лечения. Далее приведены общие принципы лечения пациентов с саркомами костей скелета и более детально — особенности наиболее частых типов сарком костей.
Хирургическое лечение пациентов со злокачественными опухолями костей является одним из важнейших и ключевых в комбинированном лечении, поэтому оно должно выполняться в специализированных многопрофильных онкологических клиниках с врачебным персоналом, имеющим опыт лечения данной категории больных. Основной целью хирургического лечения является радикальное удаление опухоли с максимальной возможностью выполнения органосохраняющего вмешательства, главным условием которого является абластичное удаление опухоли. Радикальные органосохраняющие операции на костях конечностей подразумевают под собой сегментарные резекции кости с удалением опухоли en block (в пределах здоровых тканей) с отступом от края опухоли не менее 3–5 см (при отсутствии опухолевого поражения в костномозговом канале оставшейся части кости), с замещением дефекта эндопротезом удаленного фрагмента скелета. При выборе вида эндопротеза предпочтение должно отдаваться современным модульным системам онкологического протезирования. При выполнении радикального хирургического лечения в редких анатомических локализациях может быть рассмотрен вариант замещения дефекта индивидуальными системами протезирования.
В случае невозможности выполнения радикальной органосохраняющей операции показаны радикальные калечащие операции, которые выполняются при:
-
• поражении магистральных сосудисто-нервных структур, при которых невозможно выполнение реконструктивно-пластических операций;
-
• обширном местнораспространенном опухолевом процессе;
-
• вовлечении в опухолевый процесс всех мышечных футляров;
-
• по жизненным показаниям (угроза кровотечения, распад опухоли).
-
3.1.2. Лекарственное лечение
-
3.1.3. Лучевая терапия
-
3.2. ОСОБЕННОСТИ ЛЕЧЕНИЯ ОПУХОЛЕЙ КОСТЕЙ СКЕЛЕТА
-
3.2.1. Остеосаркома
-
При небольших по размеру хондросаркомах G1 и гигантоклеточной опухоли возможно выполнение радикального хирургического лечения в объеме экскохлеации опухоли с обязательной обработкой полости локальными адъювантами (бор (механический), спирт 96% и т. д).
Периоперационная ХТ как часть комбинированного лечения пациентов с локализованной остеосаркомой и СЮ значительно улучшает 5-летнюю выживаемость (до 60% и 75% соответственно). Общая продолжительность комбинированного лечения СЮ составляет не менее 12 месяцев. Классическая хондросаркома и хордома, напротив, обладают низкой чувствительностью к ХТ, поэтому лекарственная терапия при данных типах костных сарком применяется в случае невозможности выполнения хирургического лечения или ЛТ, а проявления заболевания являются клинически значимыми (например, выраженный болевой синдром). Особенности лекарственной терапии наиболее частых гистологических типов описаны ниже.
Костные саркомы обладают низкой чувствительностью к ЛТ, поэтому решение о проведении облучения должно быть принято только на консилиуме. При наличии показаний возможно рассмотреть вопрос о проведении стереотаксической радиохирургии, стереотаксической ЛТ, протонной ЛТ. В случае множественных метастазов рекомендуется рассмотреть возможность проведения системной радиотерапии Sm153-EDTMP. В случае олигометастатического поражения рекомендуется рассмотреть возможность проведения стереотаксической ЛТ или радиохирургии. Подобно хирургическому и лекарственному лечению проведение ЛТ рекомендуется в одном специализированном медицинском учреждении с большим опытом работы.
Остеосаркома (ОС) — это злокачественная опухоль, клетки которой продуцируют остеоид или незрелую кость. Новообразование может возникать интрамедуллярно (80% случаев), юкстакортикально или в мягких тканях. Классическая остеосаркома чаще поражает метафизарные отделы длинных трубчатых костей, в частности кости, формирующие коленный сустав. С учетом локализации и степени дифференцировки выделяют следующие типы остеосарком:
-
• интрамедуллярные:
-
1) высокой степени злокачественности (80 % случаев всех остеосарком)
-
2) низкой степени злокачественности (2%)
-
• юкстакортикальные:
-
1) паростальные (низкая степень злокачественности)
-
2) периостальные (промежуточная степень злокачественности)
-
3) поверхностная остеосаркома высокой степени злокачественности.
Особые формы ОС — мелкоклеточная (МКОС) и телеангиэктатическая (ТАЭОС) остеосаркомы, требуют индивидуального подхода.
Клинически проявления соответствуют костным саркомам в общем. Исходно высокие уровни ЩФ и ЛДГ могут снижаться на фоне предоперационной терапии и, наряду с другими методами, рекомендуются в качестве маркеров эффективности лечения.
Периоперационная химиотерапия. Неоадъювантная и адъювантная ХТ в сочетании с радикальным хирургическим лечением позволяет повысить общую 5-летнюю выживаемость при остеосаркоме до 71%, а при локализованной форме — приблизить к 80%. Оптимальное начало индукционной ХТ — не позднее 3–4 недель с момента диагностической биопсии. Режимы ХТ при локализованной и генерализованной остеосаркоме представлены в табл. 4 и 7.
Таблица 4. Выбор схемы химиотерапии при остеосаркоме
|
Предпочтительные схемы |
Альтернативные схемы |
|
|
Неоадъювантная терапия, 2–4 цикла (первая линия, 6 циклов) (МКЗ 0-В) |
|
• HD I |
|
Адъювантная терапия при лечебном патомор-фозе > III степени (некроз опухоли более 90 %, 2–4 цикла (МКЗ 0-C) |
|
• HD I |
|
Адъювантная терапия при лечебном патомор-фозе < III степени (некроз опухоли менее 90 %, 6 циклов (МКЗ 0-C) |
• HD I |
• GemTax |
|
Последующие линии (МКЗ II-В) |
|
|
Предоперационное лекарственное лечение оказывает раннее воздействие на микрометастазы и улучшает условия для радикального локального лечения. Для промежуточной оценки эффекта (в специализированных центрах) должны использоваться клинические, инструментальные и лабораторные критерии, позволяющие при необходимости сменить режим ХТ. Обязательным условием проведения ХТ является строгое соблюдение методики введения высоких доз метотрексата, ифосфамида, цисплатина. Использование метотрексата оправдано у пациентов молодого возраста, эффективность у больных старше 40 лет сомнительна, поэтому у данного контингента в качестве первой линии рассматривается схема АР. Послеоперационная ХТ направлена на продолжение системного воздействия на микрометастазы и консолидацию лечебного эффекта после радикального удаления первичной опухоли. Лечебный патоморфоз (степень некротизации, оцененная при тщательном изучении всей удаленной опухоли) продолжает оставаться независимым фактором прогноза. При выраженном гистологическом ответе на предоперационную ХТ (некроз опухоли > 90%) рекомендуется продолжить лечение теми же препаратами. 5-летняя безрецидивная выживаемость в данной клинической ситуации достигает 70–80%. В то же время в случае слабо выраженного ответа (некроз опухоли < 90%) и переходе на альтернативные схемы адъювантной ХТ или добавлении новых цитостатиков 5-летняя безрецидивная выживаемость составляет около 45–57%.
Хирургическое лечение. Органосохраняющие операции являются современным стандартом лечения пациентов с остеосаркомой. Принципы хирургического лечения для остеосаркомы соответствуют общим принципам хирургического лечения костных сарком. В случае невозможности выполнения радикальной органосохраняющей операции рекомендовано выполнение калечащих радикальных вмешательств в объеме ампутации или экзартикуляции конечности.
Особенности тактики лечения в зависимости от рентген-морфологического варианта остеосаркомы и распространенности заболевания представлен на схеме 1.
Лучевая терапия. Проведение ЛТ следует рассмотреть при R1 или R2 резекции, а также в случае невозможности выполнения оперативного лечения:
-
• послеоперационный курс дистанционной ЛТ проводится в режиме стандартного фракционирования РОД 2 Гр до СОД 54 Гр на ложе удаленной опухоли, СОД 64–68 Гр на область R1 или R2 резекции;
-
• при невозможности выполнения радикального хирургического лечения показано проведение курса дистанционной ЛТ на область опухоли в РОД 2 Гр до СОД 60–70 Гр (в зависимости от толерантности окружающих тканей).
-
3.2.2. Саркома Юинга
Саркома Юинга (СЮ) является редкой круглоклеточной высоко злокачественной опухолью, которая, согласно классификации ВОЗ 2020 г., относится к группе недифференцированных мелкокруглоклеточных сарком костей и мягких тканей. Саркома Юинга характеризуется слиянием гена EWS (EWSR1) на хромосоме 22q12 с различными членами семейства генов ETS (FLI1, ERG, ETV1, ETV4 и FEV). Слияние EWS и FLI1 на хромосоме 11 и соответствующая хромосомная транслокация t (11;22) (q24; q12) выявляется примерно у 85% пациентов. Наиболее распространенными первичными локализациями СЮ являются кости конечностей (50%), за которыми следуют таз, ребра и позвонки. Потенциально может поражаться любая кость, однако возможно и экстраскелетное происхождение, особенно среди взрослых (30%).
Лечение рецидива заболевания. Примерно у 30–40% пациентов со IIB стадией и у 80% больных с IIIB стадией развивается прогрессирование в течение первых двух лет после окончания программной терапии. При возникновении рецидива заболевания лечение направлено на достижение второй ремиссии путем хирургического удаления всех опухолевых образований или применения аблативных методик. При рефрактерном течении остеосаркомы и раннем прогрессировании выбор второй линии ХТ зависит от первичного лечения (табл. 4 и 7). При позднем прогрессировании возможно возвращении к ранее использованному режиму ХТ.
Факторы прогноза. Наиболее существенными факторами неблагоприятного прогноза считаются наличие метастазов в момент установления диагноза, слабо выраженный лечебный патоморфоз после предоперационной ХТ, нерадикальное хирургическое вмешательство. При локализованной форме, некрозе опухоли > 90% и радикальной операции 5-летняя выживаемость превышает 80%. При метастатической остеосаркоме более благоприятный исход ассоциируется с небольшим количеством метастатических узлов (1–2) и достижением полной хирургической ремиссии.
СЮ в настоящее время считается отличной от более редких и недавно выявленных форм, таких как:
-
• круглоклеточная саркома с транслокацией химерного гена EWSR7-non-ETS;
-
• саркома с перестройкой гена CIC (CIC–DUX4);
-
• саркома с перестройкой гена BCOR.
У 25% пациентов при постановке диагноза выявляется отдаленное метастазирование. Наиболее частыми локализациями первичного очага являются кости таза, бедренная кость и кости грудной клетки, хотя СЮ может поражать любую кость. Как правило, причиной обращения пациентов становится характерный для всех костных сарком болевой синдром и отек в области пораженной кости, а также лихорадка, потеря веса и утомляемость. В анализах крови может быть выявлен лейкоцитоз, повышенный уровень ЛДГ.
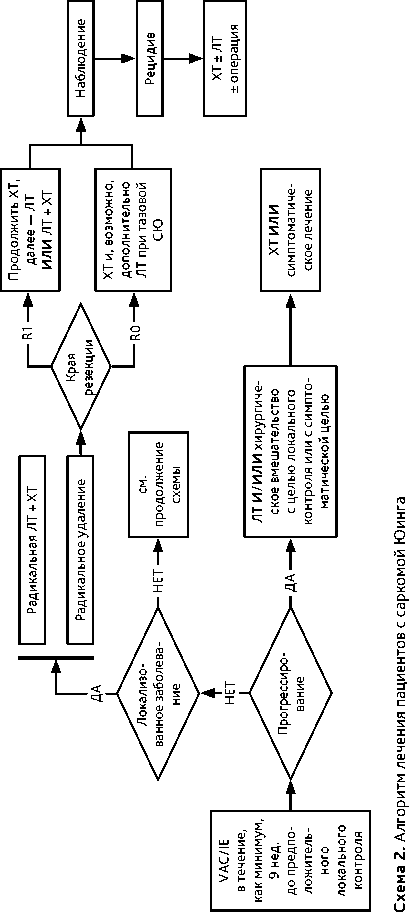
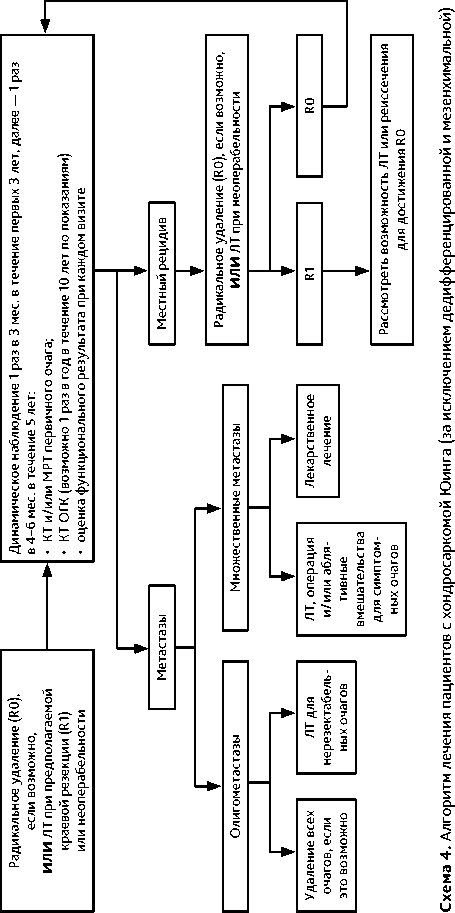
Особенности комбинированного лечения. Лечение СЮ требует комплексного подхода и должно быть назначено мультидисциплинарным консилиумом в референсных сар-комных центрах. Комбинация ХТ, операции и/или ЛТ позволяет достичь 5-летней выживаемости, равной 75%. Лечение практически всегда начинается с ХТ независимо от того, локализованный это процесс или диссеминированный (схема 2 и 3). Проводяся 4–6 циклов ХТ (табл. 5 и 7) каждые 3 недели с последующим этапом локального контроля (хирургическое лечение и/или ЛТ). Наиболее эффективной считаются альтернирующая комбинация циклофосфамида, винкристина, доксорубицина, ифосфамида и этопозида (VAC/IE).
Выполнение радикальной операции является оптимальным вариантом локального контроля. Приоритетом является выполнение органосохраняющих операций. Резекта-бельным является процесс, при котором выполнимо радикальное удаление опухоли, что гарантирует отсутствие местного рецидива. При первично резектабельной опухоли, а также в случаях, когда первично не резектабельная опухоль стала резектабельной после 4–6 циклов индукционной ХТ, производится хирургическое лечение. При поражении ребер, диафизарных локализациях, протяженных поражениях по костномозговому каналу, стабилизации в результате лекарственной терапии выполняется экстирпация кости. При исходном поражении регионарных лимфатических узлов выполняется регионарная лимфаденэктомия. При полной или значительной клинической регрессии опухоли в результате индукционной ХТ, особенно при сложных локализациях (позвоночник, кости таза), альтернативой хирургическому вмешательству может быть ЛТ. При невозможности выполнения органосохраняющих операций, сложной анатомической локализации или в случае нерадикальной операции целесообразно рассмотреть возможность проведения ЛТ.
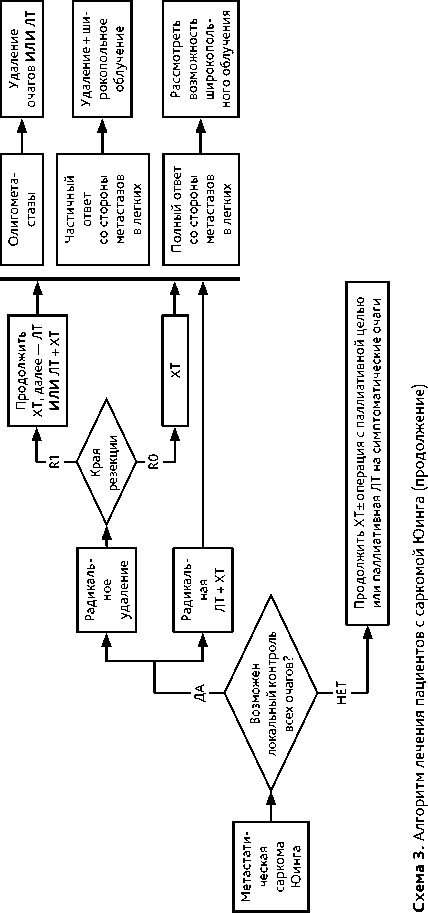
После этапа локального контроля возобновляется проведение адъювантной или лечебной ХТ; проводится от 6 до 10 циклов ХТ в зависимости от эффективности предоперационного лечения. Хорошим лечебным патоморфозом является определение менее 10% жизнеспособных опухолевых клеток, в этом случае после операции проводится ХТ по той же схеме. При метастатическом поражении легких выполнение метастазэктомии или проведение ЛТ увеличивает выживаемость пациентов.
Таблица 5. Выбор схемы химиотерапии при саркоме Юинга
|
Предпочтительные схемы |
|
|
Неоадъювантная терапия, 4–6 циклов (первая линия, 12–14 циклов) (МКЗ 0-A) |
• VAC/IE |
|
Адъювантная терапия при лечебном патоморфозе > III степени (некроз опухоли более 90%), 6–8 циклов (МКЗ 0-A) |
• VAC/IE |
|
Адъювантная терапия при лечебном патоморфозе < III степени (некроз опухоли менее 90%), 6–10 циклов (МКЗ 0-C) |
|
|
Последующие линии (МКЗ II-A) |
|
Лучевая терапия. ЛТ — важный компонент лечения пациентов с СЮ. В зависимости от клинической ситуации возможно проведение консолидирующего, предоперационного или послеоперационного курсов дистанционной ЛТ области первичного очага, также возможно проведение ЛТ по поводу отдаленных метастазов. Проведение консолидирующего курса дистанционной ЛТ показано при невозможности проведения радикального хирургического лечения. Облучение следует начать на 12–18 неделе ХТ. ЛТ проводится в РОД 2 Гр, СОД 44 Гр на область первичной опухоли до начала проведения лекарственного лечения (масимальный размер опухоли по первичной МРТ) с включением в объем облучения 1–1.5 см окружающих тканей, СОД 54 Гр на область первичной опухоли после проведения лекарственного лечения (определяется по МРТ, выполненному перед ЛТ) с включением в объем облучения 1–1.5 см окружающих тканей.
Проведение предоперационного курса дистанционной ЛТ рекомендуется при высокой вероятности R1 или R2 резекции. ЛТ проводится в режиме стандартного фракционирования с РОД 2 Гр, СОД 44 Гр на область исходного распространения опухоли до проведения лекарственного лечения (максимальный размер опухоли по МРТ) с включением в объем облучения 2 см окружающих тканей.
Послеоперационный курс дистанционной ЛТ нужно начать в срок не позднее 60 дней после операции. При R0 резекции облучение поводится в случае неполного патоморфо-логического ответа. ЛТ в режиме стандартного фракционирования в РОД 2 Гр, СОД 44 Гр на область исходного распространения опухоли до проведения лекарственного лечения (максимальный размер опухоли по МРТ) с включением в объем облучения 1–1,5 см окружающих тканей. При R1 резекции объем облучения, РОД и СОД такие же. При R2 резекции следует дополнительно эскалировать СОД на область остаточной опухоли и окружающие ткани в пределах 1–1,5 см до 54 Гр.
При метастатическом поражении легких, в случае достижения полного клинического ответа, возможно рассмотреть вариант облучения всего объема легких. Облучение проводится в режиме РОД 1,5 Гр до СОД 18 Гр.
Лечение рецидива заболевания. При позднем прогрессировании заболевания возможно возобновление применявшихся ранее схем ХТ (например, VAC/IE, если не достигнута максимально допустимая кумулятивная доза доксорубицина). При раннем прогрессировании целесообразно применение схем второй и последующих линий ХТ (табл. 5 и 7). В единственном рандомизированном исследовании III фазы при рефрактерной и/или рецидивной саркоме Юинга была показана эффективность высокодозного ифосфамида по сравнению с комбинацией циклофосфамида и топотекана, при этом введение высоко-дозного ифосфамида требует адекватной функции почек с учетом предлеченности пациентов. При последующем прогрессировании возможно назначение ингибиторов тирозинкиназ, в том числе кабозантиниба. В одноцентровом исследовании II фазы у пациентов с диссеминированной СЮ частичный ответ был достигнут в 25% случаев.
Факторы прогноза. Локализация первичного очага в позвоночнике или крестце является неблагоприятным фактором прогноза. Поздний рецидив (≥ 2 лет с момента постановки диагноза), изолированное поражение легких, местный рецидив, который возможно радикально удалить, а также возможность проведения высокодозной ХТ являются наиболее благоприятными прогностическими факторами, в то время как ранний рецидив (< 2 лет с момента с момента постановки диагноза) в сочетании или без метастатического поражения легких и/или метастазов других локализаций, повышенный уровень ЛДГ при постановке первичного диагноза считаются неблагоприятными прогностиче- скими факторами. Примерно у 30–40% пациентов с СЮ возникают ранние рецидивы заболевания (локальные и/или отдаленные). Пациенты с метастатическим поражением костей и/или костного мозга имеют неблагоприятный прогноз (5-летняя выживаемость менее 20%). Пациенты с длительным временем без прогрессирования имеют больше шансов на положительный эффект от проводимого лечения в случае развития рецидива.
-
3.2.3. Хондросаркома
Особенности лечения (схема 4). Основным вариантом лечения является хирургическое радикальное удаление опухоли в пределах здоровых тканей, что является прогностически важным фактором. У пациентов с небольшими по размеру опухолями и степенью дифференцировки G1 в ряде случаев возможно выполнение экскохлеации опухоли с тщательной обработкой полости. Классическая хондросаркома отличается низкой чувствительностью к лекарственному лечению. Исключения составляют мезенхимальная и дедифференцированная хондросаркомы, отличающиеся неблагоприятным прогнозом. В отношении данных подтипов рекомендовано проведение тех же принципов лечения, как для СЮ и остеосаркомы соответственно (табл. 6 и 7).
Лучевая терапия. Предоперационный курс дистанционной ЛТ следует проводить в случае опухоли высокой степени злокачественности, распространяющейся за пределы костных структур и только при высоком риске положительных краев резекции. В объем облучения входит вся первичная опухоль. Облучение проводится в режиме стандартного фракционирования РОД 2 Гр до СОД 50 Гр. Послеоперационный курс дистанционной ЛТ проводится только при крае резекции R1 или R2. Показано облучение ложа удаленной опухоли в РОД 2 Гр до СОД 70 Гр при R1, возможна эскалация дозы до СОД 78 Гр при R2. При невозможности выполнения радикальной операции рекомендуется проведение курса дистанционной ЛТ области первичной опухоли РОД 2 Гр до СОД 70–78 Гр (в зависимости от толерантности окружающих тканей). Возможно рассмотреть варианты лечения неоперабельных опухолей при помощи стереотаксической ЛТ или радиохирургии, либо в лечебных учреждениях, располагающих протонной ЛТ.
Факторы прогноза. Основными факторами прогноза при классической хондросаркоме являются степень дифференцировки опухоли, ее размер и возможность радикального хирургического лечения. Редкие подтипы — мезенхимальная и дедифференцированная хондросаркомы, отличаются значительно более неблагоприятным прогнозом.
Таблица 6. Выбор схемы химиотерапии при отдельных типах опухолей костей скелета
Предпочтительные схемы
Метастатическая и/или • Дазатиниб, до прогрессирования или неприемлемой токсичности нерезектабельная • Пазопаниб, до прогрессирования или неприемлемой токсичности классическая хондросаркома
(МКЗ II-B)
|
Предпочтительные схемы |
|
|
Дедифференцированная хондросаркома |
• см. раздел «Остеосаркома» |
|
Мезенхимальная хондросаркома |
• см. раздел «Саркома Юинга» |
|
Недифференцированная плеоморфная саркома кости |
• см. раздел «Остеосаркома» |
|
Хордома (МКЗ III-C) |
|
|
Гигантоклеточная опухоль кости (МКЗ I-A) |
• Деносумаб, см. табл. 7 |
|
MSI-h/dMMR/TMB-h (МКЗ II-C) |
• Пембролизумаб, до прогрессирования или неприемлемой токсичности • Ниволумаб + ипилимумаб, до прогрессирования или неприемлемой токсичности |
-
3.2.4. Хордома
-
3.2.5. Гигантоклеточная опухоль
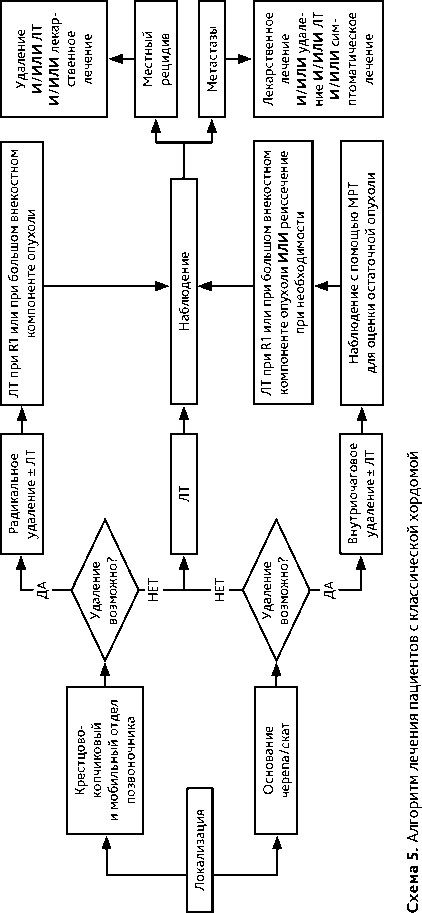
Хордома представляет собой низкозлокачественную медленно растущую, но местноинвазивную и агрессивную опухоль, встречающуюся в структурах основания черепа и осевого скелета. Наиболее распространенной локализацией является крестцовая/коп-чиковая область (50%), за которой следуют сфено-затылочная область (35%) и мобильный отдел позвоночника (около 10–15%).
Клиническая картина полностью зависит от расположения хордомы. Симптомы часто бывают стертыми и долго проявляются в слабой форме, что обуславливает отсроченное, в среднем в течение 10 месяцев, обращение пациентов к врачу. Гистологически выделяют 3 типа хордом: классическую, низкодифференцированную и дедифференцированную хордомы; кроме того, выделяют хондроидную хордому как один из вариантов классической хордомы.
Особенности лечения (схема 5). Хирургическая en-bloc резекция с отрицательными краями является стандартом лечения хордом позвоночника и крестца. Радикальная резекция опухолей с негативными краями резекции связана с более длительной безрецидивной выживаемостью. Однако, радикальное хирургическое лечение не всегда возможно, особенно при локализации в позвоночнике. Кроме того, en-bloc резекция сопряжена с высокой частотой развития осложнений. При высоких резекциях крестца радикальное оперативное вмешательство приводит к стойкому нарушению функции тазовых органов и большому риску развития раневой инфекции. В случае положительного края резекции обязательным является проведение послеоперационной ЛТ.
Возможности лекарственной терапии при распространенной хордоме ограничены (табл. 6 и 7). Иматиниб и сорафениб являются агентами с наибольшим доказательством эффективности при прогрессирующей хордоме и представляют разумные варианты паллиативного лечения для замедления прогрессирования заболевания или облегчения симптомов. Низкодифференцированные или дедифференцированные хордомы лечат в соответствии с рекомендациями по лечению саркомы мягких тканей, ХТ проводится при клинических показаниях.
Лучевая терапия. Предоперационный курс дистанционной ЛТ при локализации опухоли в позвонках или крестце следует проводить только при большой вероятности R1 или R2 края резекции. Рекомендовано проведение курса дистанционной ЛТ на область первичной опухоли в режиме стандартного фракционирования РОД 2 Гр до СОД 50 Гр. В случае локализации опухоли в костях основания черепа проведение предоперационного курса ЛТ не рекомендуется. Послеоперационный курс дистанционной ЛТ следует проводить только в случае нерадикальной операции. Показано облучение ложа удаленной опухоли в РОД 2 Гр до СОД 70 Гр при R1, эскалация дозы до СОД 72–78 Гр — в случае R2 в крае резекции. При невозможности выполнения радикальной операции показано проведение курса дистанционной ЛТ на область первичной опухоли в РОД 2 Гр до СОД 72–78 Гр. Как и для хондросарком, возможно рассмотреть варианты лечения нерезектабельных опухолей при помощи стереотаксической ЛТ или радиохирургии, либо в лечебных учреждениях, располагающих протонной ЛТ.
Гигантоклеточная опухоль (ГКО) является относительно редким остеолитическим новообразованием костей скелета, для которого характерны местно-агрессивный характер течения, высокая частота местных рецидивов и низкий метастатический потенциал. Примерно в половине всех случаев заболевания поражается дистальный отдел бедренной кости или проксимальный отдел большеберцовой кости.
Хирургическое лечение, возможности лекарственной терапии при ГКО. Радикальное хирургическое лечение является стандартом лечения ГКО и соответствует общим хирургическим принципам лечения костных сарком. Однако, при некоторых локализациях (позвоночник, кости таза, кисть, стопа) или распространенности процесса это не всегда возможно или приводит к ухудшению функциональных результатов и качества жизни пациента. При выполнении нерадикального объема операции функциональные результаты значительно лучше, но при этом риск местного рецидива достигает 60%. Деносумаб снижает потребность в инвалидизирующем хирургическом вмешательстве или откладывает его, приводит к быстрому снижению болевого синдрома, позволяет достичь длительного контроля над заболеванием и, по данным некоторых нерандомизированных исследований, влияет на снижение риска рецидива заболевания (табл. 7). При нерезектабельном и/или диссеминированном заболевании рекомендовано длительное лечение, в том числе с переходом на поддерживающую терапию (табл. 7). При резектабельной ГКО кости проведение предоперационной терапии деносумабом позволяет выполнить операцию с лучшим функциональным результатом и, в зависимости от объема операции, влияет на риск рецидива заболевания. Минимальная продолжительность предоперационной терапии составляет 6 введений и может быть увеличена при нарастании положительного эффекта на фоне лечения, при анатомически сложных локализациях заболевания и высоких рисках послеоперационных осложнений или рецидива заболевания. Злокачественная ГКО (первичная и вторичная) встречается крайне редко, прогноз значительно хуже, а лечение соответствует протоколам лечения костных сарком. Тактика лечения пациентов с ГКО должна определяться в референтных онкоортопедических центрах (схема 6).
Лучевая терапия. В случае невозможности выполнения радикальной операции, при прогрессировании или рецидиве, если резервы лекарственного лечения (деносумаб) исчерпаны, рекомендуется проведение курса дистанционной ЛТ области первичной опухоли в режиме стандартного фракционирования с РОД 2 Гр до СОД 50 Гр. Возможна эскалация СОД до 60 Гр. По данным литературы, существует вероятность малигнизации опухоли после проведения облучения (вторично злокачественная ГКО).
-
3.2.6. Другие опухоли
Тактика лечения редких гистологических типов опухолей костей скелета в обязательном порядке должна быть принята мультидисциплинарным консилиумом в референтных саркомных центрах. В основном при бурном прогрессировании опухоли применяются общие принципы лечения, как при остеосаркоме или СЮ в зависимости от принадлежности опухоли к той или иной гистологической группе (табл. 4 и 5). Проведение иммунотерапии при костных опухолях не является стандартом лечения и на основе имеющихся исследований показало низкую эффективность. Терапия пембролизумабом или ниволу-мабом + ипилимумабом возможна при отсутствии/исчерпанности стандартных методов лечения, наличии MSI-H и/или высокой мутационной нагрузки в опухоли.
Таблица 7. Рекомендуемые схемы лекарственной терапии при первичных опухолях костей скелета
Схема Режим лечения
Химиотерапия при первичных опухолях костей скелета
VAC-IE VAC:
-
• День 1: винкристин 2 мг в/в кап.
-
• День 1: доксорубицин 75 мг/м 2 в/в кап.
-
• День 1: циклофосфамид 1200 мг/м 2 в/в
-
• День 2–11: филграстим 5 мкг/кг п/к или до восстановления АЧН ≥ 5,0 × 10 9 /л (или во 2-й день эмпэгфилграстим 7,5 мг п/к или другие формы пегилированных КСФ)
Далее через 2–3 недели
|
Схема |
Режим лечения |
|
IE:
Каждые 2–3 недели |
|
|
HD I |
Каждые 3 недели |
|
АР |
Каждые 4 недели Или
Каждые 3 недели |
|
МАР (для пациентов молодого возраста) |
Каждые 6 недель |
|
HD Mtx (для пациентов молодого возраста) |
• День 1: метотрексат 4 12000 мг/м 2 в/в с последующей инфузией кальция фолината и контролем концентрации метотрексата в крови Каждые 2 недели |
|
GemTax |
Стандартный режим:
Каждые 3 недели Или |

|
Схема |
Режим лечения |
|
Режим для пациентов, раннее получавших системную ХТ с эпизодами гематологической токсичности 3–4 степени и/или после ЛТ костей таза:
Каждые 3 недели |
|
|
Темозоломид + иринотекан |
|
|
Винкристин + темозоломид + иринотекан |
|
|
Циклофосфамид + топотекан |
|
Таргетная и иммунотерапия при первичных опухолях костей
|
Пазопаниб |
800 мг в сутки внутрь |
|
Дазатиниб |
70 мг × 2 раза в сутки внутрь |
|
Иматиниб |
400 мг × 1 раз сутки внутрь |
|
Сунитиниб |
37,5 мг внутрь |
|
Сорафениб + эверолимус |
Сорафениб 400 мг × 2 раза в сутки внутрь + эверолимус 5 мг × 1 раз в сутки внутрь |
|
Сорафениб |
400 мг × 2 раза в сутки внутрь |
|
Кабозантиниб |
60 мг в сутки внутрь |
|
Регорафениб |
160 мг 1 раз в сутки внутрь с 1-го по 21-й день, каждые 4 недели |
|
Эрлотиниб |
150 мг в сутки внутрь |
|
Лапатиниб |
1500 мг в сутки внутрь |
|
Деносумаб |
День 1, 8, 15, 28: 120 мг п/к, далее — 1 раз в 28 дней, предоперационная длительность введения в зависимости от объема операции и локализации опухоли Поддерживающая терапия: 120 мг п/к 1 раз в 3 месяца, длительно |
|
Пемброли-зумаб |
200 мг в/в кап. каждые 3 недели или 400 мг в/в кап. каждые 6 недель |
|
Ниволумаб + ипилимумаб |
День 1: ниволумаб 240 мг в/в кап. каждые 2 недели День 1: ипилимумаб 1 мг/кг в/в кап. каждые 6 недель |
2 Цисплатин вводится на фоне гипергидратации солевых растворов с форсированным маннитоло-вым диурезом и комбинированной антиэметической терапией.
3 Доксорубицин вводится в центральную вену в виде суточной инфузии с помощью инфузомата или помпы.
4 Метотрексат вводится на фоне гипергидратации, подщелачивания и антидотной терапии лейковорином в дозе 15 мг /м2начиная с 24ч от начала инфузии метотрексата каждые 6 часов до снижения концентрации метотрексата в крови до уровня менее 0,1 μM. Контроль концентрации метотрексата в конце 4 часа инфузии, и далее каждые 24 часа от начала инфузии метотрексата.
4. НАБЛЮДЕНИЕ
Пациенты с саркомой кости, закончившие программное лечение, должны наблюдаться с периодичностью 1 раз в 3 мес. в течение первых 2 лет, в третий год — 1 раз в 4 мес., далее — 1 раз в 6 мес. в течение 4–5 лет. Обязательными процедурами являются выяснение жалоб, осмотр, рентгенография органов грудной клетки (КТ — по показаниям), УЗИ области послеоперационного рубца, рентгенография зоны костного поражения, определение уровня ЩФ, остеосцинтиграфия и ПЭТ-КТ (по показаниям). При сомнительной ультразвуковой и рентгенологической картине — дообследование (выполнение МРТ и/или РКТ).
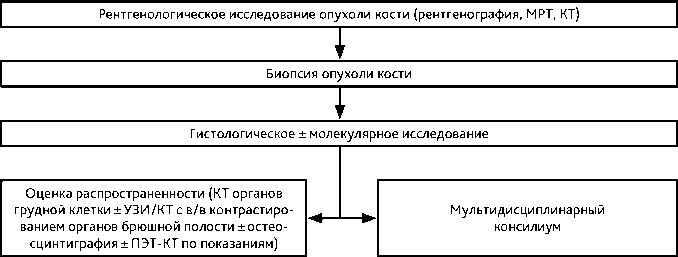
Рисунок 1. Рекомендуемый алгоритм обследования пациентов с опухолью костей скелета
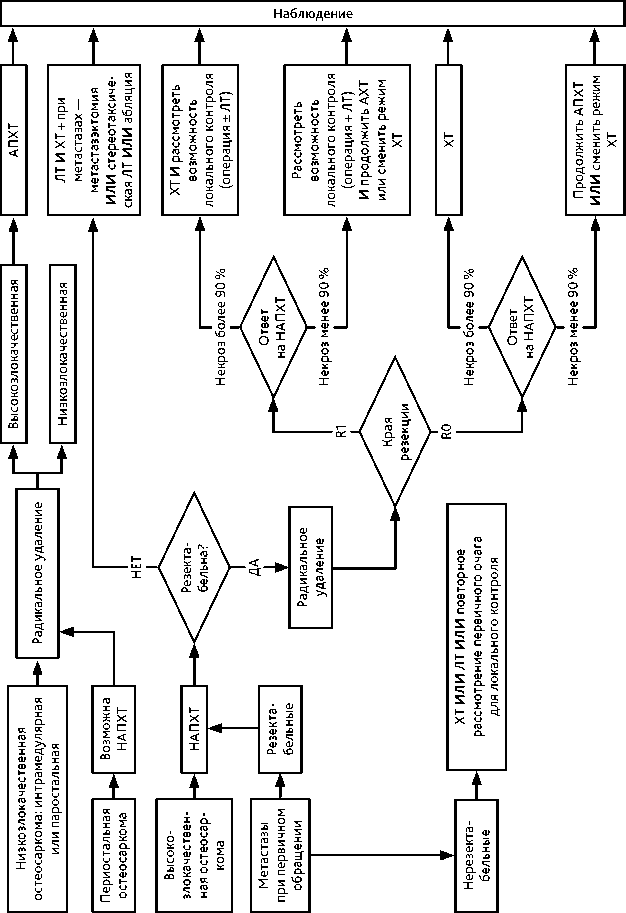
Схема 1. Алгоритм лечения пациентов с остеосаркомой
Оценка распространенности и локализации ГКО
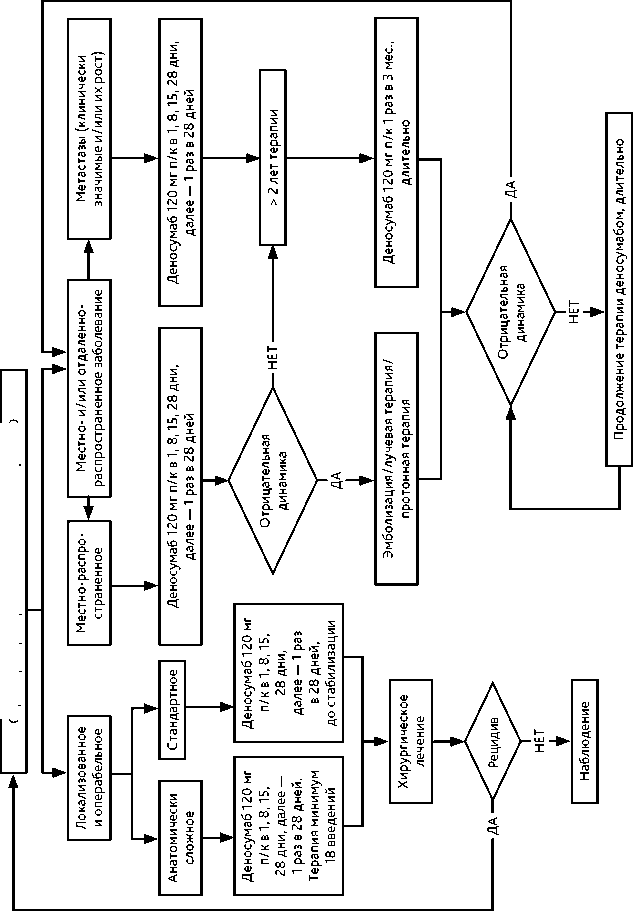
Схема 5. Алгоритм лечения пациентов с ГКО
том/vol. 15(3s2)2025
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


