Первые результаты комплексных исследований современных микроорганизмов физико-химическими и минералого-геохимическими методами
Автор: Силаев В.И., Кокин А.В., Павлович Н.В., Шанина С.Н., Киселева Д.В., Васильев Е.А., Мартиросян О.В., Смолева И.В., Филиппов В.Н., Хазов А.Ф., Шуйский А.С., Щемелинина Т.Н., Игнатьев Г.В., Слюсарь А.В.
Журнал: Вестник геонаук @vestnik-geo
Рубрика: Научные статьи
Статья в выпуске: 9 (321), 2021 года.
Бесплатный доступ
Исследованы 14 образцов грамотрицательных и грамположительных бактерий, одноклеточных дрожжей и зеленых водорослей с использованием оптической, атомно-силовой и аналитической сканирующей электронной микроскопии, термического анализа, газовой хроматографии, инфракрасной спектроскопии, масс-спектрометрии с индуктивно-связанной плазмой и изотопной масс-спектрометрии. По форме клетки микроорганизмы варьируются от палочковидных до чечевицеподобных и глобуло-коккообразных, по размеру - от мезонанометровых до микрометровых. Между крайними размерами клеток установлена сильная положительная корреляция. В химическом составе исследованных микроорганизмов обнаружена примесь неорганических химических элементов - Mg, Ca, Ba, Sr, Si, Na, K, Cu, Zn, P, S, Cl - и субмикронные по размеру выделения минеральных фаз - карбонатов, фосфатсульфатов, гидрогенсульфатфосфатов, гидрогенфосфатов, галита, каолинита, металлических сплавов латунного состава, бадделеита. В число 45 микроэлементов, выявленных в микроорганизмах, входят 7 элементов-эссенциалов (Э), 17 физиогенно-активных (ФА) и 19 абиотических (АБ). Суммарная концентрация микроэлементов колеблется в диапазоне 0.003-0.26 мас. %. Значение эссенциального коэффициента - Э/АБ - составляет в среднем 196 ± 153. Микроорганизмы характеризуются смешанным жиробелковым элементным составом. В них выявлены 14 аминокислот, относящихся к алифатической, ароматической, основной, кислой, гидроксильной, имино и серусодержащей группам. Суммарное содержание аминокислот колеблется от 409 до 942 (682 ± 221) мг/г. До половины аминокислот представлены левым (L) и правым (D) энантиомерами. Степень рацемизации (D/L) колеблется в пределах 0.01-0.37. Наиболее изотопно-тяжелым составом углерода в сочетании с относительно изотопно-лёгким азотом характеризуются дрожжи Rhodotorula glutinis и микроводоросли Chlorella vulgaris. В бактериях установлен статистически более лёгкий углерод в сочетании со значительно более тяжелым азотом. По ряду свойств - химическому составу органического вещества, микроэлементам, степени обогащения элементами-антибионтами, содержанию аминокислот и степени их рацемизации - грамотрицательные и грамположительные бактерии различаются. В целом же исследованные биологические микроорганизмы по элементному и аминокислотному составу, изотопии углерода и азота принципиально отличаются от абиогенных органических веществ, выявленных в метеоритах и продуктах современного вулканизма.
Мультидисциплинарные научные исследования, бактерии, одноклеточные дрожжи, хлорелла, микростроение, химический и аминокислотный состав, микроэлементы, изотопный состав углерода и кислорода, абиогенное органическое вещество в метеоритах и продуктах современного вулканизма
Короткий адрес: https://sciup.org/149139305
IDR: 149139305 | УДК: 550.7 | DOI: 10.19110/geov.2021.9.1
Текст научной статьи Первые результаты комплексных исследований современных микроорганизмов физико-химическими и минералого-геохимическими методами
Одноклеточные микроорганизмы — уникальные биологические образования, появившиеся на Земле раньше эукариотов (ядерные живые организмы) и с тех пор весьма активно участвующие в разнообразных геологических процессах породо- и минералообразования [2, 8, 12, 13, 15, 22, 27, 28, 29, 52]. С более общих научных позиций, согласно парадигме академика Н. П. Юшкина о биоминеральных взаимодействиях [38, 39], микробиальный мир является непосредственным продуктом биоминеральных взаимодействий, начавшихся еще в космическом пространстве, и имеет с минеральным миром общий источник происхождения — неконденсированные ионно-молекулярные структуры. Эта парадигма в настоящее время подтверждается не только многочисленными находками неземных микроорганизмов в метеоритах (Оргей, Алаис, Альенде, Ефремовка, Муррей, Мурчисон, Нагойя), но и некоторыми экспериментальными данными. К последним, 4
например, относятся результаты опытов по фиксации углерода на каталитических осадках переходных металлов при температуре 80—120 °С с образованием упорядоченного ряда химических соединений от гидроксидов до аминокислот с общей формулой последних — R–CHA–COOH, где R = H, CH3, C2O5, HOCH2, а А = ОН или NH2 [46]. Кроме того, недавно был установлен факт соответствия распределения микроэлементов в современных земных бактериях закону периодичности первичной распространенности химических элементов в Солнечной системе [17]. Таким образом, широко известный феномен биостиму-лированного породо- и минералообразования на Земле [5—7, 23] можно рассматривать как вполне естественное продолжение коэволюции минеральной и живой материй, начавшейся еще в космосе.
К сожалению, следует констатировать, что до настоящего времени уровень изучения микроорганизмов современными методами экспериментального естествознания остается, за редким исключением, крайне низким [8, 14, 21, 24, 25]. Поэтому предпринятое нами исследование современных микроорганизмов с использованием хорошо зарекомендовавшего себя комплекса физико-химических и минералогогеохимических методов можно признать весьма актуальным. Особое значение такого рода исследования приобрели в настоящее время в связи с открытием ор- ганоидов абиогенного происхождения в продуктах современного континентального и океанического вулканизма [31—33].
Объекты и методы исследований
В качестве объектов исследований выступили две группы штаммов микроорганизмов (табл. 1). В пер-
Таблица 1. Объекты исследований / Table 1. Objects of research
|
№ п/п |
№ обр. Sample No. |
Вид Species |
Характеристика Characteristics |
Вес, мг Weight, mg |
Происхождение образца Origin of sample |
Источник Source |
|
1 |
БАК-1 |
Pseudomonas yamanorum sp. VKM В-3033D |
псевдомонадовые грамотрицательные аэробные бактерии pseudomonad gramnegative aerobic bacteria |
40 |
выделены из грунта железнодорожного полотна isolated from the soil of a railway track |
Институт биологии ФИЦ Коми НЦ УрО РАН Institute of Biology, FRC Komi SC UB RAS |
|
2 |
БАК-2 |
« |
« |
« |
« |
« |
|
3 |
ДРЖ-1 |
Rhodotorula glutinis VKM Y-2998D |
аэробные розовые дрожжи aerobic rose yeast |
« |
выделены из нефтяного шламонакопителя isolated from an oil sludge pond |
« |
|
4 |
ДРЖ-2 |
« |
« |
40 |
« |
« |
|
5 |
МВД-1 |
Chlorella vulgaris Beijer. f. Globosa V. Andr IPPAS C-2024 |
хлорелла — одноклеточная микроводоросль chlorella — a singlecelled microalga |
50 |
выделена из почвы на стоянке оленеводов isolated from the soil at a reindeer breeders' camp |
« |
|
6 |
МВД-2 |
« |
« |
50 |
« |
« |
|
7 |
ПЧИ-1 |
Escherichia col i 1015 энтеропа-тогенная (клинический изолят) Enteropatogenic (clinical isolate) |
кишечная палочка — грамотрицательная бактерия escherichia coli is a gram-negative bacterium |
50 |
выделена из человека isolated from a human |
Ростовский-на-Дону противочумный институт Rostov-on-Don Anti-Plague Institute |
|
8 |
ПЧИ-2 |
Vibrio cholerae О139 16077 (токсигенный штамм) (toxigenic strain) |
холерный вибрион — грамотрицательная анаэробная бактерия vibrio cholerae — gram-negative anaerobic bacterium |
34 |
« |
« |
|
9 |
ПЧИ-3 |
Vibrio cholerae О139 17918 (атоксигенный штамм) (atoxigenic strain) |
« |
25 |
выделена из воды isolated from water |
« |
|
10 |
ПЧИ-4 |
Vibrio cholerae Eltor 19667 (токсигенный) (toxigenic) |
« |
36 |
выделена из человека isolated from a human |
« |
|
11 |
ПЧИ-5 |
Vibrio cholerae Eltor 19430 (атоксигенный) (atoxigenic) |
« |
45 |
выделена из воды isolated from water |
« |
|
12 |
ПЧИ-6 |
Francisella tula-rensis subsp. hol-arctica 15 НИИЭГ (вакцинный) |
туляремийный грамотрицательный микроб tularemia gramnegative microbe |
100 |
выделена из человека isolated from a human |
« |
Окончание таблицы 1 / End of table 1
|
№ п/п |
№ обр. Sample No. |
Вид Species |
Характеристика Characteristics |
Вес, мг Weight, mg |
Происхождение образца Origin of sample |
Источник Source |
|
13 |
ПЧИ-7 |
Francisella tula-rensis subsp. hol-arctica 503 (природный, вирулентный) (natural, virulent) |
« |
82 |
« |
« |
|
14 |
ПЧИ-8 |
Staphylococcus aureus 12617 |
золотистый стафилококк — грамполо-жительная шаровидная бактерия staphylococcus aureus — grampositive globular bacterium |
54 |
« |
« |

вую группу вошли шесть образцов бактерий рода Pseudomonas, розовых одноклеточных дрожжей Rhodotorula glutinis и одноклеточных зеленых водорослей Chlorella vulgaris, полученных в Институте биологии Коми НЦ УрО РАН в ходе разработки методов биоочистки природных почв от нефтезагрязнений. Вторую группу составили восемь образцов обеззараженной массы штаммов болезнетворных бактерий, переданных нам на исследования из Ростовского-на-Дону противочумного института Роспотребнадзора [26]. В ча- сти исследований второй группы образцов между Противочумным институтом и Институтом геологии Коми НЦ УрО РАН был заключен договор о научном сотрудничестве, отчетом по которому и является настоящая статья.
Бактерии рода Pseudomonas и розовые дрожжи представлены афанитовой массой, варьирующейся по окраске от светло-оранжевой до оранжевой (рис. 1). Хлорелла образует агрегаты хлопьевидных частиц насыщенно-зеленого цвета размером 100—300 мк (рис. 2).
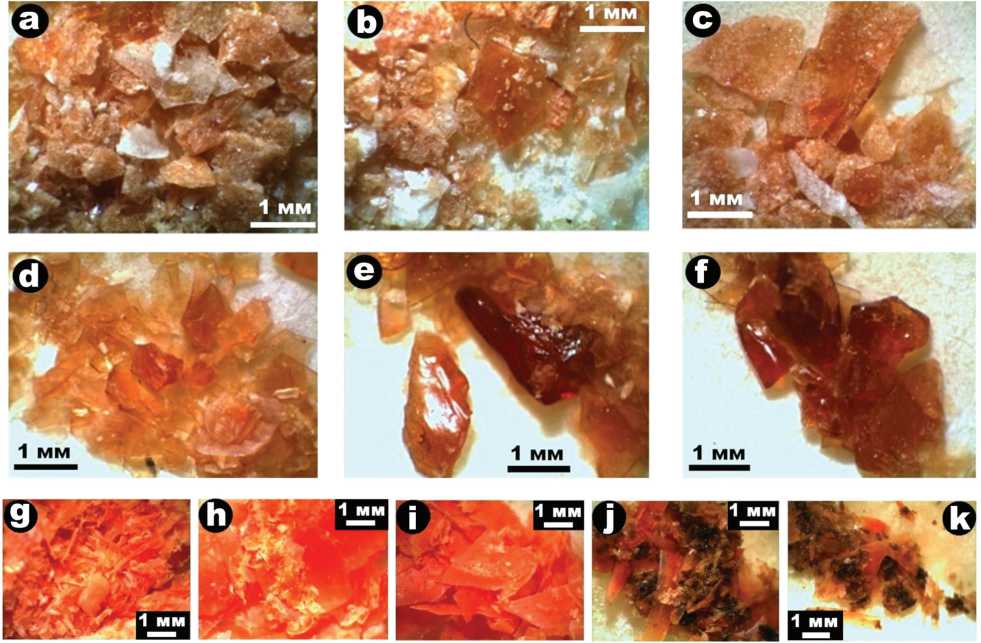
Рис. 1. Внешний вид колоний псевдомонад (a—f) и дрожжей — до (g—i) и после (j, k) опыта по биологической очистке почв от нефтезагрязнений
Fig. 1 . Appearance of colonies of pseudomonads (a—f) and yeast — before (g—i) and after (j, k) experiment on the biological cleaning of soils from oil pollution

Рис. 2. Внешний вид образца хлореллы / Fig. 2. Chlorella vulgaris sample appearance
Для колоний кишечной палочки характерен довольно чистый желтый цвет, а скопления холерного вибриона отличаются светло-бурой окраской (рис. 3). Массы туляремийного микроба резко выделяются темно-бурым цветом, а золотистому стафилококку свойственна ярко-оранжевая окраска (рис. 4).
В ходе исследований применялся широкий комплекс современных аналитических методов, хорошо зарекомендовавший себя в приложении ко многим палеонтологическим, минералогическим и археологическим объектам. В упомянутый комплекс вошли: оптическая (OLYMPUS BX51) и аналитическая сканирующая электронная микроскопия (JSM-6400 Jeol; Tescan Vega 3); атомно-силовая микроскопия («Интегра Прима» фирмы NT-MDT, В. А. Радаев); термический анализ (DTG-60А/60 АН, Shimadzu, Е. М. Тропников); газовая
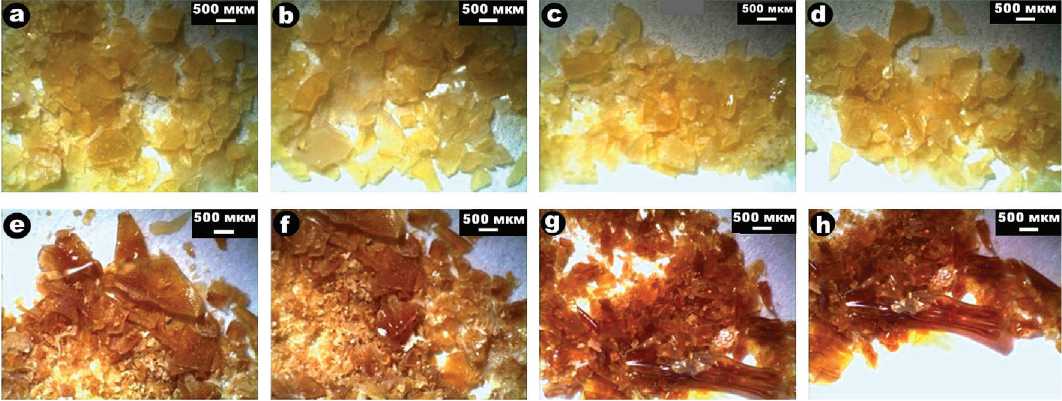
Рис. 3. Внешний вид колоний кишечной палочки (a—d) и холерного вибриона (e—h)
Fig. 3 . The appearance of colonies of Escherichia coli (a—d) and Vibrio cholerae (e—h)

Рис. 4. Внешний вид масс туляремийного микроба (a—d) и золотистого стафилококка (e—h)
Fig. 4 . Appearance of masses of tularemia microbe (a—d) and Staphylococcus aureus (e—h)

хроматография (GC-17A Shimadzu с пламенно-ионизационным детектором); масс-спектрометрия с индуктивно связанной плазмой (NexION 300S Perkin Elmer, Н. В. Чередниченко); инфракрасная спектроскопия (VERTEX-70 с микроскопом HYPERION 1000); изотопная масс-спектрометрия (Delta V Advantage).
Микростроение, химический состав и биоминеральные примеси
Микростроение бактерий исследовалось методом атомно-силовой микроскопии. Полученные результаты можно обобщить следующим образом.
Масса штамма Pseudomonas yamanorum sp. (рис. 5) сложена палочковидными формами, часто с линейными цепочками углублений. Статистический размер бактерий — (1.552 ± 0.304) × (0.558 ± 0.12) мкм, коэффициент удлинения составляет 2.89 ± 0.85. Коэффициент парной корреляции между крайними размерами — 0.3. При больших увеличениях в пределах палочек выявляется сеть разориентированных червеобразных субиндивидов размером (0.138 ± 0.01) × (0.028 ± 0.01) мкм. Коэффициент их удлинения — 5.3 ± 1.46, коэффициент парной корреляции между крайними размерами — 0.53.
Розовые дрожжи Rhodotorula glutinis (рис. 5) образованы плотными агрегатами уплощенных прямоугольных форм, большей частью с угловато-прямолинейными торцами. Размеры форм варьируются в пределах (3.111 ± 1.744) × (0.595 ± 0.321) мкм, коэффициент удлинения составляет 5.7 ± 2.69. Коэффициент парной корреляции между крайними размерами — 0.58.
Для штамма Chlorella vulgaris (рис. 5) характерны лентовидные формы шириной (1.877 ± 0.637) мкм с мелкими изометричными ямками. При больших увеличениях выявляются глобуло- и чечевицеобразные частицы размером (0.114 ± 0.184) × (0.082 ± 0.115) мкм и коэффициентом удлинения 1.34 ± 0.43.
В штамме кишечной палочки (рис. 6) собственно палочковидные формы оказались редкими. Здесь преобладают кокко-кольцеобразные формы с углублением в центре (черное на АСМ-изображениях). Статистический размер таких форм — (0.588 ± 0.197) × (0.534 ± ± 0.147) мкм, коэффициент вытянутости — 1.09 ± 0.12. Коэффициент корреляции между крайними размерами — 0.94. Величина биоминеральных нанофаз, обнаруженных на АСМ-изображениях колоний, колеблется в пределах 20—50 нм.
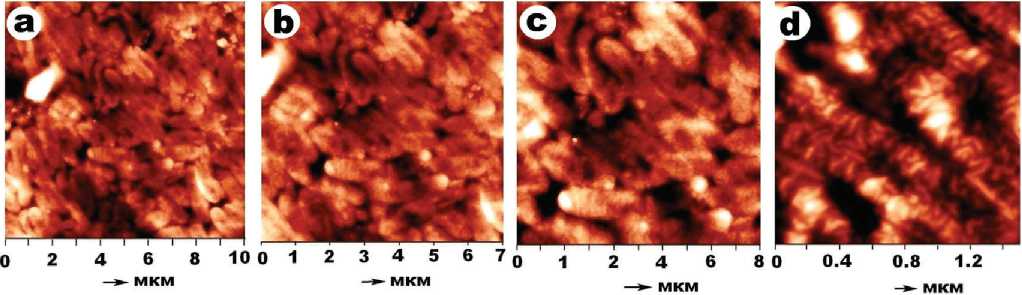
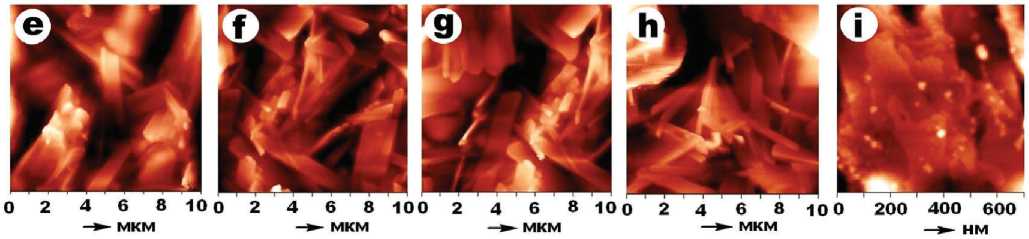
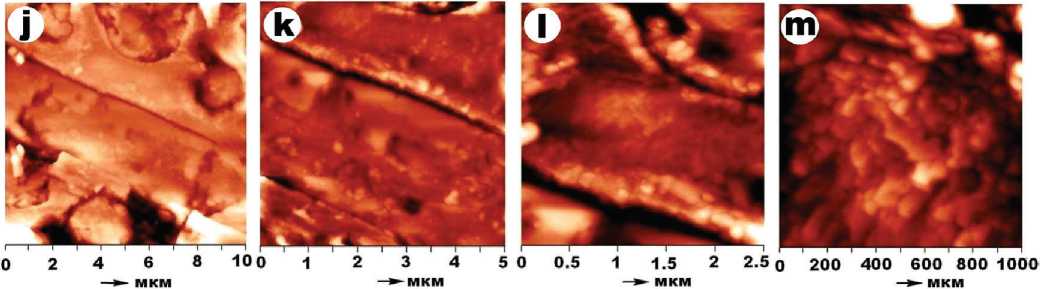
Рис. 5 . АСМ-изображения псевдомонад (a—d), дрожжей (e—i) и хлореллы (j—m)
Fig. 5 . AFM images of pseudomonads (a—d), yeast (e—i) and chlorella (j—m)
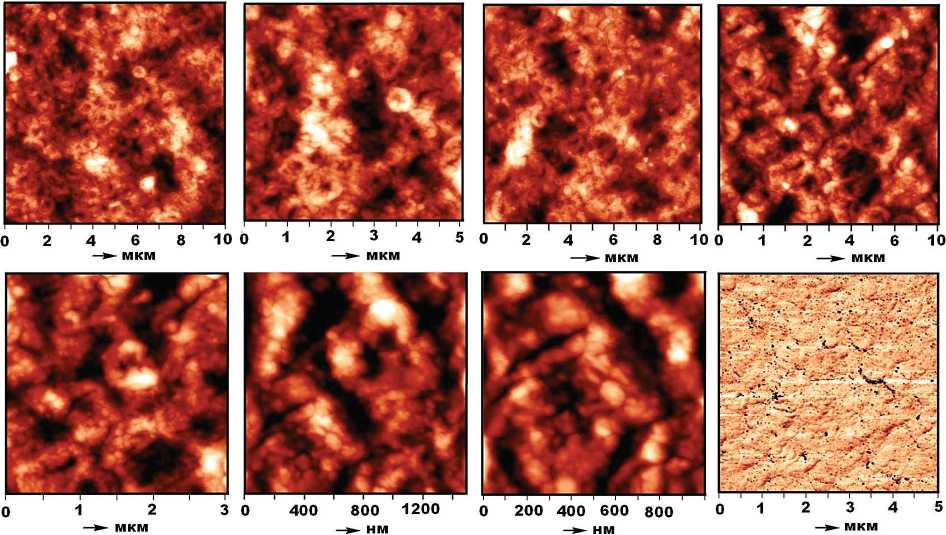
Рис. 6 . АСМ-изображения кишечной палочки. В нижнем ряду на крайнем справа изображении черным цветом показаны наноразмерные выделения биоминералов
Fig. 6. AFM images of Escherichia coli . In the bottom row, on the far right of the image, nano-sized precipitates of biominerals are shown in black
В массе холерного вибриона (рис. 7) палочковидные формы тоже встречаются редко, их размер (1.5—4) × × (0.2—0.4) мкм со значением коэффициента удлинения 9—9.5. Преобладают же гроздьевидные агрегаты, сложенные субиндивидами чечевицеобразной формы. Агрегаты варьируются по размеру в статистических пределах (0.57 ± 0.129) × (0.404 ± 0.113), коэффициент их удлинения составляет 1.47 ± 0.33. Коэффициент парной корреляции между крайними размерами — 0.68. Кроме того, наблюдаются тонкие цепочки, образован- ные очень мелкими (50—100 нм) коккоидными телами. Размер таких цепочек составляет (0.831 ± 0.38) × × (0.69 ± 0.012) мкм.
Туляремийный микроб (рис. 8) представлен сплошной массой коккоидных и чечевицеподобных бацилл размером (0.452 ± 0.23) × (0.335 ± 0.18) мкм с коэффициентом удлинения 1.38 ± 0.41. Коэффициент корреляции между крайними размерами составляет 0.89. На фоне сплошных масс наблюдают линейные колонии более мелких, примерно на порядок, коккобацилл.
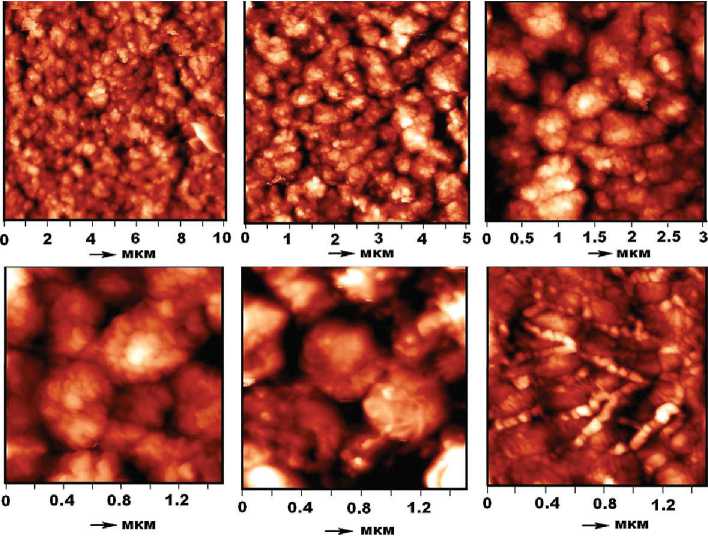
Рис. 7. АСМ-изображения холерного вибриона / Fig. 7 . AFM images of Vibrio cholerae


Рис. 8. АСМ-изображения туляремийного микроба / Fig. 8 . AFM images of tularemia microbe
В колонии золотистого стафилококка преобладают шаровидные формы двух типов (рис. 9): 1) крупные, агрегатного сложения, на порядок более мелкие коккоиды и 2) мелкие коккоиды в рассеянном распределении. Формы первого типа варьируются по размеру в статистических пределах (0.453 ± 0.16) × (0.415 ± ± 0.14) мкм, коэффициент вытянутости — 1.09 ± 0.1. Коэффициент парной корреляции между крайними размерами 0.96. Мелкие формы характеризуются размером (0.081 ± 0.037) × (0.074 ± 0.035) мкм, коэффициентом вытянутости 1.13 ± 0.12 и коэффициентом парной корреляции между крайними размерами 0.98. Спорадически встречаются палочковидные бактерии размером (0.43 ± 0.21) × (0.11 ± 0.03) мкм, с коэффициентом удлинения 4.29 ± 2.54.
Химический состав неорганической компоненты изучался методом аналитической СЭМ (табл. 2). В результате проведенных исследований в микроорганизмах установлены Mg, Ca, Na, K, P, S, Cl (рис. 10) и, кроме того, спорадически встречающиеся Ba, Sr, Si, Cu, Zn. Суммарное содержание неорганических элементов колеблется в пределах 1.95—14.52 мас. %. По этому признаку исследованные образцы выстраиваются в следующую последовательность (мас. %): золотистый стафилококк (1.95) < псевдомонады (2.94—3.75) < холер- ный вибрион (3.36) < кишечная палочка (4.8) < туляремийный микроб (5.21) < дрожжи (6.7—6.82) < хлорелла (14.52). При этом проанализированные микроорганизмы заметно варьируются по пропорциям обогащения неорганическими элементами. Штамм Pseudomonas yamanorum sp. характеризуется последовательностью снижения степени обогащения: S > Cl > K > P > Ca > Mg. В образце псевдомонад после опытов биоочистки почв от нефтезагрязнений эта последовательность несколько изменилась: Cl > P > S > K > Si. Для кишечной палочки установлена последовательность: Cl > P > K; для холерного вибриона: Cl > P > S < Ca > K; для туляремийного микроба: P > Cl > K > S > Na > Ca > Si; для золотистого стафилококка: Cl > S > P.
Таким образом, для исследованных бактерий выявляется примерно одинаковая тенденция снижения степени обогащения неорганическими элементами в направлении от неметаллов — хлора, фосфора и серы — к щелочным и щелочноземельным металлам. Одноклеточные дрожжи Rhodotorula glutinis обнаруживают более сложную последовательность обогащения, в которой неметаллы и металлы чередуются: P > K > S > Cl > Na > Zn > Cu. Хлорелла демонстрирует особенную последовательность обогащения, в которой на лидирующие позиции выходят скорее металлы, чем неметал-
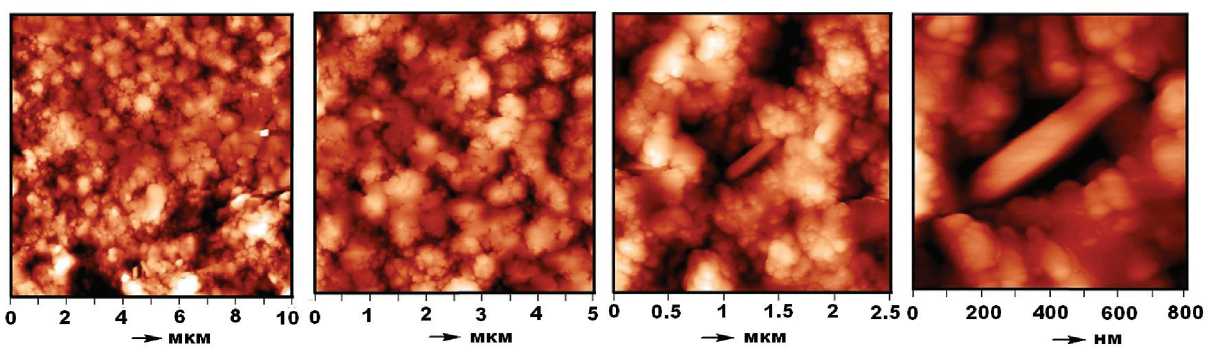
Рис. 9. АСМ-изображения золотистого стафилококка / Fig. 9 . AFM images of Staphylococcus aureus
Таблица 2. Содержание неорганических элементов-примесей в исследованных микроорганизмах, мас. %
Table 2. The content of inorganic elements-impurities in the investigated microorganisms, wt. %
|
№ п/п |
Образец Sample |
Si |
Ti |
Cu |
Zn |
Mg |
Ca |
Ba |
Sr |
Na |
K |
P |
S |
Cl |
Сумма Total |
|
1 |
БАК-1 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.29 |
0.41 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.53 |
1.67 |
0.7 |
0.86 |
4.46 |
|
2 |
« |
« |
« |
« |
н. о. n/d |
0.22 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.43 |
1.02 |
0.88 |
0.49 |
3.04 |
|
|
Среднее ± СКО |
0 |
0 |
0 |
0 |
0.15 ± |
0.32 ± |
0 |
0 |
0 |
0.48 ± |
0.35 ± |
0.79 ± |
0.68 ± |
3.75 ± |
|
|
Average ± RMS |
0.21 |
0.13 |
0.07 |
0.46 |
0.13 |
0.26 |
1.0 |
||||||||
|
3 |
БАК-2 |
0.16 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.17 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.25 |
0.52 |
0.48 |
1.44 |
3.02 |
|
4 |
0.2 |
« |
« |
« |
« |
0.29 |
« |
« |
« |
0.29 |
0.56 |
0.53 |
1.07 |
2.94 |
|
|
5 |
0.15 |
« |
« |
« |
« |
0.4 |
« |
« |
« |
0.27 |
0.54 |
0.41 |
1.08 |
2.85 |
|
|
Среднее ± СКО |
0.17 ± |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0.27 ± |
0.54 ± |
0.47 ± |
1.2 ± |
2.94 ± |
|
|
Average ± RMS |
0.03 |
0.02 |
0.02 |
0.06 |
0.21 |
0.03 |
|||||||||
|
6 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.89 |
2.83 |
2.72 |
0.38 |
0.77 |
7.59 |
|
|
7 |
« |
« |
« |
« |
« |
« |
« |
« |
0.92 |
2.49 |
2.59 |
0.38 |
0.35 |
6.73 |
|
|
8 |
ДРЖ-1 |
« |
« |
« |
« |
« |
« |
« |
« |
Н. о. |
1.94 |
2.01 |
0.36 |
0.38 |
4.69 |
|
9 |
« |
« |
« |
« |
« |
« |
« |
« |
0.37 |
2.91 |
2.31 |
0.48 |
0.43 |
6.5 |
|
|
10 |
« |
« |
« |
« |
« |
« |
« |
2.53 |
0.36 |
2.46 |
2.82 |
1.79 |
0.33 |
10.29 |
|
|
11 |
« |
« |
« |
« |
« |
« |
« |
н. о. n/d |
н. о. n/d |
2.15 |
2.27 |
0.34 |
0.37 |
5.13 |
|
|
Среднее ± СКО Average ± RMS |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0.42 ± 1.3 |
0.51 ± 0.41 |
2.46 ± 0.36 |
2.45 ± 0.31 |
0.61 ± 0.57 |
0.43 ± 0.17 |
6.82 ± 2.01 |
|
|
12 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.98 |
2.86 |
2.9 |
0.45 |
0.46 |
7.65 |
|
|
13 |
« |
« |
« |
« |
« |
« |
« |
« |
0.66 |
3.73 |
4.53 |
0.63 |
0.66 |
10.21 |
|
|
14 |
ДРЖ-2 |
« |
« |
« |
« |
« |
« |
« |
« |
н. о. |
2.17 |
2.3 |
0.22 |
0.43 |
5.12 |
|
n/d |
|||||||||||||||
|
15 |
« |
« |
1.72 |
1.27 |
« |
« |
« |
« |
« |
2.03 |
1.98 |
0.26 |
0.36 |
7.62 |
|
|
16 |
« |
« |
н. о. n/d |
н. о. n/d |
« |
« |
« |
« |
« |
2.23 |
2.48 |
0.28 |
0.38 |
5.37 |
|
|
17 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
1.74 |
1.78 |
0.45 |
0.23 |
4.2 |
|
|
Среднее ± СКО Average ± RMS |
0 |
0 |
0.29 ± 0.7 |
0.21 ± 0.52 |
0 |
0 |
0 |
0 |
0.27 ± 0.44 |
2.46 ± 0.72 |
2.66 ± 0.99 |
0.38 ± 0.16 |
0.42 ± 0.14 |
6.7 ± 2.22 |
|
|
№ п/п |
Образец Sample |
Si |
Ti |
Cu |
Zn |
Mg |
Ca |
Ba |
Sr |
Na |
K |
P |
S |
Cl |
Сумма Total |
|
18 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
1.02 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
4.59 |
2.59 |
2.69 |
н. о. n/d |
10.89 |
|
|
19 |
« |
« |
« |
« |
3.73 |
« |
« |
« |
« |
6.35 |
4.77 |
4.48 |
0.2 |
19.53 |
|
|
20 |
« |
« |
« |
« |
3.21 |
« |
10.23 |
« |
« |
5.21 |
3.91 |
5.04 |
н. о. n/d |
27.6 |
|
|
21 |
МВД |
2.39 |
« |
« |
« |
н. о. n/d |
« |
н. о. n/d |
« |
« |
3.35 |
0.5 |
1.07 |
« |
7.31 |
|
22 |
3.71 |
« |
« |
« |
« |
« |
« |
« |
« |
3.27 |
0.69 |
1.15 |
« |
8.82 |
|
|
23 |
н. о. n/d |
« |
« |
« |
1.79 |
« |
« |
« |
« |
5.54 |
3.43 |
3.29 |
0.27 |
14.32 |
|
|
24 |
« |
« |
« |
« |
1.87 |
« |
« |
« |
« |
4.82 |
2.91 |
3.38 |
0.21 |
13.19 |
|
|
Среднее ± СКО |
0.87 ± |
0 |
0 |
0 |
1.66 ± |
0 |
1.46 ± |
0 |
0 |
4.73 ± |
2.69 ± |
3.01 ± |
0.1 ± |
14.52 ± |
|
|
Average ± RMS |
1.53 |
1.45 |
3.87 |
1.12 |
1.59 |
1.52 |
0.12 |
7.02 |
|||||||
|
25 |
ПЧИ-1 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.56 |
1.45 |
0.67 |
2.12 |
4.8 |
|
26 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
Н. о. |
0.4 |
0.52 |
3.63 |
4.55 |
|
|
27 |
ПЧИ-2 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.16 |
0.56 |
0.65 |
2.57 |
3.94 |
|
28 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
Н. о. |
0.86 |
0.92 |
3.73 |
5.51 |
|
|
29 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.17 |
0.37 |
0.72 |
2.46 |
3.72 |
|
|
30 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
Н. о. |
0.57 |
0.84 |
1.29 |
2.7 |
|
|
31 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.55 |
0.8 |
0.99 |
2.34 |
|
|
32 |
ПЧИ-3 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.37 |
0.7 |
0.67 |
1.74 |
|
33 |
« |
« |
« |
« |
« |
0.24 |
« |
« |
« |
« |
0.9 |
0.64 |
1.72 |
3.5 |
|
|
34 |
« |
« |
« |
« |
« |
0.19 |
« |
« |
« |
« |
0.8 |
0.79 |
1.84 |
3.62 |
|
|
35 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.29 |
0.42 |
0.33 |
1.04 |
|
|
36 |
ПЧИ-4 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.26 |
0.58 |
2.42 |
3.26 |
|
37 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.27 |
0.44 |
0.68 |
1.39 |
|
|
38 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.52 |
0.56 |
1.85 |
2.93 |
|
|
39 |
« |
« |
« |
« |
« |
0.37 |
« |
« |
« |
0.78 |
1.92 |
0.64 |
2.25 |
5.96 |
|
|
40 |
ПЧИ-5 |
« |
« |
« |
« |
« |
« |
« |
« |
н. о. |
0.2 |
0.26 |
1.34 |
1.8 |
|
|
41 |
« |
« |
« |
« |
« |
0.43 |
« |
« |
« |
0.43 |
2.16 |
0.69 |
2.08 |
5.79 |
|
|
Среднее ± СКО |
0 |
0 |
0 |
0 |
0 |
0.08 ± |
0 |
0 |
0 |
0.1 ± |
0.69 ± |
0.64 ± |
1.87 ± |
3.36 ± |
|
|
Average ± RMS |
0.15 |
0.22 |
0.57 |
0.17 |
0.98 |
1.53 |
|||||||||
|
42 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.48 |
1.72 |
0.35 |
1.52 |
4.07 |
|
|
43 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.32 |
3.19 |
0.54 |
1.22 |
5.27 |
|
|
44 |
ПЧИ-6 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.44 |
0.68 |
0.14 |
1.06 |
2.32 |
|
45 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.18 |
2.17 |
0.64 |
1.79 |
4.78 |
|
|
46 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.18 |
1.79 |
0.34 |
0.79 |
3.1 |
|
|
47 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.25 |
1.85 |
0.45 |
0.75 |
3.3 |
|
Окончание таблицы 2 / End of table 2
|
№ п/п |
Образец Sample |
Si |
Ti |
Cu |
Zn |
Mg |
Ca |
Ba |
Sr |
Na |
K |
P |
S |
Cl |
Сумма Total |
|
48 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.31 |
2 |
0.44 |
0.87 |
3.62 |
|
|
49 |
« |
« |
« |
« |
« |
0.52 |
« |
« |
« |
0.59 |
1.68 |
0.56 |
1.56 |
4.91 |
|
|
50 |
« |
« |
« |
« |
« |
н. о. n/d |
« |
« |
1.07 |
0.68 |
2.89 |
0.6 |
3.13 |
8.37 |
|
|
51 |
0.28 |
« |
« |
« |
« |
« |
« |
« |
н. о. n/d |
0.5 |
2.16 |
0.31 |
1.61 |
4.86 |
|
|
52 |
н. о. n/d |
« |
« |
« |
« |
« |
« |
« |
« |
0.33 |
1.61 |
0.2 |
1.83 |
3.97 |
|
|
53 54 |
ПЧИ-7 |
« « |
« « |
« « |
« « |
« « |
« « |
« « |
« « |
« « |
0.69 0.55 |
1.47 1.54 |
0.4 0.41 |
1.98 2.14 |
4.54 4.64 |
|
55 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.63 |
2.23 |
0.3 |
1.89 |
5.05 |
|
|
56 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.43 |
2 |
0.58 |
2.49 |
5.5 |
|
|
57 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.51 |
2.13 |
0.5 |
2.35 |
5.49 |
|
|
58 |
« |
« |
« |
« |
« |
« |
« |
« |
« |
0.72 |
2.45 |
0.64 |
1.94 |
5.75 |
|
|
59 |
« |
« |
« |
« |
« |
« |
« |
« |
1.4 |
0.93 |
2.41 |
0.5 |
5.64 |
10.88 |
|
|
60 |
« |
« |
« |
« |
« |
« |
« |
« |
н. о. n/d |
0.64 |
2.49 |
0.49 |
1.84 |
5.46 |
|
|
61 |
« |
« |
« |
« |
« |
« |
« |
« |
1.17 |
0.9 |
2.92 |
0.55 |
2.82 |
8.36 |
|
|
Среднее ± СКО |
0.01 ± |
0 |
0 |
0 |
0 |
0.03 ± |
0 |
0 |
0.18 ± |
0.51 ± |
2.07 ± |
0.45 ± |
1.96 ± |
5.21 ± |
|
|
Average ± RMS |
0.06 |
0.12 |
0.45 |
0.22 |
0.58 |
0.14 |
1.08 |
1.99 |
|||||||
|
62 |
ПЧИ-8 |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
н. о. n/d |
0.24 |
0.33 |
1.38 |
1.95 |
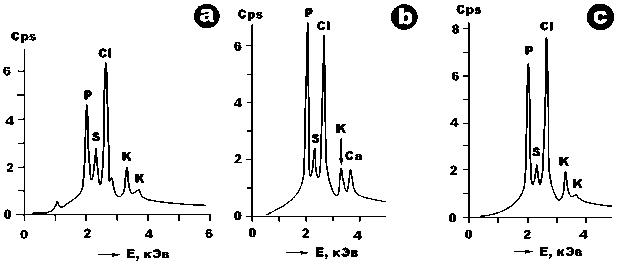
Рис. 10 . Типичные энергодисперсионные спектры, полученные от органического вещества микроорганизмов: a — кишечная палочка, b — холерный вибрион, c — туляремийный микроб
Fig. 10. Typical energy dispersive spectra obtained from organic substances of microorganisms: a — Escherichia coli, b — Vibrio cholerae, c — tularemia microbe лы: K > S > P > Mg >Ba > Si > Cl. Важно подчеркнуть, что в исследованных микроорганизмах неметаллические элементы-примеси характеризуются гораздо большей однородностью распределения (среднее значение коэффициента вариации составляет 57 %), чем металлические (185 %). Это может свидетельствовать о разной степени сродства неорганических элементов с органическим веществом микроорганизмов.
В результате электронно-микроскопических исследований практически во всех микроорганизмах были установлены нанометровые до субмикронных выделения биоминеральных фаз (рис. 11), как раз и концентрирующих отмеченные выше примеси неорганических элементов. Так, в псевдомонадах установлены кальцит Ca[CO3] и гидрогенфосфат магния H1.1—1.16 Mg0.9—0.95 [PO4]. В патогенных бактериях (кишечная па-

Рис. 11 . Внутреннее строение и наномикроразмерные биоминеральные фазы в составе микроорганизмов: a — псевдомонады; b — дрожжи; c, d — кишечная палочка; e, f — холерный вибрион, выделения гипса на поверхности колонии; g, h — туляремийный микроб, соответственно нановыделения латуни и гипс внутри колонии; k, l — золотистый стафилококк, соответственно нановыделения бадделеита и микросростки гипса внутри колонии. СЭМ-изображения в режимах вторичных (a—c, e—g, i, j, l) и упругоотраженных (d, h, k) электронов
Fig. 11. Internal structure and nano-micro-sized biomineral phases in the composition of microorganisms: a — pseudomonas; b — yeast; c, d — Escherichia coli; e, f — Vibrio cholera, — gypsum secretions on the surface of the colony; g, h — tularemia microbe, respectively, nano-emission of brass and gypsum inside the colony; k, l — Staphylococcus aureus, respectively, nanoemission of baddeleyite and micro-growth of gypsum inside the colony. SEM images in the modes of secondary (a—c, e—g, i, j, l) and elastically reflected (d, h, k) electrons лочка, холерный вибрион, туляремийный микроб и золотистый стафилококк) обнаружены галит NaCl (большей частью на поверхности штаммов), кальцит, доломит CaMg[CO3]2, каолинит Al4[Si4O10](OH)8, бадделеит ZrO2 и металлический сплав латунного состава Cu0.55—0.67Zn0.36—0.45 (рис. 12). В дрожжах Rhodotorula glutinis выявлены два гидрогенсульфатфосфата бария: 1) H0.31—0.58(Ba2.1—2.17Cu0.08—0.1K0.04—0.06Zn0—0.07)2.24—2.31 [PO4]1 02—1.04[SO4]0.96—0.98 или с целочисленными коэффициентами — H2Ba9 [PO4]4[SO4]4 и 2) H2.42(Ba0.95 K0.49Cu0.08 Zn0.07)1.59[PO4]1.11[SO4]0.89 или H21—22 (Ba8.5—9K4—4.5(Cu,Zn)1—1.5)14—14.5[PO4]10[SO4]8. Кроме того, здесь же зарегистрированы два фосфатсульфата бария:
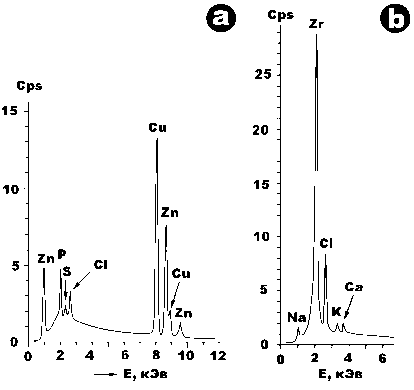
Рис. 12 . Энергодисперсионные спектры, полученные от микровыделений латунного сплава (a) и бадделеита (b) в органическом веществе соответственно туляремийного микроба и золотистого стафилококка
Fig. 12 . Energy dispersive spectra obtained from microprecipitations brass alloy (a) and baddeleyite (b) in organic matter, respectively tularemia microbe and Staphylococcus aureus
-
1) (Ba 1.33—1.46 K 0.04—0.21 ) 1.37—1.67 [SO 4 ] 0.74—0.88 [PO4]0.12—0.16(OH)0.74—1.01 или с целочисленными коэффициентами — (Ba22K)23 [SO4]12[PO4]2.5(OH)13.5 и 2) (Ba 3.04—3.86 K 0.07—0.01 ) [PO 4 ] 0.91—0.92 [SO 4 ] 1.08—1.09 или H 17—20 (Ba 24—27 K 0.5—1 ) 25—27.5 [PO 4 ] 6.5—7.5 [SO 4 ] 7.5—9 (OH) 17—20 . В хлорелле выявлены гидрогенсульфатфосфаты H 0.51—2.88 (K 0.57—1.5 Mg 0.45—0.74 Ba 0—1.28 ) 1.63—2.66 [PO 4 ] 0.54—1.05 [SO4]0.95—1.46 или с целочисленными коэффициентами — H 1.5 (K 1—9 Mg 1—4 Ba 0—2.5 ) 4.5—13 [PO 4 ] 1—6.5 [SO 4 ] 2—6 .
Следует подчеркнуть, что отмеченный выше факт обнаружения в микроорганизмах естественных для них биоминералов не является пионерским. Ранее сульфаты, карбонаты, пирит, оксигидроксиды железа, самородно-металлические фазы и металлоорганические соединения с Cu, Fe, Cr, Ni, Mn, Al, Au уже отмечались как компоненты бактериальных клеток в пигментном холелите [10].
Микроэлементы
Содержание микроэлементов в исследованных микроорганизмах определялось высокочувствитель- ным методом масс-спектрометрии с индуктивно связанной плазмой. В результате проведенного анализа в составе объектов были установлены 45 микроэлементов, суммарная концентрация которых варьируется в диапазоне 0.003—0.26 мас. % (табл. 3). В направлении роста этой концентрации проанализированные микроорганизмы образуют следующую последовательность: туляремийный микроб < холерный вибрион < кишечная палочка < золотистый стафилококк << оригинальный штамм холерного вибриона (ПЧИ-5) < дрожжи < псевдомонадные бактерии << хлорелла. В целом распределение микроэлементов в изученных микроорганизмах согласуется с универсальным законом их распределения в природных объектах в зависимости от атомных масс: в направлении от легких к тяжелым содержание микроэлементов в бактериях сокращается [18].
В связи с известным фактом прогрессивного накопления микроэлементов в органическом веществе и костях при фоссилизации значительный интерес представляет сопоставление степени обогащения микроэлементами исследованных микроорганизмов и органических тканей ископаемых животных. Сравнение показало, что суммы микроэлементов даже в хорошо сохранившихся органических тканях предголоцено-вого мамонта системно сдвинуты относительно современных микроорганизмов в сторону значительно больших концентраций (рис. 13).
Расчеты отношений биокларков (средних содержаний в бактериях и наземных растениях) к их кларкам в терригенных горных породах [11] позволяет подразделить элементы по степени сродства к биоорга-ническому веществу на три группы (рис. 14): 1) эссенциальные — жизненно необходимые и потому концентрирующиеся в организмах; 2) функционально-активные — промежуточные по характеру распределения между организмами и горными породами; 3) абиотические — концентрирующиеся в горных породах и большей частью токсичные для организмов. Применительно к исследованным микроорганизмам функциональный состав микроэлементов выглядит следующим образом: эссенциальных элементов в них 9 (Zn, As, Se, Rb, Mo, Ag, Cd, Pb, Bi); физиогенно-актив-ных — 17 (Li, Ti, V, Cr, Mn, Co, Ni, Cu, Ga, Sr, Y, Zr, Sn, Sb, Cs, Ba, U); абиотических — 19 ((B, Sc, Nb, W, Tl, лантаноиды). Групповые содержания и пропорции между ними в составе исследованных образцов широко варьируются, но при этом сохраняется принцип подавляющего преобладания эссенциальных элементов над абиотическими (среднее отношение Э/АБ = 196 ± ± 153), что отражает, очевидно, естественное состояние нефоссилизированных организмов. Например, для фоссилизированных тканей предголоценового мамонта эти значения на 1—2 порядка ниже. Тем не менее между собой исследованные нами микроорганизмы по величине коэффициента Э/АБ несколько различаются, выстраиваясь в следующую последовательность его уменьшения: дрожжи > холерный вибрион > хлорелла > кишечная палочка > туляремийный микроб > псевдомонады > золотистый стафилококк. Обращает также на себя внимание, что бактерии, выращенные в стерильных условиях, и микроорганизмы, выделенные из почв (псевдомонады, дрожжи, хлорелла), по этому коэффициенту системно не различаются.
Таблица 3. Содержание микроэлементов в исследованных микроорганизмах, мг/т
Table 3. The content of trace elements in the studied microorganisms, ppb
|
Элементы Elements |
БАК-1 |
БАК-2 |
ДРЖ-1 |
ДРЖ-2 |
МВД-1 |
МВД-2 |
ПЧИ-1 |
ПЧИ-2 |
ПЧИ-3 |
ПЧИ-4 |
ПЧИ-5 |
ПЧИ-6 |
ПЧИ-7 |
ПЧИ-8 |
|
Li |
12 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
260 |
209 |
43 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
819 |
|
B |
н. о. / n/d |
« |
« |
« |
10580 |
621 |
н. о. / n/d |
« |
« |
« |
« |
« |
« |
|
|
Sc |
« |
« |
« |
« |
н. о. / n/d |
н. о. / n/d |
« |
« |
« |
« |
22 |
« |
« |
« |
|
Ti |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
126705 |
« |
« |
« |
|
V |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
10754 |
« |
« |
« |
|
Cr |
« |
1566 |
205 |
236 |
« |
621 |
« |
« |
3129 |
39921 |
128 |
1166 |
3217 |
|
|
Mn |
10296 |
487 |
7370 |
6589 |
9008 |
7175 |
2353 |
1876 |
2146 |
1931 |
23369 |
800 |
1011 |
3885 |
|
Co |
н. о. / n/d |
27 |
4 |
н. о. / n/d |
8 |
н. о. / n/d |
42 |
14 |
8 |
15 |
1045 |
н. о. |
14 |
85 |
|
Ni |
2811 |
716 |
914 |
1442 |
1713 |
1699 |
396 |
5734 |
2003 |
1005 |
17107 |
1927 |
855 |
2738 |
|
Cu |
2435 |
6907 |
637 |
1492 |
6460 |
3192 |
1501 |
5536 |
2661 |
2204 |
83303 |
6242 |
4714 |
6365 |
|
Zn |
н. о. |
н. о. |
н. о. |
н. о. |
1352189 |
146032 |
33832 |
16624 |
15058 |
21009 |
42662 |
13625 |
16670 |
10735 |
|
Ga |
261 |
43 |
159 |
126 |
262 |
222 |
127 |
70 |
73 |
47 |
534 |
169 |
207 |
277 |
|
As |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
886 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
1843 |
320 |
332 |
582 |
|
Se |
« |
« |
« |
« |
« |
« |
1025 |
« |
« |
« |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
2994 |
|
Rb |
3506 |
2063 |
777 |
634 |
10442 |
12496 |
721 |
140 |
87 |
25 |
2968 |
226 |
794 |
1147 |
|
Sr |
69816 |
5935 |
7569 |
7235 |
8834 |
7032 |
12168 |
4759 |
3707 |
3967 |
2677 |
1627 |
1537 |
36250 |
|
Y |
7 |
8 |
28 |
28 |
41 |
28 |
27 |
173 |
25 |
64 |
||||
|
Zr |
362 |
335 |
334 |
|||||||||||
|
Nb |
92 |
44 |
103 |
« |
25 |
« |
« |
« |
130 |
« |
« |
« |
||
|
Mo |
1695 |
2079 |
6180 |
5669 |
2103 |
562 |
453 |
« |
« |
« |
137 |
« |
« |
735 |
|
Ag |
7736 |
37 |
752 |
4220 |
575 |
2208 |
200 |
854 |
338 |
121 |
95 |
269 |
187 |
425 |
|
Cd |
188 |
261 |
97 |
289 |
163 |
282 |
112 |
190 |
277 |
161 |
205 |
278 |
205 |
128 |
|
Sn |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
52 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
22 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
|
Sb |
« |
« |
« |
« |
43 |
« |
126 |
« |
« |
« |
81 |
« |
10 |
« |
|
Cs |
22 |
27 |
н. о. / n/d |
7 |
« |
« |
« |
27 |
« |
3 |
14 |
|||
|
Ba |
415747 |
25327 |
89023 |
480467 |
1166984 |
243046 |
3161 |
19797 |
13095 |
14678 |
13597 |
7382 |
8373 |
10953 |
|
La |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
39 |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
83 |
|
Ce |
« |
« |
« |
« |
« |
« |
69 |
« |
« |
« |
« |
« |
« |
254 |
|
Pr |
« |
« |
« |
« |
« |
« |
16 |
« |
« |
« |
« |
« |
« |
53 |
|
Nd |
« |
« |
« |
« |
« |
« |
76 |
« |
« |
« |
« |
« |
« |
267 |
|
Sm |
« |
« |
« |
« |
« |
« |
н. о. / n/d |
« |
« |
« |
« |
« |
« |
72 |
|
Eu |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
32 |
|
Gd |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
74 |
|
Tb |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
10 |
|
Dy |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
40 |
|
Ho |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
8 |
|
Er |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
17 |
|
Tm |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
2 |
|
Yb |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
14 |
Окончание таблицы 3 / End of table 3
|
Элементы Elements |
БАК-1 |
БАК-2 |
ДРЖ-1 |
ДРЖ-2 |
МВД-1 |
МВД-2 |
ПЧИ-1 |
ПЧИ-2 |
ПЧИ-3 |
ПЧИ-4 |
ПЧИ-5 |
ПЧИ-6 |
ПЧИ-7 |
ПЧИ-8 |
|
Lu |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
« |
2 |
|
W |
3 |
« |
« |
« |
61 |
23 |
27 |
« |
77 |
84 |
108 |
« |
155 |
424 |
|
Tl |
173 |
24 |
« |
« |
« |
« |
28 |
« |
н. о. / n/d |
н. о. / n/d |
17 |
« |
8 |
12 |
|
Pb |
932 |
896 |
162 |
388 |
1914 |
480 |
1155 |
2768 |
1691 |
1971 |
2043 |
457 |
268 |
1334 |
|
Bi |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
н. о. / n/d |
9 |
н. о. / n/d |
21 |
544 |
558 |
404 |
261 |
н. о. |
н. о. |
24 |
|
U |
« |
23 |
27 |
25 |
104 |
27 |
н. о. |
н. о. |
н. о. |
н. о. |
27 |
« |
4 |
128 |
|
Сумма Total |
515633 |
46418 |
114337 |
508628 |
2572466 |
425306 |
59258 |
58947 |
41807 |
50800 |
370145 |
33475 |
36513 |
84263 |
|
Эссенциалы (ЭС) Essentials |
14057 |
5359 |
7995 |
11225 |
1367499 |
162087 |
38405 |
21120 |
18009 |
23691 |
50214 |
15175 |
18460 |
18232 |
|
Физиогенно-активные (ФА) |
501400 |
41058 |
106277 |
497384 |
1194327 |
262602 |
20573 |
37827 |
23721 |
27025 |
319654 |
18300 |
17894 |
64795 |
|
Physiogenically active |
||||||||||||||
|
Антибионты (АБ) Antiobionts |
176 |
н. о. / n/d |
65 |
19 |
10640 |
617 |
280 |
н. о. / n/d |
77 |
84 |
277 |
н. о. / n/d |
159 |
1236 |
|
ЭС/АБ Essentials/Antiobionts |
80 |
н. о. / n/d |
123 |
591 |
129 |
263 |
137 |
н. о. / n/d |
234 |
282 |
181 |
н. о. / n/d |
116 |
15 |

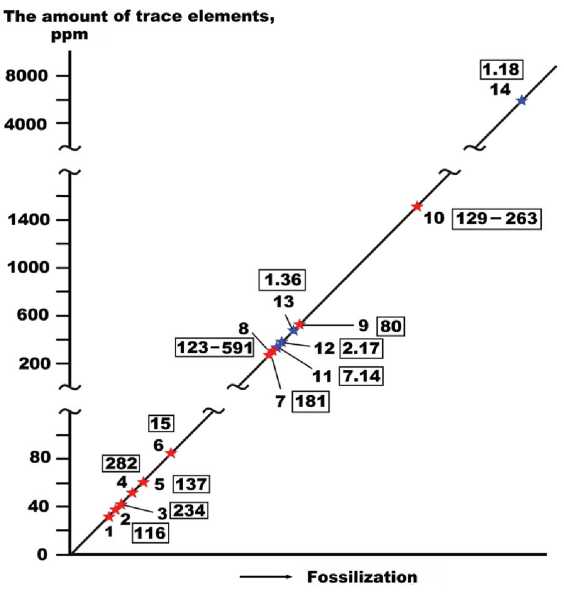
Рис. 13 . Вариации суммарной концентрации микроэлементов в исследованных микроорганизмах и фоссилизи-рованных органических тканях таймырского предголо-ценового мамонта. Микроорганизмы: 1, 2 — туляремийный микроб; 3, 4 — холерный вибрион; 5 — холерный вибрион и кишечная палочка; 6 — золотистый стафилококк; 7 — аномальный Vibrio cholera Eltor 19430; 8 — дрожжи; 9 — псевдомонады; 10 — хлорелла. Ткани мамонта: 11 — волосы; 12 — кожа; 13 — жировая ткань; 14 — мышечная ткань. В рамках приведены значения Э/АБ
Fig. 13 . Variations in the total concentration of trace elements in the studied microorganisms and fossilized organic tissues of the Taimyr pre-Holocene mammoth. Microorganisms: 1, 2 — tularemia microbe; 3, 4 — Vibrio cholerae ; 5 — Vibrio cholerae and Escherichia coli ; 6 — Staphylococcus aureus ; 7 — abnormal Vibrio cholerae Eltor 19430; 8 — yeast; 9 — pseudomonas; 10 — chlorella. Mammoth tissues: 11 — hair; 12 — leather; 13 — adipose tissue; 14 — muscle tissue. The frames show E/AB values
Корреляционный анализ показывает, что около 62 % микроэлементов в составе исследованных микроорганизмов связаны между собой сильными положительными связями (коэффициенты парной корреляции колеблются от 0.3 до 1). В целом выявляется шесть групп таких элементов: 1) Sc, Ti, V, Cr, Mn, Co, Ni, Cu, Ga, As, Sr, Y, Zr, Nb, Sb, Cs, Pb, Mo; 2) W, Ga, As, Se, Y, Bi; 3) Sr, Sc, Se, U, W; 4) Zn, Rb, Zr, Nb, Sn, Ba, U, W; 5) Sr, Zr, Ag, Cs, Tl; 6) Mo, Ag, Ba. При этом в число положительно связанных между собой элементов входят 8 из 9 (89 %) эссенциалов, 16 из 17 (94 %) физиогенно-актив-ных и только 4 из 19 (21 %) антибионтов. Из чего следует, что увязанными между собой в составе микроорганизмов являются преимущественно эссенциальные и физиогенно-активные микроэлементы, и лишь изредка антибиотические.
Сравнительный анализ показал, что исследованные образцы микроорганизмов различаются не только по суммарным и групповым содержаниям, но и по ассоциациям наиболее характерных (типоморфных) для них микроэлементов. Так, для псевдомонад в качестве типоморфных выступают Mn, Sr, Ag, Ba, Tl. В образце псевдомонад после опыта биоочистки к ним добавился Cr. В дрожжах в качестве типоморфных зарегистрированы Mn, Mo, Ba, Ag. Для хлореллы характерны Li, B, Mn, Cu, Zn, Rb, Ag, Ba, U, а для кишечной палочки — Zn, As, Se, Sb, La, Ce, Pr, Nd (при сумме лантаноидов около 200 мг/т). В большинстве образцов холерного вибриона в качестве типоморфных содержатся Ni, Cu, Y, Pb, Bi, Cr. При этом в одном штамме из четырех изученных (ПЧИ-5) обнаружилась гораздо более широкая ассоциация таких элементов — Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ga, As, Rb, Y, Zr, Nb, Sb, W, Pb. Для туляремийного микроба типичными оказались только Cu и W. Наконец, золотистый стафилококк — единственная в нашем случае грамположительная бактерия — содержит наиболее широкую группу типоморфных микроэлементов, включающую Li, Cr, Co, Ni, Cu,
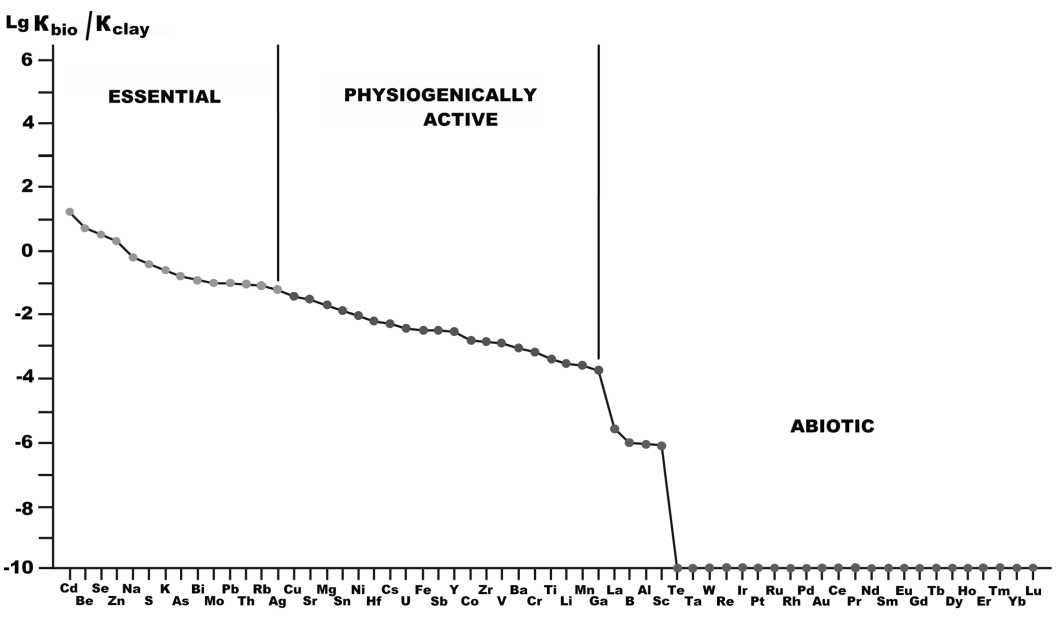
Рис. 14. Функциональные группы микроэлементов в живых организмах. На ординате показаны логарифмы отношений кларков химических элементов в наземных растениях и в терригенных породах
Fig. 14. Functional groups of trace elements in living organisms. The ordinate — logarithms of the ratio of the clarkes of chemical elements in terrestrial plants and in terrigenous rocks
As, Se, Sr, Y, Mo, W, Pb, U и даже все лантаноиды. Последнее особенно примечательно, поскольку именно лантаноиды являются наиболее токсичными для живых организмов абиотическими элементами.
Элементный и аминокислотный состав органического вещества
Состав органического вещества хорошо тестируется термическим анализом. Полученные нами данные показали, что нагревание вещества микроорганизмов сопровождается несколькими этапами термических превращений (рис. 15). В интервале 90—190 °С происходит низкотемпературная дегидратация, представленная одним-двумя небольшими эндотермическими эффектами. При больших температурах осуществляется термическое окисление, отражающееся серией экзотермических эффектов и значительной потерей массы. На первом этапе окисляется углеводно-липидная (жировая) компонента органического вещества, выгорающая в интервале 260—370 °С с образованием на кривой нагревания нескольких экзотермических пиков, интенсивность которых повышается с ростом температуры. Второй этап окисления приходится на диапазон 390—560 °С и соответствует выгоранию белковой компоненты органического вещества, которое тоже протекает неравномерно с образованием двух-трех экзотермических эффектов разной интенсивности. Среди последних эффект с максимумом при 550—560 °С демонстрирует максимальную интенсивность.
Следует подчеркнуть, что в картине термических преобразований исследованных микроорганизмов сильно преобладают эффекты выгорания именно белковой составляющей при сохранении высокой температуры ее окисления, что разительно отличается от соответствующих картин термического окисления существенно фоссилизированных биоорганических веществ. В последнем случае эффект выгорания часто сводит-
ся к практически единичному экзотермическому эффекту средней интенсивности в области относительно низких температур 300—350 °С.
Сравнительный анализ приводит к выводу, что большинство проанализированных микроорганизмов характеризуются близкими термическими свойствами. Исключением являются два образца. Это, во-первых, холерный вибрион, на кривой нагревания которого в интервале выгорания белковой компоненты наблюдается лишь единичный весьма интенсивный эндотермический пик с максимумом при 372 °С. А во-вторых — хлорелла, на кривой нагревания которой доминирует один очень узкий и интенсивный пик с максимумом при 370 °С.
Непосредственно элементный состав органического вещества микроорганизмов анализировался методом аналитической СЭМ с использованием ЭДС-спектрометра Х-max 50. Согласно полученным данным (табл. 4), исследованные образцы широко варьируются по составу, особенно в части содержания азота. Очевидно, что это обусловлено колебанием пропорции между белковой (азотсодержащей) и жировой компонентами. Судя по отношению N/C, исследованные микроорганизмы по признаку «белковости» могут быть сведены в следующую последовательность: псевдомонады > кишечная палочка > туляремийный микроб > холерный вибрион > хлорелла > золотистый стафилококк > дрожжи. Наиболее однородными по этому признаку являются холерный вибрион и кишечная палочка, а самыми неоднородными — дрожжи и туляремийный микроб.
На соответствующей диаграмме (рис. 14, а) эта последовательность подтверждается и хорошо иллюстрируется статистическими полями состава микроорганизмов. Сопоставление данных по исследованным образцам с рядом важных природных органических веществ (рис. 14, б) приводит к следующим выводам. Во-первых, изученные микроорганизмы действительно имеют смешанный жиробелковый состав, о чем сви-
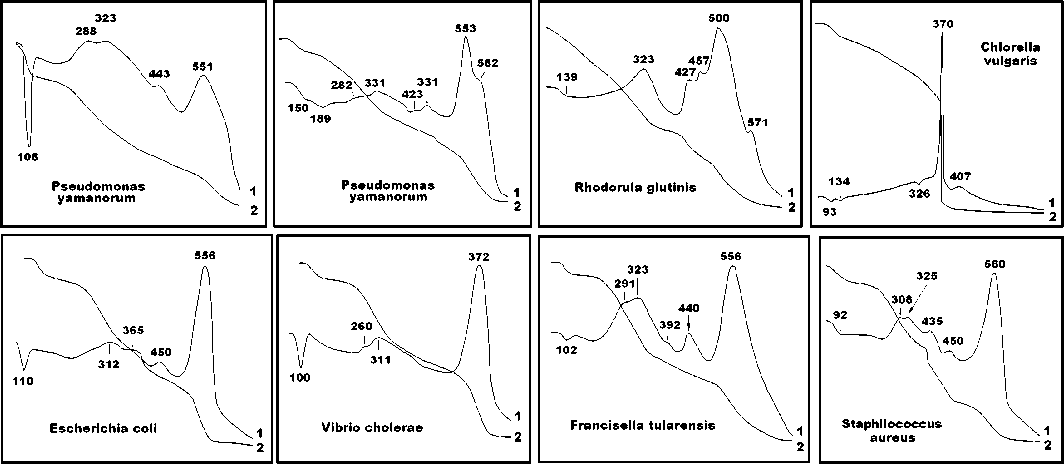
Рис. 15. Типичные кривые нагревания (1) и потери веса (2), полученные в ходе термического анализа микроорганизмов
Fig. 1 5. Typical curves of heating (1) and weight loss (2) obtained during thermal analysis of microorganisms
Таблица 4. Элементный состав исследованных микрорганизмов, мас. %
Table 4. Elemental composition of the studied microorganisms, wt. %
|
Образец / Sample |
С |
N |
O |
N/C |
|
БАК-1 Pseudomonas yamanorum sp. |
60.40 |
20.73 |
18.87 |
0.34 |
|
« |
67.0 |
24.24 |
8.71 |
0.36 |
|
БАК-2 Pseudomonas yamanorum sp. |
82.50 |
11.11 |
6.39 |
0.13 |
|
« |
75.89 |
11.86 |
12.25 |
0.16 |
|
Среднее ± СКО (коэффициент вариации, %) Average ± RMS (variation coefficient, %) |
71.45 ± 9.72 (14) |
16.99 ± 6.52 (38) |
11.56 ± 5.44 (47) |
0.25 ± 0.12 (48) |
|
ДРЖ-1 Rhodorula glutinis |
83.35 |
2.21 |
14.44 |
0.03 |
|
« |
73.05 |
5.58 |
21.37 |
0.08 |
|
« |
67.98 |
5.92 |
26.10 |
0.09 |
|
« |
74.45 |
5.99 |
19.56 |
0.08 |
|
ДРЖ-2 Rhodorula glutinis |
81.91 |
4.30 |
13.19 |
0.05 |
|
« |
73.42 |
6.26 |
20.32 |
0.08 |
|
« |
85.37 |
4.16 |
10.47 |
0.05 |
|
« |
55.19 |
12.25 |
28.56 |
0.22 |
|
« |
65.50 |
11.20 |
23.30 |
0.17 |
|
Среднее ± СКО / Average ± RMS |
73.36 ± 9.61 (13) |
6.43 ± 3.27(51) |
19.7 ± 6.03 (31) |
0.09 ± 0.06 (67) |
|
МВД-1 Chlorella vulgaris |
64.49 |
16.30 |
19.21 |
0.25 |
|
« |
72.12 |
8.02 |
19.86 |
0.19 |
|
МВД-2 Chlorella vulgaris |
41.43 |
6.94 |
51.63 |
0.17 |
|
« |
92.47 |
4.15 |
3.38 |
0.04 |
|
Среднее ± СКО / Average ± RMS |
67.63 ± 21.08 (31) |
8.85 ± 5.23 (59) |
23.52 ± 20.23 (86) |
0.16 ± 0.09 (56) |
|
ПЧИ-1 Escherichia coli |
78.01 |
13.76 |
8.23 |
0.18 |
|
« |
66.08 |
18.78 |
15.14 |
0.28 |
|
Среднее ± СКО (коэффициент вариации, %) Average ± RMS (variation coefficient, %) |
72.05 ± 8.44(12) |
16.27 ± 3.55 (22) |
11.68 ± 4.89 (42) |
0.23 ± 0.07 (30) |
|
ПЧИ-2 Vibrio Cholerae 0139 |
84.22 |
10.82 |
4.96 |
0.13 |
|
« |
78.54 |
14.17 |
7.29 |
0.18 |
|
« |
70.47 |
18.14 |
11.39 |
0.26 |
|
« |
81.73 |
10.26 |
8.01 |
0.13 |
|
« |
84.44 |
9.28 |
6.28 |
0.11 |
|
« |
80.08 |
13.14 |
6.78 |
0.16 |
|
ПЧИ-3 Vibrio Cholerae 0139 |
78.22 |
12.11 |
9.67 |
0.15 |
|
« |
79.31 |
14.69 |
6.00 |
0.19 |
|
ПЧИ-4 Vibrio Cholerae Eltor |
74.42 |
14.37 |
11.21 |
0.19 |
|
« |
72.43 |
19.22 |
8.35 |
0.27 |
|
ПЧИ-5 Vibrio Cholerae Eltor |
71.43 |
15.87 |
12.70 |
0.22 |
|
Среднее ± СКО (коэффициент вариации, %) Average ± RMS (variation coefficient, %) |
77.75 ± 4.94(6) |
13.82 ± 3.14 (23) |
8.42 ± 2.51 (30) |
0.18 ± 0.05 (28) |
|
ПЧИ-6 Francisella tula rensis |
62.15 |
19.09 |
18.76 |
0.31 |
|
« |
77.74 |
10.27 |
11.99 |
0.13 |
|
« |
53.78 |
24.59 |
21.63 |
0.46 |
|
« |
70.27 |
13.31 |
16.42 |
0.19 |
|
« |
86.74 |
6.24 |
7.02 |
0.07 |
|
ПЧИ-7 Francisella tulare nsis |
69.50 |
15.42 |
15.08 |
0.22 |
|
Среднее ± СКО (коэффициент вариации, %) Average ± RMS (variation coefficient, %) |
70.03 ± 11.53 (16) |
14.85 ± 6.49 (44) |
15.15 ± 5.15 (342) |
0.23 ± 0.14 (61) |
|
ПЧИ-8 Staphylococcus aureu s |
76.96 |
11.82 |
11.22 |
0.15 |
Рис. 16 . Элементный состав органического вещества в исследованных микроорганизмах и ряда эталонных углеродных веществ. Поля и точки на a : 1, 2 — псевдомонады; 3 — кишечная палочка; 4 — туляремийный микроб; 5 — холерный вибрион; 6 — хлорелла; 7 — золотистый стафилококк; 8, 9 — дрожжи. Поля и точка на b : БАК — исследованные микроорганизмы; В — воски; С — смолы; Ж — жиры + углеводы; Б — белки; Лиг — лигнин; Ц — целлюлоза; ЗП — зоопланктон; ФП — фитопланктон; ЗБ — зообентос; ФБ — фитобентос; 1—7 — частицы и нитевидные формы абиогенных органоидов в продуктах современного вулканизма; М, Х, Б — углеродное вещество в метеоритах Мокойа, Харипура, Коккевельд
Fig. 16. Elemental composition of organic matter in the studied microorganisms and a number of reference carbon substances. Fields and points on a : 1, 2 — pseudomonads; 3 — Escherichia coli ; 4 — tularemia microbe; 5 — Vibrio cholerae ; 6 — chlorella; 7 — Staphylococcus aureus ; 8, 9 — yeast. Fields and point on b : БАК — investigated microorganisms; B — waxes; C — resin; Ж — fats + carbohydrates; Б — proteins; Лиг — lignin; Ц — cellulose; ЗП — zooplankton; ФП — phytoplankton; ЗБ — zoobenthos; ФБ — phytobenthos; 1—7 — particles and filamentous forms of abiogenic organelles in the products of modern volcanism; M, X, Б — carbon matter in the Mokoia, Haripura, Kokkeveld meteorites
Таблица 5. Основные полосы ИК-поглощения в микроорганизмах
Table 5. Main IR absorption bands in microorganisms
|
Положение максимумов, см–1 Position of maxima, cm–1 |
Интерпретация Interpretation |
Привязка к функциональным группам Linking to functional groups |
Обозначения на графиках (рис. 1, 2) Legend on the graphs (Fig. 1, 2) |
|
614 |
Деформационные колебания химических связей С–Н Bending vibrations of С–Н chemical bonds |
Ароматические Aromatic |
АР |
|
600—700 |
Внеплоскостные колебания химических связей С–С Out-of-plane vibrations of C–C chemical bonds |
« |
« |
|
890 |
Деформационные колебания химических связей С–Н Bending vibrations of С–Н chemical bonds |
« |
« |
|
700—1360 |
Деформационные колебания химических связей в полимерных цепях –СН2=СН2=СН2– и –СН2–СН3–СН3–СН2– Bending vibrations of chemical bonds in polymer chains –СН2=СН2=СН2– and –СН2–СН3–СН3–СН2– |
Алифатические Aliphatic |
АЛ |
|
980—990 |
Внеплоскостные колебания ОН-ионов в карбоновых кислотах Out-of-plane vibrations of OH-ions in carboxylic acids |
Фенольные гидроксилы или спирты Phenolic hydroxyls or alcohols |
Ф |
|
1000—1055 |
Валентные колебания химических связей С–О и С–С в скелете молекул углеводов Stretching vibrations of C–O and C–C chemical bonds in the skeleton of carbohydrate molecules |
« |
« |
|
1123 |
Валентные колебания связей С–О–С Stretching vibrations of С–О–С bonds |
Алифатические Aliphatic |
АЛ |
|
1140—1160 |
Валентные колебания С–О или деформационные колебания ОН-ионов Stretching vibrations of C–O or bending vibrations of OH-ions |
Простые эфиры или спирты Ethers or alcohols |
Э |
|
1116—1164 |
Валентные колебания химических связей С=О Stretching vibrations of chemical bonds C=O |
Карбонильные Carbonyl |
К |
Продолжение таблицы 5 / Continuation of table 5
|
Положение максимумов, см–1 Position of maxima, cm–1 |
Интерпретация Interpretation |
Привязка к функциональным группам Linking to functional groups |
Обозначения на графиках (рис. 1, 2) Legend on the graphs (Fig. 1, 2) |
|
1240 |
Деформационные колебания химических связей СН2 в цепочках СН2(ОН)–СО–СН2(ОН) Bending vibrations of СН2 chemical bonds in СН2(ОН)–СО– СН2(ОН) chains |
Алифатические Aliphatic |
АЛ |
|
1250—1279 |
Валентные колебания химических связей С–О Stretching vibrations of C–O chemical bonds |
Карбонильные Carbonyl |
К |
|
1327—1370 |
Деформационные колебания ОН-ионов в цепочках СН2(ОН)–СО–СН2(ОН) Bending vibrations of OH ions in СН2(ОН)–СО–СН2(ОН) chains |
Алифатические Aliphatic |
АЛ |
|
1300—1440 |
Деформационные колебания химических связей СН2 и СН3 Bending vibrations of CH2 and CH3 chemical bonds |
« |
« |
|
1550—1570 |
Деформационные колебания химических связей NH Bending vibrations of chemical bonds NH |
Группа аминов –амид II Amine group — amide II |
АМ |
|
1590—1600 |
Плоскостные колебания скелета С=С In plane vibrations of the skeleton C=C |
Ароматические Aromatic |
АР |
|
1620 |
Деформационные колебания химических связей в молекулах Н2О Bending vibrations of chemical bonds in H2O molecules |
Гидроксильные Hydroxyl |
Г |
|
1630—1640 |
Деформационные колебания химических связей СО–ОН Bending vibrations of CO–OH chemical bonds |
Группа аминов — амид I Amine group — amide I |
АМ |
|
1654 |
Валентные колебания химических связей С=О Stretching vibrations of chemical bonds C=O |
Карбонильные Carbonyl |
К |
|
1700—1800 |
Валентные колебания С=О Stretching vibrations C=O |
« |
« |
|
2100—2300 |
Валентные колебания химических связей С=С=С, NH=C=O или тройных связей С ≡ С, С ≡ N Stretching vibrations of chemical bonds С=С=С, NH=C=O or triple bonds С ≡ С, С ≡ N |
Алленовые Allenic |
АЛЛ |
|
2130—2360 |
Валентные колебания химических связей в группах СН и СН2 Stretching vibrations of chemical bonds in CH and CH2 groups |
Алифатические Aliphatic |
АЛ |
|
2400—245 |
Колебания связанной группы –NH при образовании водородной связи NH…O=C Vibrations of the bound –NH group during the formation of the NH… O=C hydrogen bond |
Группа аминов Amine group |
АМ |
|
2800—2950 |
Валентные колебания химических связей в СН2 и СН3 Stretching vibrations of chemical bonds in CH2 and CH3 |
Алифатические Aliphatic |
АЛ |
|
3000—3500 |
Валентные колебания химических связей в NH и ОН Stretching vibrations of chemical bonds in NH and OH |
Группы аминов — амиды I и II Amine groups — amide I and II |
АМ |
|
3200—3400 |
Валентные колебания гидроксил-ионов, участвующих в межмолекулярных и внутримолекулярных водородных связях Stretching vibrations of hydroxyl ions involved in intermolecular and intramolecular hydrogen bonds |
Гидроксильные Hydroxyl |
Г |
|
3255 |
Валентные колебания связанной группы –NH Stretching vibrations of a bound group –NH |
Группа аминов Amine group |
АМ |
|
3584 |
Валентные колебания свободных групп –NH или колебания внутримолекулярных ОН-ионов Stretching vibrations of free groups –NH or vibrations of intramolecular OH-ions |
Группы аминов и гидроксил-ионы Amine groups and hydroxyl-ions |
АМ + Г |
|
4012—4053 |
Составные колебания химических связей –СН Compound vibrations of chemical bonds –CH |
Алифатические Aliphatic |
АЛ |
|
4160—4380 |
Составные колебания химических связей –СН2 Compound vibrations of chemical bonds –CH2 |
« |
« |
Окончание таблицы 5 / End of table 5
Молекулярный состав микроорганизмов анализировался ИК-спектроскопическим методом. В результате этого в спектрах ИК-поглощения исследованных образцов было зарегистрировано 38 полос (табл. 5), включая 27 полос в средней ИК-области (400—4000 см–1) и 11 полос в ближней (4000—14000 см–1). Проведенный анализ показал, что по спектроскопическим данным в составе микроорганизмов присутствуют до 8 функциональных групп (в скобках число ИК-полос в %): алифатических (31.7), аминов (24.4), ароматических (12.2), гидроксильных (12.2), карбонильных (9.8), фенольных (2.4), алленовых (2.4), простых эфиров (2.4).
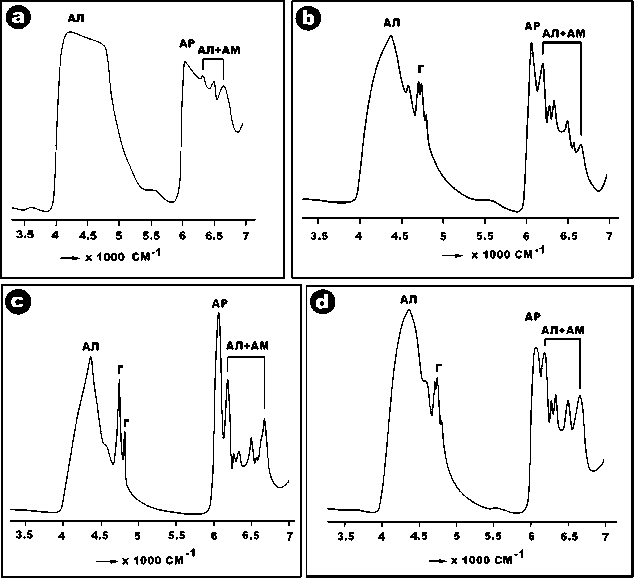
Наиболее сильное и дифференцированное поглощение проявилось в ближней ИК-области (рис. 17, 18). Выявленная картина оказалась для исследованных микроорганизмов однообразной. Во всех полученных спектрах область ИК-поглощения распадается на две части: 1) 3500—5500 см–1, где регистрируются уширенные полосы алифатических и гидроксильных групп, и 2) 6000—7000 см–1, где комбинируются более узкие и хорошо дифференцированные полосы алифатических, ароматических групп и аминов.
Непосредственный анализ аминокислотного состава микроорганизмов осуществлялся методом газовой хроматографии. Для этого образцы подвергались гидролизу в 6М-соляной кислоте в течение 12 часов при температуре 105 °С. К полученному гидролизату добавлялся внутренний стандарт — L-норвалин. Очистка
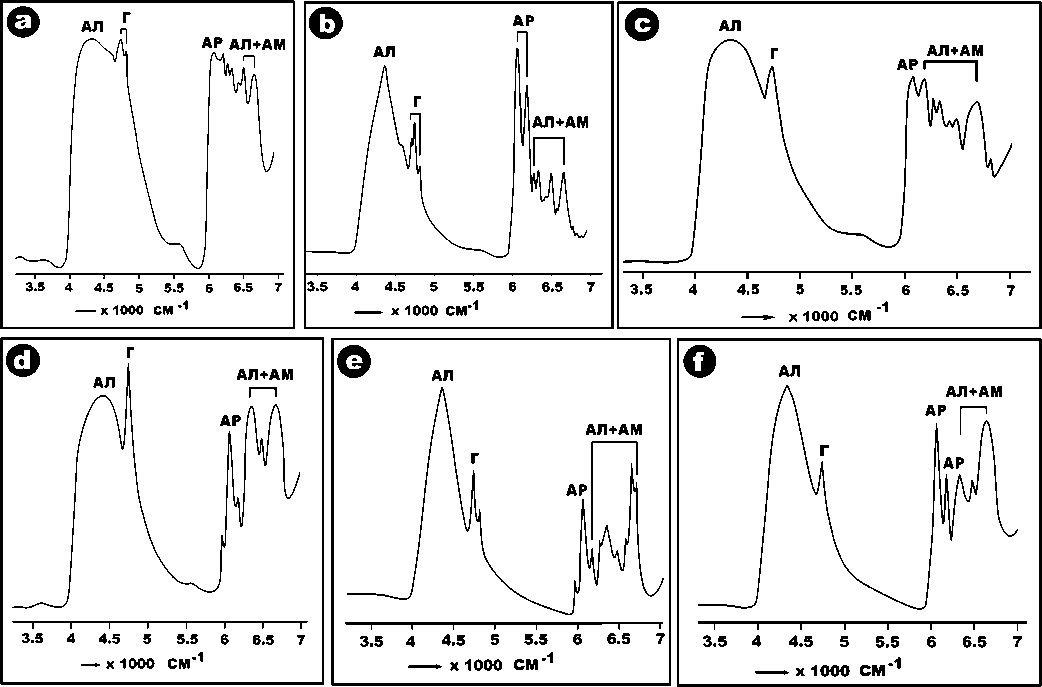
Рис. 17 . Спектры поглощения в ближней ИК-области: a—c — псевдомонады; d, e — дрожжи; f — хлорелла
Fig. 17 . Absorption spectra in the near infrared region: a—c — pseudomonads; d, e — yeast; f — chlorella
Рис. 18 . Спектры поглощения в ближней ИК-области: a — кишечная палочка, b — холерный вибрион, c — туляремийный микроб, d — золотистый стафилококк
Fig. 18. Absorption spectra in the near infrared region: a — Escherichia coli, b — cholera vibrio, c — tularemia microbe, d — Staphylococcus aureus растворов проводилась в колонке, заполненной сорбентом-катионообменником Dowex 50W X8. Элюирование аминокислот осуществлялось 2.5М-гидроксидом аммония. Высушенные препараты перераство-рялись в 0.1М-соляной кислоте, замораживались, высушивались и этерифицирова-лись пентафторпропионовым ангидритом при температуре 110 °С. Полученные изо
пропиловые эфиры аминокислот растворяли в дих-лорметане и отправляли на хроматографический анализ. Все используемые реагенты имели высокую степень чистоты (производство фирмы Aldrich-Fluka). Для разделения L- и D-энантиомеров использовалась капиллярная колонка Chirasil-L-Val длиной 25 м и внутренним диаметром 0.25 мм. В качестве газа-носителя применялся гелий. Температура испарителя составляла 250 °С, температура пламенно-ионизационного детектора — 275 °С. Анализ производился в течение 4 мин в изотермическом режиме при 90 °С, затем температура повышалась со скоростью 2 °С/мин до 210 °С. Полная длительность анализа составляла 70 мин. Обработка и запись хроматограмм осуществлялась с использованием программы GC Solution. Использованная методика не позволяет определять некоторые аминокислоты, а именно аргинин, гистидин, цистеин и триптофан, для анализа которых требуются индивидуальные условия дериватизации.
В результате проведенных исследований в микроорганизмах выявлено 14 аминокислот, распределившихся по семи группам (табл. 6): алифатической (5 аминокислот), ароматической (2), основной (1), кислой (2), гидроксильной (2), имино (1), серусодержащей (1). Половина аминокислот — аланин, валин, лейцин, ти-разин, лизин, глутаминовая и аспарагиновая кислоты — представлена обоими энантиомерами, левым и правым, переходы между которыми являются одним из фундаментальных признаков органических веществ биогенного происхождения [20, 48]. В большинстве проанализированных бактерий степень рацемизации (D/L) колеблется в пределах 0.01—0.12 и только в золотистом стафилококке увеличивается до 0.37, составляя в среднем 0.17 ± 0.16. Полученные данные вполне соответствуют прижизненным параметрам организмов — для них характерны L-формы, но D-формы в незначительном количестве тоже образуются в стенках бактерий. Однако и в таких обстоятельствах обращает на себя внимание явно повышенное содержание правых 24
энантиомеров в золотистом стафилококке, что может иметь отношение к нетождественности свойств гра-мотрицательных и грамположительных бактерий. Важно также отметить, что в дрожжах и хлорелле признаков рацемизации аминокислот мы не обнаружили.
Валовое содержание аминокислот в исследованных бактериях варьируется в пределах от 409 до 942 мг/г, составляя в среднем 682 ± 221 мг/г и возрастая в последовательности: псевдомонады < туляремийный микроб < кишечная палочка < холерный вибрион < золотистый стафилококк. Таким образом, обнаруживается, что грамположительная бактерия по валовому содержанию аминокислот заметно преобладает над грамотрицательными бактериями. Что же касается дрожжей и хлореллы, то в них содержание аминокислот уступает таковому в бактериях соответственно в 5—25 раз.
Определенный интерес представляет сравнение исследованных микроорганизмов по валовому содержанию аминокислот с органическими веществами разного происхождения. Так, в человеческих конкрементах — желчных, мочевых, фосфатных, оксалатных, зубных и слюнных камнях [1, 9, 16] — суммарное содержание аминокислот уступает таковому в исследованных нами микрооганизмах в 25—95 раз. В коллагене ископаемых костей и сохранившихся мягких тканях, коже и волосах плейстоцен-голоценовых млекопитающих среднее валовое содержание аминокислот колеблется в пределах 504—842 мг/г, что довольно близко к таковому в исследованных микроорганизмах. В современных морских осадках содержится в 50 раз меньше аминокислот [4], в торфах и углях содержание аминокислот меньше бактериального в 86 раз [3], в ископаемых смолах уступает в 3000 раз [40], в твердых битумах — в 2500 раз [37], а в реликтовом органическом веществе раннепалеозойских брахиопод содержание аминокислот меньше в 6500—7000 раз [36]. Как можно предполагать, выявленные различия обусловлены, во-первых, содержанием в сопоставляемых органических веще-
Таблица 6. Аминокислотный состав исследованных микроорганизмов
Table 6. Amino acid composition of the studied microorganisms
В этой связи большой интерес представляет тот факт, что в неизмененном органическом веществе абиогенного происхождения, например в конденсированных органоидах из эксплозивных продуктов современного наземного вулканизма [31] и в углеродизирован-ных вулканических шлаках в зоне Срединного Атлантическом хребта, содержание аминокислот меньше, чем в веществе исследованных бактерий, соответственно в 11 и 145—150 раз. И это при том, что общее содержание органического вещества в абиогениках мало уступает бактериальному. Выявленную диспропорцию можно, вероятно, расценивать как один из признаков принципиального различия органических веществ биогенного и абиогенного происхождения. В последних содержание аминокислот всегда на один-два порядка ниже.
Расчеты показали, что между большинством аминокислот в исследованных микроорганизмах реализуются лишь положительные корреляции (табл. 7). При этом значения коэффициентов парных корреляций между левыми энантиомерами варьируются в диапазоне 0.5—1, а между левыми и правыми снижаются до 0.3—0.5. Между правыми формами сила парной корреляции уменьшается еще больше. Все это, очевидно, объясняется разным содержанием энантиомеров в исследованных бактериях — левых гораздо больше, чем правых.
По относительному содержанию групп аминокислот исследованные микроорганизмы подразделяются на четыре типа. К первому типу относятся грам-отрицательные бактерии (псевдомонады, кишечная палочка, холерный вибрион, туляремийный микроб), для которых характерна следующая последовательность сокращения групповых содержаний: алифатические > кислые > ароматические > гидроксильные > основные > имино > серусодержащие. В грамположи-тельном золотом стафилококке характерен второй тип последовательности, в которой на третье место вышла группа основных аминокислот: алифатические > кислые > основные > ароматические > гидроксильные > имино > серусодержащие. Третий тип последовательности аминокислот демонстрируют дрожжи: алифатические > кислые > гидроксильные > основные > ароматические > имино > серусодержащие. Наконец, четвертым, принципиально отличным типом последовательности аминокислот характеризуется хлорелла: имино > ароматические > кислые > алифатические > серусодержащие > основные > гидроксильные. Полученные нами данные хорошо согласуются с ранее опубликованными результатами исследований около 30 грамотрицательных и грамположительных бактерий [41, 43, 45, 47, 49—51].
В связи с обнаружением аминокислот в метеоритах и земном абиогенном оганическом веществе вулканического происхождения представляет интерес сопоставление этих проявлений с изученными микроорганизмами. Примером метеорита с органическим веществом может служить углистый хондрит Оргей [44]. В нем аминокислоты по относительному содержанию выстраиваются в следующую последовательность: алифатические > гидроксильные > ароматические > кислые > серусодержащие. В случае углеродно- 26
го вещества в продуктах континентального и океанического вулканизма аналогичная последовательность имеет вид: кислые > имино > ароматические > алифатические > гидроксильные. Из представленных примеров видно, что в абиогенных органоидах на лидирующие места выходят аминокислоты из гидроксильной и имино групп, которые в составе биогенных микроорганизмов играют второстепенную роль.
Изотопия углерода и азота
Определение изотопного состава углерода и азота в микроорганизмах производилось методом масс-спектрометрии в режиме постоянного потока гелия (CF-IRMS) на масс-спектрометре Delta V Advantage, соединенном через газовый коммутатор Conflo IV с элементным анализатором Flash EA 1112. В последнем происходило сжигание образцов при 1020 °С для получения СО2 и при 680 °С для получения N2. Определение контролировалось анализом международного стандарта USGS-40 (Glutamic acid) и внутреннего стандарта Acetanilide (C8H9NO). Точность оценки изотопного состава составляла ± 0.15 ‰ (1 σ ). В качестве эталонов использовались PDB для углерода и Air (атмосферный воздух) для азота.
Согласно полученным данным (табл. 8), исследованные микроорганизмы заметно варьируются по изотопии как углерода, так и азота. Наиболее изотопнотяжелым углеродом и относительно изотопно-легким азотом характеризуются дрожжи и хлорелла. Бактерии обнаружили статистически более легкий изотопный состав по углероду в сочетании со значительно более изотопно-тяжелым азотом. По изотопии углерода бактерии выстраиваются в следующую последовательность: туляремийный микроб > кишечная палочка > золотистый стафилококк > псевдомонады ≈ холерный вибрион. Аналогичная последовательность изменения изотопного состава азота имеет вид: кишечная палочка > золотистый стафилококк > холерный вибрион > псевдомонады > туляремийный микроб. Из приведенных последовательностей следует, что изотопные составы углерода и азота в исследованных бактериях коррелируются обратно, т. е. по мере изотопного облегчения углерода азот изотопно утяжеляется. Коэффициент соответствующей парной корреляции составил –0.36. Следует подчеркнуть, что полученные нами данные хорошо согласуются с уже известной статистикой по современным микроорганизмам [42].
Значительный интерес представляет сопоставление по изотопному составу современных микроорганизмов с органическими веществами абиогенного происхождения. Соответствующий сравнительный анализ (рис. 19) показал, что микроорганизмы принципиально отличаются от абиогенных органоидов статистически более тяжелым изотопным составом как углерода, так и азота. В части углерода микроорганизмы характеризуются составом, колеблющимся в пределах –22 …–14 ‰, а в части азота — от –0.28 до 9.62 ‰. В разнообразных абиогенных органических веществах, выявленных в продуктах современного вулканизма и метеоритах, углерод и азот по изотопному составу системно более легкие, находятся соответственно в пределах –31 …–22 и –2.5 …4 ‰.
Таблица 7. Коэффициенты парной корреляции содержаний аминокислот в составе исследованных микроорганизмов
Table 7. Coefficients of pair correlation of amino acid content in the composition of the studied microorganisms
|
Gly |
1 |
||||||||||||||||||||
|
L-Ala |
0.77 |
1 |
|||||||||||||||||||
|
D-Ala |
0.91 |
0.44 |
1 |
||||||||||||||||||
|
L-Val |
0.74 |
0.93 |
0.46 |
1 |
|||||||||||||||||
|
D-Val |
0.56 |
0.56 |
0.48 |
0.58 |
1 |
||||||||||||||||
|
L-Leu |
0.67 |
0.98 |
0.32 |
0.96 |
0.57 |
1 |
|||||||||||||||
|
D-Leu |
0.76 |
0.94 |
0.47 |
0.96 |
0.58 |
0.96 |
1 |
||||||||||||||
|
L-Ile |
0.77 |
0.85 |
0.56 |
0.96 |
0.54 |
0.88 |
0.95 |
1 |
|||||||||||||
|
L-Phe |
0.72 |
0.98 |
0.38 |
0.96 |
0.59 |
0.99 |
0.97 |
0.9 |
1 |
||||||||||||
|
L-Tyr |
0.68 |
0.94 |
0.37 |
0.95 |
0.67 |
0.97 |
0.95 |
0.88 |
0.97 |
1 |
|||||||||||
|
D-Tyr |
0.83 |
0.29 |
0.98 |
0.31 |
0.41 |
0.16 |
0.31 |
0.41 |
0.22 |
0.21 |
1 |
||||||||||
|
L-Lys |
0.97 |
0.7 |
0.91 |
0.73 |
0.49 |
0.62 |
0.75 |
0.82 |
0.67 |
0.62 |
0.83 |
1 |
|||||||||
|
D-Lys |
0.82 |
0.29 |
0.98 |
0.31 |
0.41 |
0.16 |
0.31 |
0.41 |
0.22 |
0.21 |
1 |
0.84 |
1 |
||||||||
|
L-Glu |
0.84 |
0.98 |
0.56 |
0.96 |
0.6 |
0.96 |
0.97 |
0.93 |
0.98 |
0.94 |
0.41 |
0.81 |
0.41 |
1 |
|||||||
|
D-Glu |
0.91 |
0.46 |
1 |
0.47 |
0.5 |
0.34 |
0.48 |
0.56 |
0.4 |
0.39 |
0.98 |
0.92 |
0.98 |
0.57 |
1 |
||||||
|
L-Asp |
0.75 |
0.93 |
0.47 |
0.98 |
0.49 |
0.95 |
0.98 |
0.97 |
0.96 |
0.93 |
0.31 |
0.76 |
0.31 |
0.97 |
0.48 |
1 |
|||||
|
D-Asp |
0.9 |
0.58 |
0.91 |
0.67 |
0.69 |
0.53 |
0.69 |
0.77 |
0.59 |
0.59 |
0.85 |
0.94 |
0.85 |
0.72 |
0.91 |
0.67 |
1 |
||||
|
L-Ser |
0.72 |
0.92 |
0.39 |
0.91 |
0.29 |
0.91 |
0.91 |
0.87 |
0.92 |
0.84 |
0.25 |
0.71 |
0.25 |
0.93 |
0.4 |
0.95 |
0.54 |
1 |
|||
|
L-Thr |
0.79 |
0.96 |
0.51 |
0.99 |
0.65 |
0.96 |
0.96 |
0.94 |
0.97 |
0.96 |
0.37 |
0.76 |
0.37 |
0.98 |
0.53 |
0.97 |
0.7 |
0.91 |
1 |
||
|
L-Pro |
0.74 |
0.97 |
0.4 |
0.85 |
0.44 |
0.93 |
0.9 |
0.76 |
0.94 |
0.89 |
0.25 |
0.76 |
0.32 |
0.93 |
0.41 |
0.87 |
0.5 |
0.91 |
0.88 |
1 |
|
|
L-Met |
0.5 |
0.11 |
0.61 |
0.31 |
0 |
0.11 |
0.35 |
0.51 |
0.18 |
0.13 |
0.6 |
0.66 |
0.6 |
0.3 |
0.6 |
0.38 |
0.68 |
0.34 |
0.28 |
0.11 |
1 |
|
Сумма |
0.88 |
0.95 |
0.63 |
0.96 |
0.61 |
0.93 |
0.97 |
0.95 |
0.95 |
0.92 |
0.49 |
0.86 |
0.49 |
0.99 |
0.65 |
0.99 |
0.78 |
0.91 |
0.98 |
0.9 |
0.39 |
Таблица 8. Изотопный состав углерода и азота в органическом веществе исследованных микроорганизмов
Table 8. Isotopic composition of carbon and nitrogen in organic the substance of the investigated microorganisms
|
№ обр Sample No. |
δ 13С PDB |
δ 15N Air |
Микроорганизмы Microorganisms |
|
БАК-1 |
–21.8 |
4.9 |
псевдомонады pseudomonads |
|
БАК-2 |
–18.39 |
8.9 |
|
|
Среднее ± СКО Average± RMS |
–20.09 ± 2.41 |
6.9 ± 0.82 |
|
|
ДРЖ-1 |
–15.13 |
0.65 |
дрожжи yeast |
|
ДРЖ-2 |
–14.94 |
1.18 |
|
|
« |
–15.81 |
0.02 |
|
|
Среднее ± СКО Average± RMS |
–15.29 ± 0.46 |
0.62 ± 0.58 |
|
|
МВД-1 |
–14.48 |
2.82 |
хлорелла chlorella |
|
МВД-2 |
–17.91 |
3.18 |
|
|
Среднее ± СКО Average± RMS |
–16.19 ± 2.43 |
3 ± 0.25 |
|
|
ПЧИ-1 |
–17.16 |
11.01 |
кишечная палочка escherichia coli |
|
ПЧИ-2 |
–20.09 |
7.59 |
холерный вибрион vibrio cholerae |
|
ПЧИ-3 |
–20.67 |
7.22 |
|
|
ПЧИ-4 |
–19.46 |
7.56 |
|
|
ПЧИ-5 |
–20.18 |
7.89 |
|
|
Среднее ± СКО Average± RMS |
–20.1 ± 0.5 |
7.56 ± 0.27 |
|
|
ПЧИ-6 |
–16.02 |
–0.28 |
туляремийный микроб tularemia microbe |
|
ПЧИ-7 |
–17.22 |
0.34 |
|
|
Среднее ± СКО Average± RMS |
–16.62 ± 0.85 |
0.03 ± 0.44 |
|
|
ПЧИ-8 |
–19.07 |
9.62 |
золотистый стафилококк staphylococcus aureus |
|
Среднее ± СКО Average± RMS |
–19.0 ± 1.8 |
6.48 ± 3.76 |
бактерии в целом bacteria |
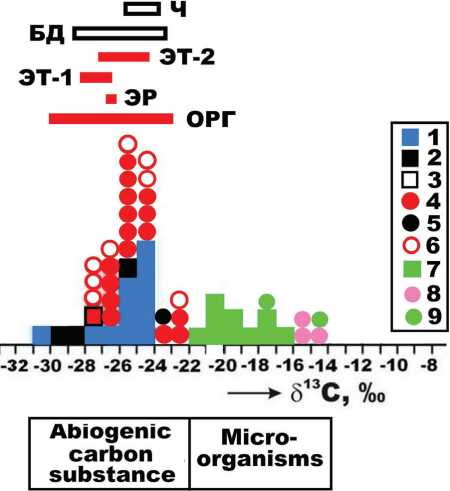
Рис. 19. Изотопный состав углерода в исследованных микроорганизмах в сравнении с углеродными образованиями абиогенного происхождения: 1—6 — углеродные фазы и минералы в продуктах современного вулканизма на Камчатке и Курилах, соответственно дисперсно-рассеянное углеродное вещество в вулканитах, частицы шунгитоподобного вещества, частицы самородного алюминия с включениями углеродного вещества, алмазы, углеродные глобулы, карбиды [33]; 7—9 — исследованные микроорганизмы, соответственно бактерии, дрожжи и хлорелла. Рамками показаны диапазоны варьирования изотопного состава в вулканогенных органоидах с Камчатки — ОРГ, в углеродном веществе, рассеянном в вулканитах Эребуса — ЭР [34] и Этны — ЭТ-1 [32], в органоидах из тефры Этны –ЭТ-2 [32], в углеродном веществе из железного метеорита Большой Долгучан — БД [30] и хондрита Челябинск — Ч [35]
Fig. 19. The isotopic composition of carbon in the studied microorganisms in comparison with carbon formations of abiogenic origin: 1—6 — carbon phases and minerals in the products of modern volcanism in Kamchatka and the Kuriles, respectively, dispersed carbon matter in volcanic, particles of shungite-like matter, particles of native aluminum with carbon inclusions substances, diamonds, carbon globules, carbides [33]; 7—9 — investigated microorganisms, bacteria, yeast and chlorella, respectively. The frames show ranges of variation of the isotopic composition in volcanogenic organelles from Kamchatka — ORG, in carbon matter dispersed in the volcanic of Erebus — ER [34] and Etna — ET-1 [32], in organoids from Etna tephra — ET-2 [32], in carbon matter from the iron meteorite Bol'shoi Dolguchan — BD [30] and chondrite Chelyabinsk — Ch [35]
Заключение
Исследованы 14 образцов грамотрицательных и грамположительных бактерий, одноклеточных дрожжей и зеленых микроводорослей с использованием комплекса методов оптической, атомно-силовой и аналитической сканирующей электронной микроскопии, термического анализа, газовой хроматографии, инфракрасной спектроскопии, масс-спектрометрии с ин- 28
дуктивно-связанной плазмой и изотопной масс-спектрометрии.
Методом атомно-силовой микроскопии высокого разрешения определены форма и размеры клеток в колониях микроорганизмов. По форме клетки варьируются от палочковидных до чечевицеподобных и глобуло-коккообразных; по размеру колеблются от мезонанометровых до микрометровых. Между крайними размерами клеток установлена сильная положительная корреляция, что более всего характерно именно для биологических объектов.
В химическом составе исследованных микроорганизмов обнаружена примесь неорганических химических элементов — Mg, Ca, Ba, Sr, Si, Na, K, Cu, Zn, P, S, Cl и субмикронные по размеру выделения минеральных фаз — карбонатов, фосфатсульфатов, гидроген-сульфатфосфатов, гидрогенфосфатов, галита, каолинита, металлических сплавов латунного состава, бадделеита.
В микроорганизмах установлены 45 микроэлементов, в том числе 7 эссенциальных, 17 физиогенно-ак-тивных и 19 абиотических (токсичных). Наибольшим разнообразием микроэлементов характеризуется грам-положительный золотистый стафилококк — в его образце присутствуют все 14 лантаноидов. Суммарная концентрация микроэлементов в исследованных микроорганизмах колеблется в диапазоне 0.003— 0.26 мас. %. Значение эссенциального коэффициента — Э/АБ (отношение групповых концентраций эссенциальных и абиотических элементов) составляет в среднем 196 ± 153, достигая максимума в дрожжах и минимума в грамположительном золотистом стафилококке.
Большинство исследованных микроорганизмов характеризуются близкими термическими свойствами, демонстрируя последовательное выгорание углеводно-жировой и белковой компонент органического вещества. Его смешанный жиробелковый состав подтверждается и данными элементного анализа. Выявлено, что наибольшей «белковостью» отличается грамполо-жительный золотистый стафилококк. В целом проанализированные нами микроорганизмы по многим свойствам контрастно отличаются от абиогенных органоидов, выявленных в продуктах современного вулканизма.
В молекулярном составе микроорганизмов установлено до 8 функциональных групп — алифатических, аминов, ароматических, гидроксильных, карбонильных, фенольных, алленовых, простых эфиров. Эти группы распределяются по 14 выявленным аминокислотам, объединяющимся в 7 групп — алифатическую, ароматическую, основную, кислую, гидроксильную, имино и серусодержащую. До половины аминокислот представлены левым (L) и правым (D) энантиомерами. Степень рацемизации (D/L) колеблется в пределах 0.01—0.37, достигая максимума в грамположительном золотистом стафилококке. Суммарное содержание аминокислот в исследованных микроорганизмах колеблется от 409 до 942 (682 ± 221) мг/г, достигая максимума в грамположи-тельном стафилококке. Это содержание в 11—150 раз превышает таковое в абиогенных органоидах.
По изотопному составу как углерода, так и азота микроорганизмы принципиально отличаются от абиогенных органических веществ в метеоритах и продуктах современного вулканизма. Наиболее изотопно-тяжелым составом углерода в сочетании с относительно изотопно-лёгким азотом характеризуются штаммы дрожжей Rhodotorula glutinis VKM Y-2998D и микроводорослей Chlorella vulgaris IPPAS C-2024. В бактериях установлен статистически более лёгкий углерод в сочетании со значительно более тяжелым азотом. При этом между изотопным составом углеро- да и азота в бактериях выявляется значимая отрицательная связь.
Обобщая данные исследований, мы приходим к выводу о том, что по многим параметрам — степени «белковости» органического вещества, валовому ми-кроэлементному составу, степени обогащения элемен-тами-антибионтами, содержанию аминокислот и степени их рацемизации — грамотрицательные и грам-положительные бактерии значительно различаются, что подтверждает представление о нетождественно-сти свойств клеточных стенок [19].
Благодарим сотрудников Института биологии Коми НЦ УрО РАН — А. В. Гогонина, Е. М. Анчугову и сотрудников Ростовского-на-Дону противочумного института А. В. Тришина, М. В. Цимбалистову, О. С. Чемисову за подготовку и передачу на исследования образцов микроорганизмов. Выражаем также благодарность старшему научному сотруднику Института геологии и геохимии УрО РАН Н. В. Чередниченко и инженерам-исследователям Института геологии Коми НЦ УрО РАН В. А. Радаеву и Е. М. Тропникову за прекрасно выполненную аналитическую работу. Мы признательны также профессору Санкт-Петербургского госуниверситета Е. Н. Котельниковой за ценные научные консультации.
Анализ содержания микроэлементов проведен в рамках темы № AAAA-A18-118053090045-8 государственного задания ИГГ УрО РАН. Дооснащение и комплексное развитие ЦКП «Геоаналитик» ИГГ УрО РАН осуществляется при финансовой поддержке гранта Министерства науки и высшего образования Российской Федерации, Соглашение № 075-15-2021-680.
Список литературы Первые результаты комплексных исследований современных микроорганизмов физико-химическими и минералого-геохимическими методами
- Амосова О. Е., Машина Е. В., Шанина С. Н. Аминокислоты как биомаркеры состава холелитов // Вестник геонаук. 2020. № 10. С. 22—30.
- Андрейчук В., Климчук А., Бостон П., Галускин Е. Уникальные железомарганцевые колонии микроорганизмов в пещере Золушка (Украина — Молдова) // Спелеология и карстология. 2009. № 3. С. 5—23.
- Анищенко Л. А., Шанина С. Н. Аминокислоты в природных объектах Тимано-Печорского бассейна // Происхождение биосферы и коэволюция минерального и биологического миров. Сыктывкар, 2007. С. 95—116.
- Анищенко Л. А., Шанина С. Н. Аминокислоты как возможные индикаторы условий накопления и консервации органического вещества // Органическая минералогия. Сыктывкар: Геопринт, 2009. С. 71—74.
- Антошкина А. А. Бактериальное породообразование — реальность современных методов исследований // Ученые записки Казанского университета. 2011. № 153 (4). C. 114—126.
- Антошкина А. А., Добрецова И. Г., Силаев В. И., Киселёва Д. В., Смолева И. В., Чередниченко Н. В. Особенности состава и строения карбонатных построек в северной зоне Срединного Атлантического хребта // Геология рифов. Сыктывкар: Геопринт, 2020. С. 19—22.
- Антошкина А. А., Пономаренко Е. С., Силаев В. И. Биохемогенная природа ордовикских шамозитов на Северном Урале // Вестник Института геологии Коми НЦ УрО РАН. 2017. № 9. С. 12—22.
- Астафьева М. М., Герасименко Л. М., Гептнер А. Р., Жегалло Е. А., Жмур С. И., Карпов Г. А., Орлеанский В. К., Пономаренко А. Г., Розанов А. Ю., Сумина Е. Л., Ушатин-ская Г. Т., Хувер Р., Школьник Э. Л. Ископаемые бактерии и другие микроорганизмы в земных породах и астромате-риалах. М.: ПИН РАН, 2011. 172 с.
- Вельская Л. В., Голованова О. А. Особенности аминокислотного состава зубных и слюнных камней // Минералогия и жизнь: происхождение биосферы и коэволюция минерального и биологического миров. Сыктывкар: ИГ Коми НЦ УрО РАН, 2007. С. 81-83.
- Воровкова Е. В., Филиппов В. Н. Микровключения в пигментном холелите // Вестник ИГ Коми НЦ УрО РАН. 2009. № 8. С. 9-11.
- Войткевич Г. В., Кокин А. В., Мирошников А. Е., Прохоров В. Г. Справочник по геохимии. М.: Недра, 1990. 480 с.
- Гинзбург И. И. Роль микроорганизмов в выветривании пород и образовании минералов // Кора выветривания. 1952. № 1. С. 6-35.
- Глинская Л. Г., Занин Ю. Н., Рудина Н. А. Бактериальный генезис фосфатов кальция в организме человека и в природе // Литология и полезные ископаемые. 2007. № 1. С. 63-65.
- Гусев М. В., Минеева Л. А. Микробиология. М.: Академия, 2003. 464 с.
- Занин Ю. И. Микробиальные формы в фосфоритах — первые 100 лет изучения // Литосфера. 2005. № 2. С. 159-165.
- Каткова В. И., Симаков А. Ф. Роль аминокислот в генезисе биоминеральных образований // Сыктывкарский минералогический сборник. 1998. № 27. С. 58-66.
- Кокин А. В., Силаев В. И., Павлович Н. В., Киселёва Д. В., Слюсарь А. В. О соответствии распределения микроэлементов в составе современных бактерий закону периодичности космогеохимической распространенности химических элементов // Вестник геонаук. 2020. № 7. С. 3-8.
- Кокин А. В., Силаев В. И., Павлович Н. В., Киселёва Д. В., Слюсарь А. В., Слюсарь А. А. О возможной связи мочекаменной болезни с деятельностью бактерий в организме человека // Наука юга России. 2020. № 16 (1). С. 77-87.
- Коротяев А. И., Бабичев С. А. Медицинская микробиология, иммунология и вирусология. СПб.: СпецЛит, 2010. 760 с.
- Котельникова Е. Н. Особенности проявления изомерии, хиральности, четности и упаковки молекул в кристаллической структуре природных органических веществ // Современные проблемы теоретической, экспериментальной и прикладной минералогии. Сыктывкар: Геопринт, 2014. С. 207-208.
- Круглов Ю. В. Микробное сообщество почвы: физиологическое разнообразие и методы исследования // Сельскохозяйственная биология. 2016. № 51(1). С. 46-59.
- Кузнецов С. И. Геологическая деятельность микроорганизмов // Вестник АН СССР. 1952. № 2. С. 78-92.
- Леин А. Ю., Москалев Л. И., Богданов Ю. А., Сагале-вич А. М. Гидротермальные системы океана и жизнь // Природа. 2000. № 5. С. 47-55.
- Мудрецова-Висс К. А., Дедюхина В. П., Масленникова Е. В. Основы микробиологии. М.: ИНФРА-М, 2014. 354 с.
- Нетрусов А. И., Котова И. В. Микробиология. М., 2009. 352 с.
- Павлович Н. В., Кокин А. В., Силаев В. И., Аронова Н. В., Цимбалистова М. В., Киселёва Д. В., Слюсарь А. В. Сравнительный анализ состава микроэлементов у бактерий различных видов // Актуальные вопросы изучения особо опасных и природноочаговых болезней. Ростов-на-Дону. 2019. С. 309-313.
- 27.Полынов Б. Б. Кора выветривания. Часть 1. Процессы выветривания. Основные фазы и формы коры выветривания и их распределение. Л.: АН СССР, 1934. 243 с.
- Розанов А. Ю. Ископаемые бактерии, седименто-генез и ранние стадии эволюции биосферы // Палеонтологический журнал. 2003. № 6. С. 41—49.
- Сергеев В. Н. Окремненные микрофоссилии докембрия: природа, классификация и биостратиграфическое значение. М.: ГЕОС, 2006. 279 с.
- Силаев В. И., Кокин А. В., Филиппов В. Н., Киселёва Д. В., Нефедьева Н. С. Железный метеорит Большой Долгучан: результаты минералого-геохимических исследований // Вестник ИГ Коми НЦ УрО РАН. 2016. № 7. С. 10— 18.
- Силаев В. И., Аникин Л. П., Шанина С. Н., Карпов Г. А., Васильев Е. А., Шуйский А. С., Смолева И. В., Киселёва Д. В., ВергасоваЛ. П. Абиогенные конденсированные органические полимеры в продуктах современного вулканизма в связи с проблемой возникновения жизни на Земле. Сыктывкар: Геопринт, 2018. 128 с.
- Силаев В. И., Карпов Г. А., Аникин Л. П., Scribano V., Ремизов Д. Н., Филиппов В. Н., Киселёва Д. В., Макеев Б. А., Шанина С. Н., Тарасов К. В., Симаков С. К. Тефра катастрофического извержения вулкана Этна на Сицилии в 1669 г.: ее петро-минерало-геохимические свойства и геодинамический аспект // Вулканология и сейсмология. 2021. № 3. С. 41—62.
- Силаев В. И., Карпов Г. А., Аникин Л. П., Васильев Е. А., Вергасова Л. П., Смолева И. В. Минерально-фазовый парагенезис в эксплозивных продуктах современных извержений вулканов Камчатки и Курил. Часть 1. Алмазы, углеродистые фазы, конденсированные органоиды // Вулканология и сейсмология. 2019. № 5. С. 54—67.
- Силаев В. И., Карпов Г. А., Филиппов В. Н., Макеев Б. А., Шанина С. Н., Хазов А. Ф., Тарасов К. В. Минералого-геохимические свойства прикратерной тефры вулкана Эреус (Антарктида) из материалов извержения 2000 г. // Вулканология и сейсмология. 2020. № 4. С. 40—56.
- Силаев В. И., Филиппов В. Н., Голубева И. И., Люто-ев В. П., Потапов С. С., Симакова Ю. С., Петровский В. А., Хазов А. Ф. Метеорит Челябинск. Результаты минералого-геохимических исследований // Метеорит Челябинск — год на Земле. Челябинск. 2014. С. 443—473.
- Шанина С. Н., Безносова Т. М. Аминокислоты в ран-непалеозойских брахоиоподах Тимано-Североуральского региона // Известия Коми НЦ УрО РАН. 2012. № 2. С. 73— 83.
- Шанина С. Н., Бушнев Д. А. Изотопный состав углерода аминокислот твердых битумов // ДАН. 2014. № 456 (5). С. 586—590.
- Юшкин Н. П. Биоминеральные взаимодействия: 42-е Чтения им. В. И. Вернадского. М.: Наука, 2002. 60 с.
- Юшкин Н. П. Минеральный мир и биосфера: Програм. доклад на IV Междунар. семинаре «Минералогия и жизнь» // Вестник Института геологии Коми НЦ УрО РАН. 2007. № 6. С. 2—5.
- Юшкин Н. П., Бушнев Д. А., Шанина С. Н. Ископаемые смолы Северной Евразии // Вестник ИГ Коми НЦ УрО РАН. 2006. № 11. С. 2—5.
- Bhattachary S. K., Banerjer A. B. D-Amini Acids in the Cell Pool of Bacteria // Folia Microbial. 1974. No. 19. pp. 43—50.
- Degens E. T. Geochemistry of sediments. Prentice. N. Y. 1965. P. 342.
- 43.Detkova E. N., Boltyanskaya Yu. V. Relationships between the Osmoadaptation Strategy, Amino Acid Composition of Bulk Protein, and Properties of Certain Enzymes of Haloalkaliphilis Bacteria // Microbiology. 2006. No. 75 (3). P. 250-265.
- Hayes J. M. Organic constituents of meteorites — a review // Geochimica et Cosmochimica Acta. 1967. No. 31. P. 1354—1440.
- Hecky R. E., Mopper K., Kilham P., Degens E. T. The Amino Acids and Sugar Composition of Diatom Cell-Walls // Marine Biology. 1973. No. 19. P. 323—331.
- Huber C., Wachterauser G. a-Hydroxy and a-Amino Acids under Possible Hadean, Volcanic Origin-of-Life Condions // Science. 2006. No. 6. P. 630—632.
- 47.Igarachi H., Fujikawa H., Usami H., Kawabata Sh., Morita T. Purification and Characterization of Staphylococcus aureus FRI 1169 and 587nToxic Shock Syndrome Exotoxins // Infection and Immunity. 1984. No. 44 (1). P. 175—181.
- Kotelnikova E. N., Isakov A. I., Kryuchkova L. Y., Zolotarev A. A., Bocharov S. N. Lorenz H. Acids with Chiral molecules as essential organic compounds of biogenic — abiogen-ic systems // Processes and Phenomena on the Boundary Between Biogenic and Abiogenic Nature. Springer. Cham, Switzerland. 2020. P. 695—719.
- Lee S. D., Fischetti V.A. Purification and Characterization of LPXT-Gase from Staphylococcus aureus: the Amino Acid Composition Mirros That Found S. aureus in the Peptidoglycan // J. Bacteriological. 2006. No. 188 (2). P. 389—398.
- Schieber A., Bruckner H., Ling J. R. GC-MS analysis of diaminopimelic acid Stereoisomers and amino acid enantio-mers in rumen bacteria // Biomedical chromatography. 1999. No. 19. P. 40—50.
- Stokes J. L., Gunness M. The Amino Acid composition of microorganisms // J. Bacteriology. 1946. No. 52. P. 195—207.
- Tazaki K. Biomineralization of layer silicates and hydrated Fe/Mn oxides in microbial mats an electron microsco-pial study // Clays Clay Minerals. 1997. No. 45 (2). P. 203—212.


