Первые результаты создания гибридного гидрогеля на основе фибрина и поливинилового спирта: сравнение с монокомпонентными гидрогелями
Автор: Е.А. Сенокосова, М.А. Резвова, В.В. Севостьянова, В.Г. Матвеева
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Фибрин крайне перспективен в тканевой инженерии. Однако он лишён необходимых физико-механических характеристик при создании материалов для нужд сердечно-сосудистой хирургии. Получение гибридного гидрогеля с взаимопроникающей сетью на основе фибрина и поливинилового спирта может улучшить свойства фибрина, в частности, повысить физико-механические характеристики и уменьшить склонность к усадке. Цель – выполнить последовательную полимеризацию фибрина и поливинилового спирта для получения гибридного гидрогеля и изучить его свойства в сравнении с монокомпонентными гидрогелями. Материал и методы. Из периферической крови пациентов методом этаноловой преципитации выделяли фибриноген, к нему добавляли поливиниловый спирт, растворенный в физиологическом растворе. Сначала инициировали полимеризацию фибрина, добавляя в раствор хлорид кальция. После следовал этап криоструктурирования поливинилового спирта циклами заморозки, разморозки и оттаивания. Таким образом, были приготовлены гибридные гидрогели на основе фибрина и поливинилового спирта и образцы из чистого фибрина и чистого поливинилового спирта. Изучали структуру гидрогелей, физико-механические свойства, усадку и биологическую активность. Статистическую обработку проводили в программе GraphPad Prism 6. Результаты. 3-D структура гибридного гидрогеля представлена сочетанием полигональных полостей поливинилового спирта, оплетенных сетью тонких фибриновых волокон. Распределение компонентов было равномерным в толще образцов, тогда как на поверхности преобладал поливиниловый спирт. Удлинение (247 (220,0; 293,2) %; р = 0,0005) и модуль Юнга (0,09 (0,11; 0,13) мПа; р = 0,0001) гибридного гидрогеля были статистически значимо выше относительно значений фибрина. Гибридный гидрогель не дал усадку, в отличие от фибрина, который усел в 11 раз. Количество адгезированных эндотелиальных клеток на матрицах из гибридного гидрогеля было в 8 раз выше, чем на поливини- ловом спирте, но в 10 раз меньше, чем на фибрине. Пролиферативная активность клеток на поливиниловом спирте отсутствовала, на IPN-гидрогеле отмечено 13,6% пролиферирующих клеток, на фибрине 59,52%. Заключение. Способ последовательной полимеризации IPN-гидрогеля фибрина и поливинилового спирта дает равномерное распределение волокон в толще материала и позволяет получать гидрогели с улучшенными механическими свойствами, отсутствием склонности к усадке. Но перераспределение компонентов на поверхности гибридного гидрогеля в пользу поливинилового спирта с поддержанием относительно низкой адгезионности материала диктует необходимость проведения дальнейших экспериментов по созданию оптимальных условий для жизнедеятельности клеток.
Фибрин, поливиниловый спирт, биоматериалы, биосовместимость, эндотелиальные клетки
Короткий адрес: https://sciup.org/149141592
IDR: 149141592 | УДК: 612.115:547.962.4.05:678.744.472:544.773.432 | DOI: 10.29001/2073-8552-2023-38-1-140-150
Текст научной статьи Первые результаты создания гибридного гидрогеля на основе фибрина и поливинилового спирта: сравнение с монокомпонентными гидрогелями
УДК 612.115:547.962.4.05:678.744.472:544.773.432
Fibrin is a natural polymer with unique biological properties useful for tissue engineering. It is an ideal cell carrier with a high ability to retain cells on the surface [1–3], to bind and dosed release of growth factors for supports angiogenesis and tissue repair [4, 5]. Autologous fibrin can be obtained simply and in sufficient quantities from the patient’s own blood, making it a very attractive material for personalized tissue engineering [6]. In contrast, sources of other autologous human biopolymers (such as collagen, fibronectin, elastin) have low availability. However, poor mechanical properties of fibrin and tendency to shrink limit its use in construction that carry significant mechanical loads and require shape retention, such as small-diameter vessel prostheses.
The formation of hybrid hydrogels with Interpenetrating polymer network (IPN-hydrogels) may be one of the ways to reduce fibrin disadvantages. IPN-hydrogels combine the favorable properties of each of the polymeric components and imitate the structure of native tissue [7–9]. Polyvinyl alcohol (PVA) hydrogels have a 3D structure and sufficient mechanical strength to act as reliable scaffolds for replacing human organs and tissues [10, 11]. PVA polymerization by cryostructuring makes it possible to avoid the use of toxic and chemically aggressive substances, which is an advantage in the creation of tissue engineering products [12]. However, the lack of sites for cell adhesion makes PVA a bioinert material with impossible retention cells on the surface [13]. The proteins incorporation into PVA structure will improve cell adhesion and biological characteristics of the material. On the other hand, the intercalation into fibrin of a component that enhances the frame properties and increases strength can also be very useful. Combining of fibrin and PVA in a single IPN hydrogel structure will help to obtain an improved material. Fibrin fibers will support cell activity, and the PVA network will increase mechanical strength and reduce shrinkage of the IPN hydrogel.
The proposed technology for the formation of an IPN hydrogel includes thorough mixing of the components and, sequential polymerization of fibrin first, then cryostructuring of PVA. As a result, hydrogel with a homogeneous structure, consisting of intertwining networks of fibrin and PVA, should be formed. The work uses the method of obtaining completely autologous fibrin, without the use of exogenous thrombin [14].
Aim
To perform sequential polymerization of fibrin and PVA to obtain an IPN hydrogel and study its properties.
Material and Methods
The study was approved by the Local Ethics Committee No. 4/1 dated April 18, 2022.
We used donor blood taken with 3.8% sodium citrate. The precipitate was isolated from plasma by ethanol precipitation with low ethanol concentration. The fibrinogen concentration in the precipitate was adjusted to 75 mg/ml.
PVA solution was prepared from a polymer with a molecular weight of 89-98 kDa, the degree of hydrolysis of acetate groups > 99% (Sigma-Aldrich, USA), which was питации с низким содержанием этанола. Концентрацию фибриногена в преципитате доводили до 75 мг/мл.
Для получения раствора ПВС использовали полимер молекулярной массы 89–98 кДа, степенью гидролиза ацетатных групп > 99% (Sigma-Aldrich, США), который растворяли в NaCl 0,9% при температуре 90 °С до получения прозрачного раствора с концентрацией 75 мг/мл.
Приготовление образцов IPN-гидрогеля фибрина и ПВС
В преципитат фибриногена вносили ПВС в соотношении 1 : 1 и тщательно перемешивали. Для запуска полимеризации фибрина к раствору преципитата и ПВС добавляли CaCl2 0,4% в соотношении 1 : 4 и апротинин. Готовую смесь заливали в форму и оставляли для полимеризации. Итоговая концентрация фибриногена и ПВС в образцах составила 30 мг/мл. Следующим этапом было криоструктурирование ПВС в образце. Для этого образцы охлаждали до –40 °С в течение суток, далее выполняли градиентную разморозку при –4 °С с экспозицией 8 ч и оттаивание при +6 °С. Циклы замораживания и оттаивания повторяли трижды.
Приготовление контрольных образцов фибрина
Концентрацию фибриногена в преципитате доводили до 60 мг/мл, далее вносили раствор CaCl2 0,2% в соотношении 1 : 1 и апротинин, перемешивали, заливали в форму и оставляли для полимеризации. Итоговая концентрация фибриногена в фибрине 30 мг/мл.
Приготовление контрольных образцов ПВС
Раствор линейного ПВС готовили, как описано выше, доводили концентрацию в растворе до 30 мг/мл. Циклы замораживания и оттаивания контрольных образцов фибрина и ПВС выполняли вместе с образцами IPN-гидрогелей.
Изучение структуры гидрогелейСканирующая электронная микроскопия (СЭМ)
Готовые образцы фиксировали в 1% растворе глутарового альдегида (Sigma-Aldrich, США) в течение суток и отмывали в растворе фосфатно-солевого буфера (ФСБ) (Gibco, США) и дистиллированной воде. После этого образцы замораживали и лиофилизировали в установке Freezone 2.5 (Labconco, США) при температуре –40 °C и давлении < 0,133 мБар. Для визуализации внутренней структуры лиофилизированные образцы замораживали в жидком азоте и ломали. Методом ионного распыления на поверхность разлома наносили токопроводящее (Au/ Pd) покрытие толщиной 7 нм. Структуру оценивали на микроскопе S-3400N (Hitachi, Япония) в условиях высокого вакуума при ускоряющем напряжении 10 кВ в режиме вторичных электронов.
Гистологическая окраска срезов гематоксилином и эозином
Для подготовки срезов образцы фиксировали в 10% забуференном формалине (BioVitrum, Россия) и в 2% глютаровом альдегиде, дегидратировали, пропитывали и заливали парафином ГИСТОМИКС (БиоВитрум, Россия). Из полученных блоков с помощью микротома HM 325 (Thermo Scientific, США) изготавливали поперечные срезы толщиной 8 мкм которые депарафинизировали и дегидратировали. Окрашивание проводили раствором гематоксилина Гарриса (BioVitrum, Россия) 15 мин и далее раствором эозина (БиоВитрум, Россия) 30 сек. После промывания водой образцы дегидратировали в серии спиртов, просветляли dissolved in NaCl 0.9% at a temperature of 90°C to obtain a clear solution with a concentration of 75 mg / ml.
Sample preparation of IPN hydrogel fibrin and PVA
PVA was added to the fibrinogen precipitate as 1:1 and thoroughly mixed. To start the polymerization of fibrin, CaCl2 0.4% in a ratio of 1:4 and aprotinin were added to the precipitate and PVA solution. Immediately poured into a mold and left for polymerization. The final concentration of fibrinogen and PVA in the samples was 30 mg/ml. The next stage included cryostructuring of PVA in the sample. The samples were cooled to –40 °C during the day. Then gradient defrosting was performed at –4 °C with an exposure of 8 hours and thawing at +6 °C. Freeze-thaw cycles were repeated three times.
Preparation of fibrin control samples
The concentration of fibrinoge in the precipitate was adjusted to 60 mg/ml. Then a 0.2% solution of CaCl2 was added in a ratio of 1:1 and aprotinin, mixed, poured into a mold, and left for polymerization. The final concentration of fibrinogen in fibrin is 30 mg/m
Preparation of PVA control samples
A solution of linear PVA was prepared as described above; the concentration in the solution was adjusted to 30 mg/mL. Freeze and thaw cycles of fibrin and PVA control samples were performed together with IPN hydrogel samples.
Studying the structure of hydrogels
Scanning electron microscopy (SEM)
The samples were fixed in 1% glutaraldehyde (Sigma-Aldrich, USA) for 24 hours and washed in phosphate-buffered saline (PBS) (Gibco, USA) and then in distilled water. Next, the samples were frozen and lyophilized in a Freezone 2.5 unit (Labconco, USA) at a temperature of –40 °C and a pressure of < 0.133 mBar. To visualize the internal structure, lyophilized samples were frozen in liquid nitrogen and broken. A conductive (Au/Pd) coating 7 nm thick was applied to the fracture surface by ion sputtering. The structure was evaluated using an S-3400N microscope (Hitachi, Japan) under high vacuum conditions at an accelerating voltage of 10 kV in the secondary electron mode.
Histological staining of sections with hematoxylin and eosin
Sections were fixed in 10% buffered formalin (BioVitrum, Russia) and 2% glutaraldehyde, then dehydrated, impregnated and embedded in GISTOMIX paraffi (BioVitrum, Russia). The paraffi blocks were cut into transverse slices 8 μm using an HM 325 microtome (Thermo Scientific, USA). Slices were deparaffinize and dehydrated, stained with Harris’ hematoxylin solution (BioVitrum, Russia) for 15 minutes and then with eosin solution (BioVitrum, Russia) for 30 sec. Samples were washed with water and dehydrated in alcohol series, cleared by xylene and mounted in a mounting medium (BioVitrum, Russia) under a coverslip. Samples were visualized by AXIO Imager A1 microscope (Carl Zeiss, Germany).
в ксилоле и заключали в монтирующую среду (BioVitrum, Россия) под покровное стекло. Визуализацию проводили с помощью световой микроскопии с использованием микроскопа AXIO Imager A1 (Carl Zeiss, Германия).
Инфракрасная спектроскопия с преобразованием Фурье (ИК-спектроскопия)
Химическую структуру полученных гидрогелей характеризовали с помощью ИК-спектроскопии в диапазоне 400–4000 см-1. Предварительно образцы лиофилизировали. Для IPN-гидрогелей после лиофилизации выполняли разлом в жидком азоте с последующим исследованием поверхности и толщи образцов.
Изучение механических свойств IPN-гидрогелей
Образцы готовили на вырубном прессе ZCP 020 (Zwick/Roell, Германия) с использованием ножа специальной формы. Механические свойства тестировали на универсальной испытательной машине серии Z (Zwick/ Roell, Германия) при температуре 37 °С с использованием датчика номинальной силы 50 Н. Предел прочности определяли по максимальному напряжению при растяжении (МПа), упруго-деформативные свойства – по относительному удлинению до начала разрушения (%), модуль Юнга (МПа) определяли в пределах малых деформаций. В качестве групп сравнения тестировали монокомпонент-ные гели на основе фибрина и ПВС.
Оценка усадки образцов
Образцы полимеризовали в 24-луночном планшете, отделяли от формы и измеряли радиус ( r ) и высоту ( h ) образцов гидрогелей (мм) ( n = 5). Объем гидрогелей ( V ) рассчитывали по формуле: V = π × r2 × h (mm3).
Изучение биологических свойств
Тестирование биологических свойств гидрогелей проведено на культуре гибридомы эндотелиальных клеток пупочной вены человека EA hy 926. Для этого образцы гидрогелей в стерильных условиях заливали в лунки 24-луночного планшета ( n = 6), формировали гидрогели как описано выше. Поверхность гидрогелей заселяли клетками по 20 тыс. клеток/лунку и культивировали 72 ч в CO2-инкубаторе при 5% СО2и температуре 37,0 °C.
Оценка жизнеспособности клеток
Клетки окрашивали ядерными красителями Hoechst 33342 (10 мкг/мл, 14533, Sigma Aldrich, USA, St. Louis, МО) в течение 10 мин, и этидиум бромидом (30 мкг/мл, 46067, Sigma Aldrich, Sigma Aldrich, USA, St. Louis, MO) в течение 1 мин. Подсчет мертвых клеток (ядра окрашены этидиум бромидом) и общего количества клеток (ядра окрашены Hoechst) на образцах и культуральном пластике производили на инвертированном микроскопе Axio Observer Z1 (Carl Zeiss, Germany) с 5 случайных полей зрения с каждого дубля.
Количество мертвых клеток (%) = Абсолютное количество мертвых клеток × 100% / Абсолютное количество всех адгезированных клеток. Относительное количество живых клеток определяли путем вычитания доли мертвых клеток из 100% адгезированных клеток.
Оценка пролиферативной активности клеток
Использовали набор Click-iT™ Plus EdU Cell Proliferation Kit for Imaging (Thermo Fisher Scientific, USA). Клетки инкубировали с EdU-реагентом в течение 16 ч,
Fourier transform infrared spectroscopy (IR spectroscopy)
The chemical structure of hydrogels was characterized by IR spectroscopy in the range of 400–4000 cm–1. Samples were lyophilized beforehand. After lyophilization, the IPN hydrogels were broken in liquid nitrogen; and the surface and thickness were examined.
Studying of mechanical properties of IPN hydrogels
Samples were prepared on a ZCP 020 punching press (Zwick/Roell, Germany) using a specially shaped knife. The mechanical properties were tested on a Z-series universal testing machine (Zwick/Roell, Germany) at a temperature of 37 °С using a 50 N nominal force probe. The tensile strength was determined by the maximum tensile stress (MPa), the elastic-deformation properties – by the relative elongation before the onset of failure (%), the Young’s modulus (MPa) – within small deformations. Monocomponent gels of fibrin and PVA were tested as comparison groups.
Sample Shrinkage Assessment
The samples were polymerized in a 24-well plate, removed from the mold. Аnd the radius (r) and height (h) of the hydrogel samples (mm) were measured ( n = 5). The volume of hydrogels (V) was calculated by the formula: V = π × r2 × h (mm3) .
The study of biological properties
The biological properties of hydrogels were tested on a culture of Human Umbilical Vein Endothelial Cell hybridoma EA. hy926. Samples of hydrogels were poured under sterile conditions into the wells of a 24-well plate ( n = 6). Hydrogels were formed as described above. The surface of the hydrogels was colonized with cells at 20 thousand cells/well and cultured for 72 hours in a CO2 incubator at 5% CO2 and a temperature of 37°C.
Cell viability assessment
Cells were stained with Hoechst 33342 nuclear stains (10 µg/mL, 14533, Sigma Aldrich, USA, St. Louis, MO) for 10 minutes followed by ethidium bromide (30 µg/mL, 46067, Sigma Aldrich, Sigma Aldrich, USA, St. Louis, MO) within 1 minute. The calculation of dead cells (nuclei stained with ethidium bromide) and the total number of cells (nuclei stained with Hoechst) on samples and culture plastic was performed on an inverted microscope Axio Observer Z1 (Carl Zeiss, Germany) with 5 random fields of view from each take.
Relative number of dead cells (%) = Absolute number of dead cells × 100% / Absolute number of all adhered cells. The relative number of living cells was determined by subtracting the proportion of dead cells from 100% adherent cells.
Assessment of cell proliferative activity
We used the Click-iT™ Plus EdU Cell Proliferation Kit for Imaging (Thermo Fisher Scientific, USA). Cells were incubated with the EdU reagent for 16 hours, and then stained according to the manufacturer’s instructions. After the procedure, the cell nuclei were counterstained with DAPI 10 μg/ml (Sigma Aldrich, USA). The preparations were analyzed using a scanning confocal microscope далее окрашивали в соответствии с инструкцией производителя. После окончания процедуры ядра клеток контрастировали DAPI 10 мкг/мл (Sigma Aldrich, USA). Препараты анализировали с помощью сканирующего конфокального микроскопа LSM700 (Carl Zeiss, Germany), оценивали 10 случайно выбранных полей зрения для каждой группы (n = 3). Количественный анализ изображений осуществляли в программе ImageJ (National Institutes of Health, USA), подсчитывали общее количество клеток и количество пролиферирующих клеток в поле зрения. Относительное количество пролиферирующих клеток = количество пролиферирующих клеток в поле зрения × 100 / общее количество клеток в поле зрения. Для определения количества адгезированных клеток выполнен пересчёт клеток с поля зрения на 1 мм2.
Статистическая обработка данных
Статистическую и графическую обработку результатов выполняли в программе Prism 6. Нормальность распределения количественных показателей проверяли по критерию Колмогорова – Смирнова. Количественные данные представлены в виде медианы и 1-го и 3-го квартиля ( Me ( Q1; Q3 )). Достоверность различий между группами оценивали с помощью критерия Краскела – Уоллиса с поправкой результатов с учетом множественности сравнения методом FDR. Статистическая значимость определена как p < 0,05 во всех тестах.
Результаты
Структура гидрогелей
На фотографиях со СЭМ видны различия в 3D-струк-туре образцов (рис 1А). Фибрин представлен сетью тонких переплетающихся волокон, ПВС состоит из трубчатых и полигональных полостей, разделенных тонкими стенками, в которых имеются поры. IPN-гидрогель фибрина и ПВС включает оба элемента: стенки и трубчатые структуры покрыты сетью переплетающихся волокон (рис. 1). Однако данный метод не позволяет достоверно отличать структуры, относящиеся к различным источникам (фибрин или ПВС).
Хорошее визуальное разделение 2D структур фибрина и ПВС дает гистологическая окраска гематоксилином и эозином. При этом фибрин окрашивается в ярко красный цвет, ПВС в нежно-сиреневый (рис. 1В). Толща IPN-гидрогеля состоит из равномерно распределенных волокон фибрина и полостей ПВС. Гистологические результаты подтверждают данные СЭМ и свидетельствуют о том, что данный способ позволяет выполнять последовательную полимеризацию с равномерным распределением компонентов в толще IPN-гидрогеля. Однако визуализация края IPN-гидрогеля показывает, что на поверхности и непосредственно вблизи краевой зоны превалирует ПВС (рис. 1С).
Результаты ИК спектроскопии (Fourier Transform Infrared Spectroscopy – FTIR)
FTIR спектр фибрина содержит полосы, типичные для амидной связи белковой структуры, а именно: 1635 см-1 (амид I, обусловлена растяжением связи C-H карбонильной группы), 1550 см-1 (амид II, обусловлена деформационными колебаниями связи N-H и растяжением связи C-N) [15, 16]. Характерные пики поглощения валентных колебаний связи O-H от меж- и внутримолекулярных во-
LSM700 (Carl Zeiss, Germany). 10 randomly selected visual fields were evaluated for each group ( n = 3). Quantitative analysis of images was carried out using the ImageJ program (National Institutes of Health, USA), the total number of cells and the number of proliferating cells in the field of view were counted.
Relative number of proliferating cells = number of proliferating cells in the visual field × 100 / total number of cells in the visual field. To determine the number of adherent cells, they were recalculated from the fieldof view per 1 mm2.
Statistics
Statistical and graphical processing of the results was performed using the Prism 6 program. The normality of the data distribution was evaluated using the Kolmogorov-Smirnov test. Quantitative data are presented as median and 1st and 3rd quartiles ( Me ( Q 1; Q 3)). Comparison between groups was carried out by Kruskal –Wallis test with correction of the results taking into account the multiplicity of comparisons by the FDR method. Statistical significance is defined a p < 0.05 in all tests.
Results
3D and 2D structure of hydrogels
The SEM images show differences in the 3D structure of the samples (Fig. 1A). Fibrin is represented by a network of thin intertwining fibers; PVA consists of tubular and polygonal cavities separated by thin walls with pores. The IPN hydrogel fibrin/P A includes both elements: walls and tubular structures are covered with a network of intertwining fibers (Fig. 1). However, this method does not allow distinguishing structures belonging to different sources (fibrin or P A).
Good visual separation of the 2D structures of fibrin and PVA is obtained by histological staining with hematoxylin and eosin. Wherein, fibrin colored in red; and PVA colored in soft purple (Fig. 1B, 1C). IPN hydrogel inside consists of evenly distributed fibrin fibers and PVA cavities (Fig. 1B). The histological results confirm the SEM images and indicate that this method allows sequential polymerization with a homogeneous distribution of components throughout the IPN hydrogel (Fig. 1В). However, visualization of IPN hydrogel edge shows the predominance of PVA on the surface and immediately near the edge zone (Fig. 1C).
IR spectroscopy (Fourier Transform Infrared Spectroscopy – FTIR)
The FTIR spectrum of fibrin contains bands typical of the amide bond of the protein structure, namely: 1635 cm-1 (amide I, due to the stretching of the C-H bond of the carbonyl group), 1550 cm-1 (amide II, due to bending vibrations of the N-H bond and stretching of the C-N bond) [15, 16] (Fig. 2).
Characteristic absorption peaks of stretching vibrations of the O–H bond from inter- and intramolecular hydrogen bonds are noted at 3300 cm–1 in the spectra of PVA, the bands are also duplicated in the spectra of дородных связей отмечены при 3300 см-1 в спектрах ПВС, полосы дублируются и в спектрах IPN-композитной структуры. Также в обоих спектрах (ПВС и IPN-гидрогелей) обнаружены полосы валентных колебаний C-H алкильных групп в области 2930–2900 см-1 и растяжения C-O-связи гидроксильной группы при 1085 см-1 [17, 18] (рис. 2).
По сравнению с чистым ПВС в спектрах IPN-гидрогеля наблюдали рост интенсивности полос в области, соответствующей амидной связи, что обусловлено присутствием фибрина в составе композитного материала. Отмечены различия в спектрах IPN гидрогеля с поверхности и толщи образца (разлома), которые демонстрируют присутствие большего количества фибрина в толще по сравнению с поверхностью. Эти данные подтверждают результаты гистологического исследования.
Биологические свойства образцов
Медиана количества адгезированных клеток на матрицах из IPN-гидрогеля примерно в 8 раз выше, чем для ПВС, но в 10 раз меньше, чем на фибрине. Пролиферативная активность клеток на ПВС отсутствовала, на IPN-гидрогеле отмечено 13,6% пролиферирующих клеток, максимальные показатели зарегистрированы на фибрине (рис. 3). При этом жизнеспособность прикрепленных клеток была высокой и не различалась в группах (таблица 1).
Примечания: * – p < 0.05 по сравнению с фибрином, # – p < 0.05 по сравнению с ПВС.
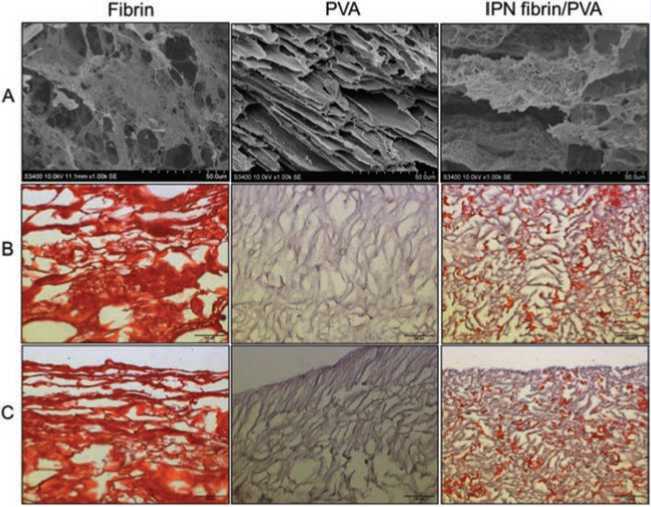
Таблица 1. Клеточная адгезия и жизнеспособность
Biological properties of samples
The median number of adherent cells on IPN hydrogel matrices was about 8 times higher than for PVA, but 10 times less than on fibrin (Table). There was no proliferative activity of cells on PVA. 13.6% of proliferating cells were noted on IPN hydrogel. The maximum values were registered on fibrin (Fig. 3). At the same time, the viability of attached cells was high and did not differ in groups.
Table. Cell adhesion and viability
|
Options |
Fibrin |
PVA |
IPN Fibrin/PVA |
|
Number of cells, mm2 |
294,90 (247,9; 332,6) |
3,13 * (0,00; 11,69) |
25,10 *# (15,69; 38,52) |
|
Proliferative activity, % |
59,52 (54,62; 67,69) |
0,00 * (0,00; 0,00) |
13,63 * # (0,00; 33,33) |
|
Viability, % |
100,00 (100,00; 100,00) |
100,00 (81,25; 100,00) |
100,00 (100,00; 100,00) |
Note: *– p < 0.05 compared to fibrin, # – p < 0.05 compared to PVA.
Рис. 1. Структура гидрогелей. А. СЭМ. Линейка = 50 µm.; В, С. Световая микроскопия. В – толща гидрогелей; С – край гидрогелей. Линейка = 100 µm
Fig. 1. The structure of hydrogels. A. SEM (magnification × 1000); B, C. Light microscopy.
B – inside of hydrogels; C – edge of hydrogels. Scale bar = 100 μm
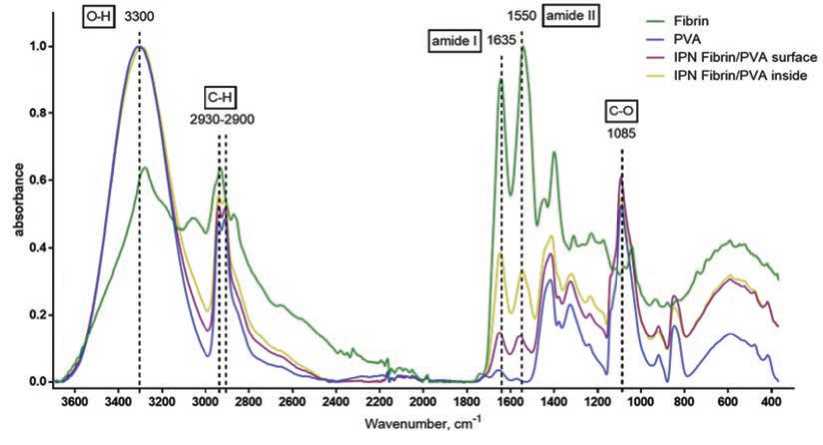
Рис. 2. Спектры поглощения ИК-спектроскопии для фибрина, ПВС, Фибрин-ПВС-гидрогеля с поверхности и толщи Fig. 2. IR absorption spectra for fibrin, P A, IPN Fibrin/PVA hydrogel from surface and inside
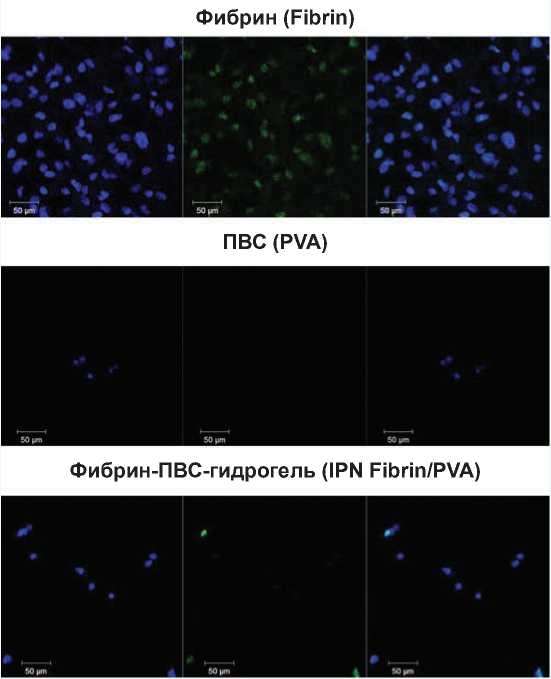
Рис. 3. Конфокальная микроскопия пролиферирующих клеток на гидрогелях. Синее свечение – ядра всех адгезированных клеток, зеленое свечение – ядра пролиферирующих клеток. Линейка = 50 µm.
Fig.3. Confocal microscopy of proliferating cells on hydrogels. Blue, nuclei of all adherent cells, green, nuclei of proliferating cells. Scale bar = 50 μm
Усадка матриц
Объем шаблона для заливки гидрогелей составил 2318,3 (2254,8; 2365,8) мм3. Фибрин после трехкратного замораживания и оттаивания дал значительную усадку и его объем уменьшился до 204,3 (199,5; 216,4) мм3(рис. 4). IPN-гидрогель и полимеризованный ПВС практически не
Matrix shrinkage
The volume of the template for pouring hydrogels was 2318.3 (2254.8; 2365.8) mm3. Fibrin after three times freezing and thawing showed a significant shrinkage and its volume decreased to 204.3 (199.5; 216.4) mm3 (Fig 4). IPN hydrogel and polymerized PVA practically did not подверглись усадке, их объем составил 1683,1 (1640,7; 1789,3) мм3 и 1701 (1643,6; 1763,5) мм3 соответственно.
Механические характеристики гидрогелей
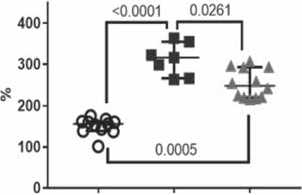
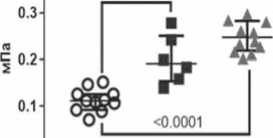
Прочность и удлинение до разрушения образцов IPN-гидрогеля была выше по сравнению с фибрином и ниже, чем ПВС (рис 5). Медианы модуля Юнга (упругости) у IPN-гидрогелей и ПВС не различались между собой, при этом были значительно выше, чем у фибрина.
shrink; their volume was 1683.1 (1640.7; 1789.3) mm3 and 1701 (1643.6; 1763.5) mm3, respectively.
Mechanical characteristics of hydrogels
The strength and elongation at break of the IPN hydrogel samples were higher compared to fibrin and lower than PVA (Fig. 5). The medians Young’s modules (elasticity) of IPN hydrogels and PVA did not differ from each other, while they were significantly higher than those of fibrin.
Фибрин Fibrin
ПВС PVA
Фибрин-ПВС
IPN Fibrin/PVA

Рис. 4. Внешний вид образцов гидрогелей фибрина, ПВС и Фибрин-ПВС-гидрогеля Fig. 4. View of fibrin, PVA and IPN hydrogel samples of fibrin and PVA
Объем
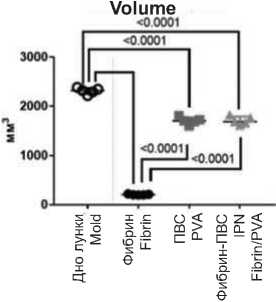
Прочность Tensile strength
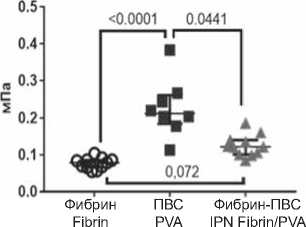
Рис. 5. Механические свойства образцов Fig. 5. Mechanical properties of hydrogels
Относительное удлинение Elongation at break
Фибрин ПВС Фибрин-ПВС
Fibrin PVA IPN Fibrin/PVA
Модуль Юнга
Youngs modulus 0.4т
0.0089 А
0.0---------।--------------1--------------।----------
Фибрин ПВС Фибрин-ПВС
Fibrin PVA IPN Fibrin/PVA
Обсуждение
Мы изучили наиболее важные свойства гибридного IPN-гидрогеля фибрина и ПВС и сравнили со свойствами монокомпонентных контрольных образцов. Визуализация структуры IPN-гидрогелей подтвердила, что предложенный метод позволяет проводить последовательную полимеризацию фибрина и далее ПВС. В результате формируется IPN-гидрогель, состоящий из сети волокон фибрина, покрывающих полостные структуры ПВС. При этом в толще распределение компонентов можно считать равномерным, но на поверхности преобладают структуры ПВС.
Несмотря на улучшение показателей биосовместимости IPN-гидрогеля по сравнению с ПВС, мы не получили ожидаемого высокого роста биологической активности
Discussion
We studied the most important properties of the IPN hydrogel fibrin/PVA and compared with those of monocomponent controls. IPN hydrogels structure confirmed that the proposed method allows sequential polymerization of fibrin and then PVA. As a result, IPN hydrogel is formed by fibrin network and fibrin fibers covering the PVA cavity structures. In this case, the distribution of components inside the IPN hydrogel can be considered homogeneous, but the surface mainly includes PVA.
Despite the improvement in the biocompatibility of the IPN hydrogel compared to PVA, we did not obtain the expected high increase in the biological activity of the IPN hydrogel. That may be due to the peculiarities
IPN-гидрогеля, что может быть связано с особенностями перераспределения компонентов на поверхности матриц в пользу ПВС. ПВС известен своей гидрофильной природой, к тому же не содержит сайты для адгезии клеток, что затрудняет адгезию и удержание клеток [19, 20]. Тем не менее, присутствие относительно небольшого количества фибрина на поверхности IPN-гидрогеля позволило создать условия для адгезии (количество клеток) и жизнедеятельности (пролиферативной активности) клеток, но показатели были существенно ниже, чем на фибрине. При этом ПВС и IPN-гидрогель не обладали цитотоксичностью, об этом свидетельствует высокая жизнеспособность адгезированных клеток.
Одним из существенных недостатков фибрина является выраженная склонность к усадке образцов после отделения от формы (рис. 4). Введение ПВС в структуру фибрина в форме IPN-гидрогеля позволило сформировать резистентный к усадке каркас, что облегчает использование материала для создания конструкций определенной формы в тканевой инженерии. Как ожидалось, введение ПВС в состав фибрина и создание IPN-гидрогеля улучшило прочность, эластичность и упругость материала.
Заключение
Способ последовательной полимеризации IPN-гидрогеля фибрина и ПВС дает равномерное распределение волокон в толще материала и позволяет получать гидрогели с улучшенными механическими свойствами, отсутствием склонности к усадке. Однако перераспределение компонентов на поверхности IPN-гидрогеля в пользу ПВС с поддержанием относительно низкой адгезионности материала, диктует необходимость проведения дальнейших экспериментов по созданию оптимальных условий для жизнедеятельности клеток.
of the redistribution of components on the surface of the matrices in favor of PVA. PVA for its hydrophilic nature rendering thus difficul to support cell adhesion and spreading [19, 20].
Nevertheless, a relatively small amount of fibrin on the surface of the IPN hydrogel made it possible to create conditions for adhesion (number of cells) and vital activity (proliferative activity) of cells, but the indicators were significantly lower than on fibrin. At the same time, PVA and IPN hydrogel did not possess cytotoxicity, which is evidenced by the high viability of adherent cells.
One of the significant disadvantages of fibrin is a pronounced tendency for samples to shrink after separation from the mold (Fig. 4). The introduction of PVA into the fibrin structure in the form of an IPN hydrogel made it possible to form a shrink-resistant scaffold, which facilitates the use of the material to create structures of a certain shape in tissue engineering. As expected, the introduction of PVA into the composition of fibrin and the creation of an IPN hydrogel improved the strength, elasticity, and resilience of the material.
Conclusion
The method of successive polymerization of IPN hydrogel fibrin/P A gives an equal distribution of fibers in the thickness of the material and makes it possible to obtain hydrogels with improved mechanical properties and no tendency to shrink. However, the redistribution of components on the surface of the IPN hydrogel in favor of PVA while maintaining a relatively low adhesiveness of the material dictates the need for further experiments to create optimal conditions for cell activity.
Список литературы Первые результаты создания гибридного гидрогеля на основе фибрина и поливинилового спирта: сравнение с монокомпонентными гидрогелями
- Chlupáč J., Filová E., Riedel T., Houska M., Brynda E., Remy-Zolghadri M. et al. Attachment of human endothelial cells to polyester vascular grafts: pre-coating with adhesive protein assemblies and resistance to shortterm shear stress. Physiol. Res. 2014;63(2):167–177. DOI: 10.33549/physiolres.932577.
- Filová E., Brynda E., Riedel T., Chlupáč J., Vandrovcová M., Svindrych Z. et al. Improved adhesion and differentiation of endothelial cells on surface-attached fibrin structures containing extracellular matrix proteins. J. Biomed. Mater. Res. Part A. 2014;102(3):698–712. DOI: 10.1002/jbm.a.34733.
- Marinaro F., Silva J.M., Barros A.A., Aroso I.M., Gómez-Blanco J.C., Jardin I. et al. A fibrin coating method of polypropylene meshes enables the adhesion of menstrual blood-derived mesenchymal stromal cells: a new delivery strategy for stem cell-based therapies. Int. J. Mol. Sci. 2021;22(24):13385. DOI: 10.3390/ijms222413385.
- Morin K.T., Tranquillo R.T. In vitro models of angiogenesis and vasculogenesis in fibrin gel. Exp. Cell Res. 2013;319(16):2409–2417. DOI: 10.1016/j.yexcr.2013.06.006.
- Certelli A., Valente P., Uccelli A., Grosso A., Di Maggio N., D’Amico R et al. Robust angiogenesis and arteriogenesis in the skin of diabetic mice by transient delivery of engineered VEGF and PDGF-BB proteins in fibrin hydrogels. Front. Bioeng. Biotechnol. 2021;9:688467. DOI: 10.3389/fbioe.2021.688467.
- Ханова М.Ю., Великанова Е.А., Глушкова Т.В., Матвеева В.Г. Создание персонифицированного клеточнозаселенного сосудистого протеза in vitro. Комплексные проблемы сердечно-сосудистых заболеваний. 2021;10(2S):89–93. [Khanova M.Yu., Velikanova E.A., Glushkova T.V., Matveeva V.G. Development of personalized cell-populated vascular graft in vitro. Complex Issues of Cardiovascular Diseases. 2021;10(2S):89–93. (In Russ.)]. DOI: 10.17802/2306-1278-2021-10-2S-89-93.
- Utracki L.A., Wilkie C.A. (editors). Polymer Blends Handbook. New York, Heidelberg, Dordrecht, London: Springer Reference; 2002. DOI: 10.1007/978-94-007-6064-6.
- Slaughter B.V., Khurshid S.S., Fisher O.Z., Khademhosseini A., Peppas N.A. Hydrogels in regenerative medicine. Adv. Mater. 2009;21(32–33):3307–3329. DOI: 10.1002/adma.200802106.
- Dhand A.P., Galarraga J.H., Burdick J.A. Enhancing biopolymer hydrogel functionality through interpenetrating networks. Trends Biotechnol. 2021;39(5):519–538. DOI: 10.1016/j.tibtech.2020.08.007.
- Kumar A., Han S.S. PVA-based hydrogels for tissue engineering: A review. Int. J. Polym. Mater. Polym. Biomater. 2017;66(4):159–182. DOI: 10.1080/00914037.2016.1190930.
- Weller W.J. Emerging technologies in upper extremity surgery: polyvinyl alcohol hydrogel implant for thumb carpometacarpal arthroplasty and processed nerve allograft and nerve conduit for digital nerve repairs. Orthop. Clin. North. Am. 2019;50(1):87–93. DOI: 10.1016/j.ocl.2018.08.011.
- Deshmukh K., Ahamed M.B., Deshmukh R., Pasha S.K., Bhagat P., Chidambaram K. Biopolymer composites with high dielectric performance: Interface engineering. Biopolymer Composites in Electronics. 2017:27–128. DOI: 10.1016/B978-0-12-809261-3.00003-6.
- Gupta S.T.G., Basu B., Goswami S., Sinha A. Stiffness- and wettability- dependent myoblast cell compatibility of transparent poly(vinyl alcohol) hydrogels. J. Biomed. Mater. Res. Part B: Appl. Biomater. 2013;101B:346–354. DOI: 10.1002/jbm.b.32845.
- Способ изготовления аутологичного фибрина с регулируемым содержанием фибриногена без использования экзогенного тромбина. Патент RU 2758260 C1. Антонова Л.В., Матвеева В.Г., Ханова М.Ю., Барбараш О.Л., Барбараш Л.С. Дата регистрации: 27.10.2021. [Method for manufacturing autologous fibrin with controlled fibrinogen content without using exogenous thrombin. Patent RU 2758260 C1. Antonova L.V., Matveeva V.G., Khanova M.Yu., Barbarash O.L., Barbarash L.S. Date of registration: 27.10.2021. (In Russ.)]. URL: https://elibrary.ru/item.asp?id=47122803 (09.01.2023).
- Brown E.E., Zhang J., Laborie M.P.G. Never-dried bacterial cellulose/ fi brin composites: preparation, morphology and mechanical properties. Cellulose. 2011;18:631–641. DOI: 10.1007/s10570-011-9500-8.
- Blat A., Dybas J., Chrabaszcz K., Bulat K., Jasztal A., Kaczmarska M. et al. FTIR, Raman and AFM characterization of the clinically valid biochemical parameters of the thrombi in acute ischemic stroke. Scientifi c reports. 2019;9(1):1–10. DOI: 10.1038/s41598-019-51932-0.
- Choo K., Ching Y., Chuah C., Julai S., Liou N.S. Preparation and characterization of polyvinyl alcohol-chitosan composite fi lms reinforced with cellulose nanofi ber. Materials. 2016;9(8):644. DOI: 10.3390/ma9080644.
- Sa’adon S., Ansari M.N.M., Razak S.I.A., Anand J.S., Nayan N.H.M., Ismail A.E. et al. Preparation and physicochemical characterization of a diclofenac sodium-dual layer polyvinyl alcohol patch. Polymers. 2021;13:2459. DOI: 10.3390/polym13152459.
- Ino J.M., Chevallier P., Letourneur D., Mantovani D., Le Visage C. Plasma functionalization of poly(vinyl alcohol) hydrogel for cell adhesion enhancement. Biomatter. 2013;3(4):e25414. DOI: 10.4161/biom.25414.
- Qiu K., Netravali A.N. A composting study of membrane-like polyvinyl alcohol based resins and nanocomposites. J. Polym. Environ. 2013;21:658–674. DOI: 10.1007/s10924-013-0584-0.


