Первые результаты визуализации и структурной оценки гликокаликса эндотелиоцитов при варикозной болезни
Автор: Шевченко Ю.Л., Мелькумянц А.М., Стойко Ю.М., Яшкин М.Н., Черняго Т.Ю., Гудымович В.Г.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Редакционные статьи
Статья в выпуске: 4 т.18, 2023 года.
Бесплатный доступ
Изучение функции эндотелия в настоящее время значительно расширяет представления о ряде физиологических и патологических процессов, происходящих в организме человека. Их спектр весьма широк и охватывает не только такие направления как ангиология, сердечно-сосудистая патология, флебология, но и смежные области - сепсисологию, онкологию, нефрологию и другие. Структурный компонент клетки - гликокаликс - до настоящего времени является малоизученным. Основной причиной этого, прежде всего, является хрупкость вследствие его функционального предназначения. Попытки его микроскопического исследования, в основном, носят непрямой характер. Непосредственная визуализация гликокаликса с помощью электронной микроскопии крайне трудна. Статья посвящена анализу особенностей изучения микроскопической структуры гликокаликса и его функции. Представлены первые результаты электронной микроскопической картины гликокаликса эндотелия венозной стенки у пациентов с варикозной болезнью, описание методики и особенностей проведения данного исследования для его визуализации.
ID: 140303495 Короткий адрес: https://sciup.org/140303495
Текст ред. заметки Первые результаты визуализации и структурной оценки гликокаликса эндотелиоцитов при варикозной болезни
Кардинальное изменение представлений о роли эндотелия в функционировании сердечно-сосудистой системы произошло в начале восьмидесятых годов прошлого века. До 1980 года за монослоем клеток эндотелия признавали только две функции: барьерную, не допускающую проникновения форменных элементов крови в сосудистую стенку, и антитромбогенную, препятствующую внутрисосудистому свертыванию крови. Однако Р. Фурчготт и Дж. Завадски [1] в своей классической работе показали, что эндотелий играет важнейшую роль в регуляции сосудистого тонуса, опосредуя расслабление гладких мышц в ответ на действие многих сосудорасширяющих агонистов [2]. Тогда же было экспериментально доказано, что диаметр сосудов постоянно приспосабливается к величине скорости кровотока и что эта реакция обусловлена способностью эндотелия вырабатывать фактор, расслабляющий гладкие мышцы, в ответ на повышение напряжения сдвига на сосудистой стенке [3; 4]. В течение короткого промежутка времени было показано, что производимый эндотелием фактор, расслабляющий гладкие мышцы, представляет собой образующийся из L-аргинина оксид азота (NO) [5; 6].
Дальнейшие исследования показали, что эндотели-оциты производят не только факторы, расслабляющие гладкие мышцы, такие как NO, эндотелиальный фактор гиперполяризации, простациклин, но и факторы, вызывающие вазоконстрикцию — эндотелины, тромбоксан А2, ангиотензин II. Особое значение имеет тот факт, что большинство из этих субстанций, включая также производимые эндотелием фактор фон Виллебранда и тканевой фактор, играют важную роль в системе гемостаза [7]. Наконец, нужно отметить, что эндотелий может принимать

участие и в процессах воспалительного и иммунного ответов, поскольку способен секретировать как провос-палительные, так и антивоспалительные цитокины и хемокины [8; 9].
Таким образом, накопленные знания не оставляют сомнений в том, что сосудистый эндотелий играет фундаментальную роль в нормальном функционировании организма, и что эндотелиальная дисфункция должна приводить к серьезным нарушениям не только сердечнососудистой системы, но и всего организма.
В большинстве статей, посвященных структуре сосудистой стенки и функции ее различных слоев, можно найти утверждение о том, что именно монослой эндотелиоцитов является «границей» между кровью и сосудистой стенкой, это утверждение не совсем верно. Эндотелий действительно является первым слоем клеток, с которым контактирует текущая по сосудам кровь, но у эндотелия есть свой защитный неклеточный слой — производимый самим эндотелием внеклеточный матрикс, — гликокаликс. Это слой макромолекул, состоящий из протеогликанов, гликозаминогликанов, гликопротеинов и гликолипидов [10]. Он покрывает люминальную (обращенную в просвет сосуда) поверхность эндотелиальных клеток [11], и именно гликокаликс в комбинации с эндотелием обеспечивают гомеостаз сосудистой стенки, поскольку они регулируют её проницаемость [12; 13], тонус гладких мышц и гидравлическое сопротивление сосудов [14; 15], а также предотвращают возникновение микрососудистого тромбоза и подавляют адгезию лейкоцитов и тромбоцитов [16].
Гликокаликс представляет собой слой, покрывающий плазматическую мембрану большинства клеток-эукариотов и состоящий из связанных с мембраной белков, гликопротеинов, гликолипидов и протеогликанов. Предположение о том, что и клетки эндотелия имеют такое покрытие, было впервые высказано еще в 40-х годах прошлого века [17; 18]. Однако, поскольку обнаружить его с помощью световой микроскопии было невозможно, это предположение в течение более двадцати лет оставалось ничем не подкрепленным утверждением. Лишь в 1958 году Копли и Стейпл [19], прижизненно микроскопируя сосуды защечного мешка хомяка, показали, что при внутривенном введении голубого понтамина в микрососудах отчетливо определяется практически неподвижный неокрашенный пристенный слой плазмы. Авторы предположили, что движение плазмы в непосредственной близости от сосудистой стенки тормозит некий неклеточный слой, в который не проникает краситель. В 1963 году Bennett [20] назвал этот слой гликокаликсом, что в переводе с греческого означает «сладкая шелуха» или «сладкая оболочка». Такое название довольно точно отражало представление тех лет о том, что этот обволакивающий клетки слой состоит из мукополисахаридов, производимых самими клетками, то есть представляет собой углеводистый внеклеточный матрикс.
Спустя три года Люфт [21], используя рутениевый красный — катионный краситель, имеющий высокое сродство к мукополисахаридам, являющимся углеводной частью гликокаликса, смог с помощью электронной микроскопии визуализировать тонкий слой макромолекул, покрывающий эндотелий. Толщина этого слоя, по данным Люфта, составляла порядка 20 нм, то есть всего в 2–3 раза превосходила толщину эндотелиальной мембраны. И с того времени в течение почти 30 лет, несмотря на использование разных красителей и методов фиксации, электронномикроскопические исследования показывали, что толщина эндотелиального гликокаликса (ЭГ) даже в крупных артериях не превосходит 60–100 нм. Трудно было себе представить, что имеющее столь малую толщину покрытие эндотелиоцитов могло значимо влиять на функционирование сосудистой стенки.
Однако, начиная с конца 1970-х годов, в литературе стали появляться данные гемодинамических исследований, указывавшие на то, что слой ЭГ должен иметь значительно большую толщину, чем это следовало из данных электронной микроскопии [22; 23]. Эти физиологические измерения показывали, что толщина гликокаликса в капиллярах и артериях млекопитающих должна составлять примерно от 0.5 до 3.0 мкм [24], что, по крайней мере, на порядок больше величин, которые давали микроскопические измерения.
Многие исследователи высказывали предположение о том, что гликокаликс представляет собой весьма «хрупкий» слой, который может легко повреждаться в процессе приготовления препарата для электронной микроскопии и что именно это повреждение обусловливает столь маленькие значения толщины гликокаликса при его микроскопировании. И действительно, ван ден Берг и соавторы, изменив протокол окрашивания и фиксации препарата и использовав в качестве красителя голубой алциан 8GX, показали, что толщина слоя гликокаликса в капиллярах миокарда крыс может достигать 500 нм [12]. Несколько позднее методом конфокальной лазерной сканирующей микроскопии было показано, что толщина гликокаликса в культуре эндотелиальных клеток пупочной вены человека составляет 2–3 мкм [25]. Далее, методом двухфотонной сканирующей микроскопии было показано, что толщина гликокаликса в интактных сонных артериях мышей составляет в среднем 4.5 мкм [26].
Отметим, что толщина гликокаликса, во-первых, различна в сосудах разного калибра (от 0,4 мкм в капиллярах до 3–5 мкм в артериях) и, во-вторых, эта величина в каждом сосуде весьма непостоянна, поскольку, с одной стороны, содержащиеся в крови протеазы и гликозидазы постоянно слущивают (укорачивают) волокна гликока-ликса, а, с другой стороны, эндотелий постоянно нарабатывает новый гликокаликс, причем тем интенсивнее, чем выше напряжение сдвига на стенке сосуда [27; 28]. Как следствие, в литературе можно найти довольно противоречивую информацию о структуре и размерах отдельных компонентов ЭГ.
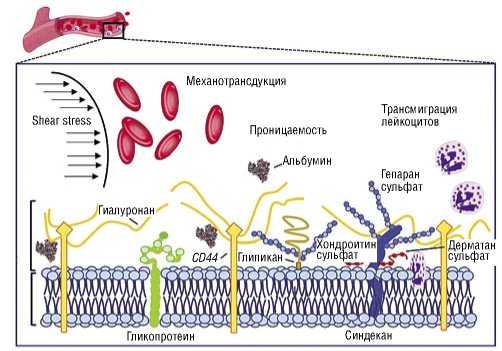
Рис. 1. Структура и функции ЭГ. Схематическое изображение основных компонентов и функций ЭГ. ЭГ состоит из протеогликанов с длинными боковыми цепями гликозаминогликанов (GAG-цепь) и гликопротеинов с короткими разветвленными углеводными боковыми цепями. ЭГ модулирует процессы коагуляции, воспаления и механотрансдукции [29] (с адаптацией).

Составляющие гликокаликса можно «пометить» специфическими маркерами, что окрашивает их и позволяет наблюдать в флуоресцентном микроскопе. Таким образом, состав и строение гликокаликса можно достаточно хорошо определить при микроскопировании сосуда. Наиболее общие представления о структуре гликокаликса в норме и при патологических состояниях дают рисунки 1–4.
Поскольку, как мы уже отметили, состояние эндотелия в значительной степени определяет способность сердечно-сосудистой системы нормально функционировать, то нет сомнений в том, что достигнуть максимальной эффективности в лечении сердечно-сосудистой патологии невозможно без понимания процессов, приводящих к дисфункции эндотелия. В частности, известно, что варикозная болезнь является следствием изменений, происходящих как в эндотелиоцитах, так и во внеклеточном матриксе, приводящих, в конечном итоге, к изменениям венозного тонуса. Таким образом, можно утверждать, что нарушения состояния и функции венозных сосудов с высокой вероятностью связаны с трансформацией ЭГ.
Периодическая структура ЭГ была впервые выявлена в исследовании Squire и соавторов [33], которые, используя преобразование Фурье изображений, полученных при электронной микроскопии, показали, что компоненты ЭГ образуют квазипериодическую трехмерную сеть, связанную с актином цитоскелета. Позднее, эта модель ультраструктуры гликокаликса позволила исследователям доказать, что ЭГ является механорецептором, воспринимающим действующую на него со стороны текущей крови силу вязкого трения (напряжение сдвига), что обеспечивает эндотелий-зависимую регуляцию тонуса сосудов при изменениях скорости кровотока [14; 15].
Несмотря на очевидно важную роль ЭГ, его оценка в современной научной литературе не находит широкого внимания, что, вероятно, обусловлено трудоемкостью инструментальных исследований, позволяющих визуализировать ЭГ. Разработка методов стабилизации клеточной мембраны дала ключ к реальной визуализации гликока-ликса сначала с помощью трансмиссионной электронной микроскопии, а затем и других методов (просвечивающей электронной, флуоресцентной, конфокальной, конфокальной лазерной сканирующей микроскопии, двухфотонной лазерной сканирующей микроскопии и др.).
Гликокаликс непрерывно обновляется за счет сбалансированных и достаточно интенсивных процессов деградации и синтеза. При различных заболеваниях этот баланс смещается в сторону деградации, что приводит к чистой потере гликокаликса. При этом утрачиваются или нарушаются многие функции, за которые он отвечает. В зависимости от заболевания скорость, с которой про-
Residue of Core Protein
Platelet
Monocyte
Residue of Glucosaminoglycan
Activated Granulocyte
Cytokines
Hyaluronan
Reduced hyaluronan
Glycocalyx
Thin cocalyx
Thrombus
Glucosaminogly
Core Protein
Reduced Glucosaminogl
Б
B
[ Integrins ICAMs ~т PECAM-1 Selectin—■
А Endothelial Cells____^________I____I
Injured Endothelial Cells
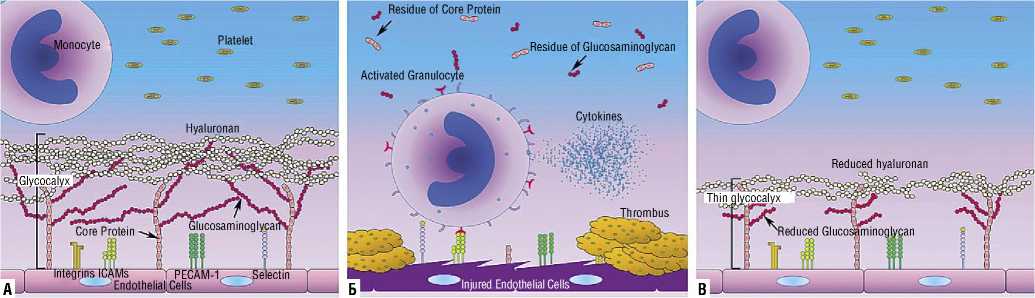
Рис. 2. Схема ЭГ поверхностные рецепторы нормального эндотелия покрыты ЭГ, который состоит из сердцевинного белка, гликозаминогликанов и гиалуроновой кислоты. Только основной белок связывается с эндотелиальными клетками; гликозаминогликаны и гиалуронан напрямую не взаимодействуют с этими клетками (левая панель). (Б) Тяжелые воспалительные состояния, такие как цитокиновый шторм, могут разрушать ЭГ. Это может привести к экспонированию как поверхностных, так и поверхностных рецепторов эндотелиальных клеток в просвет сосуда; это, в свою очередь, позволяет гранулоцитам и тромбоцитам прикрепляться к эндотелиальным клеткам и вызывать повреждения и образование тромбов, которые могут блокировать кровоток (средняя панель). (В) Хронические состояния, такие как диабет, ХБП и гипертриглицеридемия, могут снижать выработку компонентов гликокаликса; это приводит к истончению структуры гликокаликса, делая ее более уязвимой для повреждения внешними раздражителями (правая панель) [30].

исходит потеря гликокаликса, различается, и это может иметь решающее значение для терапии, необходимой для его восстановления. К заболеваниям со стремительной деградацией гликокаликса и острой потребностью в его восстановлении относятся острые ишемически-репер-фузионные состояния, сепсис, хирургический стресс, ожоги, пережатие аорты при сердечно-сосудистом шунтировании, а также инфекционные заболевания, вызванные Staphylococcus aureus, Pseudomonas aeruginosa или сибирской язвой [11–14]. Вторая большая группа заболеваний связана с постепенно нарастающим дисбалансом между синтезом и деградацией, приводящим к дефектам гликокаликса. Он представлен сахарным диабетом, хроническими сердечно-сосудистыми заболеваниями, хроническими заболеваниями почек, опухолями, хроническими воспалительными процессами [34–37].
Исследования, посвященные хроническим заболеваниям вен нижних конечностей, определяют одним из ведущих звеньев патогенеза этой группы заболеваний развитие эндотелиальной дисфункции. Действительно, дисбаланс обмена жидкости в системе «сосуд-ткань-сосуд» нарушается. Причины таких нарушений лежат, по-видимому, не только в плоскости изменения соотношения давлений. Здесь задействован также и ряд универсальных механизмов, включающих воспалительную реакцию сосудистой стенки, ишемию тканей и др. Прогрессирование клапанной недостаточности, повышение венозного давления, возникновение веновенозного рефлюкса способствуют прогрессированию воспалительных реакций на венозном эндотелии. Этот патологический цикл вызывает хроническое повреждение венозной стенки. Лейкоцит-эндотелиальные взаимодействия играют важную роль в формировании хронической венозной недостаточности. Таким образом, можно предположить, что феномен эндотелиальной дисфункции является ранним и ключевым событием в расширении вен, недостаточности венозных клапанов, и, следовательно, в патофизиологии варикозной болезни вен нижних конечностей [38]. Безусловно, частный вклад воспалительных реакций в общую картину макроскопических патоморфологических изменений может быть различным. Но объединяющим является процесс повреждения гликокаликса, влекущий за собой последующие патологические каскады.
К сожалению, эта тематика на сегодняшний день представляется новой и недостаточно изученной. На текущем этапе отсутствуют данные о визуализации ЭГ у человека при сосудистых заболеваниях и, в частности, при варикозной болезни вен нижних конечностей.
Как уже было отмечено, исследователями были предприняты множественные попытки визуализации гликокаликса эндотелия. Таких исследований в научной литературе у пациентов с варикозной болезнью не проводилось. В своей работе мы преследовали цель визуализировать гликокаликс у пациентов с варикозной болезнью вен нижних конечностей.
Образцы вен были получены при проведении плановых оперативных вмешательств. Вена блокируется с двух сторон на расстоянии 2 см. Вводится две иглы на расстоянии 1–2 см друг от друга. За иглами вена перевязывается и осуществляется перфузия образца через одну из игл раствором Рингера до появления прозрачного эффлюента из второй иглы. Затем в этот сегмент вены вводится 2,5% раствор Рингера, осуществляется фиксация в течение 5 мин. Затем вырезается сегмент вены, не травмируя его срединный участок и помещается в бюкс, содержащий 2,5% глутарового альдегида на Рингере. Бюкс плотно закрывается, маркируется, помещается в темный холодильник с последующей отправкой в лабораторию для выполнения электронной микроскопии.
Срезы изучались и были сфотографированы на трансмиссионном электронном микроскопе JEOL JEM-1011 (просвечивающий электронный микроскоп с ускоряющим напряжением 100 кВ, предназначенный для работы с биологическими объектами в режиме повышенного контраста и широкого поля с разрешающей способностью 0,3 нм). Микроскоп оборудован электронной CCD камерой Gatan Orius 832 с разрешением 4008 x 2672.
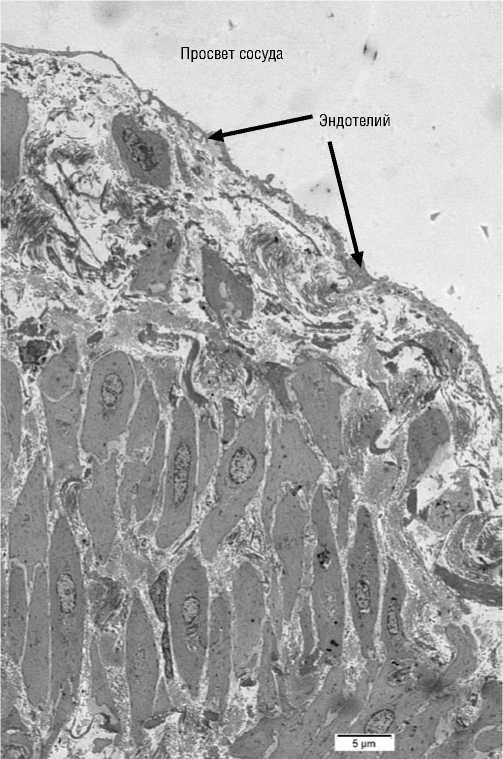
Электроннограмма эндотелия 1. Общий вид вены (увеличение Х3000).
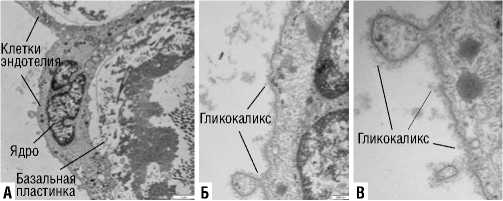
Электроннограмма эндотелия 2. Клетка эндотелия вены, А – увеличение Х12000, Б – у величение Х40000, В – увеличение Х60000.
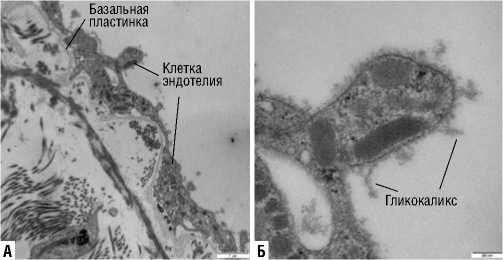
Электроннограмма эндотелия 3. Клетка эндотелия вены, А – увеличение Х12000, Б – увеличение Х60000.
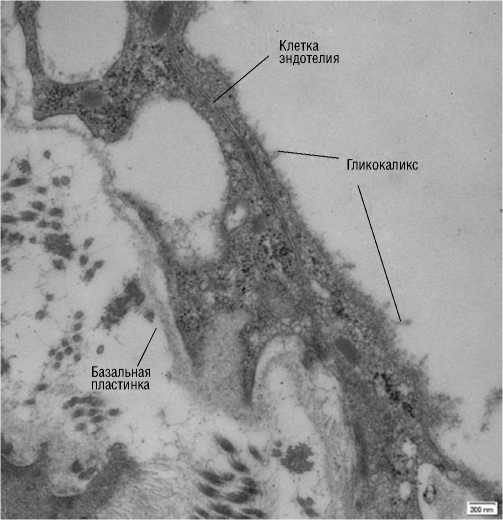
Электроннограмма эндотелия 4. Клетка эндотелия вены с гликокаликсом, увеличение Х50000.
Полученные результаты с фрагментами гликокалик-са представлены на электроннограммах эндотелия (1–4). На электроннограмме эндотелия 1 полость варикозно расширенной вены выстлана эндотелием. Клетки покрыты тонким слоем гликокаликса толщиной до 250 нм.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Первые результаты визуализации и структурной оценки гликокаликса эндотелиоцитов при варикозной болезни
- Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 1980; 288 (5789): 373-376. doi: 10.1038/288373a0.
- Furchgott RF. Role of endothelium in responses of vascular smooth muscle. Circulation research. 1983; 53(5): 557-573. doi: 10.1161/01.res.53.5. 557.
- Smieško V, Kožík J, Doležel S. Role of endothelium in the control of arterial diameter by blood flow. Journal of Vascular Research. 1985; 22(5): 247-251.
- Melkumyants AM, Balashov SA, Khayutin VM. Control of arterial lumen by shear stress on endothelium. Physiology. 1995; 10(5): 204-210. doi: 10.1093/cvr/23.9.741.
- Ignarro LJ, Buga G, Wood KS, et al. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proceedings of the National Academy of Sciences. 1987; 84(24): 9265-9269. doi: 10.1073/pnas.84.24.9265.
- Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 1987; 327(6122): 524-526. doi: 10.1038/327524a0.
- Verhamme P, Hoylaerts MF. The pivotal role of the endothelium in haemostasis and thrombosis. Acta Clinica Belgica. 2006; 61(5): 213-219. doi: 10.1179/acb.2006.036.
- Cines DB, Pollak ES, Buck CA, Loscalzo J, et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders. The Journal of the American Society of Hematology. 1998; 91(10): 3527-3561.
- Фрейдлин И.С., Шейкин Ю.А. Эндотелиальные клетки в качестве мишеней и продуцентов цитокинов // Медицинская иммунология. — 2001. — Т.3. — №4. — С.499-514. [Frejdlin IS, SHejkin YUA. Endotelial’nye kletki v kachestve mishenej i producentov citokinov. Medicinskaya immunologiya. 2001; 3(4): 499-514. (In Russ.)]
- Weinbaum S, Tarbell JM, Damiano ER. The structure and function of the endothelial glycocalyx layer. Annи Rev Biomed Eng. 2007; 9: 121-167. doi: 10.1146/annurev.bioeng.9.060906.151959.
- Alphonsus CS, Rodseth RN. The endothelial glycocalyx: a review of the vascular barrier. Anesthesia. 2014; 69(7): 777-784. doi: 10.1111/anae. 12661.
- van den Berg BM, Vink H, Spaan JA. The endothelial glycocalyx protects against myocardial edema. Circulation research. 2003; 92(6): 592-594. doi: 10.1161/01.RES.0000065917.53950.75.
- Collins SR, Blank RS, Deatherage LS, et al. The endothelial glycocalyx: Emerging concepts in pulmonary edema and acute lung injury. Anesthesia and Analgesia. 2013; 117(3): 664. doi: 10.1213/ANE.0b013e3182975b85.
- Мелькумянц А.М. О роли эндотелиального гликокаликса в механогенной регуляции сопротивления артериальных сосудов // Успехи физиологических наук. — 2012. — Т.43. — №4. — С.45-58. [Mel’kumyanc AM. O roli endotelial’nogo glikokaliksa v mekhanogennoj regulyacii soprotivleniya arterial’nyh sosudov. Uspekhi fiziologicheskih nauk. 2012; 43(4): 45-58. (In Russ.)]
- Мелькумянц А.М., Балашов С.А., Гончар И.В. Влияние повреждения эндотелиального гликокаликса на способность артерий регулировать свой просвет при изменениях скорости кровотока // Российский физиологический журнал им. И.М. Сеченова. — 2017. — Т.103. — №12. — С.1370-1376. [Mel’kumyanc AM, Balashov SA, Gonchar IV. Vliyanie povrezhdeniya endotelial’nogo glikokaliksa na sposobnost’ arterij regulirovat’ svoj prosvet pri izmeneniyah skorosti krovotoka. Rossijskij fiziologicheskij zhurnal im. I.M. Sechenova. 2017; 103(12): 1370-1376. (In Russ.)]
- Weinbaum S, Cancel LM, Fu BM, Tarbell JM. The glycocalyx and its role in vascular physiology and vascular related diseases. Cardiovascular engineering and technology. 2021; 12: 37-71. doi: 10.1007/s13239-020-00485-9.
- Danielli JF. Capillary permeability and odema in the perfused frog. The Journal of physiology. 1940: 98(1): 109. doi: 10.1113/jphysiol.1940.sp003837.
- Chambers R, Zweifach BW. Functional activity of the blood capillary bed, with special reference to visceral tissue. Annals of the New York Academy of Sciences. 1946; 46(8); 683-695. doi: 10.1111/j.1749-6632.1946.tb31697.x.
- Copley FL, Staple PH. Hemorheological studies on the plasmatic zone in the microcirculation of the cheek pouch of Chinese and Syrian hamsters. Biorheology. 1962; 1(1); 3-14.
- Bennett HS. Morphological aspects of extracellular polysaccharides. Journal of histochemistry & cytochemistry. 1963; 11(1): 14-23.
- Luft JH. Fine structure of capillary and endocapillary layer as revealed by ruthenium red. Federation proceedings. 1966; 25(6); 1773-1783.
- Klitzman B, Duling BR. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. American Journal of Physiology-Heart and Circulatory Physiology. 1979; 237(4): 481-490. doi: 10.1152/ajpheart.1979.237.4.H481.
- Pries AR, Secomb TW, Gaehtgens P, et al. Blood flow in microvascular network — experiments and simulation. Microcirculation. 1990; 67(4); 826-834. (In English). doi: 10.1161/01.res.67.4.826.
- Drenckhahn D, Ness W. The endothelial contractile cytoskeleton. Vascular endothelium: physiology, pathology and therapeutic opportunities. 1977; 1-15.
- Barker A, Konopatskaya O, Neal CR, et al. Observation and characterisation of the glycocalyx of viable human endothelial cells using confocal laser scanning microscopy. Physical chemistry chemical physics. 2004; 6(5); 1006-1011. doi: 10.1039/B312189E.
- Megens RT, Reitsma S, Schiffers PH, et al. Two-photon microscopy of vital murine elastic and muscular arteries. Combined structural and functional imaging with subcellular resolution. Journal of vascular research. 2007; 44(2): 87-98. doi: 10.1159/000098259.
- Wang S, Okano M, Yoshida Y. Ultrastructure of endothelial cells and lipid deposition on the flow dividers of brachiocephalic and left subclavian arterial bifurcations of the rabbit aorta. J. Japanise Atheroscler. Soc. 1991; 19: 1089-1100.
- Woolf N. The arterial endothelium. Pathology of atherosclerosis. 1982; 25-45. doi: 10.3390/ijms23063346.
- Villalba N, Baby S, Yuan SY. The endothelial glycocalyx as a double-edged sword in microvascular homeostasis and pathogenesis. Frontiers in Cell and Developmental Biology. 2021; 9: 711003. doi: 10.3389/fcell.2021. 711003.
- Suzuki A, Tomita H, Okada H. Form follows function: The endothelial glycocalyx. Translational Research. 2022; 247: 158-167. doi: 10.1016/j.trsl. 2022.03.014.
- Moore KH, Murphy HA, George EM. The glycocalyx: a central regulator of vascular function. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2021; 320(4): 508-518. doi: 10.1152/ajpregu.00340.2020.
- Weinbaum S, Tarbell JM, Damiano ER. The structure and function of the endothelial glycocalyx layer. Annu. Rev. Biomed. 2007; 9: 121-167. doi: 10.1146/annurev.bioeng.9.060906.151959.
- Squire JM, Chew M, Nneji G, et al. Quasi-periodic substructure in the microvessel endothelial glycocalyx: a possible explanation for molecular filtering? Journal of structural biology. 2001; 136(3): 239-255. doi: 10.1006/jsbi.2002.4441.
- Abassi Z, Armaly Z, Heyman SN. Glycocalyx degradation in ischemia-reperfusion injury. The American Journal of Pathology. 2020; 190(4): 752-767. doi: 10.1016/j.ajpath.2019.08.019.
- Goligorsky MS, Sun D. Glycocalyx in endotoxemia and sepsis. The American journal of pathology. 2020; 190(4): 791-798. doi: 10.1016/j.ajpath.2019.06.017.
- Popova TG, Millis B, Bradburne C, et al. Acceleration of epithelial cell syndecan-1 shedding by anthrax hemolytic virulence factors. BMC microbiology. 2006: 6(1): 1-16. doi: 10.1186/1471-2180-6-8.
- Holzmann MS, Winkler MS, Strunden MS, et al. Syndecan-1 as a biomarker for sepsis survival after major abdominal surgery. Biomarkers in medicine. 2018; 12(2): 119-127. doi: 10.2217/bmm-2017-0231.
- Шевченко Ю.Л., Стойко Ю.М., Гудымович В.Г. Дисфункция эндотелия и эндокарда при сердечно-сосудистых заболеваниях (патогенез, диагностика, профилактика и лечение). — М.: Национальный медико-хирургический Центр им. Н.И. Пирогова, 2022. — 224 с. [SHevchenko YUL, Stoiko YUM, Gudymovich VG. Disfunkciya endoteliya i endokarda pri srdechno-sosudistyh zabolevaniyah (patogenez, diagnostika, profilaktika i lechenie). M.: Nacional’nyj mediko-hirurgicheskij Centr im. N.I. Pirogova, 2022. 224 р. (In Russ.)]
- Шевченко Ю.Л., Стойко Ю.М., Гудымович В.Г., Черняго Т.Ю. Гликокаликс — определяющий фактор в развитии эндотелиальной венозной дисфункции и возможности ее коррекции // Ангиология и сосудистая хирургия. — 2020. — Т.26, №4. — С.71-77. [SHevchenko YUL, Stojko YUM, Gudymovich VG, CHernyago TYU. Glikokaliks — opredelyayushchij faktor v razvitii endotelial’noj venoznoj disfunkcii i vozmozhnosti ee korrekcii. Angiologiya i sosudistaya hirurgiya. 2020; 26(4): 71-77. (In Russ.)]
- Шевченко Ю.Л., Стойко Ю.М., Гудымович В.Г., Черняго Т.Ю. Эндотелиальный гликокаликс в обеспечении функции сердечно-сосудистой системы // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. — 2020. — Т.15. — №1. — С.107-112. [SHevchenko YUL, Stojko YUM, Gudymovich VG, CHernyago TYU. Endotelial’nyj glikokaliks v obespechenii funkcii serdechno-sosudistoj sistemy. Vestnik Nacional’nogo mediko-hirurgicheskogo Centra im. N.I.Pirogova. 2020; 15(1): 107-112. (In Russ.)]


