Первый опыт эндоскопической лобэктомии в Волгоградской области
Автор: Хвастунов Р.А., Иванов А.И., Шерешков А.Ю., Толстопятов С.Е.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Случай из практики
Статья в выпуске: 2 (38), 2013 года.
Бесплатный доступ
Представлен первый опыт успешного выполнения эндоскопических лобэктомий.
Карциноидная опухоль легкого, типичный карциноид, эндоскопическая лобэктомия
Короткий адрес: https://sciup.org/142149044
IDR: 142149044 | УДК: 616.24-
Текст научной статьи Первый опыт эндоскопической лобэктомии в Волгоградской области
Видеоассистированные хирургические вмешательства на органах грудной и брюшной полости являются современным и перспективным трендом общей хирургии. Широкое применение эндоскопических технологий в онкологической практике наблюдается лишь в последние десятилетия и проходит период становления и накопления опыта.
Этапу хирургического применения малоинвазивных методик предшествовала эра технических открытий и клинических апробаций. Изобретателем первого эндоскопа считается P. Bozzini, в 1806 г. сконструировавший прибор «Lichtleiter». Французский хирург A. J. Desormeaux изобрел первый эндоскоп, нашедший применение в клинической практике. Авторство изобретения торакоскопа принадлежит профессору Каролинского университета H. Jacobeus, которым в 1910 г. была выполнена первая торакоскопия с целью диагностики процесса и ревизии плевральной полости больному туберкулезом, создание искусственного пневмоторакса. Данное вмешательство, пожалуй, можно считать точкой отсчета эры видеохирургии. Основоположником торакоскопии в России считается профессор, д. м. н. П. А. Герцен, который в 1925 г. выполнил первую в СССР торакоскопию больному с эмпиемой плевры.
Переломным моментом в истории видеоас-систированных операций является 1986 г., когда была осуществлена возможность трансляции видеоматериала с окуляра торакоскопа на экран монитора. Эпоха «электронной эндоскопии» берет свое начало с 90-х годов ХХ века, с момента выполнения первых оперативных вмешательств в объеме лапароскопической аппендэктомии в 1982 г. (K. Semm), холецистэктомии в 1987 г. (Ph. Mouret). Позже последовало внедрение видео-ассистированных операций в абдоминальную онкологию и онкоурологию: лапароскопическая нефрэктомия (C. Clayman, 1991), дистальная резекция желудка (P. Goh, 1991), панкреатодуоденальная резекция (S. Schtussler, M. Gagner, 1992–1996). В РФ были впервые выполнены операции в объеме дистальной резекции желудка (О. Э. Луцевич, 1993), гастрэктомии (В. П. Сажин, 1993–1994), радикальной нефрэктомии (О. Э. Лу-цевич, 1998), торакоскопической эзофагэктомии (А. А. Гуляев 1996) [1].
Первую торакоскопическую лобэктомию выполнил R. Rovierod в 1992 г., в РФ опыт первой торакоскопической лобэктомиии пневмонэктомии принадлежит Е. И. Сигалу 1993–1994 гг. и 1996 г. соответственно. Разработка и совершенствование торакоскопических инструментов, адаптированных к анатомии грудной клетки, а также сшивающих аппаратов позволили поставить малоинвазивные торакоскопические вмешательства на качественно новый уровень.
Сегодня в Российской Федерации видеоас ские лобэктомии выполняются лишь небольшим количеством крупных хирургических центров. Самым значительным опытом исполнения, около 100 лобэктомий, обладает д. м. н. профессор В. Г. Пищик (клиническая больница № 122 ФМБА г. Санкт-Петербург). Отношение к данной методике лечения онкозаболеваний остается сдержанным. Законодателями малоинвазивного хирургического лечения рака легкого являются США и Европа. Начиная с 1992 г. G. Roviaro, W. Walker, et al. (1993) регламинтируют показания к применению данного метода лечения, как правило, малыми раками без регионарных лимфометаста-зов. Тщательность предоперационной селекции больных – кандитатов на эндоскопические лобэктомии – максимальна. Регионарные и отдаленные метастазы выявляются всеми без исключения визулизационными методами – КТ, МРТ и ПЭТ. Стоимость всего лечебно-диагностического комплекса варьирует около 300 тыс. долларов США.
В России сегодня считается возможным выполнение видеоассистированных эндоскопических лобэктомий при доброкачественном или «погранично» злокачественном характере опухоли с низким потенциалом метастазирования, при злокачественных опухолях T1-2N0M0, отсутствии периваскулярного фиброза и регионарных лимфометастазов [2].
В данной статье мы приводим наш первый опыт выполнения двух торакоскопических лобэктомий по поводу высокодифференцированной нейроэндокринной опухоли (типичный карциноид) легкого.
Пациент Д. , 58 лет, поступил в отделение 28.03.13 г. в удовлетворительном состоянии без каких-либо жалоб. При прохождении профилактического медицинского осмотра по месту жительства выполнено флюорографическое исследование органов грудной клетки. Диагностировано образование в нижней доле левого легкого. Больной направлен в поликлинику ГБУЗ ВОКОД № 1. Амбулаторно пациенту выполнена рентгенография и компьютерная томография органов грудной клетки, по результатам которых диагностировано опухолевидное образование в нижней доле левого легкого, 2,7 см в диаметре с нечеткими, но достаточно ровными контурами, компрессирующее В10 (практически от устья, сегмент в состоянии умеренной гиповентиляции). Внутригрудные лимфоузлы не изменены (рис. 1, 2).
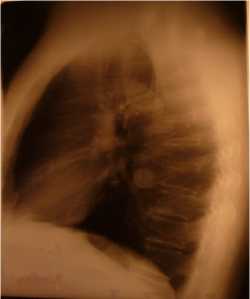
Рис. 1. Боковая рентгенограмма с опухолью в основании 10-го сегмента левого легкого
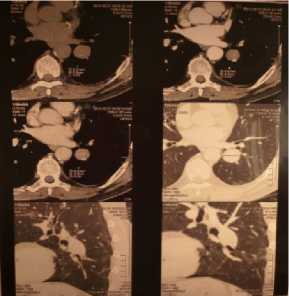
Рис. 2. КТ-грамма.
Компрессия бронха 10-го сегмента
При обследовании отдаленных метастазов не обнаружено. Лабораторные показатели в пределах нормы. 05.04.13 г. в условиях перидураль-ного обезболивания и под эндотрахеальным наркозом выполнена эндобронхиальная интубация легких, левое легкое выключено из акта дыхания. В 5-м и 6-м межреберии по средней ключичной и передней подмышечной линиям установлены, соответственно, диагностический и манипуляционный торакопорты. Расширители для миниторакотомии не использовались по принципиальным соображениям, поскольку требовали продления разрезов. При ревизии плевральная полость свободна от спаек. Отдаленных метастазов нет. В основании нижней доли в непосредственной близости от нижней легочной вены выявлена опухоль 3,0 см в диаметре плотноэластической консистенции, расположенная ин-трапаренхиматозно. Из-за близости к сосудам атипическая резекция легкого с опухолью невоз- можна. Решено произвести торакоскопическую нижнюю лобэктомию. Мобилизована легочная связка. Выделена нижняя легочная вена. Часть ее притоков порционно клипирована, а основной ствол прошит аппаратом Eсhelon. Детали обработки сосудов представлены на рис. 3. В междолевой борозде выделен основной ствол левой легочной артерии, прошит и пересечен аппаратом Eсhelon. Бронх нижней доли обнажен со сдвиганием лимфоузлов в препарат, пересечен с помощью аппарата Eсhelon. Междолевая борозда также прошита и пересечена аппаратом Eсhelon. Гемостаз: контроль на аэростаз и инородные тела. Препарат удален через отверстие торакопорта. Дренирование плевральной полости в местах стояния торако-портов по Бюлау. Ушивание послеоперационных ран. Объем интраоперационной кровопотери составил 50 мл. Продолжительность операции – 3 часа 30 минут.
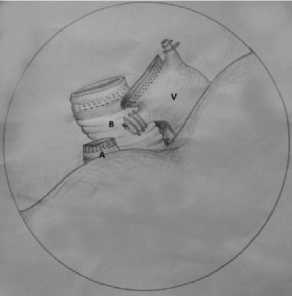
Рис. 3. Методика обработки сосудов (A – основной ствол легочной артерии, V – нижняя легочная вена) и бронха (В – нижнедолевой бронх)
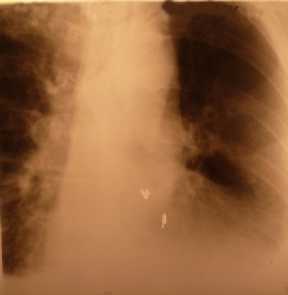
Рис. 4. Рентгенограмма грудной клетки больного Д. на вторые сутки после операции
Послеоперационный период протекал без осложнений, верхняя доля левого легкого заполнила весь объем левого гемиторакса (рис. 4). Заключение морфологов – карциноид. Дренажи удалены на 2-е сутки, пациент выписан – на 5-е сутки.
Пациенка В. поступила в ВОКОД № 1 24.04.13 г. Аналогично первому наблюдению в данном случае мы наблюдали бессимптомное течение заболевания. Образование верхней доли правого легкого было обнаружено при флюорографическом исследовании в поликлинике по месту жительства. Больная направлена в поликлинику ВОКОД № 1, где ей произведена компьютерная томография органов грудной клетки, по результатам которой диагностирован суб-левральный очаг в S 3 справа округлой формы около 1,5 см в диаметре с наличием просветлений в структуре, без достоверного накопления контрастного препарата, однако имеющий нечеткие лучистые контуры. Внутригрудные лимфоузлы не увеличены (рис. 5).
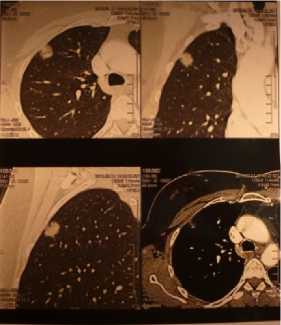
Рис. 5. КТ-грамма. Опухоль в 3-м сегменте левого легкого
30.04.13 г. в условиях мультимодальной анестезии произведена торакоскопия и атипическая резекция верхней доли легкого эндоскопическим доступом длиной 1 см в 5-м межреберии по средней ключичной линии и в 4-м межреберии по средней подмышечной линии. В препарате визуализирована опухоль до 1,5 см в диаметре с инвазией висцеральной плевры. Ответ морфологов при срочном исследовании опухоли – карциноид. Плевральная полость свободна от спаек. Решено произвести попытку эндоскопической верхней лобэктомии. Дополнительно установлен манипуляционный торакопорт в 3-м межреберии. Выделена, прошита аппаратом Eсhelon, пересечена V1-3. Выделен, прошит аппаратом Eсhelon и пересечен передний ствол a.pulmonalis dextra. При мобилизации А2 последняя травмирована, кровотечение остановлено путем двойного клипирования. Сосуд пересечен. Определена добавочная артерия второго сегмента, также дважды клипирована, пересечена. Мобилизован ВДБ, пересечен аппаратом Eсhelon (рис. 6).
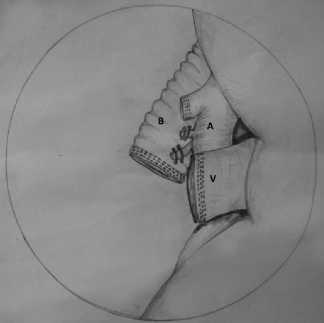
Рис. 6. Методика обработки сосудов больного М. (A – передний ствол легочной артерии, артерия 2-го сегмента, добавочная артерия 2-го сегмента, V – нижняя легочная вена) и бронха (В – верхнедолевой бронх)
Междолевая борозда разделена аппаратом Eсhelon. Контроль на гемостаз. Контроль на аэростаз и инородные тела. Опухоль удалена через отверстие торакопорта. Дренирование плевральной полости в 3-м и 5-м межреберьях по Бюлау. Рана послойно ушита наглухо. Объем интраоперационной кровопотери составил 100 мл. Продолжительность операции – 4 часа.
Плановое гистологическое исследование – высокодифференцированная нейроэндокринная опухоль (типичный карциноид). В лимфоузлах – хронический лимфаденит. Осложнений не было (рис. 7). Наркотическое обезболивание не применялось. Выписана на 4-е сутки.
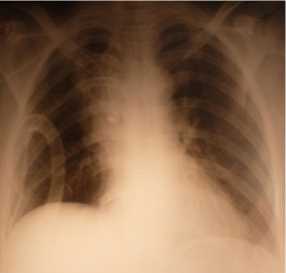
Рис. 7. Рентгенограмма грудной клетки больного В. на 2-е сутки после операции
Наш скромный опыт укрепил нас во мнении о необходимости тщательного отбора больных для эндоскопических лобэктомий. В этих условиях ценность компьютерной томографии трудно переоценить. Нераспознанное заблаговременно обширное лимфогенное метастазирование рака легкого, свидетелями которого мы являемся ежедневно в клинической практике, может создать трудности непреодолимые эндоскопически и требующие конверсии к открытому доступу.
Мы рассчитываем на уменьшение продолжительности эндоскопических операций по мере освоения метода. Но тем не менее, вынуждены критически заявить, что временные затраты на рутинную открытую лобэктомию в нашей клинике не превышают 1–1,5 часов. У лучших пропагандистов эндоскопического подхода этот показатель существенно больше. В связи с этим мы осторожно оцениваем перспективы применения эндоскопических лобэктомий у пожилых больных с противопоказаниями к длительному наркозу.


