Первый опыт клинического применения лапароскопического гамма-зонда для интраоперационной визуализации "сторожевых" лимфатических узлов при гинекологическом раке
Автор: Очиров Максим Олегович, Коломиец Лариса Александровна, Чернов Владимир Иванович, Синилкин Иван Геннадьевич, Чернышова Алена Леонидовна, Виллерт Алиса Борисовна, Молчанов Сергей Валериевич, Чуруксаева Ольга Николаевна, Кишкина Анастасия Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.17, 2018 года.
Бесплатный доступ
В настоящее время визуализация «сторожевых» лимфоузлов (СЛУ) относится к числу базовых методов диагностики регионарных лимфоузлов. Наиболее распространенным способом определения СЛУ является изотоп-ассоциированный метод с использованием лимфотропного коллоида. материал и методы. Диагностика лимфатических узлов осуществлялась при помощи стационарного гамматомографа, а их интраоперационный поиск проводился при помощи портативного гамма-сканера, что позволяет контролировать место расположения СЛУ. Результаты. Представлен первый российский опыт клинического применения лапароскопического гамма-зонда для интраоперационной визуализации «сторожевых» лимфатических узлов при гинекологическом раке. Применение этого способа для интраоперационной визуализации «сторожевых» лимфатических узлов у больных раком шейки матки молодого возраста при органосохраняющем лечении и у больных раком эндометрия I стадии вне зависимости от риска лимфогенного метастазирования и выраженной сопутствующей патологии позволяет провести оперативное лечение в радикальном объеме с персонализацией объема лимфодиссекции за счет полноценного хирургического стадирования, особенно у пациенток с низким и промежуточным риском лимфогенного метастазирования.
Рак эндометрия, рак шейки матки, "сторожевые" лимфатические узлы, радиофармпрепарат, лапароскопический гамма-зонд
Короткий адрес: https://sciup.org/140254212
IDR: 140254212 | УДК: 618.14+618.146]-006.6-089-073.916:611.428 | DOI: 10.21294/1814-4861-2018-17-5-45-51
Текст научной статьи Первый опыт клинического применения лапароскопического гамма-зонда для интраоперационной визуализации "сторожевых" лимфатических узлов при гинекологическом раке
Visualization of sentinel lymph nodes (SLN) is now widely accepted for lymph node (LN) detection using a radioactive lymphotropic trace. Preoperative lymphoscintigraphy with intraoperative lymphatic mapping under gamma detecting probe guidance proved to be an easy and reliable method for SLN detection. Material and methods. In this article we present our experience in using laparoscopic gamma-probe for intraoperative visualization of sentinel lymph nodes in gynecological cancer. Results. Intraoperative visualization of sentinel lymph nodes in young cervical cancer patients and in patients with stage I endometrial cancer allowed us to perform radical surgery with personalization of the extent of lymph node dissection, especially for patients with low and intermediate risks of lymphogenic metastasis.
В настоящее время визуализация «сторожевых» лимфоузлов (СЛУ) относится к числу базовых ме‑ тодов диагностики регионарных лимфоузлов (ЛУ) и рекомендуется экспертами в качестве стандартно‑ го метода при определении степени лимфогенной распространенности процесса у больных раком молочной железы, входит в стандарты оказания медицинской помощи у больных раком вульвы и меланомы кожи [1]. Ведутся научные исследования о возможности применения концепции сторожевых лимфатических узлов при хирургическом лечении других злокачественных новообразований.
Концепцию СЛУ впервые выдвинул и клини‑ чески обосновал R.M. Cabanas (1977). Согласно данной концепции, существует «лимфатический центр», так называемый сторожевой лимфатиче‑ ский узел, в который в первую очередь осущест‑ вляется отток лимфы из определённого участка ткани. Именно в этом узле реализуются первые метастазы опухоли. СЛУ является также фильтром для контрастных препаратов и поэтому отчётливо визуализируется на рентгенограммах при введении контрастных веществ непосредственно в лимфа‑ тические пути или ткани [2]. Далее концепцию развили D.L. Morton et al. (1991), разработав специ‑ альный лимфотропный краситель для визуализации СЛУ во время проведения хирургического вмеша‑ тельства. Исследования показали, что наиболее эффективно применение красителя «Isosulfan blue due» («Lymphasurin 1 %»), способного проникать в лимфатические сосуды и лимфатические узлы, окрашивая последние в интенсивно синий цвет, определяемый во время хирургического вмеша‑ тельства. Следующим шагом в развитии концепции СЛУ явились исследования J.C. Alex, D.N. Krag (1993), которые предложили использовать вместо специального лимфотропного красителя радиоак‑ тивный лимфотропный коллоид, способный про‑ никать сквозь стенки лимфатических капилляров. Диагностика лимфатических узлов осуществля‑ лась при помощи стационарного гамма‑томографа, а их интраоперационный поиск проводился при помощи портативного гамма‑сканера.
До сих пор нет рекомендованных стандартов определения сторожевых лимфатических узлов при злокачественных новообразованиях жен‑ ской репродуктивной системы. Применяются 3 основных метода визуализации «сторожевых» лимфатических узлов: контрастно‑визуальный, изотоп‑ассоциированный и сочетанный (краситель + + изотоп) [3].
К контрастно‑визуальным методам определения СЛУ относят метиленовый синий или синий кра‑ ситель (Isosulfan blue due) и индоцианин зеленый
(ISG). Синий краситель является самым простым способом определения СЛУ, когда нет специализи‑ рованного оборудования, однако характеризуется низким уровнем обнаружения СЛУ – до 60 % [4]. При использовании синего красителя происходит диффузное окрашивание опухоли, соединительной и жировой ткани, что затрудняет работу как хирур‑ га, так и патоморфолога, также недостатком являет‑ ся неизбирательность его накопления, что снижает точность диагностики. Наиболее эффективным из лимфотропных красителей для визуализации сто‑ рожевых лимфатических узлов во время операции является «indocyanine green» (ICG), однако данный способ требует наличия специального оборудова‑ ния, наряду с невозможностью оценить СЛУ на дооперационном этапе. Основным недостатком метода является то, что СЛУ окрашиваются через 30–60 мин после введения препарата, что требует высокой интенсивности работы операционной бригады [5, 6].
Наиболее распространенным способом опреде‑ ления СЛУ является изотоп‑ассоциированный метод с использованием рентгеноконтрастного вещества радиоактивного лимфотропного коллои‑ да, способного проникать сквозь стенки лимфати‑ ческих капилляров. Диагностика лимфатических узлов осуществляется при помощи стационарного гамма‑томографа, а их интраоперационный поиск – при помощи портативного гамма‑сканера, что позволяет удостовериться в удалении СЛУ по на‑ коплению радиофармпрепарата (РФП) [2, 7, 8].
В последнее время ведется активная разработка гибридных индикаторов, которые объединяют в себя контрастно‑визуальный и рентген‑контрастный способы обнаружения СЛУ (ICG‑99mTc‑nanocolloid). Однако данные препараты находятся в стадии разработки и не могут быть рекомендованы для широкого использования [9].
Несмотря на то, что при ряде локализаций биопсия сигнальных лимфоузлов относится к числу базовых методов [10], для рака эндометрия эффективность данной методики пока изучается, учитывая особенности данной группы пациентов, к которым относится пожилой возраст и высокий коморбидный фон. Также не решен вопрос о так‑ тике ведения пациентов с позитивными «стороже‑ выми» лимфатическими узлами. Для рака шейки матки выявление сторожевых лимфатических узлов позволяет уточнить лимфогенную распро‑ страненность при начальных стадиях заболевания, когда есть возможность не выполнять широкую тазовую лимфаденэктомию, тем самым сократить количество осложнений после лимфодиссекции при проведении полноценного хирургического стадирования [11, 12].
Таким образом, актуальным является вопрос о возможности интраоперационного определения сторожевых лимфатических узлов при лапаро‑ скопических органосохраняющих операциях у больных раком шейки матки и у больных раком эндометрия с выраженной сопутствующей па‑ тологией. Перспективной в этом плане является возможность использования лапароскопического гамма‑сканера для детекции СЛУ.
Целью исследования явилось изучение возможности визуализации «сторожевых» лим‑ фатических узлов при злокачественных новооб‑ разованиях женской репродуктивной системы с использованием лапароскопического гамма‑зонда при органосохраняющем лечении больных раком шейки матки и хирургическом лечении рака эндо‑ метрия у больных с выраженной сопутствующей патологией.
Материал и методы
В исследование вошли 26 больных раком шейки матки I стадии (T1a2NxM0 – T1bNxM0), находив‑ шихся в репродуктивном возрасте (средний возраст – 28,7 ± 4,5 года), получивших лечение в объеме лапароскопической радикальной трансабдоми‑ нальной трахелэктомии, и 36 больных раком эндо‑ метрия I стадии (средний возраст – 57 ± 9,8 года), получивших хирургическое лечение в объеме ла‑ пароскопической экстирпации матки с придатками с тазовой лимфаденэктомией в отделении онко‑ гинекологии НИИ онкологии Томского НИМЦ. Диагноз был верифицирован гистологически у всех пациентов на дооперационном этапе. Стадия заболевания определялась по системам FIGO и TNM 7‑го пересмотра. На основании комплексного обследования всем пациенткам проводилась оцен‑ ка физического статуса по классификации ASA: больные раком шейки матки относились к I классу по ASA, больные раком эндометрия относились к III классу по ASA, учитывая тяжёлые сопут‑ ствующие заболевания, такие как метаболический синдром с выраженным ожирением (ИМТ≥40), плохо контролируемая артериальная гипертензия, субкомпенсированный сахарный диабет.
Всем пациенткам выполнялось радионуклид‑ ное выявление сторожевых лимфатических узлов с использованием лимфотропного наноколлоида, меченного 99mTc. Исследование проводилось по‑ следовательно двумя способами: на доопераци‑ онном этапе методом однофотонной эмиссионной компьютерной томографии (ОЭКТ) и интраопера‑ ционно с помощью портативного лапароскопиче‑ ского гамма‑зонда RadPointer‑gamma (Швейцария), путем измерения уровня гамма‑излучения во всех лимфатических коллекторах. Готовый радиофарм‑ препарат (РФП) вводился в шейку матки в четыре точки в равных долях. Для рака шейки матки РФП вводился подслизисто по периметру опухоли. Для рака эндометрия – в две точки на 3 и 9 часах условного циферблата, вводимая доза препарата в обоих случаях составляет 80 МБк. Регистрация распределения радиоактивного наноколлоида в тазовой области выполнялась в режиме ОЭКТ на гамма‑камере с двумя фиксированными детекто‑ рами «E.CAM180» (Siemens) спустя 18 ч после введения РФП. Исследование выполняли при настройке гамма‑камеры на фотопик излучения 99mTc (140 кэВ) при ширине энергетического окна дифференциального дискриминатора – 15 %. Для исследования использовали высокоразрешающий параллельный коллиматор для низких энергий излучения. Изображение регистрировали в 16 про‑ екциях в матрицу 64×64. Время экспозиции на одну проекцию составляло 30 с. Полученные данные подвергались обработке при помощи специализи‑ рованной компьютерной системы E.Soft (Siemens) с получением трехмерного изображения (рис. 1).
Для интраоперационной детекции СЛУ при раке эндометрия впервые в РФ используется лапароскопический гамма‑сканер «RadPointer» – система, состоящая из гамма‑зонда для измерения локальных концентраций РФП и специального программного обеспечения. Сканер снабжен встро‑ енным коллиматором, отображающим уровень радиоактивности в месте введения радиофарм‑ препарата и в проекции расположения сторожевых лимфатических узлов, измеряемый в импульсах в секунду, в виде цифрового эквивалента с ото‑ бражением полученных результатов на дисплее ноутбука. Интраоперационное определение СЛУ проводилось оперирующим хирургом, путем из‑ мерения уровня радиоактивности в забрюшинных лимфатических коллекторах, сторожевым счи‑ тался лимфоузел с наибольшим уровнем гамма‑ излучения (рис. 2). После детекции сторожевой лимфатический узел выделялся из окружающей клетчатки, извлекался в специализированном кон‑ тейнере через 10‑мм троакар. Интраоперационно проводилось его цитологическое исследование. Лимфоузел разрезали острой бритвой на парал‑ лельные пластины размером 2 мм. С поверхности срезов делали мазки‑отпечатки – по 6–10 на стекло. На один лимфоузел приходилось 4–6 стекол. Цито‑ логические препараты окрашивали «Набором для быстрого окрашивания мазков крови Лейкодиф 200» в течение 15 сек. Препараты просматрива‑ лись с помощью микроскопа Zeiss Axio Scope. A1 [13]. Удаленные сторожевые лимфатические узлы,
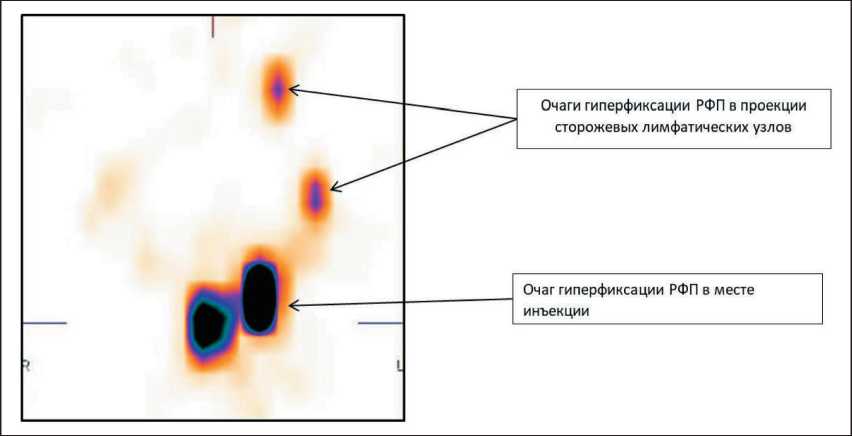
Рис. 1. Однофотонная эмиссионная компьютерная томография, через 18 ч после введения радиофармпрепарата (РФП). Аксиальный срез однофотонной эмиссионной компьютерной томографии с использованием специализированной компьютерной системы E.Soft фирмы “Siemens” (Германия)
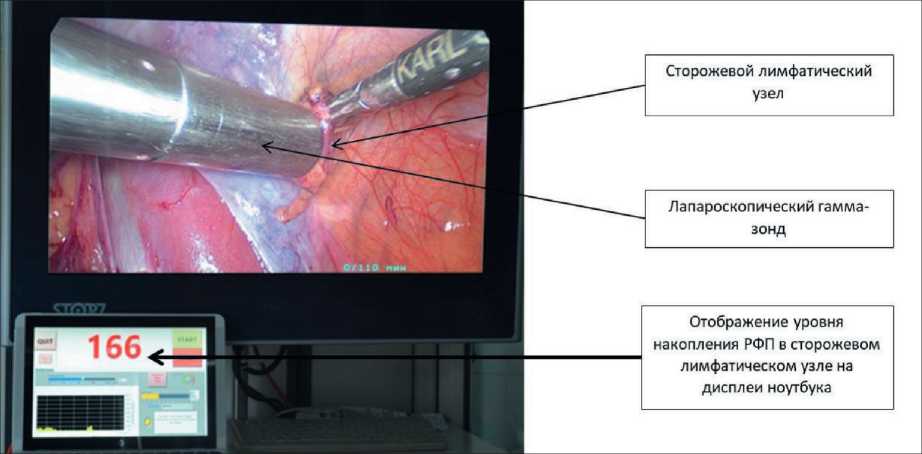
Рис. 2. Интраоперационная детекция сторожевых лимфатических узлов с использованием лапароскопического гамма-зонда
помимо экспресс‑цитологии, были также иссле‑ дованы при плановой гистологической проводке всех групп удаленных лимфатических узлов после тазовой лимфаденэктомии.
Результаты и обсуждение
Морфологически все опухоли тела матки были представлены эндометриоидной аденокарциномой (n=36), причем преобладали опухоли умеренной степени дифференцировки 61 % (n=22). У всех больных с заболеванием шейки матки диагноз был верифицирован как плоскоклеточный рак (n=26).
При анализе больных раком эндометрия по группам риска обращает на себя внимание пре‑ обладание среди них низкого и промежуточного риска – 50 и 39 % соответственно, то есть это па‑ циентки, у которых целесообразность проведения лимфодиссекции является дискутабельной. Однако в нашей выборке у 1 пациентки, относящейся к группе низкого риска лимфогенного метастазиро‑ вания, и у 2 больных в группе промежуточного риска было выявлено метастатическое поражение сторожевых лимфатических узлов.
Применение ОЭКТ малого таза и брюшной полости у больных раком шейки матки позволило определить сторожевые лимфатические узлы у 26 (100,0 %) пациенток, при интраоперационной де‑ текции СЛУ выявлены во всех 26 случаях, а всего – 54 СЛУ. Наиболее типичными локализациями СЛУ при раке шейки матки были: наружные под‑ вздошные лимфатические узлы – 28 (51,85 %), запирательные лимфатические узлы – 13 (24,0 %), внутренние подвздошные лимфатические узлы – 8 (14,8 %) и общие подвздошные лимфатические узлы – 5 (9,2 %).
Применение ОЭКТ малого таза и брюшной по‑ лости при раке эндометрия позволило определить сторожевые лимфатические узлы у 35 (97,2 %) больных и было выявлено 48 СЛУ. При этом двухстороннее накопление РФП при интраопе‑ рационной детекции было выявлено у 12 (33 %), одностороннее накопление – у 23 (63,8 %) больных, и у 1 пациентки СЛУ выявлены не были, однако у нее определялось макроскопическое метастати‑
Список литературы Первый опыт клинического применения лапароскопического гамма-зонда для интраоперационной визуализации "сторожевых" лимфатических узлов при гинекологическом раке
- NCCN guidelines. 2017 . URL: https://www.nccn.org/professionals/physician_gls/default.aspx (cited 01.10.2018).
- Чернов В.И., Синилкин И.Г., Ширяев С.В., Лишманова Ю.Б., Чернова В.И., Казначеева А.О., Усов В.Ю. Радионуклидное выявление сторожевых лимфатических узлов. Национальное руководство по радионуклидной диагностике. Томск, STT. 2010. 336. .
- Colombo N., Preti E., Landoni F., Carinelli S., Colombo A., Marini C., Sessa C.; ESMO Guidelines Working Group. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013 Oct; 24 Suppl 6: vi33-8. DOI: 10.1093/annonc/mdt353
- Papadia A., Gasparri M.L., Buda A., Mueller M.D. Sentinel lymph node mapping in endometrial cancer: comparison of fluorescence dye with traditional radiocolloid and blue. J Cancer Res Clin Oncol. 2017 Oct; 143 (10): 2039-2048. DOI: 10.1007/s00432-017-2501-8
- Khoury-Collado F., St Clair C., Abu-Rustum N.R. Sentinel Lymph Node Mapping in Endometrial Cancer: An Update. Oncologist. 2016 Apr; 21 (4): 461-6. DOI: 10.1634/theoncologist.2015-0473


