Первый опыт применения высокоинтенсивной фокусированной ультразвуковой аблации (HIFU) в лечении рака простаты
Автор: Глыбочко П.В., Фомкин Роман Николаевич, Понукалин А.Н., Блюмберг Б.И., Стативко А.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 4 т.5, 2009 года.
Бесплатный доступ
Для оценки клинической эффективности проведено 40 сеансов HIFU аблации простаты. Средняя частота воздействий - 628164 импульсов; средний объем тканей, подвергнутых воздействию за 1 процедуру, - 33,88,3 см³ (132%) объема простаты; среднее время операции - 150 мин (от 90 до 200 мин). Интраоперационных осложнений во время HIFU аблации не отмечено. В первые дни после сеанса HIFU происходил пик нарастания PSA, а затем в течение 1,5 - 3 месяцев - его снижение. Минимальный уровень PSA (nadir) достигался через 10- 12 недель после лечения и составлял от 0,02 до - 2,8 нг/мл в зависимости от стадии заболевания. Уменьшение объема простаты происходило в среднем с 30-го дня послеоперационного периода и продолжалось в течение 6 месяцев, достигая в среднем 50% от исходного объема. Послеоперационный койко-день колебался от 10 до 16 дней и в среднем составил 120,8 дней. Таким образом, применение высокоинтенсивной фокусированной ультразвуковой аблации позволяет успешно лечить различные стадии рака простаты, с минимальными побоч- ными эффектами, дает возможность ранней оценки эффективности лечения.
Высокоинтенсивная фокусированная ультразвуковая аблация, рак простаты
Короткий адрес: https://sciup.org/14916983
IDR: 14916983
Текст научной статьи Первый опыт применения высокоинтенсивной фокусированной ультразвуковой аблации (HIFU) в лечении рака простаты
Введение. Рак предстательной железы (РПЖ) в настоящее время является одним из широко рас пространенных злокачественных новообразований у Ответственный автор: Фомкин Роман Николаевич 410012, г. Саратов, Б. Казачья, 112.
ГОУ ВПО Саратовский ГМУ им. В.И. Разумовского Росздрава, кафедра урологии.
тел.: (8452) 569198,
мужчин. В России в 2008 г. зарегистрировано 12735 новых случаев РПЖ, заболеваемость составила 15,7 на 100 тысяч мужского населения, смертность – 3,9% в структуре общей смертности от онкологических заболеваний. На долю локализованных форм РПЖ, когда возможно проведение радикального противоопухолевого лечения, приходится только 31,5% всех выявленных случаев болезни; у 68,5% больных диа- гностируются местнораспространенные и генерализованные формы опухолевого процесса [1].
Одним из основных способов лечения РПЖ на ранних стадиях (Т1–Т2) является радикальная простатэктомия. Однако эта операция чревата серьезными осложнениями, которые могут инвалидизи-ровать пациента, особенно в пожилом возрасте. В настоящее время среди возможных вариантов терапии заметную роль приобретают малоинвазивные куративные методики, одной из которых является высокоинтенсивная сфокусированная ультразвуковая аблация простаты (HIFU — High Intensity Focused Ultrasound). Данный способ лечения особенно важен для больных пожилого и старческого возраста, желающих получить эффективное лечение при сохранении достойного качества жизни [2,3,4,5]. В клинике урологии Клинической больницы им. С.Р. Ми-ротворцева СарГМУ с февраля 2009 г. для лечения пациентов, больных раком предстательной железы, применяется высокоинтенсивная фокусированная ультразвуковая аблация простаты на аппарате "Ablatherm Integrated Imaging”.
Цель исследования : оценить клиническую эффективность HIFU аблации при лечении рака простаты.
Объекты и методы исследования. Работа проведена в виде продольного проспективного и ретроспективного исследования. Объектом исследования явились 40 больных с морфологически доказанным при биопсии РПЖ, находившихся на лечении в клинике урологии Клинической больницы имени С.Р. Ми-ротворцева СарГМУ в период с февраля 2009 г. по сентябрь 2009 г., которым проведено 40 сеансов первичного оперативного лечения методом HIFU аблации простаты.
Средний возраст пациентов составил 66,3±5,83 года; минимальный возраст – 52 года, максимальный – 94 года. В наиболее зрелом, социально активном возрасте (до 60 лет) находилось 7 пациентов (17,5%), пожилом и старческом возрасте – 33 (82,5%). Группировка пациентов по возрасту проведена на основании периодизации, рекомендованной VII Всесоюзной научной конференцией по проблемам возрастной морфологии, физиологии и биохимии (Москва, 1965) (табл.1).
Критерии включения пациентов в исследование . Показания.
-
1) РПЖ локализованных стадий Т1-Т2N0M0 у пациентов с невозможностью выполнения радикальной простатэктомии (тяжелый интеркуррентный фон, возраст больного и т.п.) или в случае отказа больного от «открытого» оперативного вмешательства по тем или иным причинам;
-
2) местно-распространенный и распространенный РПЖ в комбинации с андрогенной депривацией в виде адъювантной или неоадъювантной терапии;
-
3) рецидив рака предстательной железы после радикальной простатэктомии, лучевой и HIFU терапии.
Критерии исключения из исследования. Противопоказаниями являлись: утолщенная стенка прямой кишки (более 5 мм при трансректальном ультразвуковом сканировании), пациенты с рецидивом после брахитерапии, выраженный проктит после лучевой терапии, наличие ректоуретральных фистул, прорастание опухолью стенки прямой кишки, наличие инородных тел между простатой и прямой кишкой (металлические клипсы и др.), объем ампулы прямой кишки менее 50 см3, отсутствие прямой кишки, наличие при ТРУЗИ гиперэхогенных образований с акустической дорожкой в простате более 5 мм, располагающиеся в периферической зоне.
Всем больным проводилось клиническое обследование, включавшее: сбор анамнеза; исследование общих анализов крови и мочи, уровня сывороточного PSA, биохимического анализа крови; исследование простаты (пальцевое, трансректальное ультразвуковое сканирование, магнитно-резонансная томография), ультразвуковое исследование органов брюшной полости и забрюшинного пространства. Для определения распространенности опухолевого процесса и исключения отдаленного метастазирования проводили сцинтиграфию скелета и рентгенографическое исследование легких. При необходимости выполнялась КТ или МРТ брюшной полости и/или малого таза.
Для верификации диагноза выполнялась трансректальная мультифокальная биопсия простаты. Больным с местно-распространенным и генерализованным процессом проводилась адъювантная и/или неоадъювантная гормональная терапия в режиме максимальной андрогенной блокады. Объем предстательной железы до лечения составлял от 15 до 62,3 см3. Уровень PSA у больных со стадией Т1-Т2 составлял от 5,1 до 26,3 нг/мл, со стадией Т3а-b от 11,0 до 52 нг/мл.
У всех пациентов выявлена сопутствующая патология в виде хронических заболеваний органов дыхания, сердечнососудистой, пищеварительной, эндокринной систем.
Распределение пациентов по стадиям заболевания представлено в табл. 2. По степени онкологического риска (по Д'Амико А.В. И др., 2003) больные распредилились следующим образом:
-
1. Локализованный РПЖ (T1-T2N0M0):
-
• низкий онкологический риск (PSA < 10 нг/мл, Глисон < 6) — 6 пациентов,
-
• умеренный риск (PSA 10—20 нг/мл, Глисон 6—7) — 19 пациентов,
-
• высокий риск (PSA > 20 нг/мл, Глисон > 8) — 3 пациента.
-
2. Местно-распространенный процесс:
-
• стадия ТЗа — 7 пациентов,
-
• стадия ТЗЬ — 3 пациента,
-
• гормонорезистентный РПЖ стадия ТЗЬ — 1 пациент.
-
3. Генерализованный РПЖ стадия Т4 (N+M+) — 1 пациент.
Таблица 1
Группировка пациентов по возрасту
|
Возрастные группы |
Возраст (годы) |
Количество больных |
|
|
Абс. |
% |
||
|
2-й период зрелого возраста |
36—60 |
7 |
17,5 |
|
Пожилой возраст |
61—74 |
27 |
67,5 |
|
Старческий возраст |
75—95 |
6 |
15 |
|
ИТОГО |
40 |
100 |
|
Таблица 2
Распределение больных РПЖ в зависимости от стадии
|
Стадия РПЖ |
Локализованный (n=28) |
Местнораспространенный (n=11) |
Распространенный (n=1) |
|||||||||||||
|
Т1а–1b |
Т1с |
Т2а |
Т2в |
Т2с |
Т3а |
Т3в |
T4 |
|||||||||
|
Число больных |
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
4 |
10 |
2 |
5 |
7 |
17,5 |
7 |
17,5 |
8 |
20 |
7 |
17,5 |
4 |
10 |
1 |
2,5 |
|
|
N+ |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
|
M+ |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2,5 |
Методика проведения HIFU аблации простаты. Сущность оперативного пособия заключается в воздействии на ткань предстательной железы сфокусированными ультразвуковыми волнами частотой 3 МГц (HIFU – High Intensity Focused Ultrasound). Операция выполняется в положении больного на правом боку под спинальной анестезией на специально оборудованном столе. Через прямую кишку устанавливается датчик, излучающий высокоинтенсивные, конвергирующие ультразвуковые волны. Сфокусированные ультразвуковые волны, генерируемые трансдуктором, абсорбируются на площади мишени, оказывая механическое (кавитация) термическое воздействия и не повреждая тканей вне зоны излучения. В определенной точке, где происходит фокусирование лучей, наблюдается повышение локальной температуры (от 85 до 100 0С), что приводит к деструкции клетки и возникновению эффекта кавитации. За счет термического воздействия на ткань (аблация) в течение нескольких секунд происходит коагуляционный некроз участка ткани с четкими границами. Зона разрушения при каждом воздействии составляет – до 26 мм по высоте и 1,7 мм в диаметре. Контроль расстояния между датчиком и стенкой прямой кишки в реальном времени в комбинации с автоматической коррекцией расположения фокальной точки позволяют обеспечить безопасное и точное позиционирование. Путем поэтапного воздействия на всю простату достигается некроз железы с последующим замещением его соединительной тканью, что позволяет ликвидировать патологический процесс и избавить пациента в последующем от приема медикаментозных препаратов. Практически всем больным (92,5%) перед сеансом HIFU терапии выполнена трансуретральная резекция простаты (ТУРП) для уменьшения объема предстательной железы, что делает последующую HIFU терапию более радикальной. При необходимости возможно проведение повторного сеанса лечения. Непосредственно после воздействия агрессивных ультразвуковых лучей развивается отек ткани предстательной железы за счет некроза, что требует постоянного отведения мочи. Дренирование мочевого пузыря после сеанса HIFU терапии осуществлялось уретральным катетером.
Послеоперационный период наблюдения за больными составил от 1 до 8 месяцев.
В качестве объективных критериев эффективности проводимого лечения учитывали: степень реализации операционной программы, количество интра – и послеоперационных осложнений, длительность операции, сроки пребывания больных в стационаре (послеоперационный койко-день). Онкологический контроль пролеченных пациентов осуществляли с помощью динамического контроля уровня PSA через 1,5; 3; 4,5; 6 и 8 месяцев, трансректального ультра- звукового сканирования простаты спустя 6 и 8 месяцев. Для оценки динамики изменения кровотока в предстательной железе после HIFU в контрольное обследование пациентов была включена эходоппле-рография простаты.
Полученные количественные данные обрабатывали вариационно-статистическим методом с использованием пакета прикладных программ «Statis-tica-6». Нормальность распределения оценивали по величине асимметрии (Аs) и эксцессы (Ех) и показателей их достоверности Таs и Тех. Для определения достоверности разности средних величин использовали критерий Стьюдента и непараметрические статистические критерии серии Вальда-Вольфовица, U-критерий Манна-Уитни и двухвыборочный критерий Колмогорова-Смирнова.
Результаты. Всего проведено 40 сеансов HIFU аблации простаты. Средняя частота воздействий – 628±164; средний объем тканей, подвергнутых воздействию, – 33,8±8,3 см³ за 1 процедуру; объем тканей, подвергнутых воздействию высокоинтенсивного ультразвука, – 132% объема предстательной железы; среднее время операции – 150 мин (от 90 до 200 мин). Интраоперационных осложнений во время HIFU аблации нами не отмечено. Уретральный катетер удаляли через 7 (от 6 до 10) дней после операции. Мочеиспускание у пациентов восстанавливалось к 5-10 дню (в среднем на 6 день) после операции с комбинированным лечением (ТУРП + HIFU) и к 1418 суткам у больных без предварительной ТУРП (в среднем к 16-му дню у пациентов, дооперационный объем простаты, которых составлял до 20 см3). Максимальная скорость мочеиспускания составляла от 6,0 мл/с до 20,1 мл/с через 2 недели, от 9,0 до 26 мл/с через 1 месяц и от 12,5 до 24 через 4-5 месяцев (табл. 3).
В течение первых дней после удаления уретрального дренажа наблюдалось учащение мочеиспускания, а также императивные позывы у 18% больных. Среди осложнений наиболее серьезным было недержание мочи 1 и 2 степени (10,5%). Ни у одного больного не наблюдалось тотального недержания мочи. Максимально недержание наблюдалось до 6 месяцев после лечения. У 2 больных спустя 4 и 5 месяцев после операции возникли рубцовые изменения в уретре, что потребовало проведения эндоуретротомии. У 1 пациента (2,5%) возникла инфекция мочевыводящих путей в виде восходящего пиелонефрита, купированного консервативно, у 5 (12,5%) – непродолжительная гематурия. Отсутствие эректильной функции после лечения, при наличии её до операции, отметили 6 пациентов (15%) из числа неполучавших гормональную терапию, эякуляция отсутствовала у всех больных.
Среднее время госпитализации составило 7 (от 3 до 14) дней. Послеоперационный койко-день коле- бался от 10 до 16 дней и в среднем составил 12±0,8 дней (n=40; s=2,4 дней; Сv=18,5%).
В первые дни после сеанса HIFU происходил пик нарастания PSA, а затем в течение 1,5–3 месяцев его снижение. Минимальный уровень PSA (nadir) достигался через 10-12 недель после лечения и составлял от 0,02 до – 0,5 нг/мл (медиана – 0,26 нг/мл) (р<0,02). В группе с локализованным РПЖ стадией Т1-2 и низким онкологическим риском у 2 больных PSA не превышал 0,05 нг/мл, у остальных 26 – от 0,1 до 0,3 нг/ мл (медиана 0,2 нг/мл). В группе пациентов со средним риском уровень PSA колебался от 0,3 до 0,4 нг/ мл (медиана 0,35 нг/мл) и высоким риском – 0,3 – 0,5 нг/мл (медиана 0,4 нг/мл) (табл. 4, рис. 1).
У больных со стадией Т3а, получающих параллельно гормональную терапию, значение PSA варьировало от 0,15 до 2,6 нг/мл и в среднем составило 1,3 нг/мл. Пациенты с местно-распространенным и метастатическим поражением получали неоадъювантную и/или адъювантную гормональную терапию в режиме максимальной андрогенной блокады, вследствие чего уровень PSA перед HIFU был у них относительно низким. У больных из этой группы динамика значений PSA, несмотря на первоначально достоверное снижение после операции (р<0,05), была подвержена изменениям и имела тенденцию к постепенному нарастанию (табл. 5, рис. 2).
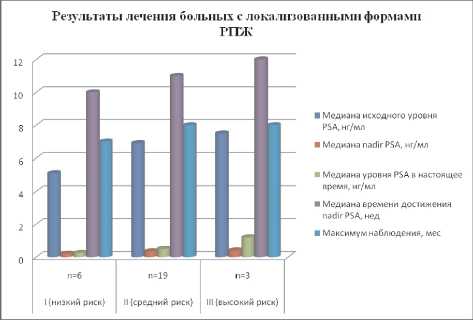
Рис. 1. Результаты лечения больных с локализованными формами РПЖ методом HIFU
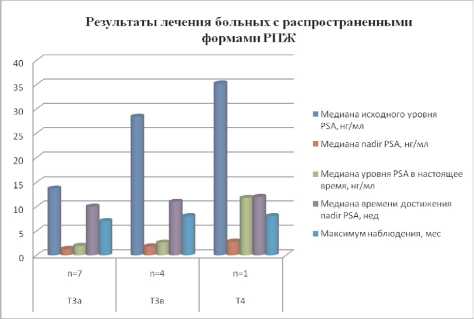
Рис. 2. Результаты лечения больных с локализованными формами РПЖ методом HIFU
Таблица 3
Максимальная скорость мочеиспускания и урофлоуметрический индекс в послеоперационном периоде после HIFU в комбинации с ТУРП и монорежиме (Q max, med, мл/сек)
|
Оперативное пособие |
14 сутки послеоперационного периода |
30 сутки послеоперационного периода |
||
|
А |
М±m |
А |
М±m |
|
|
ТУРП+HIFU аблация простаты |
9,6-20,1 |
13,8± 0,14 |
11-26 |
17± 0,2 |
|
HIFU аблация простаты |
6,0-9,0 |
7,1± 0,1 |
9,0-11,0 |
10± 0,1 |
Таблица 4
Степень риска по Д'Амико (1993)
|
Показатель |
I (низкий риск) n=6 |
II (средний риск) n=19 |
III (высокий риск) n=3 |
|
Медиана исходного уровня PSA, нг/мл |
5,1 |
6,9 |
7,5 |
|
Медиана nadir PSA, нг/мл |
0,2 |
0,35 |
0,4 |
|
Медиана уровня PSA в настоящее время, нг/мл |
0,25 |
0,5 |
1,2 |
|
Медиана времени достижения nadir PSA, нед |
10 |
11 |
12 |
|
Максимум наблюдения, мес |
7 |
8 |
8 |
Таблица 5
Результаты лечения больных с распространенными формами РПЖ методом HIFU
|
Показатель |
Т3а n=7 |
Т3в n=4 |
T4 n=1 |
|
Медиана исходного уровня PSA, нг/мл |
13,7 |
28,4 |
35,2 |
|
Медиана nadir PSA, нг/мл |
1,3 |
1,8 |
2,8 |
|
Медиана уровня PSA в настоящее время, нг/мл |
1,9 |
2,6 |
11,8 |
|
Медиана времени достижения nadir PSA, нед |
10 |
11 |
12 |
|
Максимум наблюдения, мес |
7 |
8 |
8 |
Результаты лечения больных с локализованными формами РПЖ методом HIFU
После ТУР простаты и HIFU терапии практически все пациенты переводились в общую палату. Среди нежелательных явлений в послеоперационном периоде у 5% пациентов после HIFU была отмечена незначительная боль и дискомфорт в области промежности (2 больных), которая не требовала обезболивания и проходила на 2 сутки после лечения. Следует отметить, что ни у одного пациента не наблюдалось ректо-уретральных фистул, ожогов слизистой прямой кишки, выраженной гематурии; не понадобилось экстренных хирургических вмешательств после HIFU терапии.
При эходопплерографии простаты было выявлено отсутствие сосудистого рисунка при цветном допплеровском картировании и увеличение простаты в объеме в среднем на 60% от исходного в первые дни после операции. Уменьшение объема простаты происходило в среднем с 30-го дня послеоперационного периода и продолжалось в течение 6 месяцев, достигая около 50% от исходного объема.
Обсуждение. Результаты лечения одних из первых 7 больных по поводу РПЖ методом HIFU в клинике урологии Клинической больницы имени С.Р. Миротворцева СарГМУ подтвердили данные зарубежных авторов об обоснованности применения комбинации трансуретральной резекции простаты и HIFU [6,7,8,9]. К нежелательным эффектам после HIFU терапии следует отнести нарушение акта мочеиспускания вследствие отека ткани простаты.
Благодаря точной визуализации области воздействия и контролю хода лечебного процесса, малой инвазивности, а также высокому уровню безопасности, метод отличается высокой эффективностью и малым количеством осложнений, что позволяет использовать его у пациентов с осложненным соматическим статусом и тех пациентов, у которых простатэктомия не может быть выполнена или сопряжена с большим риском. Преимуществом метода по сравнению с радикальной простатэктомией является его малая травматичность; с лучевой терапией – отсутствие ионизирующего излучения, в связи с чем воздействие происходит только на ткань простаты; с медикаментозным лечением – меньшие финансовые затраты, лечение выполняется за один сеанс.
Для более точного определения показаний или противопоказаний к HIFU терапии необходимо предварительное полное комплексное инструментальнолабораторное обследование пациента. Мы согласны с мнением большинства специалистов в области HIFU, что не всем больным может применяться HIFU терапия. Из противопоказаний следует отметить большие размеры предстательной железы (более 60 см3). У этих больных, несмотря на предварительную ТУР простаты, очень сложно добиться радикальности. Так же при наличии калькулеза простаты HIFU терапия будет не радикальной в связи с невозможностью прохождения лучей через «твердые» ткани. Предварительная ТУРП более чем в 70% позволяет избавиться от акустически твердых участков в простате и значительно снижает процент осложнений после лечения, связанных с расстройствами мочеиспускания Прогноз лечения зависит от степени онкологического риска, который устанавливается по данным проведенного обследования. Чем меньше агрессия опухоли и её распространенность в простате – тем лучше результаты лечения [10].
Заключение. HIFU аблация простаты позволяет успешно лечить различные стадии РПЖ, с минимальными побочными эффектами, дает возможность ранней оценки эффективности лечения и прогноза в случае рецидива. Сочетание данного метода с ТУРП значительно расширяет показания к его применению, при этом количество осложнений не возрастает. Кроме того, ультразвуковая абляция может использоваться как спасительная терапия при рецидивах РПЖ после других методов лечения. В случае рецидива РПЖ возможно повторить сеанс HIFU или прибегнуть к иному виду лечения, что является одним из наиболее весомых преимуществ HIFU, так как, несмотря на повышение риска развития осложнений, не существует максимально переносимых доз УЗ-излучения. Отсутствие серьезных осложнений и низкая частота нежелательных эффектов после HIFU-терапии позволяют применять этот метод у некоторых пациентов с ПИН высокой градации и высоким риском РПЖ. Несмотря на незначительный срок наблюдения и ограниченное число наблюдений, полученные данные свидетельствуют о том, что ультразвуковая абляция является современным, неинвазивным и безопасным методом лечения РПЖ. Необходимо дальнейшее изучение этой технологии с получением отдаленных результатов лечения.
Список литературы Первый опыт применения высокоинтенсивной фокусированной ультразвуковой аблации (HIFU) в лечении рака простаты
- Рак предстательной железы (компакт-диск)/Н.А. Лопаткин, А.В. Сивков, О.И. Аполихин и др. -М.: НИИ урологии Минздрава РФ, 2002.
- Trackless surgery using focused ultrasound: Technique and case report/G.R. Haar, R.L. Clarke, M.G. Vaughan, C.R. Hill//Minimal Invasive Ther. -1991. -№ 1. -Р. 13-15.
- Histological changes in rat liver tumours treated with highintensity focused ultrasound/L. Chen, I. Rivens, G.R. Haar et al.//Ultrasound Med. Biol. -1993. -Vol. 19. -67-74.
- In vivo effects of high-intensity ultrasound on prostatic adenocarcinoma Dunning R3327/J.Y. Chapelon, J. Margonari, F. Vernier et al.//Cancer Res. -1992. -Vol. 52. -P. 6353-6357.
- Influence of high-intensity focused ultrasound on the development of metastases/G.O.N. Oosierhof, E.В. Cornel, G.A.H.J. Smits et al.//Eur. Urol. -1997. -Vol. 32. -P. 91-95.
- Effect of high-intensity focused ultrasound on human prostate cancer in vivo/S. Madersbacher, M. Pedevilla, L. lingers et al.//Cancer Res. -1995. -Vol.55 (15). -P. 3346 -3351.
- High-intensity focused ultrasound and localized prostate cancer: Efficacy results from the European Multicentric study/S. Thuroff, C. Chaussy, G.Vallancien et al.//J. Endourol. 2003. -Vol. 17. -Р. 673-677.
- High-intensity focused ultrasound for the treatment of localized prostate cancer: 5-year experience/A. Blana, В. Walter, S. Rogenhofer, W.F. Wieland//Urology. -2004. -Vol. 63 (2). -Р. 297-300.
- Transrectal high intensity focused ultrasound for the treatment of localized prostate cancer: Factors influencing the outcome/A. Gelet, J.Y. Chapelon, R. Bouvier et al.//Eur. Urol. -2001. -Vol. 40. -Р. 124-129.
- Results of transrectal focused ultrasound for the treatment of localized prostate cancer (120 patients with PSA L. Poissonnier, A. Gelet, J.Y. Chapelon et al.//Progr. Urol. -2003. -Vol. 13 (1). -Р. 60-72.


