Первый опыт транскатетерной имплантации прототипа нового самораскрывающегося протеза аортального клапана в эксперименте
Автор: Кретов Е.И., Козырь К.В., Таркова А.Р., Сергеевичев Д.С., Коробейников А.А., Тимченко Т.П., Зубарев Д.Д., Зыков И.С., Байструков В.И.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.20, 2016 года.
Бесплатный доступ
Кальцинированный аортальный стеноз - заболевание аортального клапана атеросклеротического генеза у 2-4% лиц старше 65 лет, большинству из которых противопоказано открытое хирургическое вмешательство. Модели самораскрывающихся аортальных клапанов обладают существенными недостатками. Авторы разработали прототип нового усовершенствованного протеза аортального клапана и представляют первый успешный опыт его имплантации лабораторному животному.
Стеноз аортального клапана, транскатетерная имплантация аортального клапана
Короткий адрес: https://sciup.org/142140772
IDR: 142140772 | DOI: 10.21688-1681
Текст научной статьи Первый опыт транскатетерной имплантации прототипа нового самораскрывающегося протеза аортального клапана в эксперименте
Кальцинированный аортальный стеноз — заболевание аортального клапана, чаще атеросклеротического генеза, занимающее 3-е место после ишемической болезни сердца и артериальной гипертензии [1]. Данная патология является наиболее часто встречающимся клапанным заболеванием у пожилых людей (2–4% пациентов старше 65 лет), распространенность которого с каждым годом растет по мере старения населения [2].
Транскатетерная имплантация аортального клапана — альтернатива «открытому» протезированию аортального клапана [3]. С учетом малоинвазивного характера технологии и благоприятных клинических исходов, данная процедура — признанный и популярный вариант лечения пациентов высокого риска с тяжелой сопутствующей патологией и неоперабельных больных с тяжелым аортальным стенозом [4]. Технология не требует кожного разреза, распила грудины и подключения аппарата искусственного кровообращения, что позволяет значительно снизить риск после- операционной летальности и осложнений. Миниинва-зивная имплантация аортального клапана существенно сокращает длительность пребывания пациентов в стационаре (до 2–4 дней), что приводит к снижению затрат в послеоперационном периоде.
Несмотря на преимущества, как и любое другое вмешательство, транскатетерная имплантация аортального клапана имеет ряд осложнений: обструкцию коронарных артерий, парапротезную регургитацию, атриовентрикулярную блокаду.
ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава России совместно с ООО «Ангиолайн» (Новосибирск) разработали прототип нового саморас-крывающегося протеза аортального клапана. Каркас протеза выполнен из никелида титана и обладает эффектом «памяти формы». Створчатый аппарат клапана изготовлен из свиного перикарда, обработанного эпокси-компаундом по стандартной технологии [5] (рис. 1).
В статье представлен первый опыт успешной имплантации разработанного прототипа протеза аортального клапана лабораторному животному.

Статья доступна по лицензии Creative Commons Attribution 4.0.
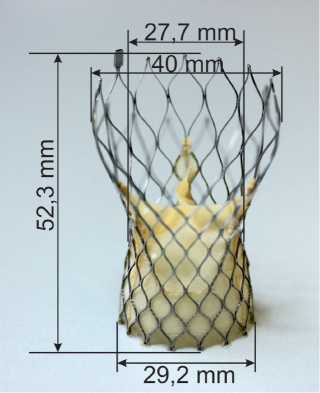
Рис. 1. Внешний вид прототипа протеза аортального клапана
Fig. 1. Physical configuration of aortic valve prosthesis
Методы
Экспериментальную работу осуществляли согласно этическим нормам, регламентирующим эксперименты на животных, в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST N 123 от 18 марта 1986 г., Страсбург, и приказом Минздрава России от 01.04.2016 N 199н «Об утверждении Правил надлежащей лабораторной практики». Все экспериментальные исследования на животном проводили в условиях специализированной ветеринарной операционной под наркозом, с соблюдением правил асептики и антисептики.
Хирургической моделью выбрали свинью мужского пола массой 114 кг. Для регистрации нарушений ритма сердца осуществляли ЭКГ-мониторинг. Лабораторному животному на всех этапах эксперимента (до, после, через 1, 2 ч и 2 нед. после операции) выполняли эхокардиографию (ЭхоКГ). Оценены размер левого предсердия, конечные диастолический и систолический размеры левого желудочка, фракция выброса левого желудочка, трансаортальный градиент давления, эффективная площадь отверстия аортального клапана, аортальная регургитация: отсутствует, незначимая, умеренная или выраженная. Для определения полноценности раскрытия каркаса клапана, правильности работы створок и контроля коронарного кровотока на всех этапах эксперимента проводили ангиографию.
Первым этапом выполнен доступ к правой общей сонной артерии. Правая общая сонная артерия выбрана для пункции ввиду анатомических особенностей расположения и отхождения брахиоцефальных артерий от дуги аорты лабораторного животного. Правая общая сонная артерия продолжает брахиоцефальный ствол; между брахиоцефальным стволом и восходящим отделом аорты отсутствует ангуляция. В общую сонную артерию установили интродьюсер 6 Fr. Далее пунктировали периферическую артерию нижней конечности лабораторного животного, устанавливали интро-дьюсер 6 Fr. Под рентгеноконтролем в коронарный синус аорты заведен диагностический катетер типа Pigtail, выполнена аортография, на основании результатов которой выбран оптимальный размер прототипа клапана.
Для проведения системы доставки к месту имплантации прототипа клапана использован сверхжесткий проводник с мягким кончиком диаметром 0,035 дюйма, заведенный в левый желудочек с помощью катетера Pigtail. Далее выполнена замена интродьюсера 6 Fr на 18 Fr. После этого по сверхжесткому проводнику в левый желудочек проведена система доставки с протезом аортального клапана 29-го размера.
Позиционирование клапана в аортальное кольцо проведено под контролем рентгеноскопии. После контрольной ангио- и эхокардиографии удалены система доставки и проводник, рана послойно ушита.
Через 4 нед. после операции лабораторное животное вывели из эксперимента, прототип клапана и восходящий отдел аорты взяли для патоморфологического исследования.
Результаты
В ходе эксперимента у лабораторного животного по данным ЭКГ-мониторинга зафиксированы редкие желудочковые экстрасистолии преходящего характера в ответ на раздражение эндокарда. Атриовентрикулярных блокад не обнаружено.
По результатам ЭхоКГ в динамике установлено, что сразу же после имплантации протеза, а также через 1 и 2 ч после имплантации у лабораторного животного наблюдалась незначительная аортальная регургитация, отсутствующая до операции. Регургитация исчезла через 2 нед. после операции. Непосредственно после успешной имплантации протеза клапана отмечалось повышение трансаортального градиента давления (6,2 против 1,8 мм рт. ст. до процедуры). Нарушений систо-
Таблица 1 Динамика показателей ЭхоКГ на разных этапах эксперимента
|
Показатель |
До операции |
Сразу после имплантации |
Через 1 ч после имплантации |
после имплантации |
после имплантации |
|
Левое предсердие, мм |
25 |
25 |
24 |
24 |
25 |
|
Конечный диастолический размер левого желудочка, мм |
39 |
40 |
40 |
39 |
42 |
|
Конечный систолический размер левого желудочка, мм |
17 |
18 |
17 |
15 |
17 |
|
Фракция выброса левого желудочка, % |
62 |
60 |
62 |
59 |
64 |
|
Трансаортальный градиент давления, мм рт. ст. |
1,8 |
6,2 |
6,0 |
5,2 |
3,4 |
|
Эффективная площадь отверстия, см2 |
2,5 |
2,1 |
2,1 |
2,0 |
2,0 |
|
Аортальная регургитация |
Отсутствует |
Незначимая |
Незначимая |
Незначимая |
Отсутствует |
лической/диастолической функции левого желудочка, миграции протеза не отмечено. Данные ЭхоКГ представлены в табл. 1.
По данным ангиографии сразу после имплантации, а также через 1 и 2 ч после операции выявили парапро-тезную регургитацию, которая полностью исчезла при отдаленном мониторинге (2 нед.). Нарушения работы створок прототипа клапана, коронарного кровотока ни на одном из этапов мониторинга не обнаружили (рис. 2).
По результатам патоморфологического исследования, прототип клапана плотно прилегал к стенке аорты, а его нижний край находился вблизи кольца митрального клапана и достаточно далеко от папиллярных мышц.
Створки нативного аортального клапана были зажаты между протезом и кольцом клапана. Устья коронарных артерий были свободны. После удаления прототипа протеза из аорты на интиме аорты четко просматривались отпечатки сетчатой структуры каркаса прототипа протеза, что говорит о высоком радиальном давлении (рис. 3).
Обсуждение
Транскатетерное протезирование аортального клапана — альтернатива лечению возрастных пациентов с выраженным стенозом аортального клапана, которым отказывают в операции или не предлагают ее из-за высокого хирургического риска или других причин. Безо-
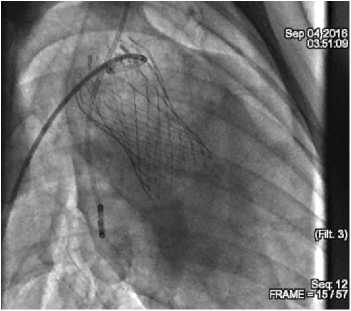
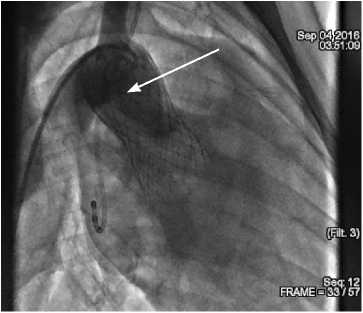
Рис. 2. Контрольная аортография: A — сразу после имплантации прототипа протеза клапана; B — отсутствие значимой регургитации
Fig. 2. Check aortography: ( A ) immediately after prosthesis implantation; ( B ) no significant regurgitation
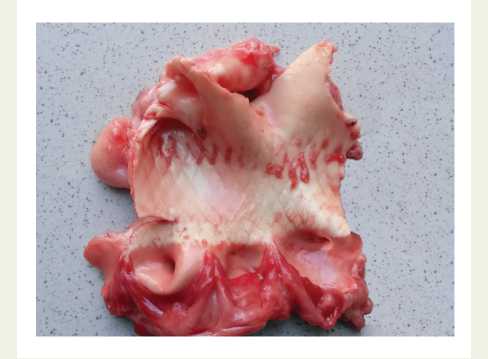
Рис. 3. Макроскопический препарат стенки аорты после удаления прототипа протеза
Fig. 3. Macroscopic specimen of the aortic wall after prosthesis prototype removal пасность и эффективность данных имплантаций доказана в течение двух десятилетий [6].
Тем не менее технические сложности делают транскатетерную имплантацию аортального клапана более рискованной процедурой. После вмешательства могут возникнуть серьезные осложнения. Для повышения терапевтической эффективности имплантации клапана, упрощения процедуры и снижения риска осложнений мы разработали новое поколение самораскрывающихся протезов аортального клапана и исследовали их на лабораторных животных.
Свиньи — распространенная и успешная экспериментальная модель для кардиоваскулярных исследований. Животных легко содержать, а анатомия их сердечно-сосудистой системы схожа с человеческой. В исследовании мы успешно применили доступ через сонную артерию для имплантации разработанного устройства. Такой доступ используют из-за слишком малого диаметра бедренных артерий. Кроме того, значительный изгиб аорты не позволяет проводить слишком жесткие устройства, доставляемые через бедренные артерии. В то же время общая сонная артерия свиньи обладает достаточными диаметром и длиной для установки интродьюсера необходимого диаметра. Тем не менее сонную артерию обычно не используют в качестве доступа в клинической практике, поэтому проведенный эксперимент не полностью имитирует клиническую ситуацию. Кроме того, из-за зависимости размера сосудов у свиней от их массы необходима эхокардио-или ангиография, чтобы выбрать наиболее точные размеры аортальных протезов клапанов.
В исследовании выявлено, что имплантация разработанного прототипа протеза не нарушает коронарный кровоток благодаря конструкции и относительно высокому расположению коронарных устьев у свиней.
Проводящая система сердца расположена в непосредственной близости от кольца аортального клапана, поэтому при имплантации попадает под ту часть каркаса, где радиальное усилие максимальное. Следовательно, более глубокая установка в выходной отдел левого желудочка протеза клапана может с большей вероятностью вызвать нарушение ритма. Полная атриовентрикулярная блокада сразу же после имплантации может свидетельствовать о слишком сильном давлении или тяжелом повреждении проводящих путей, вызванных имплантируемым клапаном. В исследовании мы уменьшили радиальную силу прототипа каркаса клапана в его нижней части, чтобы уменьшить давление в выходном отделе левого желудочка.
Заключение
Исследования и разработки в данной области, возможно, позволят сделать транскатетерную имплантацию протеза аортального клапана более безопасной и доступной для пациентов, которым противопоказано открытое хирургическое вмешательство. Несомненно, для более полной оценки функциональности прототипа нового самораскрывающегося протеза аортального клапана необходимо увеличение объема выборки и проведение серии экспериментов на лабораторных животных.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Первый опыт транскатетерной имплантации прототипа нового самораскрывающегося протеза аортального клапана в эксперименте
- Карпова Н.Ю., Рашид М.А., Казакова Т.В. Кальцинированный аортальный стеноз: принципы диагностики и лечения//Idoctor. 2013. № 7. С. 26-29.
- Supino P.G., Borer J.S., Preibisz J., Bornstein A. The epidemiology of valvular heart disease: a growing public health problem//Heart Fail Clin. 2006. Vol. 2. No. 4. P. 379-393. http://dx.doi. org/10.1016/j.hfc.2006.09.010
- Makkar R.R., Fontana G.P., Jilaihawi H., Kapadia S., Pichard A.D., Патология кровообращения и кардиохирургия. 2016. Т. 20. № 4. С. 83-87
- Douglas P.S., Thourani V.H., Babaliaros V.C., Webb J.G., Herrmann H.C., Bavaria J.E., Kodali S., Brown D.L., Bowers B., Dewey T.M., Svensson L.G., Tuzcu M., Moses J.W., Williams M.R., Siegel R.J., Akin J.J., Anderson W.N., Pocock S., Smith C.R., Leon M.B.; PARTNER Trial Investigators. Transcatheter aorticvalve replacement for inoperable severe aortic stenosis//N. Engl. J. Med. 2012. Vol. 366. P. 1696-1704. http://dx.doi. org/10.1056/NEJMoa1202277
- Toggweiler S., Humphries K.H., Lee M., Binder R.K., Moss R.R., Freeman M., Ye J., Cheung A., Wood D.A., Webb J.G. 5-year outcome after transcatheter aortic valve implantation//J. Am. Coll. Cardiol. 2013. Vol. 61. No. 4. P. 413-419. http://dx.doi. org/10.1016/j.jacc.2012.11.010


