Первый случай протезирования почечной артерии сосудистым стент-графтом при реновисцеральном дебраншинге
Автор: Насрашвили Г.Г., Кузнецов М.С., Панфилов Д.С., Лелик Е.В., Саушкин В.В., Кожанов Р.С., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.36, 2021 года.
Бесплатный доступ
В статье продемонстрирован первый клинический случай применения сосудистого стент-графта при протезировании почечной артерии в рамках гибридного лечения пациента с диссекцией аорты, тип Stanford В, c проведением реновисцерального дебраншинга и последующим эндопротезированием аорты. Описаны возможные применяемые подходы к нефропротекции при протезировании почечных артерий, хирургическая техника использования графта, а также особенности и преимущества его применения. Обсуждаются место данной новой техники в хирургии торакоабдоминальной аорты.
Торакоабдоминальная аневризма аорты, висцеральный дебраншинг, стент-графт, протезирование почечных артерий, нефропротекция
Короткий адрес: https://sciup.org/149136647
IDR: 149136647 | УДК: 616.136.7-77-089:615.472.5.032.13:001.895 | DOI: 10.29001/2073-8552-2021-36-2-123-127
Текст научной статьи Первый случай протезирования почечной артерии сосудистым стент-графтом при реновисцеральном дебраншинге
Проблема рецидива протезного инфекционного эндокардита (ИЭ) остается актуальной, несмотря на разработку новых антибиотиков, и методов профилактики. Частота встречаемости ИЭ протезированного клапана (ИЭПК) составляет от 1 до 13% [1]. В большинстве случаев местом поражения является зона между имплантированной манжетой протеза и тканями сердца (перианулярная область) с формированием в этой зоне абсцессов, иногда циркулярных, приводящих в последующем к развитию парапратезных фистул и возможному отрыву механического клапанного протеза. У биологических протезов чаще поражаются створки с их последующим разрывом и перфорацией [2]. Эффективность консервативной терапии ИЭПК крайне низкая. Прогноз без оперативного лечения неблагоприятный в 80% случаев [1].
Операции при протезном эндокардите являются технически сложными как с точки зрения повторного доступа, так и проведения эффективной санации инфекционного очага [3]. В настоящее время при выполнении интраоперационной санации рекомендовано удаление всех инородных материалов, включая инфицированный протез, прокладки и даже любой кальцинат, оставшийся от предыдущей операции. После механической обработки места инфекционного очага вторым этапом необходима химическая обработка. К химическим средствам относят различные антисептики, которые не всегда способны полностью удалить все бактериальные колонии, защищенные оболочкой из организованного фибрина и бактериальной пленки, а также могут провоцировать тотальный гемолиз при попадании в контур аппарата искусственного кровообращения (ИК) и химическое повреждение эндокарда. [4].
Приведенный ниже клинический случай демонстрирует возможность применения при хирургическом лечении ИЭПК комбинированного способа обработки воздушно-плазменным потоком и экзогенным оксидом азота (NO) места инфекционного очага с помощью аппарата «Плазон» без использования антисептиков.
Клинический случай
Пациент К., мужчина 36 лет, в плановом порядке поступил на повторное оперативное вмешательство в кардиохирургическое отделение НИИ кардиологии Томского НИМЦ по поводу ИЭ механического протеза аортального клапана.
Из анамнеза известно, что в мае 2017 г. пациенту было проведено протезирование аортального клапана механическим протезом «МедИнж» размером 25 в условиях ИК и антеградной кардиоплегии раствором «Куста-диол» по поводу сложного порока аортального клапана с преобладанием стеноза. Послеоперационный период протекал без особенностей, на 12-е сут пациент выписан в удовлетворительном состоянии для наблюдения кардиологом по месту жительства.
В марте 2020 г. у пациента появилась фебрильная лихорадка до 39 oC, диспепсические проявления, пять дней лечился дома самостоятельно, принимал парацетамол, аспирин. На 6-е сут вызвал бригаду скорой медицинской помощи, которой был доставлен в дежурный терапевтический стационар. По данным инструментальных исследований, при проведении трансторакальной эхокардиографии (ЭхоКГ) были выявлены подвижные вегетации на опорном кольце протеза аортального клапана. Дополнительно была выполнена чреспищеводная ЭхоКГ – обнаружен конгломерат вегетаций на запирательных элементах протеза. В стационаре пациенту начата антибактериальная терапия с положительной динамикой по лабораторным показателям. После консультации кардиохирурга пациент был переведен в НИИ кардиологии Томского НИМЦ для репротезирования аортального клапана.
При поступлении больной предъявлял жалобы на давящие, сжимающие боли за грудиной, возникающие при быстрой ходьбе, которые проходили в покое самостоятельно через 5–7 мин, одышку преимущественно инспираторного характера при физической нагрузке, эпизоды повышения артериального давления до 150/90 мм рт. ст., увеличение температуры тела до фебрильных значений, озноб, слабость, боль в правом плече.
Объективный статус при поступлении: общее состояние средней степени тяжести. Сознание ясное. Температура субфебрильная – 37,5 oC. Аускультатив-но: дыхание везикулярное, немного ослаблено в базальных отделах обоих легких, частота дыхательных движений – 16 в мин. Тоны сердца ясные, выслушивается мягкий систолический шум на фоне сниженной работы запирательных элементов протеза аортального клапана. Частота сердечных сокращений – 89 уд./мин. Артериальное давление одинаковое на обеих руках 125/80 мм рт. ст.
По данным лабораторных исследований определялся лейкоцитоз 10,5 х 109/л, увеличение скорости оседания эритроцитов (29 мм/ч), повышение показателей МНО (2,67 отн. ед.) и протромбинового времени (31,6 с) на фоне приема варфарина.
Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки и грудины: выявлено небольшое расширение восходящего отдела аорты, ее уплотнение и обызвествление, пневмофиброз с наличием небольших тяжей в S5 справа и S5, S8 слева.
Трансторакальная ЭхоКГ: по данным исследования камеры сердца не расширены, умеренная гипертрофия левого желудочка. Механический протез в аортальной позиции. В области переднего края протеза подвижная вегетация размером до 15 мм. Регургитация на протезе до 1-й степени. Остальные клапаны сердца без патологических изменений. (рис. 1).
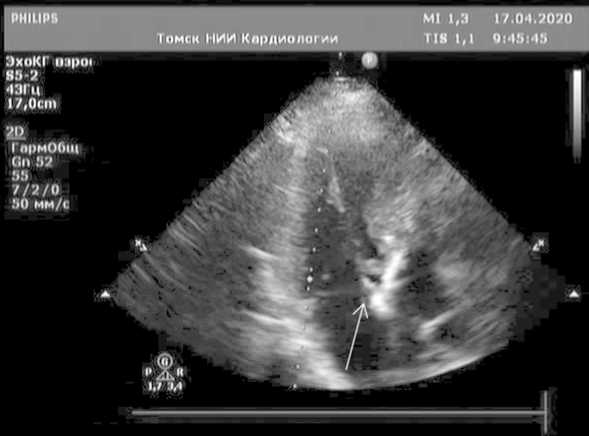
Рис. 1. Трансторакальная ЭхоКГ, стрелкой указано место расположения вегетации Fig. 1. Transthoracic echocardiography. The arrow indicates the location of vegetation
Пациенту было выполнено микробиологическое исследование, по результатам которого был выявлен умеренный рост Enterococcus facialis . В связи с этим до операции пациент начал получать ванкомицин в дозе 1 г 2 раза в сутки.
Учитывая тяжесть состояния, вегетацию на створке протеза, нарушение его нормального функционирования, пациенту выполнена операция – репротезирование аортального клапана в условиях ИК и фармакохолодовой кардиоплегии.
После выполнения срединной рестернотомии в переднем средостении и полости перикарда определялся выраженный спаечный процесс. Произведено подключение аппарата ИК по схеме «аорта – правое предсердие». Выполнено поперечное пережатие аорты и ее вскрытие по старому шву, на 1 см выше устья правой коронарной артерии (ПКА), кардиоплегия – раствором «Кустодиол» (Dr. F. Koehler Chemie GmbH, Бенсхайм, Германия) 1000 мл антеградно в устья коронарных артерий. При ревизии протеза аортального клапана в области некоронарного синуса обнаружено место вскрывшегося абсцесса фиброзного кольца, под манжетой протеза множественные вегетации бело-розового цвета, на передней створке про- теза – объемная вегетация размером 1 × 1,5 см, ограничивающая движение запирательных элементов. После иссечения протеза обнаружены участки «расплавления» фиброзного кольца, с фиброзного кольца взяты участки ткани и вегетации на посев (рис. 2).
На рисунке 3 представлен удаленный протез и вегетация, нарушающая работу запирательных элементов.
Зона фиброзного кольца и вскрывшегося абсцесса промыта физиологическим раствором, затем данные зоны обработаны воздушно-плазменной смесью с содержанием NO (50 ppm). Смесь получали при помощи аппарата «Плазон» в режиме щадящей стерилизации. Температура в обрабатываемой зоне не превышала 60– 70 oC. Обработка проводилась сканирующими движениями в течение 2 мин (рис. 4). После обработки для контроля эффективности процедуры повторно взяты фрагменты ткани с фиброзного кольца и зоны абсцесса для бактериального посева.
Дополнительно была выполнена пластика основания передней створки митрального клапана. Затем на П-образных швах с прокладками в аортальную позицию имплантирован механический протез «МедИнж-2» размером 23.
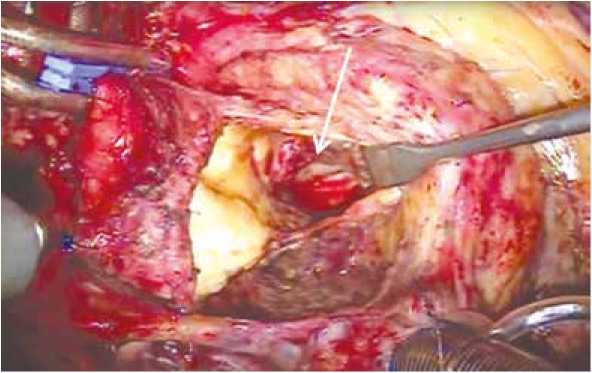
Рис. 2. Общий вид пораженного фиброзного кольца, стрелкой указано место расположения абсцесса
Fig. 2. General view of the affected annulus fibrosus. The arrow indicates the location of the abscess
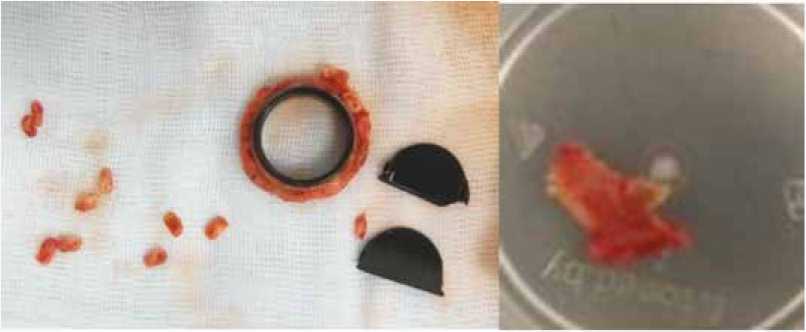
Рис. 3. Удаленный протез аортального клапана «МедИнж» размером 25 и вегетация, удаленная с одной из створок протеза Fig. 3. The aortic valve prosthesis «MedIng» size 25 and vegetation removed from one of the valves of the prosthesis
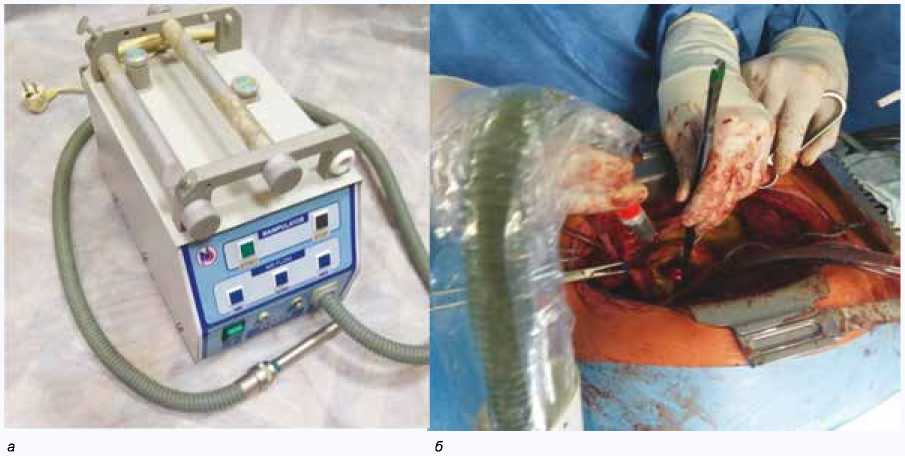
Рис. 4. а ) Аппарат «Плазон»; б ) Общий вид обработки инфицированной ткани в области протезирования аортального клапана воздушно-плазменным потоком с комбинированным воздействием оксидом азота
Fig. 4. а ) Plazon device; б ) General view of the treatment of infected tissue in the area of aortic valve prosthetics using Plazon device providing air-plasma flow combined with nitric oxide delivery
Аорта ушита двурядными швами на прокладках. Проведена профилактика воздушной эмболии. Снят зажим с аорты. Самостоятельное восстановление сердечной деятельности. Окончено ИК. Поскольку у пациента была септицемия, после окончания основного этапа, для профилактики инфекционных раневых осложнений пациенту было проведено воздействие воздушно-плазменным потоком на ткань ранее рассеченной грудины в режиме жесткой стерилизации с экспозицией по 1 мин на каждый из краев операционной раны. После ушивания и сведения краев грудины провели воздействие воздушно-плазменным потоком на мягкие ткани раны по всей ее поверхности в режиме щадящей стерилизации с экспозицией по 2 мин на каждый из краев. После этого края раны ушиты послойно.
Сразу же после операции дополнительно к консервативной терапии был назначен кларитромицин по 500 мг внутривенно 1 раз в сутки и ванкомицин 1 г 2 раза в сутки. Общее состояние пациента было стабильным, экстубирован через 6 ч после операции, потребность в инотропной поддержке отсутствовала, на 2-е сут больной переведен в кардиохирургическое отделение.
Послеоперационный период протекал без осложнений, пациент выписан на 10-е сут в удовлетворительном состоянии. На момент выписки: по данным лабораторных показателей была положительная динамика белого миелоидного ростка (уровень лейкоцитов – 7,5 х 109/л), красного кровяного ростка (гемоглобин – 123 г/л; гематокрит 0,41%), специфических биохимических маркеров воспаления (СРБ 8,3 мг/л, прокальцитонин – <0,5 нг/мл).
Результаты посевов: интраоперационный (фрагменты вегетаций с фиброзного кольца аортального клапана) – рост Enterococcus facialis ; интраоперационный – после обработки зоны инфекционного очага воздушно-плазменной смесью с комбинированным воздействием терапией NO роста бактериальной флоры нет.
Трансторакальная ЭхоКГ: камеры сердца не расширены, общая сократимость желудочков в норме. Нарушений локальной сократимости нет. Механический протез в аортальной позиции, признаков дисфункции не выявлено. Остальные клапаны функционируют нормально (рис. 5).
Рис. 5. Трансторакальная ЭхоКГ в послеоперационном периоде Fig. 5. Transthoracic echocardiography in the postoperative period
МСКТ органов грудной клетки: сердце не увеличено. Небольшое расширение восходящего отдела аорты, ее уплотнение и обызвествление. Снижение прозрачности в задненижних отделах S9, S10 с обеих сторон (возможно, за счет гиповентиляции) Пневмофиброз с наличием небольших тяжей в S5 справа и S5, S8 слева.
Обсуждение
Внедрение способа комбинированного воздействия воздушно-плазменного потока с NO терапией на очаг инфекционного воспаления при ИЭ основано на успешном опыте применения для профилактики и лечения инфекционных раневых осложнений в клинической практике. Известно, что экзогенный NO обладает хорошим бакте- рицидным действием, как собственным, так и опосредованным воздействием путем формирования пероксинитрита, образующимся в тканях при взаимодействии NO с супероксид-анионом (NO+О2- →ONOO-). Кроме этого, NO индуцирует фагоцитоз бактерий нейтрофилами и макрофагами; оказывает усиление продукции противовоспалительных и прорегенеративных цитокинов и факторов ангиогенеза, усиливает прямую индукцию пролиферации фибробластов, роста сосудов, синтеза коллагена, образования и созревания грануляционной ткани. Таким образом, важнейшим преимуществом NO-терапии в отличие от большинства физических и медикаментозных лечебных факторов является воздействие полифункционального NO на все фазы единого воспалительно-регенераторного процесса. Еще одним преимуществом NO-терапии является способность экзогенного NO диффундировать не только через раневую поверхность, но и через неповрежденную ткани, т. е. возможность неинвазивного воздействия не только на поверхностные, но и глубокие очаги инфекционного воспаления в ткани [5, 6].
Заключение
Вышеизложенный клинический случай иллюстрирует опыт положительного комплексного и безопасного применения аппарата «Плазон», включающий комбинированное воздействие воздушной плазмы и экзогенного NO для обработки и санации внутрисердечных очагов инфекции.
Список литературы Первый случай протезирования почечной артерии сосудистым стент-графтом при реновисцеральном дебраншинге
- Hughes G.C., Andersen N.D., Hanna J.M., McCann R.L. Thoracoabdominal aortic aneurysm: Hybrid repair outcomes. Ann. Cardiothorac. Surg. 2012;1(3):311-319. DOI: 10.3978/j.issn.2225-319X.2012.08.13.
- Shuto T., Wada T., Miyamoto S., Kamei N., Hongo N., Mori H. Ten-year experience of the thoraco-abdominal aortic aneurysm treatment using a hybrid thoracic endovascular aortic repair. Interact. CardioVasc. Thorac. Surg. 2018;26(6):951-956. DOI: 10.1093/icvts/ivy021.
- Riga C.V., Jenkins M.P. Best surgical option for thoracoabdominal aneurysm repair - the hybrid approach. Ann. Cardiothorac. Surg. 2012;1(3):339-344. DOI: 10.3978/j.issn.2225-319X.2012.08.11.
- Quinones-Baldrich W.J., Panetta T.F., Vescera C.L., Kashyap V.S. Repair of type IV thoraco-abdominal aneurysm with a combined endovascular and surgical approach. J. Vasc. Surg. 1999;30:555-560. DOI: 10.1016/s0741-5214(99)70084-4.
- Tshomba Y., Melissano G., Logaldo D., Rinaldi E., Bertoglio L., Civilini E. et al. Clinical outcomes of hybrid repair for thoraco-abdominal aortic aneurysms. Ann. Cardiothorac. Surg. 2012;1(3):293-303. DOI: 10.3978/j. issn.2225-319X.2012.07.15.
- Damrauer S.M., Fairman R.M. Visceral debranching for the treatment of thoraco-abdominal aortic аneurysms: Based on a Presentation at the 2013 VEITH Symposium, November 19-23, 2013 (New York, NY, USA). AORTA (Stamford). 2015;3(2):67-74. DOI: 10.12945/j.aor-ta.2015.14-066.
- Drinkwater S.L., Bockler D., Eckstein H., Cheshire N.J.W., Kotelis D., Wolf O. et al. The visceral hybrid repair of thoraco-abdominal aortic aneurysms - a collaborative approach. Eur. J. Vasc. Endovasc. Surg. 2009;38(5):578-585. DOI: 10.1016/j.ejvs.2009.07.002.
- Белов Ю.В., Винокуров И.А. Острая почечная недостаточность после операций на торакоабдоминальном отделе аорты в условиях защиты органов раствором Кустодиол. Кардиология и сердечнососудистая хирургия. 2014;7(4):24-28.
- Chiesa R., Kahlberg A., Mascia D., Tshomba Y., Civilini E., Melissa-no G. Use of a novel hybrid vascular graft for sutureless revascularization of the renal arteries during open thoraco-abdominal aortic aneurysm repair J. Vasc. Surg. 2014;60(3):622-630. DOI: 10.1016/j. jvs.2014.03.256.
- Tshomba Y., Kahlberg A., Melissano G., Coppi G., Marone E., Ferrari D. et al. Comparison of renal perfusion solutions during thoracoabdominal aortic aneurysm repair. J. Vasc. Surg. 2014;59(3):623-633. DOI: 10.1016/j.jvs.2013.09.055.
- Козлов Б.Н., Насрашвили Г.Г., Кузнецов М.С., Панфилов Д.С., Черных Ю.Н., Мочула А.В. и др. Непосредственные результаты реновисцерального дебранчинга у пациентов с патологией торакоабдоминальной аорты. Кардиология и сердечно-сосудистая хирургия. 2020;13(2):104-107. DOI: 10.17116/kardio202013021104.
- Cho K.J., Park J.Y. Visceral debranching thoracic endovascular aneurysm repair for chronic dissecting thoraco-abdominal aortic aneurysm. Korean J. Thorac. Cardiovasc. Surg. 2014;47(6):548-551. DOI: 10.5090/kjtcs.2014.47.6.548.
- Landry G.J., Lau I.H., Liem T.K., Mitchell E.L., Moneta G.L. Adjunctive renal artery revascularization during juxtarenal and suprarenal abdominal aortic aneurysm repairs. Am. J. Surg. 2010;199(5):641-645. DOI: 10.1016/J.AMJSURG.2010.01.010.
- Biasi L., Tecchio T., Ali T., Morgan R., Loftus I., Thompson M. Visceral ischaemia and organ dysfunction after hybrid repair of complex thora-co-abdominal aneurysms. Acta Biomed. 2011;82(1):41-50.


