Пилотное клиническое исследование по мониторингу эффективности химиотерапии злокачественных опухолей у пациентов с помощью маркера эпителиальных карцином Са-62
Автор: Хакимова Гульноз Голибовна, Черкасова Жаннета Рашидовна, Цуркан Сергей Александрович, Федчиков Глеб Александрович, Суганов Николай Валерьевич, Горбунова Вера Андреевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.18, 2019 года.
Бесплатный доступ
Цель исследования - оценка возможности использования контроля динамики сывороточного инновационного маркера эпителиальных карцином СА-62 для мониторинга лечения, выявления прогрессирования или стабилизации опухолевого процесса, а также для выявления рецидивов у пациентов в процессе химиотерапии. Материал и методы. Исследование проводилось в течение 12 мес двумя независимыми группами - клиническими онкологами и биохимиками в «двойном ослепленном» режиме. В пилотное клиническое исследование были включены 89 пациентов, имеющих различные солидные опухоли (рак желудка, мелкоклеточный рак легкого, колоректальный рак, нейроэндокринные опухоли и др.), подтвержденные результатами морфологического исследования, с наличием хотя бы одного измеряемого очага по критериям RECIST, состоянием на момент включения по ECOG 0-2 и удовлетворительными лабораторными показателями. Экспрессия онкомаркера СА-62 определялась при помощи опытного образца иммунохемилюминесцентного анализа «ИХА-СА-62», разработанного для выявления онкологических заболеваний эпителиального генеза, методом импульсной хемилюминесценции. Результаты. До лечения повышенный уровень биомаркера СА62 наблюдался у 76 % пациентов, который после химиотерапии снизился до нормальных референтных значений ( function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Химиотерапия, рак желудка, мелкоклеточный рак легкого, колоректальный рак, рак яичников, нейроэндокринные опухоли, раковый антиген са-62, иммунохемилюминесцентный анализ, онкомаркер, мониторинг, стабилизация, прогрессирование, са-62 cancer antigen
Короткий адрес: https://sciup.org/140254282
IDR: 140254282 | УДК: 616-006.04-08-036.8:615.28 | DOI: 10.21294/1814-4861-2019-18-5-18-28
Текст научной статьи Пилотное клиническое исследование по мониторингу эффективности химиотерапии злокачественных опухолей у пациентов с помощью маркера эпителиальных карцином Са-62
В последнее десятилетие особое внимание уделяется персонифицированному подходу в лечении онкологических больных, направленному на увеличение частоты полных и частичных ответов, согласно классификации RECIST1.1, и контролю заболевания. Улучшение качества жизни пациентов напрямую коррелирует с показателями общей выживаемости [1–3].
Для осуществления полноценного контроля лечения, оценки его эффективности, а также для выявления возможного рецидива заболевания большое практическое значение, помимо данных физикального осмотра и инструментального обследования, имеет динамика уровня опухолевых биомаркеров в сыворотке пациентов, проходящих химиотерапию. Польза сывороточных маркеров для мониторинга эффективности лечения и выявления рецидивов у пациентов с распространенной формой онкологического заболевания с недавнего времени стала привлекать широкое внимание различных исследовательских центров.
Многочисленные клинические исследования, проведенные в России, Европе, Канаде и США [4–12], определили некоторые перспективные биомаркеры, способные выявлять в отдельных случаях рецидивы, прогнозировать течение опухолевого процесса, а также предсказывать ответ опухоли на проводимое лекарственное лечение. Примерами таких маркеров являются CA 19-9, PSA, CEA, NSE, CYFRA 21-1 или СА-125. В то же время, несмотря на достаточно высокую специфичность вышеуказанных биомаркеров, они имеют недостаточную чувствительность и/или ограниченный спектр. Это не позволяет выявить прямую корреляцию между прогрессированием заболевания и уровнем экспрессии биомаркеров.
Поиск высокочувствительных опухолевых маркеров, способных служить индикатором прогрессирующего роста злокачественной опухоли или, наоборот, указывать на частичный или полный ответ опухоли на лечение, не менее актуален, чем разработка новых противоопухолевых лекарственных препаратов. В качестве перспективного маркера для мониторинга лечения пациентов с различными солидными опухолями был выбран инновационный раковый антиген CA-62 с M.W 62 kDa, который показал высокую чувствительность при выявлении эпителиальных злокачественных новообразований ранних стадий и получил высокую оценку экспертов в слепых исследованиях в Европе и Канаде [13–15].
Раковый антиген CA-62 представляет собой N-гликопротеин с NAc-гликозидной связью и разветвленными антеннами полисахаридов, который в больших количествах образуется на поверхности малигнизированных клеток эпителия с самого начала канцерогенеза. Гликопротеин СА-62 встроен в поверхностную мембрану и присоединяет АФП при помощи особой комбинации олигосахаридов [16–19], а также связывается с цитоплазматическими белками и способствует рецептор-опосредованному эндоцитозу внутрь клетки [18, 19]. Уровень и характер экспрессии ракового антигена СА-62 в клетках опухолей человека в сравнении с экспрессией этого белка в здоровых тканях значительно отличаются [19– 22], при этом опухолевые клетки выделяют две основные растворимые фракции гликопротеина в кровь, в результате чего количественное измерение циркулирующего в крови антигена СА-62 может быть использовано в качестве метода для диагностирования, скрининга и мониторинга лечения эпителиальных опухолей.
В данной работе представлены результаты изучения динамики инновационного сывороточного маркера эпителиальных карцином СА-62 в процессе химиотерапии. Измерение экспрессии биомаркера проводилось при помощи опытного образца разработанного компанией ООО «Джей-вис Диагностикс» иммунохемилюминесцентного анализа «Набор реагентов «ИХА-СА62.
Целью исследования была оценка возможности использования контроля динамики инновационного сывороточного маркера эпителиальных карцином СА-62 для мониторинга лечения, выявления прогрессирования или стабилизации опухолевого роста, а также для выявления рецидивов у пациентов, проходящих химиотерапию. Исследование было разработано таким образом, что данные измерения сывороточного уровня антигена СА62 у онкологических пациентов с IIb (n=4) и III/IV стадией заболевания (n=85), проводимого наряду с химиотерапией, сравнивались с критерием RECIST, отражающим оценку эффективности проводимого лечения.
Материал и методы
Исследование проводилось с августа 2015 г. по февраль 2016 г. двумя независимыми группами – клиническими онкологами и биохимиками – в «двойном ослепленном» режиме. В пилотное клиническое исследование были включены пациенты с морфологически подтвержденным местнораспространённым (стадии II и III) и метастатическим раком, с наличием, по крайней мере, одного измеряемого очага по критериям RECIST, состоянием на момент включения по ECOG 0–2 и удовлетворительными лабораторными показателями. Измерения уровня маркера CA-62 в сыворотке каждого пациента проводились 1 раз в месяц в ходе курса химиотерапии (3 мес) и продолжались в том же режиме в течение 2–3 мес после лечения.
Таким образом, в окончательный список исследования вошли 28 здоровых контролей и две группы больных: первая группа включает в себя 42 больных, исследование которых было начато до химиотерапии (ХТ), и вторая группа – 47 больных, вошедших в исследование уже в процессе химиотерапии. Показатели ракового антигена СА-62 у добавленных к исследованию 47 пациентов изучались уже в процессе ХТ. Оценка первоначального уровня ракового антигена СА-62 производилась только в первой группе больных, тогда как оценка эффективности проводимой терапии оценивалась в обеих группах.
Кровь у пациентов забиралась и обрабатывалась перед началом лечения (первая группа), в процессе и по окончании лечения (первая и вторая группы). Забор крови производился в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в соответствии с утвержденными стандартными протоколами. Так как исследование проводилось в рамках стандартного текущего врачебного наблюдения и его результаты не влияли на принятие решения врачом и не приводили к дополнительным медицинским процедурам для больных, то в соответствии с медицинской деонтологией разрешение этического комитета на такое исследование не требуется. Забор крови проводился совместно с лабораторными исследованиями пациентов с вышеуказанным диагнозом.
Определение уровня опухолевого маркера СА-62 в сыворотке пациентов производили при помощи опытного образца разработанного компанией ООО «Джейвис Диагностикс» иммунотеста «ИХА-СА-62». Сывороточный тест «ИХА-СА-62» представляет собой одностадийный конкурентный вариант твердофазного иммунохе-милюминесцентного анализа (ИХА), при котором происходит конкуренция между содержащимся в анализируемом образце раковым антигеном СА-62 и люминесцентным конъюгатом СА-62-Акридин за связывание с моноклональными антителами к гликопротеину СА-62, иммобилизованными на внутренней поверхности лунок планшета. Во время 2-часовой инкубации к иммобилизованным специфическим антителам добавляется раствор, содержащий разбавленный образец сыворотки и фиксированную концентрацию меченого антигена, после чего сорбент отмывается от несвязавшихся компонентов и регистрируется люминесцентный сигнал образовавшихся на твердой фазе иммунных комплексов.
Несвязавшиеся компоненты удаляются во время отмывки, а образовавшийся иммунный комплекс {анти-СА62-МаТ-(СА-62-Aкридин)} регистрируется при помощи люминесцентного сигнала, вызванного химической реакцией окисления Акридина (люминофора) при добавлении пре-активатора (водного раствора 1 ммоль/л HNO3 и 0,1 % H2O2), а затем активирующего 1N раствора NaOH. Величина регистрируемого люминесцентного сигнала продукта окисления субстрата обратно пропорциональна содержанию ракового антигена СА-62 в анализируемой пробе. Серия калибровочных проб (Стандартные калибраторы «СА-62») тестируется одновременно с образцами, на основе чего строится калибровочная кривая (Logit-Log кривая) (рис. 1) для количественного определения гликопротеина СА-62 (Ед/мл) в неизвестных образцах.
Для регистрации люминесцентного сигнала использовался метод импульсной хемилюминесценции. Считывание результатов производили на микропланшетном люминометре Glomax 96 Microplate Luminometer (Promega, США), оснащенным инжекторным блоком для проведения импульсной люминесценции.
При статистической оценке полученных результатов для ROC-анализа характеристической кривой использовали программу Analyse-it Software, Ltd., Великобритания. Для классификации случая как положительного или отрицательного по маркеру СА-62 была определена пороговая величина, которая выражалась в 95 % специфичности в нашей базе данных. После этого в качестве положительного рассматривался любой случай, который был выше этой пороговой величины. Определение коэффициента детерминации (r2) и линейного коэффициента корреляции произво-
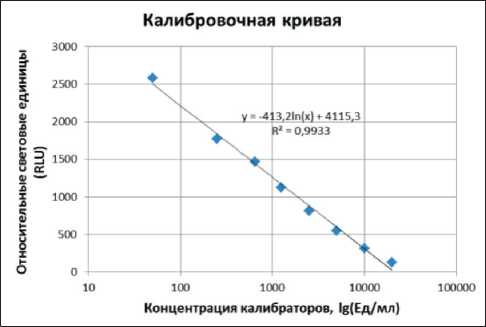
Рис. 1. Калибровочная кривая дили с использованием функции Data Analysis в программе Microsоft Excel.
Результаты
Общая длительность наблюдения пациентов составила 12 мес. За время наблюдения каждые 2–3 курса химиотерапии, согласно критериям RECIST 1.1, проводилась оценка объективного ответа по данным КТ органов грудной клетки, брюшной полости и малого таза, УЗИ, МРТ головного мозга и сцинтиграфии костей. Производилась оценка корреляции показателя маркера CA-62 с течением заболевания, обусловливающая взаимосвязь прогрессирования заболевания по RECIST 1.1. с повышением значения CA-62 свыше пороговой величины 4600 Ед/мл, а положительную динамику и стабилизацию процесса – с его уменьшением.
В ходе исследования были выделены 4 гетерогенные группы пациентов с различными локализациями онкологического процесса, основанные исключительно на динамике маркера CA62.
В 1-й группе (25 %) наблюдалось постепенное снижение уровня биомаркера СА62 в процессе химиотерапии. У 21 % таких пациентов наблюдалась стабилизация опухолевого процесса в ходе лечения, у 4 % – прогрессирование заболевания. Число умерших в 1-й группе – 1 пациент.
Во 2-й группе (27 %) в процессе ХТ сохранялся высокий уровень биомаркера CA-62 (4600–10 000 Ед/мл), что коррелировало с прогрессированием заболевания. У этих пациентов наблюдался дальнейший рост первичной опухоли, появление отдаленных метастазов и ухудшение общего состояния организма, 9 % пациентов из этой группы умерли к концу исследования. У большинства пациентов этой группы был РЖ, РПЖ или МРЛ.
В 3-й группе (29 %) в ходе лечения сохранялся стабильно низкий уровень маркера СА-62 (1000–4500 Ед/мл). У большинства пациентов этой группы (24 %) к концу лечения была достигнута стабилизация процесса, однако у 5 % пациентов наблюдалось прогрессирование заболевания,
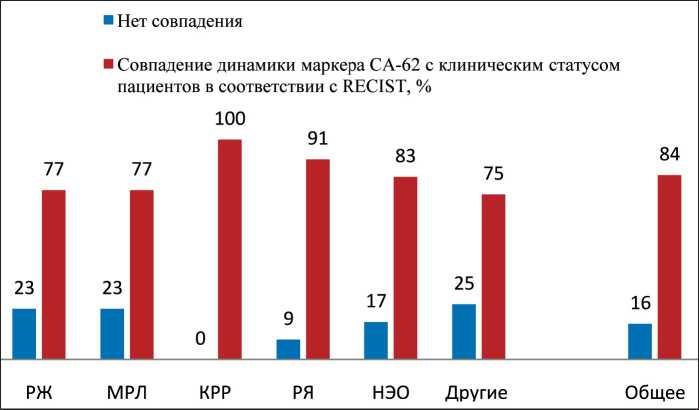
Рис. 2. Корреляция динамики уровня маркера СА-62 с клиническим статусом пациентов в ходе химиотерапии
подтвержденное инструментальными методами исследования. Ранее, до нашего исследования, 25 % больных из этой группы уже получали системное лечение. Умерших пациентов в данной группе – 9 %.
В 4-й группе (19 %) с распространенными формами РЛ, РЖ, КРР, РЯ и мезотелиомой наблюдалось повышение уровня маркера СА-62 в ходе лечения, что соответствовало прогрессированию заболевания и возникновению рецидивов, особенно у 7 % пациентов, проходивших системное лечение ранее. В данной группе не умерло ни одного больного. В зависимости от локализации онкологического процесса наблюдалось большее или меньшее количество совпадений с динамикой роста опухоли. Выявлена 75–100 % корреляция уровня биомаркера СА-62 к концу химиотерапии у больных РЖ, МРЛ, КРР, НЭО и РЯ с клиническим статусом пациентов в соответствии с критериями RECIST (рис. 2).
До начала лечения повышенный уровень биомаркера СА-62 наблюдался у 76 % пациентов, он снизился до нормальных референтных значений (<4600 Ед/мл) у 53 % больных после начала химиотерапии. У 23 % пациентов уровень экспрессии онкомаркера СА-62 оставался повышенным. Из 24 % пациентов с изначально низким уровнем онкомаркера (1000–4000 Ед/мл) до начала лечения у 12 % в ходе химиотерапии не наблюдалось никаких изменений экспрессии СА-62, при этом у 5 % больных этой группы после начала лечения наблюдалось прогрессирование заболевания, у 7 % была достигнута стабилизация. У 12 % пациентов с изначально низким уровнем СА-62 в ходе лечения наблюдался рост уровня маркера, что соответствовало прогрессированию заболевания.
У 54 % больных, которые были включены в исследование уже в процессе химиотерапии, наблюдались низкие показатели маркера СА-62, отражающие эффективность лечения, сходную с показателем эффективности в первой группе (53 %). При этом у всех пациентов со стабильно высоким уровнем экспрессии биомаркера СА-62 (6000–20000 Ед/мл), вне зависимости от проводимого лечения, наблюдалось прогрессирование заболевания. У 12 % пациентов с изначально высоким уровнем биомаркера СА-62 были выявлены рецидивы заболевания, совпадающие с динамикой уровня маркера СА-62.
Детали проводимого лечения исследованных пациентов с различной нозологией рака приведены в таблице, содержащей обобщенные данные для всех групп пациентов.
Больным РЖ (n=30) проводилась химиотерапия производными платины, фторпиримидина и трастузумабом при мутации HER2. Выявлено, что у 23 из 30 (77 %) пациентов наблюдалась прямая зависимость клинического состояния от уровня экспрессии биомаркера СА-62. Из них у 9 больных была выявлена корреляция между повышением уровня биомаркера СА-62 в ходе лечения и прогрессированием заболевания (9/15), у 14 больных наблюдалась корреляция между снижением уровня маркера и стабилизацией опухоли (14/15). Умерло 9 больных РЖ.
Больные МРЛ (n=22) получали химиотерапию производными платины и противоопухолевыми препаратами растительного происхождения, лучевую терапию на первичный очаг и область средостения, а также облучение головного мозга. Динамика развития опухолевого процесса была сопоставима с уровнем экспрессии маркера у 17 из 22 пациентов (77 %). При этом у 9 из 14 пациентов была выявлена корреляция между повышением уровня биомаркера СА-62 в ходе лечения и прогрессированием заболевания, у 8 больных наблюдалась 100 % корреляция между снижением уровня маркера и стабилизацией опухолевого ро-
|
Таблица Обобщение данных закодированного клинического исследования по всем группам больных в соответствии с критерием RECIST |
|||||
|
Диагноз |
Лечение |
Совпадение с клиническим статусом |
Клинический статус пациентов в соответствии с RECIST |
Несовпадение с клиническим статусом |
Клинический статус пациентов в соответствии с RECIST |
|
РЖ (n=30) |
Препараты платины, фтор-пиримидины или таргетная терапия при мутации HER2 |
77 % |
Прогрессирование заболевание у 50 % пациентов, метастазы по брюшине и в печень. Стабилизация в 50 %, в отдельных случаях полный эффект от лечения |
23 % |
Прогрессирование заболевания у 26 % пациентов, метастазы по брюшине, в печень, асцит |
|
КРР (n=7) |
Фторпиримидины, производные платины, противоопухолевые препараты растительного происхождения и таргетная терапия при мутации K-RAS, N-RAS и B-RAF белков |
100 % |
Прогрессирование заболевания у 28 % пациентов, метастазы в печень, в легкие, по брюшине, асцит. В 72 % случаев стабилизация процесса |
0 % |
Прогрессирование заболевания у всех пациентов, метастазы в печень, в легкие |
|
МРЛ (n=22) |
Производные платины, ингибиторы топоизомераз и противоопухолевые препараты растительного происхождения, лучевая терапия на первичный очаг и область средостения, а также облучение головного мозга |
77 % |
Прогрессирование заболевания у большей части (64 %) больных, метастазы в лимфоузлы средостения, головной мозг. В 36 % случаев стабилизация процесса |
23 % |
Прогрессирование заболевания у всех пациентов, метастазы в лимфоузлы корня легкого, средостения, в печень и кости |
|
РЯ (n=11) |
Платиносодержащие препараты, таксаны и противоопухолевые антибиотики |
91 % |
Прогрессирование заболевания у большинства (64 %) больных, метастазы по брюшине, в лимфоузлы, рост остаточной опухоли в малом тазу. В отдельных случаях метастазы в кости, в нижний отдел средостения, асцит. В 36 % случаев стабилизация процесса |
9 % |
Прогрессирование заболевания у всех пациентов, метастазы по брюшине, по плевре, в забрюшинные лимфоузлы, асцит |
|
НЭО ЖКТ и ПЖ (n=6) |
Производные платины и фторпиримидина, биотерапия аналогами соматостатина |
83 % |
Стабилизация процесса и прогрессирование заболевания в равных (50 %) долях. Метастазы в забрюшинные и внутрибрюшинные лимфоузлы |
17 % |
Прогрессирование заболевания у всех больных, метастазы по брюшине, асцит |
|
Прочие (n=13) |
Алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, таксаны и винкаалколоиды |
75 % |
Прогрессирование заболевания у 40 % больных. В зависимости от первичного очага, метастазы по брюшине, в печень, в легкие, по плевре. В большинстве случаев (60 %) наблюдается стабилизация |
25 % |
Прогрессирование заболевания у всех пациентов. В зависимости от первичного очага, метастазы в тазовые или аксилляр-ные лимфоузлы |
|
Всего (n=89) |
84 % |
16 % |
|||
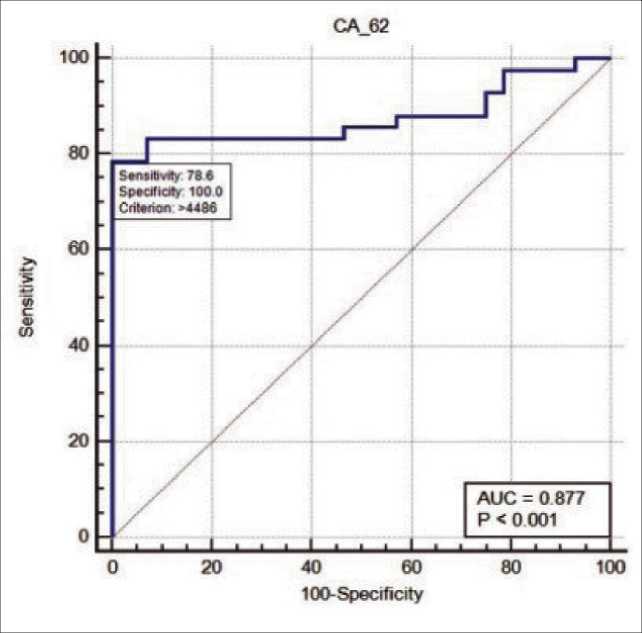
Рис. 3. Характеристическая кривая для пациентов с распространенными злокачественными новообразованиями и здоровых добровольцев
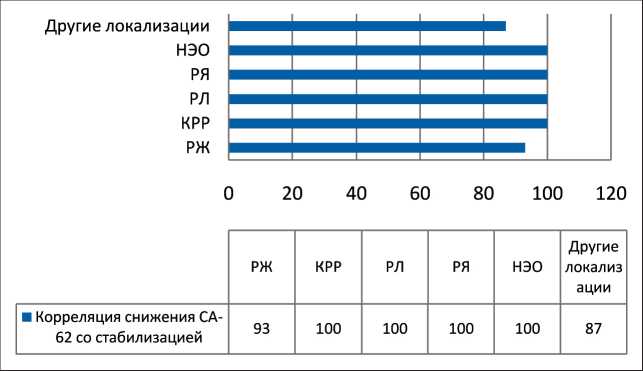
Рис. 4. Корреляция между снижением уровня СА-62 и стабилизацией роста опухоли в процессе химиотерапии
ста. Было отмечено, что у оставшихся пациентов с прогрессированием злокачественного процесса было зафиксировано уменьшение показателя биомаркера CA-62. Умерли 11 больных МРЛ.
Больные КРР (n=7) получали лечение фтор-пиримидинами, производными платины, противоопухолевыми препаратами растительного происхождения и таргетную терапию при мутации K-ras, N-ras и B-raf белков. У всех больных выявлена корреляция объективного ответа опухоли с уровнем показателя маркера CA-62. У большинства больных наблюдалась стабилизация роста опухоли (71 %), у 29 % – прогрессирование заболевания.
Больные РЯ (n=11) получали лечение производными платины, таксанами и аналогами пиримидина. У 91 % зарегистрирована корреляция клинического процесса со значениями маркера СА-62. Из них у 36 % наблюдалась стабилизация, у 54 % – прогрессирование роста опухоли. При этом у всех больных со стабилизацией опухоли наблюдалось полное совпадение экспрессии уровня маркера СА-62 с ответом опухоли на лечение. Умерла 1 больная.
Больные НЭО ЖКТ и ПЖ (n=6) получали химиотерапию производными платины и фторпири-мидина, биотерапию – аналогами соматостатина. У 83 % пациентов была зарегистрирована корреляция клинического процесса с уровнем экспрессии маркера СА-62, у которых в равных долях наблюдалась стабилизация и прогрессирование роста опухоли.
У всех больных мезотелиомой плевры (n=2), получавших лечение производными платины, была выявлена 100 % корреляция стабилизации роста опухоли с уровнем показателя маркера CA-62.
У всех больных АКР (n=3), получавших лечение противоопухолевыми антибиотиками, производными платины, антиметаболитами, ингибиторами синтеза гормонов надпочечников, соответственно, была выявлена 100 % корреляция между ростом и распространением опухоли с уровнем экспрессии биомаркера CA-62. Умер 1 человек.
Больные РШМ (n=3) получали производные платины, таксаны и антиметаболиты. В этой группе наблюдалась 75 % корреляция между динамикой уровня маркера и ответом опухоли на проводимое
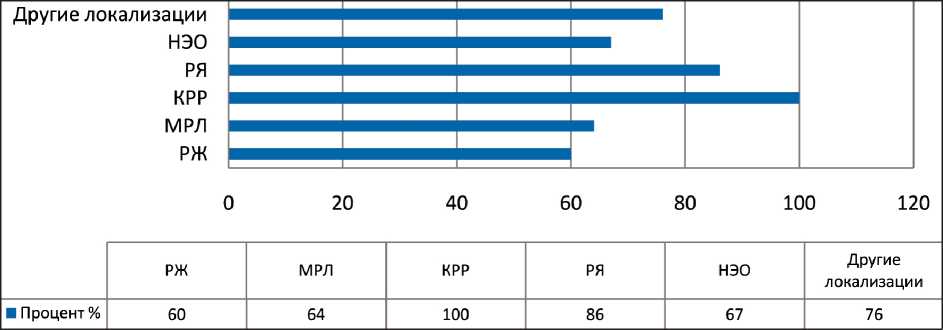
Рис. 5. Корреляция между повышением уровня маркера СА-62 и прогрессированием опухоли в процессе химиотерапии
лечение. Из них у 50 % наблюдалась стабилизация заболевания, у 25 % – прогрессирование опухоли. Умерла 1 больная.
У больных РМЖ (n=2), получавших алкилирующие агенты, противоопухолевые антибиотики и антиметаболиты, после комбинированного лечения наблюдалась 100 % корреляция между прогрессированием заболевания и повышением уровня маркера CA-62.
У всех больных саркомами мягких тканей или костей (n=3), получавших лечение противоопухолевыми антибиотиками, алкилирующими агентами и препаратами растительного происхождения, после высокодозной комбинированной химиотерапии не наблюдалось корреляции между отрицательной динамикой заболевания и повышением уровня маркера CA-62. Умер 1 человек.
До начала химиотерапии повышенный уровень маркера СА-62 наблюдался у большинства пациентов по сравнению с 28 здоровыми добровольцами из группы контроля, что соответствует 83 % чувствительности при 90 % специфичности. Характеристическая ROC-кривая представлена на рис. 4. Здесь показаны обобщенные данные корреляции между снижением уровня маркера СА-62 и стабилизацией роста опухоли у пациентов в ходе ХТ для всех групп. На рис. 5 показана корреляция между повышением уровня СА-62 и прогрессированием роста опухоли у больных в ходе химиотерапии.
Обсуждение
В связи с изменением к персонализированному подходу лечения онкологических больных во многих клинических центрах Западной Европы и Северной Америки в последние годы применяются новые методики «комбинаторного» использования нескольких биомаркеров для мониторинга онкологического процесса определенной локализации, дифференциальной диагностики заболевания или своевременного выявления рецидивов [32–35]. Комбинаторное использование нескольких опухолевых маркеров позволяет выявлять некоторые «тренды» мониторинга лечения онкологических заболеваний и тем самым повышать его эффективность [32–34]. Такие подходы уже подтвердили свою обоснованность и позволили выявить большое количество рецидивов заболевания, несмотря на то, что на данный момент использование на регулярной основе «комбинаторного» скрининга пациентов является достаточно дорогостоящим и как следствие мало востребованным подходом.
Анализ полученных ранее данных по исследованию пациентов с ранними стадиями различных онкологических заболеваний [13–15] показал, что значительное повышение уровня N-гликопротеина СА-62 в крови пациентов, по сравнению с нормальным уровнем этого белка в сыворотке здоровых людей, напрямую связано с развитием канцероге- неза. Пороговое значение маркера СА-62 составляет 4600 Ед/мл, при этом референтный диапазон, отражающий нижнюю и верхнюю границу нормы лабораторного показателя СА-62, составляет 50–4599 Ед/мл.
В проведенном исследовании экспрессия биомаркера СА-62 измерялась для пациентов каждой нозологической группы до начала химиотерапии, ежемесячно в ходе первого и последующих курсов химиотерапии и после прохождения лечения (до 6 мес). До начала лечения повышенный уровень биомаркера СА-62 наблюдался у 76 % пациентов. У всех 27 % пациентов, у которых сохранялся высокий уровень экспрессии биомаркера СА-62, вне зависимости от проводимого лечения, наблюдалось прогрессирование заболевания. Из 76 % пациентов с высоким уровнем СА-62, который снизился в ходе химиотерапии, у 44 % была достигнута стабилизация. У 5 % пациентов с изначально высоким уровнем маркера СА-62 рецидивы заболевания совпадали с динамикой уровня маркера.
Из 24 % пациентов с низким уровнем биомаркера (1000–4000 Ед/мл) до начала лечения у 22 % пациентов не наблюдалось никаких изменений в экспрессии СА-62 в ходе химиотерапии. Большинство пациентов этой группы либо уже умерли, либо у них наблюдалось прогрессирование заболевания (22 %), подтвержденное с помощью инструментальных методов исследования. У 8 % пациентов с изначально низким уровнем СА-62 наблюдался рост уровня маркера в ходе лечения, что соответствовало возникновению рецидива заболевания. У 2 % пациентов со стабильно низким уровнем биомаркера СА-62 была достигнута стабилизация к концу лечения. Статистический анализ показал отсутствие корреляции между показателем общей выживаемости и первоначальным уровнем маркера СА-62.
Другими известными биомаркерами, используемыми для мониторинга химиотерапии, являются pro-gastrin-releasing peptide (ProGRP), нейрон-специфичная енолаза (NSE), раковоэмбриональный антиген (CEA), растворимый фрагмент цитокератина 19 (CYFRA 21-1) и лактатдегидрогеназа (LDH) [32, 36]. Клинические исследования показали, что повышенный уровень биомаркеров ProGRP, NSE, CEA, CYFRA 21-1 и LDH до лечения наблюдался у 79,7; 57,8; 23,4 и 12,5 % пациентов соответственно. Несмотря на то, что предоперационный уровень СЕА считается одним из прогностических факторов безрецидив-ной и общей выживаемости, как отражающий объем опухолевой массы, далеко не все больные КРР имеют повышенный уровень маркера СЕА в сыворотке крови [35].
Несмотря на то, что у большого числа пациентов с МРЛ наблюдается экспрессия нейрон-специфичной енолазы (NSE), его диагностическая чувствительность составляет только 40–60 %
[36–42]. При этом диагностическая специфичность маркера NSE достаточно ограничена относительно высоким процентом ложноположительных результатов для пациентов с доброкачественными заболеваниями легких, нейроэндокринными опухолями и опухолями мозга [40, 42].
Использование мониторинга изменений величины биомаркера СА-62 для пациентов, проходящих химиотерапию, в проведенном нами двойном слепом клиническом исследовании достоверно показало, что у 75–100 % больных имеется прямая зависимость изменения уровня биомаркера СА-62 от ответа опухоли на ХТ. Только в 9–25 % случаев не наблюдалось корреляции между уровнем биомаркера и клиническим статусом пациентов в соответствии с критериями RECIST. При этом у пациентов с саркомой наблюдалось полное отсутствие корреляции между динамикой маркера СА-62 и клиническим статусом. У 12 % пациентов с РЖ и МРЛ, у которых изначальный уровень экспрессии биомаркера СА-62 был высоким и оставался таким в ходе химиотерапии, наблюдалось прогрессирование опухолевого роста, включая летальный исход (7 %). У 16 % больных РЖ и МРЛ, у которых уровень маркера был высоким и снижался в ходе лечения, в 9 % случаев наблюдалось прогрессирование опухоли, вплоть до летального исхода (6 %), в 7 % случаев достигнута стабилизация. Из 21 % пациентов с РЖ и МРЛ, у которых наблюдался изначально низкий уровень маркера СА-62, значительно ниже пороговой величины 4600 Ед/мл, и оставался на таком низком уровне до конца химиотерапии, прогрессирование наблюдалось у 12 % больных, включая летальный исход (8 %), в то время как стабилизация была достигнута у 9 % пациентов.
Таким образом, нормализация уровня СА-62 под воздействием эффективного противоопухолевого лечения и стабилизация его нормальных значений в крови свидетельствуют о достижении ремиссии у 42 % пациентов с РЖ и МРЛ. Постепенное или резкое увеличение значений СА-62 на фоне ремиссии наблюдалось у 7 % пациентов с РЖ и МРЛ,
Список литературы Пилотное клиническое исследование по мониторингу эффективности химиотерапии злокачественных опухолей у пациентов с помощью маркера эпителиальных карцином Са-62
- Jackson S.E., Chester J.D. Personalised cancer medicine. Int J Cancer. 2015 Jul 15; 137(2): 262-6. DOI: 10.1002/ijc.28940
- Mascaux C., Tomasini P., Greiller I., Barilsi F. Personalised medicine for nonsmall cell lung cancer. Eur Respir Rev. 2017 Nov 15; 26(146). pii: 170066. DOI: 10.1183/16000617.0066-2017
- Baxendale S., van Eedan F., Wilkinson R. The power of Zebrafish in Personalised Medicine. Adv Exp Med Biol. 2017; 1007: 179-197. DOI: 10.1007/978-3-319-60733-7_10
- Ballman K.V. Biomarker: Predictive or Prognostic? J Clin Oncol. 2015 Nov 20; 33(33): 3968-71. DOI: 10.1200/JCO.2015.63.3651
- Huang J., Hu W., Sood A.K. Prognostic Biomarkers in Ovarian Cancer. Cancer Biomark. 2010-2011; 8(0): 231-251. DOI: 10.3233/CBM-2011-0212


