Пластика митрального клапана по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной миоэктомией: пилотное рандомизированное исследование
Автор: Залесов А.С., Козьмин Д.Ю., Будагаев С.А., Афанасьев А.В., Шарифулин Р.М., Железнев С.И., Богачев-прокофьев А.В., Чернявский А.М.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Актуальность. Септальная миоэктомия в настоящее время является «золотым» стандартом хирургического лечения пациентов с обструктивной гипертрофической кардиомиопатией при неэффективности медикаментозной терапии. В ряде случаев изолированная септальная миоэктомия не устраняет SAM-индуцированную митральную недостаточность, что требует сочетанных вмешательств на митральном клапане, таких как пластика митрального клапана по методике «край-в-край».Цель. Оценка безопасности и эффективности сочетанной пластики митрального клапана по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной септальной миоэктомией.Методы. Набор в исследование проводился в период с 2019 по 2022 г. в ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России. С учетом рандомизации в опытную группу включили 20 пациентов с сочетанной пластикой митрального клапана «край-в-край» при септальной миоэктомии, в контрольную группу - 20 пациентов с изолированной миоэктомией. На госпитальном этапе оценивались непосредственные результаты, отдаленные результаты анализировались через 12 месяцев.Результаты. Сочетанная пластика митрального клапана «край-в-край» демонстрирует лучшую интраоперационную эффективность по сравнению с изолированной септальной миоэктомией (95,0% против 50,0% при p=0,001), но сопровождается повышенными трансмитральными пиковым (6,8±2,1 против 4,9±3,2 мм рт. ст., при p=0,03) и средним (3,4±1,4 против 2,5±1,7 мм рт. ст., при p=0,05) градиентами. Обе методики сопряжены с низким уровнем госпитальной летальности и осложнений в раннем послеоперационном периоде, высокой выживаемостью через 12 месяцев.Выводы. Сочетанная пластика митрального клапана по методике «край-в-край» сопоставимо безопасна с изолированной миоэктомией, однако лучше устраняет SAM-индуцированную митральную недостаточность, но характеризуется повышенными трансмитральными градиентами.
Гипертрофическая кардиомиопатия, септальная миоэктомия, альфиери, край-в-край
Короткий адрес: https://sciup.org/143180661
IDR: 143180661 | УДК: 616-089+617-5 | DOI: 10.38109/2225-1685-2023-3-54-61
Текст научной статьи Пластика митрального клапана по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной миоэктомией: пилотное рандомизированное исследование
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Некоммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: https://creativecommons. org/licenses/by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Гипертрофическая кардиомиопатия (ГКМП) представляет собой генетически обусловленное аутосомно-доминантное заболевание миокарда, характеризующееся гипертрофией мышечных стенок сердца с преимущественным вовлечением межжелудочковой перегородки (МЖП), не связанное с какой-либо причиной [1-2]. Распространённость ГКМП составляет 0,2% среди всего населения или 1 случай на 200-500 лиц [3].
Септальная миоэктомия выходного отдела левого желудочка (ВОЛЖ) является «золотым стандартом» в хирургическом лечении пациентов с обструктивной гипертрофической кардиомиопатией [4]. Чрескожная алкогольная аблация септальных ветвей МЖП является минимально инвазивным альтернативным подходом в лечении обструктивной формы ГКМП, однако имеет прямую зависимость от характера коронарного русла и низкую эффективность в устранении градиента ВОЛЖ при толстой МЖП. При этом алкогольная септальная аблация полностью не решает проблем с SAM-индуцированной митральной регургитацией и имеет высокий риск развития эквивалента полной атриовентрикулярной блокады после процедуры [5].
В большинстве случаев изолированная септальная миоэктомия устраняет обструкцию ВОЛЖ и SAM-индуцированную митральную недостаточность [6]. Однако в ряде случаев удлинение передней створки митрального клапана (МК), фиброзные изменения и рестрикция вторичными хордами передней створки МК, аномалии папиллярных мышц не позволяют эффективно устранить SAM-индуцированную митральную недостаточность (МН) [7-9]. В этих ситуациях прибегают к дополнительным хирургическим методикам по вмешательству на МК, одной из которых является пластика митрального клапана по методике «край-в-край» [10]. В настоящее время работы по непосредственным и отдаленным результатам сочетанной пластики МК «край-в-край» при септальной миоэктомии весьма ограничены.
Целью работы явилась оценка безопасности и эффективности сочетанной пластики МК по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной септальной миоэктомией.
МАТЕРИАЛ И МЕТОДЫ
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации. Протокол исследования был одобрен Этическими комитетами клинических центров – участников проекта.
Критерии включения в исследование: пациенты с обструктивной формой ГКМП (пиковый градиент ВОЛЖ более 50 мм рт. ст. в покое или при физической нагрузке), планируемые на открытую септальную миоэктомию; положительный SAM-синдром; SAM-индуцированная МН ≥ 2 степени; возраст 18-75 лет.
Критерии исключения: кардиохирургическое вмешательство в анамнезе; необходимое дополнительное оперативное пособие; органическое поражение МК; фракция выброса левого желудочка менее 50%; отказ от участия в исследовании.
Исследование является проспективным рандомизированным пилотным одноцентровым. За период с 2019 по 2022 года в ФГБУ «Национальный медицинский исследовательский центр имени академика Е.Н. Мешалкина» Министерства здравоохранения Российской Федерации выполнили 187 оперативных вмешательства пациентам с обструктивной ГКМП, среди которых 40 пациентов были включены в исследование. В опытную группу вошли 20 пациентов, которым были выполнены расширенная миоэктомия и пластика МК по методике «край-в-край». В качестве контрольной группы были 20 пациентов, которым была выполнена изолированная расширенная миоэктомия.
Первичная конечная точка (комбинированная): а) безопасность: частота крупных неблагоприятных событий (инфаркт миокарда, геморрагические и ишемические инсульты, сердечно-сосудистая летальность) и частота возникновения структурных интракардиальных дефектов (разрыв задней стенки ЛЖ и дефект МЖП) в течение госпитального периода; б) эффективность: отсутствие повторных пережатий аорты по поводу резидульного градиента на уровне ВОЛЖ или остаточной МН, отсутствие SAM-синдрома и МН ≥ 2 степени в течение госпитального периода.
Вторичные конечные точки: а) в течение госпитального периода: полная АВ-блокада; кровотечения, требующие рестернотомии с целью хирургического гемостаза; остаточный гра-
Таблица 1. Результаты чреспищеводной эхокардиографии до основного этапа операции
Table 1. Results of transesophageal echocardiography before the main stage of the operation
|
Показатели |
СМЭ, (n=20) |
СМЭ + «край-в-край», (n=20) p |
||
|
МЖП, мм |
22 [20; 25] |
23 [21; 26] |
0,51 |
|
|
Глубина резекции, мм |
35,9±7,2 [95% ДИ: 32,5-39,3] |
32,2±6,5 [95% ДИ: 29,2-35,3] |
0,09 |
|
|
Толщина резекции, мм |
10,3±2,1 [95% ДИ: 9,1-11,0] |
10,7±2,4 [95% ДИ: 9,6-11,9] |
0,37 |
|
|
SAM-синдром, n (%) |
20/20 (100) |
20/20 (100) |
1,0 |
|
|
Фиброзное кольцо МК, мм |
36 [35; 39] |
38 [36; 40] |
0,11 |
|
|
Передняя створка МК, мм |
29 [28; 30] |
30 [28; 35] |
0,26 |
|
|
Пиковый градиент МК |
4 [3; 5] |
3 [3; 4] |
0,06 |
|
|
Средний градиент МК |
2 [2; 2] |
2 [1; 2] |
0,07 |
|
|
МН, n (%) |
0-1 ст. |
0/20 (0) |
0/20 (0) |
- |
|
2 ст. |
15/20 (75) |
17/20 (85) |
0,69 |
|
|
3 ст. |
5/20 (25) |
3/20 (15) |
0,69 |
|
Примечание/Note: СМЭ – септальная миоэктомия (SM – septal myectomy); МЖП – межжелудочковая перегородка (IVS – interventricular septum); SAM-синдром – синдром систолического дрожания передней створки митрального клапана (SAM – systolic anterior motion); МК – митральный клапан (MV – mitral valve); МН – митральная недостаточность (MI – mitral insufficiency); ДИ — доверительный интервал (CI – confidence interval); данные представлены как M±SD [95% ДИ], ME [Q1; Q3] и n (%) (data are presented as M±SD [95% CI], ME [Q1; Q3] and n (%)).
диент на уровне ВОЛЖ более 30 мм рт. ст.; б) в отдаленном периоде наблюдения (через 12 месяцев после хирургического вмешательства): общая выживаемость; свобода от больших кардиоваскулярных событий (летальность, инфаркт миокарда, ишемический и геморрагический инсульты); свобода от внезапной сердечной смерти (ВСС), свобода от МН ≥ 2 степени, свобода от повторных вмешательств (по поводу обструкции ВОЛЖ и выраженной МН).
ИНТРАОПЕРАЦИОННЫЕ РЕЗУЛЬТАТЫ
Всем пациентам выполнили оперативное вмешательство с учетом рандомизации. Случаев интраоперационной летальности не наблюдалось. По данным чреспищеводной эхокардиографии (ЧП ЭхоКГ) до основного этапа не было выявлено статистически значимых различий между двумя группами (табл. 1). Глубина планируемой резекции миокарда составила 35,9±7,2 против 32,2±6,5 мм рт. ст. (р=0,09) и толщина резекции МЖП составила 10,3±2,1 против 10,7±2,4 мм рт. ст. (р=0,37). При оценке МН в большинстве случаев наблюдалась умеренная МН (75,0 против 85,0 при р=0,69). Медиана пикового и среднего диастолических градиентов была 4 [3; 5] против 3 [3; 4] мм рт. ст. (р=0,06) и 2 [2; 2] против 2 [1; 2] мм рт. ст. (р=0,07).
Медиана времени искусственного кровообращения составила 65 [48; 69] против 58 [48; 79] мин (p=0,94), медиана времени пережатия аорты — 40 [30; 47] против 40 [22; 51] мин (р=0,76), для контрольной и опытной групп, соответственно (табл. 2). В группе с изолированной миоэктомией в 3-х случаях потребовалось повторное подключения к аппарату искусственного кровообращения и пережатие аорты вследствие остаточной выраженной МН. Всем трем пациентам был выполнен отдельный доступ к полости левого предсердия позади и параллельно межпредсердной перегородки. Данным пациентам была выполнена дополнительная folding-пластика задней створки митрального клапана. В опытной группе случаев повторных окклюзий аорты зафиксировано не было, несмотря на это статистических межгрупповых различий не выявлено (p=0,23).
Госпитальные результаты
В двух группах не наблюдалось случаев 30-дневной госпитальной летальности (табл. 3). Средняя продолжительность госпитализации составила в контрольной группе 12 [11; 13] койко-дней, в группе с пластикой МК «край-в-край» составила 12 [11; 14] койко-дней (p=0,62). За 30-дневный госпитальный период в двух группах не встречались крупные неблагоприятные событий – вторичная конечная точка (инфаркт миокарда, сердечно-сосудистая летальность, геморрагический и ишемический инсульты). Среди minor-событий в группе с изолированной миоэктомией на контрольной ЭхоКГ перед выпиской у 4 (20%) пациентов отмечался резидуальный градиент >30 мм рт. ст., в опытной группе – случаев остаточного градиента не было отмечено (p=0,05).
По данным сравнительного анализа ЭхоКГ показателей (табл. 4) госпитального периода отмечались статистически значимые различия по наличию SAM-синдрома (контрольная группа – 30,0%, опытная группа – 0% при p=0,02), митральной недостаточности 0-1 степени (контрольная группа 70,0%; опытная группа 95,0% при p=0,04), митральной недостаточности 2 степени (контрольная группа – 30,0%; опытная группа – 5,0% при p=0,04), градиента на уровне ВОЛЖ (контрольная группа - 16,1±12,6; опытная группа – 9,0±3,3 мм рт. ст. при р=0,02. В группе с пластикой митрального клапана по методике «край-в-край» отмечались статистически значимые большие пиковый и средний трансмитральные градиенты 6,5±1,9 и 3,3±1,2 мм рт. ст., соответственно (p=0,01; p=0,05).
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ НАБЛЮДЕНИЯ
Все выжившие пациенты (n=40, 100%) были доступны послеоперационному наблюдению. Медиана среднего периода наблюдения составила 26 [19; 30] месяцев. Полнота наблюдения составила 100% к 12 месяцу. Всем пациентам через 12 месяцев после операции выполняли контрольные ЭКГ, трансторакальную эхокардиографию (ТТ ЭхоКГ) и осмотр врача-кардиолога с оценкой функционального статуса.
Таблица 2. Характеристика основного этапа операции
Table 2. Characteristics of the main stage of the operation
|
Показатели |
СМЭ, (n=20) |
СМЭ + «край-в-край», (n=20) |
p |
|
ИК, мин. |
65 [48; 69] |
58 [48; 79] |
0,94 |
|
ОА, мин. |
40 [30; 47] |
40 [22; 51] |
0,76 |
|
Масса иссеченного миокарда, г |
4,9 [2,7; 6,2] |
3,5 [2,6; 4,6] |
0,06 |
|
Повторная окклюзия аорты, n (%) |
3/20 (15) |
0/20 (0) |
0,23 |
|
SAM-синдром, n (%) |
3/20 (15) |
0/20 (0) |
0,23 |
|
ДМЖП, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
Разрывы ЛЖ, n (%) |
0/20 (0) |
0/20 (0) |
-+ |
|
Пиковый градиент МК |
4 [3; 4] |
7 [6; 8] |
<0,001 |
|
Средний градиент МК |
2 [2; 2] |
3 [2; 4] |
<0,001 |
|
МН n (%) 0-1 ст. |
14/20 (70) |
19/20 (95) |
0,04 |
|
2 ст. |
6/20 (30) |
1/20 (5) |
0,04 |
|
3 ст. |
0/20 (0) |
0/20 (0) |
- |
|
Градиент ВОЛЖ, мм рт. ст. |
9 [8; 13] |
9 [6; 10] |
0,30 |
Примечание/Note: СМЭ – септальная миоэктомия (SM – septal myectomy); ИК – искусственное кровообращение (CPB – cardiopulmonary bypass); ОА – окклюзия аорты (AO – aortic occlusion); ДМЖП – дефект межжелудочковой перегородки (VSD – ventricular septal defect); ЛЖ – левый желудочек (LV – left ventricle); МК – митральный клапан (MV – mitral valve); МН – митральная недостаточность (MI – mitral insufficiency); ВОЛЖ – выходной отдел левого желудочка (LVOT – left ventricle outflow tract). Данные представлены как Me [Q1; Q3] или n (%) (Data are presented as Me [Q1; Q3] or n (%)).
Отдаленная выживаемость через 12 месяцев составила 100% в двух группах. Свобода от ВСС и ОНМК составила 100% в двух группах.
В отдаленном периоде пациенты преимущественно находились в I и II функциональном классах, межгрупповой анализ не выявил статистически достоверной разницы, p=0,48 и p=0,45, соответственно. Все пациенты к контрольному периоду наблюдения через 1 год после операции находились на синусовом ритме (p=1,0).
Свобода от МН ≥2 степени в группе с изолированной расширенной миоэктомией составила 55,0% (95% ДИ: 33,3-76,5) через 12 месяцев после операции; в группе с сочетанной пластикой МК «край-в-край» при септальной миоэктомии – 95,0% (95% ДИ: 82,4-100,0); log-rank test, p=0,008 (рис. 1). Свобода от повторных вмешательств по поводу МН и градиента ВОЛЖ в двух группах составила 100% (p=1,0).
При выполнении межгруппового анализа отдаленных результатов ЭхоКГ отмечались статистически большие пиковый и средний диастолические градиенты на МК в группе с пластикой «край-в-край», p=0,03 и p=0,05, соответственно (табл. 5). Через 12 месяцев после операции чаще встречалась МН ≥ 2 степени в группе с изолированной миоэктомией (30,0% против 0% при p=0,02). Свобода от повторных вмешательств по поводу МН и градиента ВОЛЖ составили 100% в двух группах.
В соответствии с результатами одно- и многофакторного регрессионного анализа (табл. 6), статистически значимое увеличение риска возврата МН ≥ 2 степени было при выполне-
Таблица 3. Течение послеоперационного периода
Table 3. The course of the postoperative period
|
Показатели |
СМЭ, (n=20) |
СМЭ + «край-в-край», (n=20) |
p |
|
Койко-день |
12 [11; 13] |
12 [11; 14] |
0,62 |
|
Хирургический гемостаз, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
ОНМК, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
Стернальная инфекция, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
Водитель ритма на выписке |
|||
|
Синусовый, n (%) |
20/20 (100) |
20/20 (100) |
1,0 |
|
ФП, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
Имплантация ЭКС, n (%) |
0/20 (0) |
0/20 (0) |
- |
|
Первичная конечная точка |
|||
|
Интраоперационная эффективность (отсутствие повторных пережатий аорты, SAM-синдрома и МН ≥ 2ст.), n (%) |
10 (50) |
19 (95) |
0,001 |
|
Вторичные конечные точки (minor-осложнения) |
|||
|
Полная АВ-блокада, n (%) |
0 (0) |
0 (0) |
- |
|
Хирургический гемостаз, n (%) |
0 (0) |
0 (0) |
- |
|
Градиент ВОЛЖ >30 мм рт. ст., n (%) |
4 (20) |
0 (0) |
0,05 |
Примечание/Note: СМЭ – септальная миоэктомия (SM – septal myectomy); ОНМК – острое нарушение мозгового кровообращения (ACVA – acute cerebrovascular accident); ЭКС – электрокардиостимулятор (P – pacemaker); МН – митральная недостаточность (MI – mitral insufficiency); ВОЛЖ – выходной отдел левого желудочка (LVOT – left ventricle outflow tract). Данные представлены как n (%) (Data are presented as n (%)).
Таблица 4. Характеристика параметров эхокардиографии на этапе выписки
Table 4. Characteristics of echocardiography parameters at the discharge
|
Показатели |
СМЭ, (n=20) |
СМЭ + «край-в-край», (n=20) |
p |
|
SAM-синдром, n (%) |
6/20 (30) |
0/20 (0) |
0,02 |
|
Градиент ВОЛЖ, мм рт. ст. |
16,1±12,6 |
9,0±3,3 |
0,02 |
|
Пиковый градиент МК, мм рт. ст. |
4,6±2,8 |
6,5±1,9 |
0,01 |
|
Средний градиент МК, мм рт. ст. |
2,4±1,5 |
3,3±1,2 |
0,05 |
|
МН, n (%) 0-1 ст. |
14/20 (70) |
19/20 (95) |
0,04 |
|
2 ст. |
6/20 (30) |
1/20 (5) |
0,04 |
|
3 ст. |
0/20 (0) |
0/20 (0) |
- |
Примечание/Note: СМЭ – септальная миоэктомия (SM – septal myectomy); ВОЛЖ – выходной отдел левого желудочка (LVOT – left ventricle outflow tract); МК – митральный клапан (MV – mitral valve); МН – митральная недостаточность (MI – mitral insufficiency). Данные представлены как M±SD и n (%) (Data are presented as M±SD and n (%)).
нии изолированной септальной миоэктомии – ОР 11,97 (95% ДИ% 1,43-100,06) при р=0,02. Свобода от повторных вмешательств по поводу значимого градиента на уровне ВОЛЖ и выраженной митральной недостаточности в двух группах составила 100% через 12 месяцев после операции.
ОБСУЖДЕНИЕ
Немаловажный вклад в обструкцию ВОЛЖ при ГКМП вносит систолическое движение передней створки МК [11]. С одной стороны, существуют особенности строения МК при ГКМП, такие как удлинение передней створки, аномальное прикрепление папиллярных мышц и т.д. С другой стороны, постоянный контакт передней створки МК с МЖП с течением времени приводит к ее фиброзу [12], поэтому в ряде случаев не получается устранить МН при выполнении изолированной септальной миоэктомии. Для профилактики устранения МН хирурги пользуются дополнительными методиками, такими как: резекция вторичных хорд передней створки, мобилизация папиллярных мышц, иссечение дополнительных хорд к МЖП, резекция аномальных папиллярных мышц, пластика край-в-край по Альфиери и другие [13-15].
Таблица 5. Сравнительный межгрупповой анализ функции митрального клапана через 12 месяцев после операции Table 5. Comparative intergroup analysis of mitral valve function in 12 months after surgery
|
Показатели |
СМЭ, (n=20) СМЭ + «край-в-край», (n=20) p |
|
Пиковый градиент МК, мм рт. ст. |
4Д,И9:±33,,23-[69,54%] 6,8±2,1 [95% ДИ: 5,8-7,8] 0,03 |
|
Средний градиент МК, мм рт. ст. |
2Д,И5:±11,,77-[39,53%] 3,4±1,4 [95% ДИ: 2,8-4,1] 0,05 |
|
МН, n (%) |
0-1 ст. 14/20 (70) 20/20 (100) 0,02 2 ст. 6/20 (30) 0/20 (0) 0,02 3 ст. 0/20 (0) 0/20 (0) - |
|
SAM-синдром, n (%) |
1/20 (5) 0/20 (0) 0,48 |
Примечание/Note: СМЭ – септальная миоэктомия (SM – septal myectomy); МК – митральный клапан (MV – mitral valve); МН – митральная недостаточность (MI – mitral insufficiency). Данные представлены как M±SD и n (%) (Data are presented as M±SD and n (%)).
Таблица 6. Предикторы возврата митральной недостаточности ≥ 2 степени
Table 6. Predictors of mitral regurgitation recurrence ≥ grade 2
|
Факторы риска возврата МН ≥ 2 ст. |
Однофакторный анализ |
Многофакторный анализ |
||
|
ОР (95% ДИ) |
p |
ОР (95% ДИ) |
p |
|
|
ИМТ |
0,90 (0,79-1,04) |
0,15 |
0,93 (0,83-1,05) |
0,26 |
|
КДР ЛЖ |
0,91 (0,82-1,01) |
0,07 |
0,89 (0,78-1,01) |
0,07 |
|
Группа СМЭ |
9,94 (1,26-78,64) |
0,03 |
11,97 (1,43-100,06) |
0,02 |
|
ЧП ЭхоКГ МК пиковый |
1,37 (0,94-2,02) |
0,10 |
1,06 (0,70-1,60) |
0,79 |
Примечание/Note: МН – митральная недостаточность (MI – mitral insufficiency); ИМТ – индекс массы тела (BMI – body mass index); КДР – конечно-диастолический размер (EDS – end-diastolic size); ЛЖ – левый желудочек (LV – left ventricle); СМЭ – септальная миоэктомия (SM – septal myectomy); ЧП ЭхоКГ – чреспищеводная эхокардиография (TEE – transesophageal echocardiography); ОР – отношение рисков (RR – risk ratio); ДИ — доверительный интервал (CI – confidence interval).
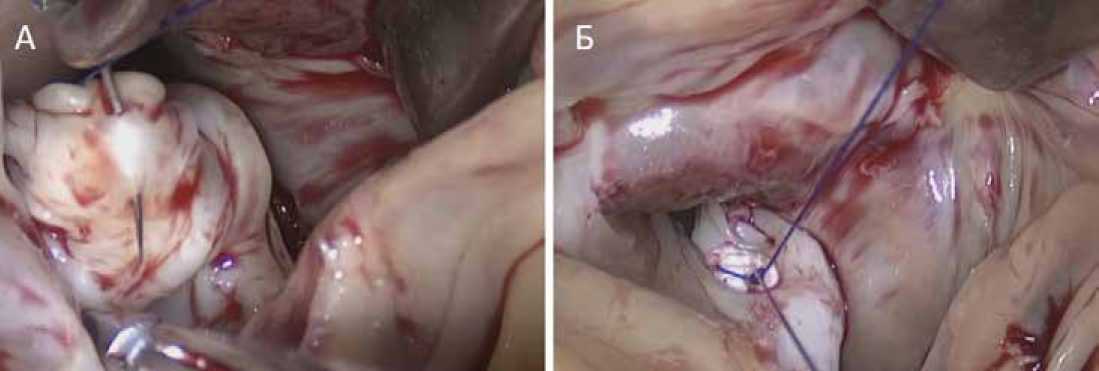
Рисунок 1. Пластика митрального клапана «край-в-край». А – прошивание передней створки митрального клапана. Б – шов «край-в-край» завязывается со встречной синтетической прокладкой
Figure 1. «Edge-to-edge» mitral valve repair. A – stitching of the anterior leaflet of the mitral valve. Б – final view of «edge-to-edge» mitral valve repair
Данное исследование отражает непосредственные и отдаленные результаты пилотного рандомизированного клинического исследования по сочетанной пластике МК по методике «край-в-край» при септальной миоэктомии с контрольной группой сравнения в виде изолированной септальной миоэктомии.
В 2016 году J.Obadia и соавторы (отделение кардиохирургии, кардиологическая больница «Луи Прадель», Университет им. Клода Бернара, Лион, Франция) опубликовали первое когортное исследование из 22 пациентов, перенесших септальную миоэктомию и пластику МК «край-в-край». Основными недостатками данной работы явились относительно небольшой размер выборки; отсутствие контрольной группы сравнения, т.к. у части пациентов гемодинамический эффект мог бы быть удовлетворительным при изолированной миоэктомии [16].
В том же году A. Shah и соавторы (отделение сердечно-сосудистой и торакальной хирургии, медицинский центр университета Дьюка, Северная Каролина, США) выполнили первое ретроспективное исследование своего опыта выполнения пластики МК «край-в-край» при септальной миоэктомии. При анализе не отмечалось значимых летальности, больших кардиоваскулярных событий, частоты повторных операций по поводу МН. Ограничениями исследования выступают небольшой размер выборки, ретроспективный анализ исследования, двум пациентам была выполнена пластика «край-в-край» доступом через левое предсердие и значимо короткий период наблюдения в 2,4±2,5 месяцев [17].
В 2017 году R.Collis и соавторы из трех клиник в Лондоне опубликовали свой опыт из 11 сочетанных операций с 12-месячным периодом наблюдения. Всем пациентам выполнили миоэктомию по Morrow и сочетанную пластику МК «край-в-край», однако пластика «край-в-край» выполнялась через доступ в левое предсердие. Значимыми недостатками работы являются маленький размер выборки, ретроспективный анализ исследования, отсутствие контрольной группы сравнения, пластика «край-в-край» через левопредсердный доступ для всех пациентов, короткий период наблюдения.
В 2020 году коллеги из отделения кардиохирургии больницы Сан-Раффаэле (Милан, Италия) доложили о своем опыте выполнения данного вмешательства. В работе септальную миоэктомию и сочетанную пластику митрального клапана «край-в-край» выполнили 26 пациентам, большинству пациентов (2 пациентам – трансаортально) пластика «край-в-край» выполнялась через левую атриотомию. Двум пациентам через 5 и 9 месяцев после операции было выполнено протезирование митрального клапана по поводу возврата митральной недостаточности. Недостатками исследования авторы отмечают длительный период набора пациентов, ретроспективный одноцентровой дизайн исследования, маленький размер выборки, отсутствие контрольной группы сравнения. Помимо этого, части пациентов с пролапсом задней створки МК дополнительно выполнялась аннулопластика опорным кольцом. По данным работы пролапс задней створки МК был предиктором рецидива МН в отдаленном периоде. Включение пациентов с альтернативным механизмом МН является значимым недостатком исследования [18].
В нашей серии случаев всем пациентам была выполнена расширенная миоэктомия выходного отдела левого желудочка. В настоящее время ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» имеет наибольший опыт выполнения расширенной миоэктомии ВОЛЖ в Российской Федерации и ближнем зарубежье. Все вмешательства были выполнены наиболее опытными хирур- гами, имеющими опыт хирургической коррекции ГКМП как минимум более 50 операций, что характеризует качественные непосредственные и отдаленные результаты. В дополнение, отсутствие полных АВ-блокад, ДМЖП и дефектов задней стенки ЛЖ в двух группах также свидетельствует о большом опыте выполнения септальной миоэктомии.
По данным предоперационных характеристик обе группы достоверно не отличались ни по одному фактору. В отличие от существующих публикаций мы не получили интраоперационной и госпитальной летальности.
Помимо этого, для выполнения пластики МК по методике «край-в-край» в большинстве случаев использовался трансаортальный доступ, при этом мы не получили интраоперационных осложнений. С накоплением опыта выполнение сочетанной пластики МК «край-в-край» становится быстрее и технически проще трансаортальным доступом для уменьшения времени ишемии миокарда, а не через левый атриотомный доступ. Кроме того, для выполнения сопутствующей пластики МК по методике «край-в-край» целесообразно использовать минимально инвазивный кардиохирургический инструментарий. При анализе интраоперационных результатов не было получено достоверной разницы по медиане длительности ишемии миокарда и искусственного кровообращения в сравнении изолированной миоэктомией – 40 против 40 (p=0,76) и 58 против 65 (p=0,94) минут, соответственно. В группе с изолированной миоэктомией в 3-х случаях потребовалось повторное подключения к аппарату искусственного кровообращения и пережатие аорты вследствие резидуальной выраженной МН. Всем трем пациентам была выполнена дополнительная folding-пластика задней створки МК через отдельный доступ в левое предсердие, достоверной разницы по повторным окклюзия аорты не было выявлено.
В общей сложности госпитальный период показал, что сочетанная пластика МК по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной септальной миоэктомией показывает сопоставимый высокий уровень безопасности. Обе процедуры являются эффективными, однако одномоментная пластика МК по методике «край-в-край» при септальной миоэктомии показывает более высокую эффективность в элиминации SAM-синдрома и SAM-индуцированной МН по сравнению с изолированной миоэктомиией в раннем послеоперационном периоде. Сочетанная пластика МК по методике «край-в-край» при септальной миоэктомии демонстрирует лучшие госпитальные результаты в отсутствие резидуального градиента на уровне выходного отдела левого желудочка по сравнению с изолированной миоэктомией. Госпитальные результаты нашего исследования значимо не отличаются от данных наших коллег [16-18]. Основным недостатком изолированной расширенной миоэктомии была резидуальная МН ≥ 2 степени и SAM-синдром. Напротив, недостатком сочетанной пластики МК по методике «край-в-край» являются статистически значимые более высокие значения пикового и среднего диастолических градиентов.
Анализ отдаленных результатов показывает, что комбинированное вмешательство в объеме септальной миоктомии и пластики МК по методике «край-в-край», как и изолированная септальная миоэктомия демонстрируют высокую выживаемость и свободу от ВСС и повторных операций по поводу МН и градиента на уровне выходного отдела левого желудочка через 12 месяцев после операции.
В заключение стоит отметить, несмотря на то, что мы выполняли сочетанное вмешательство в объеме пластики МК «край- в-край» и септальной миоэктомии, мы не вышли из целевого диапозона по безопасности и эффективности для изолированной миоэктомии в опытных кардиохирургических центрах [2].
ВЫВОДЫ
-
1. Сочетанная пластика МК по методике «край-в-край» при септальной миоэктомии сопряжена с низким уровнем госпитальной летальности и осложнений в раннем послеоперационном периоде, сопоставимыми с изолированной септальной миоэктомией.
-
2. Сочетанная пластика МК по методике «край-в-край» показывает лучшую эффективность (отсутствие повторных пережатий аорты, резидуальных МН ≥ 2 степени и SAM-синдрома) по сравнению с изолированной септальной миоэктомией интраоперационно (95,0% против 50,0% при p=0,001).
-
3. Сочетанная пластика МК по методике «край-в-край», как и изолированная миоэктомия интраоперационно характеризуется отсутствием значимого градиента на уровне выходного отдела левого желудочка, но к моменту выписки демонстрирует свое превосходство (0% против 20,0% при p=0,05).
-
4. Сочетанная пластика МК по методике «край-в-край» во время септальной миоэктомии демонстрирует более высокую свободу от МН ≥ 2 степени, по сравнению с изолированной септальной миоэктомией (0,0% против 30,0% p=0,02; при сопоставимой 100%-ной свободе от повторных вмешательств по поводу МН) через 12 месяцев после операции, однако сопровождается повышенными трансмитральными пиковым (6,8±2,1 против 4,9±3,2 при p=0,03) и средним (3,4±1,4 против 2,5±1,7 при p=0,05) градиентами.
-
5. Сочетанная пластика МК по методике «край-в-край» при септальной миоэктомии показывает сопоставимую 100%-ную выживаемость и свободу от ВСС в сравнении с изолированной септальной миоэктомией.
-
6. Пластика МК по методике «край-в-край» при септальной миоэктомии характеризуется сопоставимой 100%-ной свободой от повторных вмешательств по поводу градиента на уровне выходного отдела левого желудочка в сравнении с изолированной миоэктомией через 12 месяцев после операции.
Список литературы Пластика митрального клапана по методике «край-в-край» при септальной миоэктомии в сравнении с изолированной миоэктомией: пилотное рандомизированное исследование
- Braunwald E. et al. Idiopathic Hypertrophic Subaortic Stenosis: I. A Description of the Disease Based Upon an Analysis of 64 Patients. Circulation. 1964;29(5s4):3-119. https://doi.org/10.1161/01.cir.29.5s4.iv-3
- Ommen S.R., Mital S., Burke M.A. et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2020 Dec 22;142(25):e533-e557. https://doi.org/10.1161/CIR.0000000000000938
- Maron B.J. Hypertrophic cardiomyopathy. Braunwald’s heart disease: a textbook of cardiovascular medicine. Elsevier Inc. 2011:1582-94. https://doi.org/10.1016/S0140-6736(12)60397-3
- Lancellotti P., Gach O., Davin L. et al. Alcoolisation septale dans la cardiomyopathie hypertrophique obstructive [Alcohol septal ablation for obstructive hypertrophic cardiomopathy]. Rev Med Liege. 2019;74(S1):S51-S56. https://doi.org/10.1016/j.jacc.2017.02.080
- Найденов Р., Кретов Е., Байструков В. и соавт. Оценка безопасности и эффективности миоэктомии по Morrow и спиртовой редукции миокарда у пациентов с обструктивной гипертрофической кардиомиопатией: пилотное рандомизированное контролируемое исследование. Патология кровообращения и кардиохирургия. 2016;20(3):42-53. https://doi.org/10.21688/1681-3472-2016-3-42-53
- Hong J.H., Schaff H.V., Nishimura R.A. et al. Mitral Regurgitation in Patients With Hypertrophic Obstructive Cardiomyopathy: Implications for Concomitant Valve Procedures. J Am Coll Cardiol. 2016 Oct 4;68(14):1497-504. https://doi.org/10.1016/j.jacc.2016.07.735
- Swistel D.G., DeRose J.J. Jr, Sherrid M.V. Management of patients with complex hypertrophic cardiomyopathy: resection/plication/ release. Oper Techn. Thorac Cardiovasc Surg 2004;9:261-267. https://doi.org/10.21037/acs.2017.06.03
- Patel P., Dhillon A., Popovic Z.B. et al. Left Ventricular Outflow Tract Obstruction in Hypertrophic Cardiomyopathy Patients Without Severe Septal Hypertrophy: Implications of Mitral Valve and Papillary Muscle Abnormalities Assessed Using Cardiac Magnetic Resonance and Echocardiography. Circ Cardiovasc Imaging. 2015 Jul;8(7):e003132. https://doi.org/10.1161/CIRCIMAGING.115.003132
- Ferrazzi P., Spirito P., Iacovoni A. et al. Transaortic Chordal Cutting: Mitral Valve Repair for Obstructive Hypertrophic Cardiomyopathy With Mild Septal Hypertrophy. J Am Coll Cardiol. 2015 Oct 13;66(15):1687-96. https://doi.org/10.1016/j.jacc.2015.07.069
- Källner G., van der Linden J, Hadjinikolaou L., Lindblom D. Transaortic approach for the Alfieri stitch. Ann Thorac Surg. 2001 Jan;71(1):378-9; discussion 379-80. https://doi.org/10.1016/s0003-4975(00)02186-x
- Dulguerov F., Marcacci C., Alexandrescu C. et al. Hypertrophic obstructive cardiomyopathy: the mitral valve could be the key. Eur J Cardiothorac Surg. 2016;50(1):61-65. https://doi.org/10.1093/ejcts/ezv473
- Sherrid M.V., Chaudhry F.A., Swistel D.G. Obstructive hypertrophic cardiomyopathy: Echocardiography, pathophysiology, and the continuing evolution of surgery for obstruction. Ann Thorac Surg 2003;75:620 32. https://doi.org/10.1016/s0003-4975(02)04546-0
- Solomon Z., Breton C., Rowin E.J. et al. Surgical Approaches to Hypertrophic Obstructive Cardiomyopathy. Semin Thorac Cardiovasc Surg. 2018;30(2):125-128. https://doi.org/10.1053/j.semtcvs.2018.02.034
- Price J., Clarke N., Turer A. et al. Hypertrophic obstructive cardiomyopathy: review of surgical treatment. Asian Cardiovasc Thorac Ann. 2017;25(9):594-607. https://doi.org/10.1177/0218492317733111
- Lapenna E., Nisi T., Ruggeri S. et al. Edge-to-Edge Mitral Repair Associated With Septal Myectomy in Hypertrophic Obstructive Cardiomyopathy. Ann Thorac Surg. 2020;110(3):783-789. https://doi.org/10.1016/j.athoracsur.2020.03.095
- Shah A.A., Glower D.D., Gaca J.G. Trans-aortic Alfieri stitch at the time of septal myectomy for hypertrophic obstructive cardiomyopathy. J Card Surg. 2016 Aug;31(8):503-6. https://doi.org/10.1111/jocs.12804
- Collis R., Watkinson O., Pantazis A. et all. Early and medium-term outcomes of Alfieri mitral valve repair in the management of systolic anterior motion during septal myectomy. J Card Surg. 2017 Nov;32(11):686-690. https://doi.org/10.1111/jocs.13239
- Lapenna E., Nisi T., Ruggeri S. et al. Edge-to-Edge Mitral Repair Associated With Septal Myectomy in Hypertrophic Obstructive Cardiomyopathy. Ann Thorac Surg. 2020 Sep;110(3):783-789. https://doi.org/10.1016/j.athoracsur.2020.03.095


