Пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства как альтернатива протезированию аортального клапана
Автор: Несмачный Алексей Сергеевич, Карева Ю.Е., Рузматов Т.М., Чернявский А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Реконструктивная клапаносохраняющая хирургия корня аорты
Статья в выпуске: 2 т.20, 2016 года.
Бесплатный доступ
Цель. Оценить безопасность и воспроизводимость пластики створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства. Материал и методы. В пилотное исследование включены 7 пациентов с выраженным аортальным стенозом и ишемической болезнью сердца, которым выполнена пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства в сочетании с аортокоронарным шунтированием. Результаты. Аортальный клапан был успешно реконструирован у 7 пациентов. Нормальная функция аортального клапана была подтверждена данными эхокардиографии у всех пациентов. Послеоперационный период во всех случаях протекал без осложнений. Среднее время нахождения в стационаре составило 17 (1З; З5) дней. Реопераций на аортальном клапане за время наблюдения пациентам не выполняли. Госпитальная летальность составила О%. Максимальный срок наблюдения - 759 дней. Выживаемость в отдаленном периоде составила 86%. Свобода от дегенеративных изменений клапана, тромбоэмболии, эндокардита и реоперации - 100%. Пиковый градиент на аортальном клапане в отдаленном периоде составил 30 (26; 42) мм рт. ст., пиковая скорость - З (2,8; З,2), средняя степень регургитации - 1±О,1 ст. Заключение. Пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства является эффективной альтернативой биологическому протезированию аортального клапана. Данный метод безопасен в отношении свободы от реопераций, дегенеративных изменений клапана, тромбоэмболии, эндокардита в раннем и отдаленном послеоперационном периодах.
Аорта, протезирование аортального клапана, бескаркасный протез
Короткий адрес: https://sciup.org/142140743
IDR: 142140743 | DOI: 10.21688-1681-3472-2О16-2-58-65
Текст научной статьи Пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства как альтернатива протезированию аортального клапана
Основным преимуществом биологического протеза над механическим клапаном сердца является свобода от антикоагулянтной терапии, что приводит к улучшению качества жизни [1]. В последнее десятилетие биологические протезы все чаще имплантируют пациентам всех возрастов. Согласно ряду исследований, срок службы биологических протезов в настоящее время значительно увеличился [2]. В современной кардиохирургии представлены два типа биологических протезов: каркасные и бескаркасные. Стандартный аортальный биопротез состоит из каркаса и основания, на котором закреплены створки. Не вызывает сомнения, что такая конструкция обеспечивает большую структурную стабильность клапану и менее требовательна к технике имплантации. Тем не менее данный каркас и манжета занимают пространство и уменьшают эффективную площадь отверстия имплантированного протеза [3]. В свою очередь это вызывает относительную обструкцию выходного отдела левого желудочка и может являться причиной развития гипертрофии левого желудочка в будущем, а также остаточных градиентов на протезе [4, 5].
Бескаркасные клапаны были разработаны для снижения обструкции выходного тракта левого желудочка и увеличения эффективной площади отверстия, что привело к снижению трансклапанных градиентов и улучшению гемодинамики [3].
Альтернативой биологическим бескаркасным клапанам является пластика створок аортального клапана ксеноперикардиальными или аутоперикардиальными лоскутами. В научной литературе появляются сообщения о положительных результатах использования данной методики [6, 7]. Однако большинство применяемых способов технически сложны и требуют специальных навыков для рутинного использования. Сложности выявляются на всех этапах: начиная от правильной выкройки будущих створок и заканчивая симметричной имплантацией неостворок в аорту. Столь деликатная и кропотливая работа увеличивает время операции и соответственно искусственного кровообращения (ИК). Эти трудности могут быть нивелированы при использовании специального устройства, удерживающего неостворки во время имплантации. Предлагаемая нами методика пластики створок аортального клапана ксеноперикардиальным лоскутом аналогична имплантации обычного бескаркасного протеза и не требует определенных навыков для имплантации. Позиционирование будущих створок в удерживающем устройстве перед имплантацией позволяет быстро и точно, в соответствии с диаметром фиброзного кольца аорты, сформировать неоклапан.
Материал и методы
С января 2014 г. по январь 2016 г. выполнена пластика створок аортального клапана ксеноперикардиальными лоскутами у 7 пациентов. Средний возраст пациентов составил 69 (64; 75) лет. Среди оперированных пациентов было 5 (71%) мужчин и 2 (23%) женщины. Этиология поражения аортального клапана у данных пациентов была представлена во всех случаях стенозом аортального клапана.
Подготовку пациентов к предстоящей операции осуществляли согласно общим принципам предоперационной подготовки. Хирургическое вмешательство проводили у всех пациентов с применением интубационного наркоза. Доступ к сердцу осущест- вляли через срединную стернотомию. Всем пациентам операцию выполняли в условиях нормотермического искусственного кровообращения. Подключение ИК производили по стандартной методике: правое предсердие и аорта. В качестве кардиоплегического раствора использовали кустодиол в дозе, рекомендуемой производителем. Во время перфузии непульсирующий кровоток поддерживали 2,4–2,8 л/мин/м2 и среднее артериальное давление на уровне 50–70 мм рт. ст. У всех пациентов операцию пластики створок аортального клапана дополняли прямой реваскуляризацией миокарда.
После ревизии аортального клапана и признания его несостоятельности клапан иссекали. При необходимости выполняли декальцинацию фиброзного кольца аортального клапана. Измеряли диаметр фиброзного кольца. После чего хирургическая бригада приступала к аортокоронарному шунтированию (наложению дистальных анастомозов).
Одновременно с этим второй хирург, получив размеры фиброзного кольца, приступал к созданию будущих створок аортального клапана с помощью специального удерживающего устройства.
Для создания будущих створок аортального клапана использовали изготовленные в заводских условиях ксеноперикардиальные лоскуты размером 30 х 60 мм, толщиной 0,3 мм. Лоскуты подготовлены к использованию в операционной в соответствии с рекомендациями завода-изготовителя.

Рис. 1. Заготовка из ксеноперикарда
Fig. 1. A xenopericardial patch
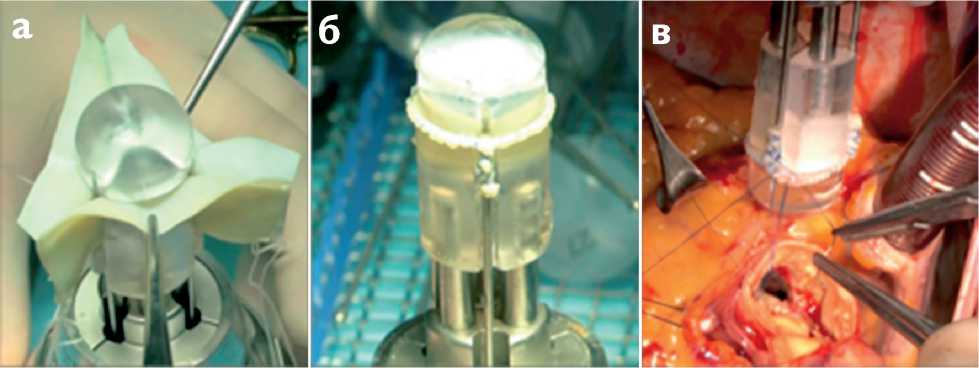
Рис. 2. Этапы формирования и имплантации неостворок: а – фиксация заготовки в удерживающем устройстве; б – неостворки в удерживающем устройстве, подготовленные к имплантации; в – имплантация неостворок
Fig. 2. Stages of formation and implantation of neoleaflets: a – fixing the patch in a holding de-vice; b – neoleaflets in the holding device prepared for implantation; c – neoleaflets implantation
Из трех ксеноперикардиальных лоскутов формировали заготовку по форме равноугольного трилистника (рис. 1), которую затем фиксировали в удерживающем устройстве (рис. 2, а ).
Излишки ксеноперикарда отсекали в соответствии с фиброзным кольцом аортального клапана пациента. Полипропиленовой нитью 5-0 выполняли фиксацию будущих створок по комиссурам и формировали манжету для пришивания к фиброзному кольцу (рис. 2, б ).
По завершении наложения дистальных коронарных анастомозов имплантировали новые створки, фиксированные в удерживающем устройстве, обвивным швом в позицию фиброзного кольца аортального клапана полипропиленовой нитью 4-0 (рис. 2, в ). После чего высвобождали створки из устройства. Фиксацию комиссур производили П-образным швом с прошиванием на наружную стенку аорты, где формировали узел с использованием синтетических прокладок (рис. 3).
Ушивали аортотомный доступ. Формировали проксимальные анастомозы коронарных шунтов с восходящей аортой. Симметричность створок и кооптацию оценивали непосредственно по окончании процедуры перед ушиваем аортотомного доступа и с помощью чреспищеводной эхокардиографии (Эх-оКГ) после отключения ИК (рис. 4).
Контроль ЭхоКГ выполняли пациентам перед выпиской из отделения и в среднеотдаленные сроки наблюдения.
Для сравнения времени ИК и окклюзии аорты (ОА) при выполнении пластики сворок аортального клапана с использованием удерживающего устройства (группа 1) и при протезировании аортального клапана биологическим протезом использовали данные пациентов, оперированных в тот же период (группа 2, таблица ).
Статистический анализ
Статистический анализ полученных результатов исследования проводили с помощью программы Statistica 8.0. Данные из совокупностей с нормальным распределением сравнивали с помощью t-критерия Стьюдента для независимых выборок. Сравнение данных из совокупностей с распределением, отличающимся от нормального, проводили с применением U-критерия Манна – Уитни. Сравнивали качественные признаки точным критерием Фишера – Фримена – Холтера. Для определения достоверности различий парных сравнений применяли критерий Уилкоксона. Непараметрические количественные признаки приведены в виде медианы и границ межквартильного интервала. Анализ выжи- ваемости выполняли с применением регрессионной модели Кокса для пропорциональных рисков.
Результаты
Аортальный клапан успешно реконструирован у 7 пациентов, что подтверждено результатами чреспищеводной ЭхоКГ: симметричность створок, их полная кооптация и отсутствие регургитации на аортальном клапане. В некоторых случаях специалисты функциональной диагностики расценивали работу аортального клапана как нативного, не зная о проведенной реконструкции (рис. 4). Средний размер фиброзного кольца аортального клапана составил 22 (21; 24) мм. Случаев дисфункции и реоперации в отношении аортального клапана в раннем послеоперационном периоде не было. Послеоперационный период во всех случаях протекал без осложнений. Среднее время нахождения в стационаре составило 17 (13; 35) дней. Реопераций на аортальном клапане за время наблюдения пациентам не выполняли. Госпитальная летальность составила 0%. У всех пациентов операция пластики створок аортального клапана сочеталась с аортокоронарным шунтированием. Среднее время создания заготовки неостворок и их фиксации в устройстве для дальнейшей импланта- ции составило 27±7 мин. Среднее время ИК – 226 (212; 250) мин. Среднее время ОА составило 161 (137; 187) мин. Это время сопоставимо с временем ИК и ОА при протезировании аортального клапана каркасным биологическим протезом в сочетании с аортокоронарным шунтированием, что подтверждается интраоперационными данными пациентов, оперированных в ННИИПК им. акад. Е.Н. Мешалки-на (рис. 5).
Среднее время отдаленного наблюдения составило 454±295 дней. Максимальный срок наблюдения – 759 дней. Выживаемость в отдаленном периоде составила 86%. Через 3 мес. после операции умер один пациент. Причиной летальности стали осложнения хронической обструктивной болезни легких. Остальные 6 пациентов до настоящего времени живы.
Нормальная функция аортального клапана была подтверждена данными ЭхоКГ у всех пациентов. Ни у одного пациента не было кальциноза аортального клапана. Свобода от дегенеративных изменений клапана, тромбоэмболии, эндокардита и реоперации составила 100%. Исходные и отдаленные клинические эхокардиографические показатели, характеризующие работу аортального клапана после пластики створок с использованием удерживающего устройства, представлены в таблице .
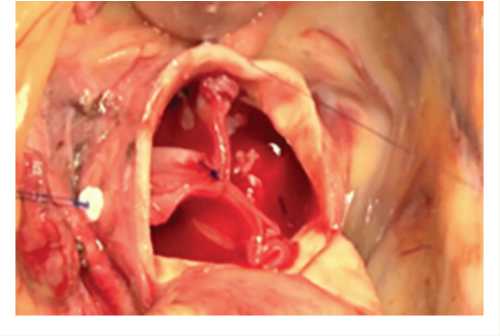
Рис. 3. Неостворки имплантированы в позицию фиброзного кольца аортального клапана (по центру три створки соединены техническим швом, который будет удален)
Fig. 3. Neoleaflets implanted in the position of a fibrous annulus of the aortic valve (the centers of 3 leaflets are connected with a technical suture which will be removed later)
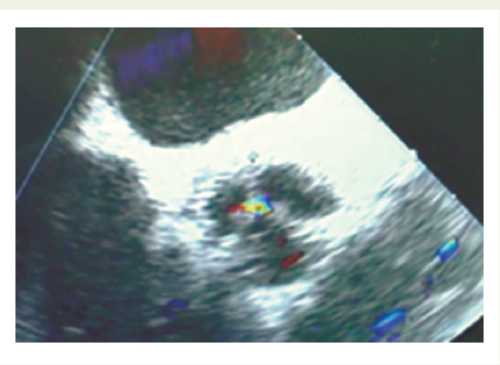
Рис. 4. Чреспищеводная эхокардиография, выполненная интраоперационно после отключения от аппарата искусственного кровообращения пациенту с пластикой створок аортального клапана
Fig. 4. Transesophageal echocardiography per-formed intraoperatively after the pump was turned off in a patient with aortic valve leaflets plasty
Группы
5 Время ИК, мин
5 Время ОА, мин
Рис. 5. Время искусственного кровообращения и окклюзии аорты при протезировании аортального клапана биологическим протезом (группа 2, n = 8) и пластике сворок аортального клапана с использованием удерживающего устройства (группа 1, n = 7). Данные представлены как среднее значение, ±95% ДИ
Fig. 5. On-pump and aorta occlusion time when replacing the aortic valve with a bioprosthesis (group 2, n=8) and performing aortic valve leaf-lets plasty with the use of a holding device (group 1, n=7). Data are given as a mean value, ±95% CI
Обсуждение
Проспективное пилотное исследование, выполненное на 7 пациентах, демонстрирует безопасность и осуществимость реконструкции аортального клапана, заключающуюся в реимплантации новых створок в позицию фиброзного кольца аортального клапана. Обращает внимание оптимальная гемодинамика, обеспеченная работой аортального клапана с минимальными градиентами на нем. Отсутствие поддерживающего каркаса и шовной манжеты в этом бескаркасном клапане максимизирует эффективную площадь отверстия и может быть особенно полезным у пациентов с малым диаметром корня аорты или сниженной функцией левого желудочка [8].
Обвивной шов между ксеноперикардиальным лоскутом и стенкой аорты позволяет создать новый клапан без использования каркасной поддержки и манжеты, что сохраняет нормальную дина-
Эхокардиографические показатели аортального клапана до операции и в отдаленном периоде после операции у пациентов после пластики створок аортального клапана с использованием удерживающего устройства (данные представлены как медиана (25-й и 75-й процентили))
|
Показатель |
Исходно |
В отдаленном периоде |
р* |
|
Пиковый градиент, мм рт. ст. |
91 (79; 97) |
30 (26; 42) |
0,04 |
|
Средний градиент, мм рт. ст. |
55 (42; 62) |
16 (12; 22) |
0,05 |
|
Пиковая скорость, м/с |
4,8 (4,5; 4,9) |
3 (2,8; 3,2) |
0,05 |
|
Средняя степень регургитации |
1±0,3 |
1±0,1 |
0,92 |
* критерий Уилкоксона мику корня аорты, расширяющуюся в диастолу и сокращающуюся в систолу [9–11]. Это уменьшает механическое напряжение сдвига на восстановленной створке клапана и, так как створки могут перемещаться вместе с аортой во время сердечного цикла, снижает риск отрыва створки и ее кальцификации [12–14]. Также оптимизированы гемодинамика клапана и эффективная площадь отверстия. Исследования бескаркасных биологических аортальных клапанов показали преимущества их использования у больных с небольшим корнем аорты и пациентов с ослабленной функцией левого желудочка [8]. Успех у этого бескаркасного клапана может быть выше, чем у доступных в продаже бескаркасных биологических протезов, так как все они имеют пришивные манжеты и, таким образом, не в полной мере сохраняют нормальную динамику корня аорты.
Некоторые исследователи полагают, что бескаркасный клапан с манжетой более удобен в имплантации, нежели пришивание отдельных лоскутов ксеноперикарда к стенке аорты. Однако вопрос удобства в данном случае решается использованием устройства, удерживающего будущие ксеноперикардиальные створки и позволяющего позиционировать их аналогично нативному клапану. Возможность пришить новые створки над фиброзным кольцом аортального клапана (непосредственно к стенке аорты) позволяет создать новый клапан именно трехстворчатым, даже если нативный имел иное количество створок. Затраты на эту процедуру до конца не установлены, однако очевидно, что стоимость такого способа лечения будет значительно ниже по сравнению с биопротезированием аортального клапана. Благодаря сайзерам и размеченной планшетке, входящим в комплект удерживающего устройства, выкроить будущие створки и позиционировать их симметрично не составит труда даже неопытному хирургу.
Принято считать, что имплантация новых ксеноперикардиальных створок обвивным швом к стенке аорты технически более сложная, чем имплантация обычного каркасного или бескаркасного биопротеза клапана, особенно при асимметрии кольца аорты. Сложность может заключаться в определении высоты неокомиссур. Принципиально важным в этой процедуре является создание трех симметричных створок клапана и комиссур, обеспечивающих адекватную кооптацию створок без пролапса после их имплантации. Следует отметить, что в случае асимметрии кольца аорты использование удерживающего створки устройства особенно удобно.
Этот бескаркасный аортальный клапан с оптимальной гемодинамикой и, возможно, улучшенной прочностью может быть особенно полезным у молодых активных пациентов, которые либо не могут, либо не хотят принимать антикоагулянты. Данная процедура менее инвазивна и требует меньшего искажения геометрии корня аорты, чем при имплантации гомографта или реимплантации корня аорты в протез [15].
Ранее идеальной заменой аортальному клапану считался аутотрансплантат легочной артерии, в настоящее время установлено, что его прочность может быть ограничена пределами первого десятилетия. Аналогично использование гомографтов в аортальной позиции у молодых пациентов в настоящее время демонстрирует меньшую долговечность, в отличие от коммерческих бескаркасных биопротезов аортальных клапанов, что не позволяет рекомендовать их в качестве оптимальной замены клапана у этих пациентов [16].
Еще одним преимуществом имплантации створок аортального клапана является то, что в данном случае реоперацию выполнить будет технически проще, нежели после имплантированного гомографта или биопротеза. Фактически это будет напоминать первичную операцию по реконструкции аортального клапана. В свою очередь эксплантация гомографта или аутографта приведет к полной реконструкции корня аорты. Кроме того, пластика створок аортального клапана позволит рассматривать данных пациентов в случае дисфункции клапана как кандидатов на транскатетерное протезирование аортального клапана и избежать проблем, связанных с несоответствием протеза, в отличие от ситуации, если ранее имплантированный клапан будет биологическим каркасным или бескаркасным протезом.
Заключение
Пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства является эффективной альтернативой биологическому протезированию аортального клапана. Данный метод является безопасным в отношении свободы от реопераций, дегенеративных изменений клапана, тромбоэмболии, эндокардита в раннем и отдаленном послеоперационном периодах.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Пластика створок аортального клапана ксеноперикардиальным лоскутом с использованием удерживающего устройства как альтернатива протезированию аортального клапана
- Rahimtoola S.H. Choice of prosthetic heart valve in adults: an update//Journal of the American College of Cardiology. 2О1О. Vol. 55. № 22. P. 241З-2426 DOI: 10.1016/j.jacc.2009.10.085
- Dunning J., Gao H., Chambers J., Moat N., Murphy G., Pagano D., Bridgewater B. Aortic valve surgery: marked increases in volume and significant decreases in mechanical valve use-an analysis of 41,227 patients over 5 years from the Society for Cardiothoracic Surgery in Great Britain and Ireland National database//The Journal of thoracic and cardiovascular surgery. 2О11. Vol. 142. № 4. P. 776-782 DOI: 10.1016/j.jtcvs.2011.04.048
- Payne D.M., Pavan Koka H., Karanicolas P.J., Chu M.W., Dave Nagpal A., Briel M., Lonn E.M. Hemodynamic Performance of Stentless Versus Stented Valves: A Systematic Review and Meta-Analysis//Journal of cardiac surgery. 2ОО8. Vol. 2З. № 5. P. 556-564 DOI: 10.1111/j.1540-8191.2008.00705.x
- Kunadian B., Vijayalakshmi K., Thornley A.R., de Beider M.A., Hunter S., Kendall S., Dunning J. Meta-analysis of valve hemodynamics and left ventricular mass regression for stentless versus stented aortic valves//The Annals of thoracic surgery. 2ОО7. Vol. 84. № 1. P. 7З-78.
- Pepper J., Cheng D., Stanbridge R., Ferdinand F.D., Jamieson W.R.E., Stelzer P., Martin J. Stentless versus stented bioprosthetic aortic valves: a consensus statement of the international society of minimally invasive cardiothoracic surgery (ISMICS) 2ОО8//Innovations: Technology and Techniques in Cardiothoracic and Vascular Surgery. 2ОО9. Vol. 4. № 2. P. 49-6О.
- Chan K.J., Rahman-Haley S., Mittal T.K., Gavino J.A., Dreyfus G.D. Truly stentless autologous pericardial aortic valve replacement: An alternative to standard aortic valve replacement//The Journal of thoracic and cardiovascular surgery. 2О11. Vol. 141. № 1. P. 276-283 DOI: 10.1016/j.jtcvs.2010.09.038
- Ozaki S., Kawase I., Yamashita H., Uchida S., Nozawa Y., Takatoh M., Kiyohara N. Aortic valve reconstruction using autologous pericardium for ages over 80 years//Asian Cardiovascular and Thoracic Annals. 2О14. Vol. 22. № 8. P. 90З-908 DOI: 10.1177/0218492314520748
- Gulbins H., Reichenspurner H. Which patients benefit from stentless aortic valve replacement?//The Annals of thoracic surgery. 2009. Vol. 88. № 6. P. 2061-2068. DOI: 10.1016/j. athoracsur.2009.06.060.
- Cheng A., Dagum P., Miller D.C. Aortic root dynamics and surgery: from craft to science//Philosophical Transactions of the Royal Society of London B: Biological Sciences. 2ОО7. Vol. 362. № 1484. P. 14О7-1419 DOI: 10.1098/rstb.2007.2124
- Rodriguez F., Green G.R., Dagum P., Nistal J.F., Harrington K.B., Daughters G.T., Miller D.C. Left ventricular volume shifts and aortic root expansion during isovolumic contraction//The Journal of heart valve disease. 2ОО6. Vol. 15. № 4. P. 465-473.
- Lansac E., Lim H.S., Shomura Y., Lim K.H., Rice N.T., Goetz W., Duran C.M.G. A four-dimensional study of the aortic root dynamics//European journal of cardio-thoracic surgery. 2002. Vol. 22. № 4. P. 497-50З.
- Grabenwöger M., Fitzal F., Gross C., Hutschala D., Böck P., Brucke P., Wolner E. Different modes of degeneration in autologous and heterologous heart valve prostheses//The Journal of heart valve disease. 2000. Vol. 9. № 1. P. 104-109.
- Thubrikar M.J., Deck J.D., Aouad J., Nolan S.P. Role of mechanical stress in calcification of aortic bioprosthetic valves//The Journal of Thoracic and Cardiovascular Surgery. 198З. Vol. 86. № 1. P. 115-125.
- Gross C., Simon P., Grabenwöger M., Mair R., Sihorsch K., Kypta A., Bröcke P. Midterm results after aortic valve replacement with the autologous tissue cardiac valve//European journal of cardiothoracic surgery. 1999. Vol. 16. № 5. P. 5ЗЗ-5З9.
- Чернявский А.М., Хван Д.С., Альсов С.А., Сирота Д.А., Ляшенко М.М. Результаты реимплантации корня аорты в протез у пациентов е аневризмой восходящего отдела аорты и недостаточностью аортального клапана//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 4. С. 38-47.
- El-Hamamsy I., Clark L., Stevens L.M., Sarang Z., Melina G., Takkenberg J.J., Yacoub M.H. Late outcomes following freestyle versus homograft aortic root replacement: results from a prospective randomized trial//Journal of the American College of Cardiology. 2010. Vol. 55. № 4. P. З68-З76. DOI: 10.1016/j. jacc.2009.09.030.


